Биохимия
| Часть серии о |
| Биохимия |
|---|
 |
Биохимия или биологическая химия — это изучение химических процессов и связанных с ними внутри живых организмов . [1] Биохимия, являющаяся субдисциплиной химии и биологии , может быть разделена на три области: структурная биология , энзимология и метаболизм . За последние десятилетия 20-го века биохимия добилась успеха в объяснении жизненных процессов с помощью этих трех дисциплин. Почти все области наук о жизни открываются и развиваются посредством биохимической методологии и исследований. [2] Биохимия фокусируется на понимании химической основы, которая позволяет биологическим молекулам вызывать процессы, происходящие внутри живых клеток и между клетками. [3] В свою очередь, это во многом связано с пониманием тканей и органов , а также структуры и функций организма. [4] Биохимия тесно связана с молекулярной биологией , изучением молекулярных механизмов биологических явлений. [5]
Большая часть биохимии занимается структурами, связями, функциями и взаимодействиями биологических макромолекул, таких как белки , нуклеиновые кислоты , углеводы и липиды . Они обеспечивают структуру клеток и выполняют многие функции, связанные с жизнью. [6] Химия клетки также зависит от реакций малых молекул и ионов . Они могут быть неорганическими (например, вода и металлов ионы ) или органическими (например, аминокислоты , которые используются для синтеза белков ). [7] Механизмы, используемые клетками для использования энергии из окружающей среды посредством химических реакций, известны как метаболизм . Результаты биохимии применяются главным образом в медицине , питании и сельском хозяйстве . В медицине биохимики исследуют причины и лечения болезней способы . [8] Диетология изучает способы поддержания здоровья и хорошего самочувствия, а также последствия дефицита питательных веществ . [9] В сельском хозяйстве биохимики исследуют почву и удобрения с целью улучшения выращивания сельскохозяйственных культур, хранения урожая и борьбы с вредителями . В последние десятилетия биохимические принципы и методы были объединены с инженерными подходами к решению проблем, позволяющими манипулировать живыми системами, чтобы создать полезные инструменты для исследований, промышленных процессов, а также диагностики и контроля заболеваний — дисциплины биотехнологии .
История [ править ]

В наиболее полном определении биохимию можно рассматривать как исследование компонентов и состава живых существ и того, как они объединяются, образуя жизнь. В этом смысле история биохимии может восходить к древним грекам . [10] Однако биохимия как отдельная научная дисциплина зародилась где-то в XIX веке или немного раньше, в зависимости от того, на каком аспекте биохимии основное внимание уделяется. Некоторые утверждали, что началом биохимии могло быть открытие первого фермента , диастазы (ныне называемой амилазой ), в 1833 году Ансельмом Пайеном . [11] в то время как другие считали первую демонстрацию Эдуардом Бюхнером сложного биохимического процесса спиртового брожения в бесклеточных экстрактах в 1897 году рождением биохимии. [12] [13] Некоторые могут также указать на начало влиятельной работы Юстуса фон Либиха 1842 года « Химия животных, или Органическая химия в ее приложениях к физиологии и патологии» , в которой представлена химическая теория метаболизма. [10] XVIII века по брожению и дыханию или даже раньше, к исследованиям Антуана Лавуазье . [14] [15] Многие другие пионеры в этой области, которые помогли раскрыть сложные уровни биохимии, были провозглашены основоположниками современной биохимии. Эмиль Фишер , изучавший химию белков , [16] и Ф. Гоуленд Хопкинс , изучавший ферменты и динамическую природу биохимии, представляют собой два примера ранних биохимиков. [17]
Термин «биохимия» впервые был использован, когда Винценц Клецинский (1826–1882) напечатал в Вене в 1858 году свой «Сборник биохимии»; оно получено в результате сочетания биологии и химии . В 1877 году Феликс Хоппе-Зейлер использовал этот термин ( биохимия на немецком языке) как синоним физиологической химии в предисловии к первому выпуску Zeitschrift für Physiologische Chemie (Журнал физиологической химии), где он выступал за создание институтов, посвященных физиологической химии. эту область обучения. [18] [19] Однако часто упоминается, что немецкий химик Карл Нойберг придумал это слово в 1903 году. [20] [21] [22] в то время как некоторые приписывают это Францу Хофмейстеру . [23]
Когда-то считалось, что жизнь и ее материалы обладают неким существенным свойством или веществом (часто называемым « жизненным принципом »), отличным от любого, обнаруженного в неживой материи, и считалось, что только живые существа могут производить молекулы жизнь. [25] В 1828 году Фридрих Вёлер опубликовал статью о своем удачном мочевины синтезе из цианата калия и сульфата аммония; некоторые считали это прямым ниспровержением витализма и утверждением органической химии . [26] [27] Однако синтез Велера вызвал споры, поскольку некоторые отвергают смерть витализма от его рук. [28] С тех пор биохимия продвинулась вперед, особенно с середины 20-го века, с развитием новых методов, таких как хроматография , рентгеновская дифракция , интерферометрия двойной поляризации , ЯМР-спектроскопия , радиоизотопная маркировка , электронная микроскопия и моделирование молекулярной динамики . Эти методы позволили открыть и детально проанализировать многие молекулы и метаболические пути клетки (цикл лимонной , такие как гликолиз и цикл Кребса кислоты), и привели к пониманию биохимии на молекулярном уровне. [ нужна ссылка ]
Еще одним важным историческим событием в биохимии является открытие гена и его роли в передаче информации в клетке. В 1950-х годах Джеймс Д. Уотсон , Фрэнсис Крик , Розалинда Франклин и Морис Уилкинс сыграли важную роль в разгадке структуры ДНК и предположили ее связь с генетической передачей информации. [29] В 1958 году Джордж Бидл и Эдвард Татум получили Нобелевскую премию за работу над грибами, показавшую, что один ген производит один фермент . [30] В 1988 году Колин Питчфорк стал первым человеком, осужденным за убийство с помощью доказательств ДНК , что привело к развитию криминалистики . [31] Совсем недавно Эндрю З. Файер и Крейг К. Мелло получили Нобелевскую премию 2006 года за открытие роли РНК-интерференции (РНКи) в подавлении экспрессии генов . [32]
Исходные материалы: химические элементы жизни [ править ]
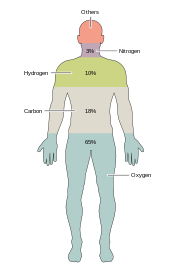
Около двух десятков химических элементов необходимы для различных видов биологической жизни . Большинство редких элементов на Земле не нужны для жизни (исключение составляют селен и йод ), [33] в то время как некоторые распространенные ( алюминий и титан ) не используются. есть некоторые различия Большинство организмов имеют общие потребности в элементах, но между растениями и животными . Например, океанские водоросли используют бром , но наземные растения и животные, похоже, в нем не нуждаются. необходим всем животным Натрий , но для растений он не является важным элементом. Растениям нужны бор и кремний , а животным — нет (или им могут потребоваться очень небольшие количества). [ нужна ссылка ]
Всего шесть элементов — углерод , водород , азот , кислород , кальций и фосфор — составляют почти 99% массы живых клеток, в том числе и в организме человека ( «Состав человеческого тела полный список см. в разделе »). В дополнение к шести основным элементам, которые составляют большую часть человеческого тела, людям требуется меньшее количество, возможно, еще 18. [34]
Биомолекулы [ править ]
Четыре основных класса молекул в биохимии (часто называемые биомолекулами ) — это углеводы , липиды , белки и нуклеиновые кислоты . [35] Многие биологические молекулы являются полимерами : в этой терминологии мономеры представляют собой относительно небольшие макромолекулы, которые соединяются вместе, образуя большие макромолекулы , известные как полимеры. Когда мономеры соединяются вместе для синтеза биологического полимера , они подвергаются процессу, называемому синтезом дегидратации . Различные макромолекулы могут собираться в более крупные комплексы, часто необходимые для биологической активности .
Углеводы [ править ]
Двумя основными функциями углеводов являются накопление энергии и обеспечение структуры. Один из распространенных сахаров , известный как глюкоза , является углеводом, но не все углеводы являются сахарами. На Земле больше углеводов, чем любого другого известного типа биомолекул; они используются для хранения энергии и генетической информации , а также играют важную роль в межклеточных взаимодействиях и коммуникациях . [ нужна ссылка ]
Простейшим видом углеводов является моносахарид , который помимо других свойств содержит углерод , водород и кислород , преимущественно в соотношении 1:2:1 (обобщенная формула C n H 2 n O n , где n равно не менее 3). Глюкоза (C 6 H 12 O 6 ) — один из важнейших углеводов; другие включают фруктозу (C 6 H 12 O 6 ), сахар, обычно ассоциирующийся со вкусом фруктов сладким . [36] [а] и дезоксирибоза (C 5 H 10 O 4 ), компонент ДНК . Моносахарид может переключаться между ациклической (с открытой цепью) формой и циклической формой. Форма с открытой цепью может быть превращена в кольцо атомов углерода, соединенных атомом кислорода, созданным из карбонильной группы на одном конце и гидроксильной группы на другом. Циклическая молекула имеет полуацетальную или гемикетальную группу, в зависимости от того, была ли линейная форма альдозой или кетозой . [38]
В этих циклических формах кольцо обычно имеет 5 или 6 атомов. Эти формы называются фуранозами и пиранозами соответственно — по аналогии с фураном и пираном , простейшими соединениями с одинаковым углерод-кислородным кольцом (хотя у них отсутствуют двойные углерод-углеродные связи этих двух молекул). Например, альдогексоза- глюкоза может образовывать полуацетальную связь между гидроксилом на углероде 1 и кислородом на углероде 4, образуя молекулу с 5-членным кольцом, называемую глюкофуранозой . Та же самая реакция может происходить между атомами углерода 1 и 5 с образованием молекулы с 6-членным кольцом, называемой глюкопиранозой . Циклические формы с 7-атомным кольцом, называемые гептозами, встречаются редко. [ нужна ссылка ]
Два моносахарида могут быть соединены гликозидной или сложноэфирной связью в дисахарид посредством реакции дегидратации, в ходе которой высвобождается молекула воды. Обратная реакция, при которой гликозидная связь дисахарида разрывается на два моносахарида, называется гидролизом . Самый известный дисахарид — сахароза или обычный сахар , который состоит из соединенных молекул глюкозы и молекулы фруктозы . Другим важным дисахаридом является лактоза , содержащаяся в молоке, состоящая из молекулы глюкозы и молекулы галактозы . Лактоза может гидролизоваться лактазой , а дефицит этого фермента приводит к непереносимости лактозы .
Когда несколько (около трех-шести) моносахаридов соединены, это называется олигосахаридом ( « олиго» означает «немногие»). Эти молекулы, как правило, используются в качестве маркеров и сигналов , а также имеют некоторые другие применения. [39] Многие моносахариды, соединяясь, образуют полисахарид . Они могут быть соединены в одну длинную линейную цепь, а могут быть и разветвленными . Двумя наиболее распространенными полисахаридами являются целлюлоза и гликоген , оба состоят из повторяющихся мономеров глюкозы . Целлюлоза растений является важным структурным компонентом клеточных стенок , а гликоген используется в качестве хранилища энергии у животных.
Сахар можно охарактеризовать наличием редуцирующих или невосстанавливающих концов. Восстанавливающий конец углеводов — это атом углерода, который может находиться в равновесии с альдегидом с открытой цепью ( альдоза ) или кето-формой ( кетоза ). Если присоединение мономеров происходит по такому атому углерода, свободная гидроксигруппа пиранозной фуранозной или формы заменяется на ОН-боковую цепь другого сахара, образуя полный ацеталь . Это предотвращает раскрытие цепи в альдегидную или кето-форму и делает модифицированный остаток невосстанавливающим. Лактоза содержит восстанавливающий конец глюкозной части, тогда как галактозная часть образует полный ацеталь с группой C4-OH глюкозы. Сахароза не имеет восстанавливающего конца из-за полного образования ацеталя между альдегидным углеродом глюкозы (С1) и кетоуглеродом фруктозы (С2).
Липиды [ править ]
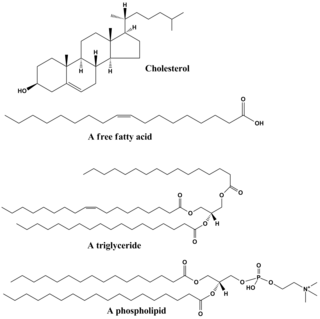
Липиды включают в себя разнообразный набор молекул и в некоторой степени являются совокупностью относительно нерастворимых в воде или неполярных соединений биологического происхождения, включая воски , жирные кислоты , полученные из жирных кислот , фосфолипиды , сфинголипиды , гликолипиды и терпеноиды (например, ретиноиды и стероиды). ). Некоторые липиды представляют собой линейные алифатические молекулы с открытой цепью, тогда как другие имеют кольцевую структуру. Некоторые из них являются ароматическими (с циклической [кольцевой] и плоской [плоской] структурой), а другие — нет. Некоторые из них гибкие, а другие жесткие. [42]
Липиды обычно состоят из одной молекулы глицерина в сочетании с другими молекулами. В триглицеридах , основной группе основных липидов, имеется одна молекула глицерина и три жирные кислоты . В этом случае мономером считаются жирные кислоты, которые могут быть насыщенными (нет двойных связей в углеродной цепи) или ненасыщенными (одна или несколько двойных связей в углеродной цепи). [ нужна ссылка ]
Большинство липидов имеют полярный характер и в значительной степени неполярны. Как правило, основная часть их структуры неполярна или гидрофобна («боится воды»), а это означает, что она плохо взаимодействует с полярными растворителями, такими как вода . Другая часть их структуры является полярной или гидрофильной («водолюбивой») и имеет тенденцию связываться с полярными растворителями, такими как вода. Это делает их амфифильными молекулами (имеющими как гидрофобные, так и гидрофильные части). В случае холестерина полярная группа представляет собой просто –ОН (гидроксил или спирт). [ нужна ссылка ]
В случае фосфолипидов полярные группы значительно больше и более полярны, как описано ниже.
Липиды являются неотъемлемой частью нашего ежедневного рациона. Большинство масел и молочных продуктов , которые мы используем для приготовления пищи и еды, таких как сливочное масло , сыр , топленое масло и т. д., состоят из жиров . Растительные масла богаты различными полиненасыщенными жирными кислотами (ПНЖК). Липидсодержащие продукты перевариваются в организме и расщепляются на жирные кислоты и глицерин, конечные продукты распада жиров и липидов. Липиды, особенно фосфолипиды , также используются в различных фармацевтических продуктах либо в качестве солюбилизаторов (например, при парентеральных инфузиях), либо в качестве компонентов- носителей лекарственного средства (например, в липосомах или трансферсомах ).
Белки [ править ]
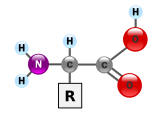
Белки — это очень большие молекулы — макробиополимеры, состоящие из мономеров, называемых аминокислотами . Аминокислота состоит из альфа-атома углерода, присоединенного к аминогруппе –NH 2 , группе карбоновой кислоты –COOH (хотя они существуют как –NH 3 + и – COO − в физиологических условиях), простой атом водорода и боковая цепь, обычно обозначаемая как «–R». Боковая цепь «R» различна для каждой аминокислоты, из которых имеется 20 стандартных . Именно эта группа «R» отличает каждую аминокислоту, а свойства боковых цепей сильно влияют на общую трехмерную конформацию белка. Некоторые аминокислоты выполняют функции сами по себе или в модифицированной форме; например, глутамат действует как важный нейромедиатор . Аминокислоты могут соединяться посредством пептидной связи . При этом дегидратационном синтезе молекула воды удаляется, и пептидная связь соединяет азот аминогруппы одной аминокислоты с углеродом группы карбоновой кислоты другой. Полученная молекула называется дипептидом , а короткие участки аминокислот (обычно менее тридцати) называются пептидами или полипептидами . Более длинные растяжки заслуживают названия «белки» . Например, важный сыворотки белок крови альбумин содержит 585 аминокислотных остатков. . [43]


Белки могут выполнять структурную и/или функциональную роль. Например, движения белков актина и миозина в конечном итоге ответственны за сокращение скелетных мышц. Одним из свойств многих белков является то, что они специфически связываются с определенной молекулой или классом молекул — они могут быть чрезвычайно избирательны в том, с чем связываются. Антитела являются примером белков, которые прикрепляются к одному конкретному типу молекул. Антитела состоят из тяжелых и легких цепей. Две тяжелые цепи будут связаны с двумя легкими цепями посредством дисульфидных связей между их аминокислотами. Антитела специфичны благодаря вариациям, основанным на различиях в N-концевом домене. [44]
Иммуноферментный анализ (ИФА), в котором используются антитела, является одним из наиболее чувствительных тестов, которые современная медицина использует для обнаружения различных биомолекул. Однако, вероятно, наиболее важными белками являются ферменты . Практически каждая реакция в живой клетке требует фермента для снижения энергии активации реакции. Эти молекулы распознают специфические молекулы-реагенты, называемые субстратами ; затем они катализируют реакцию между собой. Снижая энергию активации , фермент ускоряет эту реакцию в 10 раз. 11 или более; реакция, которая обычно спонтанно завершается более 3000 лет, с ферментом может занять менее секунды. Сам фермент не расходуется в процессе и может катализировать ту же реакцию с новым набором субстратов. С помощью различных модификаторов можно регулировать активность фермента, позволяя контролировать биохимию клетки в целом.
Структура белков традиционно описывается в иерархии четырех уровней. Первичная структура белка состоит из линейной последовательности аминокислот; например, «аланин-глицин-триптофан-серин-глутамат-аспарагин-глицин-лизин-...». Вторичная структура связана с локальной морфологией (морфология - это изучение структуры). Некоторые комбинации аминокислот имеют тенденцию сворачиваться в клубок, называемый α-спиралью , или в лист, называемый β-листом ; некоторые α-спирали можно увидеть на схеме гемоглобина выше. Третичная структура – это вся трехмерная форма белка. Эта форма определяется последовательностью аминокислот. Фактически, одно изменение может изменить всю структуру. Альфа-цепь гемоглобина содержит 146 аминокислотных остатков; замена остатка глутамата в положении 6 остатком валина настолько меняет поведение гемоглобина, что приводит к серповидноклеточной анемии . Наконец, четвертичная структура связана со структурой белка с несколькими пептидными субъединицами, например, гемоглобина с четырьмя субъединицами. Не все белки имеют более одной субъединицы. [45]

Поступившие в организм белки обычно расщепляются на отдельные аминокислоты или дипептиды в тонком кишечнике , а затем всасываются. Затем их можно объединить с образованием новых белков. Промежуточные продукты гликолиза, цикла лимонной кислоты и пентозофосфатного пути могут использоваться для образования всех двадцати аминокислот, а большинство бактерий и растений обладают всеми необходимыми ферментами для их синтеза. Однако люди и другие млекопитающие могут синтезировать только половину из них. Они не могут синтезировать изолейцин , лейцин , лизин , метионин , фенилаланин , треонин , триптофан и валин . Поскольку их необходимо принимать внутрь, это незаменимые аминокислоты . Млекопитающие обладают ферментами для синтеза аланина , аспарагина , аспартата , цистеина , глутамата , глютамина , глицина , пролина , серина и тирозина — заменимых аминокислот. Хотя они могут синтезировать аргинин и гистидин , они не могут производить их в достаточных количествах для молодых растущих животных, поэтому их часто считают незаменимыми аминокислотами.
Если аминогруппа удаляется из аминокислоты, остается углеродный скелет, называемый α- кетокислотой . Ферменты, называемые трансаминазами, могут легко переносить аминогруппу от одной аминокислоты (превращая ее в α-кетокислоту) к другой α-кетокислоте (превращая ее в аминокислоту). Это важно для биосинтеза аминокислот, так как для многих путей промежуточные продукты других биохимических путей преобразуются в скелет α-кетокислоты, а затем добавляется аминогруппа, часто посредством трансаминирования . Аминокислоты затем могут быть связаны вместе с образованием белка.
Аналогичный процесс используется для расщепления белков. Сначала он гидролизуется на составляющие его аминокислоты. Свободный аммиак (NH3), существующий в крови в виде иона аммония (NH4+), токсичен для форм жизни. Поэтому должен существовать подходящий метод его выведения. У разных животных развились разные тактики, в зависимости от их потребностей. Одноклеточные организмы выделяют аммиак в окружающую среду. Аналогичным образом, костистые рыбы могут выделять аммиак в воду, где он быстро растворяется. Как правило, млекопитающие преобразуют аммиак в мочевину посредством цикла мочевины .
Чтобы определить, связаны ли два белка или, другими словами, решить, гомологичны они или нет, ученые используют методы сравнения последовательностей. Такие методы, как выравнивание последовательностей и структурное выравнивание, являются мощными инструментами, которые помогают ученым определять гомологию между родственными молекулами. Актуальность поиска гомологии среди белков выходит за рамки формирования эволюционной модели белковых семейств . Выяснив, насколько похожи две белковые последовательности, мы получаем знания об их структуре и, следовательно, об их функциях.
Нуклеиновые кислоты [ править ]

Нуклеиновые кислоты , называемые так из-за их распространенности в клеточных ядрах , являются общим названием семейства биополимеров . Это сложные биохимические макромолекулы с высокой молекулярной массой, которые могут передавать генетическую информацию во всех живых клетках и вирусах. [2] Мономеры называются нуклеотидами , и каждый состоит из трех компонентов: азотистого гетероциклического основания ( пурина или пиримидина ), пентозного сахара и фосфатной группы. [46]
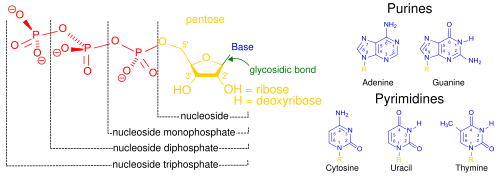
Наиболее распространенными нуклеиновыми кислотами являются дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). Фосфатная группа и сахар каждого нуклеотида связываются друг с другом, образуя основу нуклеиновой кислоты, а последовательность азотистых оснований хранит информацию. Наиболее распространенными азотистыми основаниями являются аденин , цитозин , гуанин , тимин и урацил . Азотистые основания каждой цепи нуклеиновой кислоты образуют водородные связи с некоторыми другими азотистыми основаниями в комплементарной цепи нуклеиновой кислоты. Аденин связывается с тимином и урацилом, тимин связывается только с аденином, а цитозин и гуанин могут связываться только друг с другом. Аденин, тимин и урацил содержат две водородные связи, а водородные связи, образующиеся между цитозином и гуанином, — три.
Помимо генетического материала клетки, нуклеиновые кислоты часто играют роль вторичных мессенджеров , а также образуют базовую молекулу аденозинтрифосфата (АТФ), основной молекулы-переносчика энергии, обнаруженной во всех живых организмах. Кроме того, азотистые основания, возможные в двух нуклеиновых кислотах, различны: аденин, цитозин и гуанин встречаются как в РНК, так и в ДНК, тогда как тимин встречается только в ДНК, а урацил встречается в РНК.
Метаболизм [ править ]
Углеводы как источник энергии [ править ]
Глюкоза является источником энергии у большинства форм жизни. Например, полисахариды расщепляются на мономеры ферментами ( гликогенфосфорилаза удаляет остатки глюкозы из гликогена, полисахарида). Дисахариды, такие как лактоза или сахароза, расщепляются на двухкомпонентные моносахариды. [47]
Гликолиз (анаэробный) [ править ]
Глюкоза в основном метаболизируется по очень важному десятиэтапному пути , называемому гликолизом , конечным результатом которого является расщепление одной молекулы глюкозы на две молекулы пирувата . Это также производит две чистые молекулы АТФ , энергетической валюты клеток, а также два восстанавливающих эквивалента преобразования НАД. + (никотинамидадениндинуклеотид: окисленная форма) в НАДН (никотинамидадениндинуклеотид: восстановленная форма). Для этого не требуется кислород; если кислород недоступен (или клетка не может использовать кислород), НАД восстанавливается путем преобразования пирувата в лактат (молочную кислоту) (например, у людей) или в этанол плюс углекислый газ (например, у дрожжей ). Другие моносахариды, такие как галактоза и фруктоза, могут превращаться в промежуточные продукты гликолитического пути. [48]
Аэробика [ править ]
В аэробных клетках с достаточным количеством кислорода , как и в большинстве клеток человека, пируват подвергается дальнейшему метаболизму. Он необратимо превращается в ацетил-КоА , выделяя один атом углерода в виде углекислого газа , образуя другой восстанавливающий эквивалент в виде НАДН . Две молекулы ацетил-КоА (из одной молекулы глюкозы) затем вступают в цикл лимонной кислоты , производя две молекулы АТФ, еще шесть молекул НАДН и два восстановленных (уби)хинона (через ФАДН 2 в качестве кофактора, связанного с ферментом) и высвобождая остальные атомы углерода в виде углекислого газа. Образовавшиеся молекулы НАДН и хинола затем поступают в ферментные комплексы дыхательной цепи, системы переноса электронов, в конечном итоге переносящей электроны на кислород и сохраняющей высвободившуюся энергию в виде градиента протонов над мембраной ( внутренней митохондриальной мембраной у эукариот). Таким образом, кислород восстанавливается до воды и первоначальных акцепторов электронов НАД. + и хинон регенерируются. Вот почему люди вдыхают кислород и выдыхают углекислый газ. Энергия, выделяющаяся при переносе электронов из высокоэнергетических состояний в НАДН и хиноле, сначала сохраняется в виде протонного градиента и преобразуется в АТФ посредством АТФ-синтазы. При этом образуются дополнительные 28 молекул АТФ (24 из 8 НАДН + 4 из 2 хинолов), что в сумме составляет 32 молекулы АТФ, сохраняющихся на распавшуюся глюкозу (две из гликолиза + две из цитратного цикла). [49] Понятно, что использование кислорода для полного окисления глюкозы дает организму гораздо больше энергии, чем любая независимая от кислорода функция метаболизма, и это считается причиной того, что сложная жизнь появилась только после того, как атмосфера Земли накопила большое количество кислорода.
Глюконеогенез [ править ]
У позвоночных животных , активно сокращающиеся скелетные мышцы (например, во время поднятия тяжестей или спринтерского бега), не получают достаточного количества кислорода для удовлетворения потребности в энергии, и поэтому они переходят к анаэробному метаболизму , превращая глюкозу в лактат.Комбинация глюкозы неуглеводного происхождения, например, жиров и белков. Это происходит только тогда, когда запасы гликогена в печени истощены. Этот путь представляет собой решающий разворот гликолиза с пирувата на глюкозу и может использовать многие источники, такие как аминокислоты, глицерин и цикл Кребса . Крупномасштабный катаболизм белков и жиров обычно возникает, когда человек страдает от голодания или определенных эндокринных нарушений. [50] Печень называемый регенерирует глюкозу, используя процесс, глюконеогенезом . Этот процесс не совсем противоположен гликолизу и на самом деле требует в три раза больше энергии, получаемой при гликолизе (используется шесть молекул АТФ по сравнению с двумя, полученными при гликолизе). Аналогично вышеупомянутым реакциям, полученная глюкоза может затем подвергаться гликолизу в тканях, которым нужна энергия, сохраняться в виде гликогена (или крахмала в растениях) или превращаться в другие моносахариды или присоединяться к ди- или олигосахаридам. Комбинированный путь гликолиза во время физических упражнений, проникновения лактата через кровоток в печень, последующего глюконеогенеза и выброса глюкозы в кровоток называется циклом Кори . [51]
науками «молекулярного масштаба с другими биологическими Связь »
В этом разделе есть несколько проблем. Пожалуйста, помогите улучшить его или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалять эти шаблонные сообщения )
|

Исследователи в области биохимии используют специфические методы, присущие биохимии, но все чаще сочетают их с методами и идеями, разработанными в области генетики , молекулярной биологии и биофизики . Между этими дисциплинами нет четкой границы. Биохимия изучает химию, необходимую для биологической активности молекул, молекулярная биология изучает их биологическую активность, генетика изучает их наследственность, которая передается их геномом . Это показано на следующей схеме, которая изображает один из возможных вариантов взаимосвязей между полями:
- Биохимия — наука о химических веществах и процессах жизнедеятельности, происходящих в живых организмах . Биохимики уделяют большое внимание роли, функциям и структуре биомолекул . Изучение химии биологических процессов и синтез биологически активных молекул являются приложениями биохимии. Биохимия изучает жизнь на атомном и молекулярном уровне.
- Генетика – это изучение влияния генетических различий на организмы. Об этом часто можно судить по отсутствию нормального компонента (например, одного гена ). Изучение « мутантов » — организмов, у которых отсутствует один или несколько функциональных компонентов по отношению к так называемому « дикому типу » или нормальному фенотипу . Генетические взаимодействия ( эпистаз ) часто могут сбить с толку простые интерпретации таких « нокаут- исследований».
- Молекулярная биология — это изучение молекулярных основ биологических явлений с упором на молекулярный синтез, модификацию, механизмы и взаимодействия. Центральная догма молекулярной биологии , согласно которой генетический материал транскрибируется в РНК, а затем транслируется в белок , несмотря на чрезмерное упрощение, по-прежнему обеспечивает хорошую отправную точку для понимания этой области. Эта концепция была пересмотрена в свете появления новых ролей РНК .
- Химическая биология стремится разработать новые инструменты на основе малых молекул , которые позволяют минимально возмущать биологические системы, предоставляя при этом подробную информацию об их функциях. Кроме того, химическая биология использует биологические системы для создания неприродных гибридов между биомолекулами и синтетическими устройствами (например, опустошенными вирусными капсидами , которые могут доставлять генную терапию или молекулы лекарств ).
См. также [ править ]
Списки [ править ]
См. также [ править ]
- Астробиология
- Биохимия (журнал)
- Биологическая химия (журнал)
- Биофизика
- Химическая экология
- Компьютерное биомоделирование
- Специальный химикат биологического происхождения
- Номер ЕС
- Гипотетические типы биохимии
- Международный союз биохимии и молекулярной биологии
- Метаболом
- Метаболомика
- Молекулярная биология
- Молекулярная медицина
- Биохимия растений
- Протеолиз
- Малая молекула
- Структурная биология
- цикл ТСА
Примечания [ править ]
- ^ Фруктоза — не единственный сахар, содержащийся во фруктах. Глюкоза и сахароза также содержатся в различных количествах в различных фруктах и иногда превышают присутствующую фруктозу. Например, 32% съедобной части фиников составляет глюкоза, по сравнению с 24% фруктозы и 8% сахарозы. Однако персики содержат больше сахарозы (6,66%), чем фруктозы (0,93%) или глюкозы (1,47%). [37]
Ссылки [ править ]
- ^ «Биологическое/Биохимия» . acs.org . Архивировано из оригинала 21 августа 2019 г. Проверено 4 января 2016 г.
- ^ Jump up to: Перейти обратно: а б Воэт (2005), с. 3.
- ^ Карп (2009), с. 2.
- ^ Миллер (2012). п. 62.
- ^ Эстбери (1961), с. 1124.
- ^ Элдер (2007), с. 45.
- ^ Маркс (2012), Глава 14.
- ^ Финкель (2009), стр. 1–4.
- ^ ЮНИСЕФ (2010), стр. 61, 75.
- ^ Jump up to: Перейти обратно: а б Хелвоорт (2000), с. 81.
- ^ Хантер (2000), с. 75.
- ^ Хэмблин (2005), с. 26.
- ^ Хантер (2000), стр. 96–98.
- ^ Берг (1980), стр. 1–2.
- ^ Холмс (1987), с. хв.
- ^ Фельдман (2001), с. 206.
- ^ Рейнер-Кэнхэм (2005), с. 136.
- ^ Зиесак (1999), с. 169.
- ^ Кляйнкауф (1988), с. 116.
- ^ Бен-Менахем (2009), с. 2982.
- ^ Амслер (1986), с. 55.
- ^ Хортон (2013), с. 36.
- ^ Кляйнкауф (1988), с. 43.
- ^ Эдвардс (1992), стр. 1161–1173.
- ^ Фиске (1890), стр. 419–20.
- ^ Вёлер, Ф. (1828). «Об искусственном образовании мочевины» . Анналы физики и химии . 88 (2): 253–256. Бибкод : 1828АнП....88..253Вт . дои : 10.1002/andp.18280880206 . ISSN 0003-3804 . Архивировано из оригинала 28 октября 2023 г. Проверено 4 мая 2021 г.
- ^ Кауфман (2001), стр. 121–133.
- ^ Липман, Тимоти О. (август 1964 г.). «Приготовление Вёлером мочевины и судьба витализма» . Журнал химического образования . 41 (8): 452. Бибкод : 1964ЖЧЭд..41..452Л . дои : 10.1021/ed041p452 . ISSN 0021-9584 . Архивировано из оригинала 28 октября 2023 г. Проверено 4 мая 2021 г.
- ^ Тропп (2012), стр. 19–20.
- ^ Рак (2012), с. 32.
- ^ Батлер (2009), с. 5.
- ^ Чандан (2007), стр. 193–194.
- ^ Кокс, Нельсон, Ленинджер (2008). Ленингерские принципы биохимии . Макмиллан.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Нильсен (1999), стр. 283–303.
- ^ Слабо (2007), стр. 3–6.
- ^ Уайтинг (1970), стр. 1–31.
- ^ Уайтинг , GC (1970), с. 5.
- ^ Фут (2005), стр. 358–359.
- ^ Varki (1999), p. 17.
- ^ Страйер (2007), с. 328.
- ^ Воэт (2005), Гл. 12 Липиды и мембраны.
- ^ Ахмед, Саба; Шах, Парини; Ахмед, Овайс (2023), «Биохимия, липиды» , StatPearls , Остров сокровищ (Флорида): StatPearls Publishing, PMID 30247827 , получено 30 ноября 2023 г.
- ^ Мецлер (2001), с. 58.
- ^ Файги, Матиас Дж.; Хендершот, Линда М.; Бюхнер, Йоханнес (2010). «Как сворачиваются антитела» . Тенденции биохимических наук . 35 (4): 189–198. дои : 10.1016/j.tibs.2009.11.005 . ПМЦ 4716677 . ПМИД 20022755 .
- ^ Фромм и Харгроув (2012), стр. 35–51.
- ^ Сенгер (1984), с. 84.
- ^ «Дисахарид» . Британская энциклопедия . Архивировано из оригинала 19 октября 2023 года . Проверено 14 октября 2023 г.
- ^ Фромм и Харгроув (2012), стр. 163–180.
- ^ Фут (2005), Гл. 17 Гликолиз.
- ^ Биологический словарь . Издательство Оксфордского университета. 17 сентября 2015 г. ISBN 9780198714378 . Архивировано из оригинала 10 июля 2020 года . Проверено 29 апреля 2020 г.
- ^ Фромм и Харгроув (2012), стр. 183–194.
Цитированная литература [ править ]
- Амслер, Марк (1986). Языки творчества: модели, решение проблем, дискурс . Университет Делавэра Пресс. ISBN 978-0-87413-280-9 . Архивировано из оригинала 28 октября 2023 г. Проверено 27 июля 2015 г.
- Эстбери, WT (1961). «Молекулярная биология или ультраструктурная биология?» . Природа . 190 (4781): 1124. Бибкод : 1961Natur.190.1124A . дои : 10.1038/1901124a0 . ПМИД 13684868 . S2CID 4172248 .
- Бен-Менахем, Ари (2009). Историческая энциклопедия естественных и математических наук . Спрингер. п. 2982. Бибкод : 2009henm.book.....B . ISBN 978-3-540-68831-0 .
- Бертон, Фельдман (2001). Нобелевская премия: история гения, противоречий и престижа . Аркадное издательство. ISBN 978-1-55970-592-9 .
- Батлер, Джон М. (2009). Основы судебно-медицинского типирования ДНК . Академическая пресса. ISBN 978-0-08-096176-7 .
- Сен, Чандан К.; Рой, Сашвати (2007). «МиРНК: лицензия на убийство посланника». ДНК и клеточная биология . 26 (4): 193–194. дои : 10.1089/dna.2006.0567 . PMID 17465885 . S2CID 10665411 .
- Кларенс, Питер Берг (1980). Университет Айовы и биохимия с самого начала . Университет Айовы. ISBN 978-0-87414-014-9 . Архивировано из оригинала 28 октября 2023 г. Проверено 27 июля 2015 г.
- Эдвардс, Карен Дж.; Браун, Дэвид Г.; Спинк, Нил; Скелли, Джейн В.; Нидл, Стивен (1992). «Молекулярная структура додекамера B-ДНК d (CGCAAATTTGCG)2: исследование скручивания пропеллера и структуры воды в малых канавках при разрешении 2,2 Å». Журнал молекулярной биологии . 226 (4): 1161–1173. дои : 10.1016/0022-2836(92)91059-х . ПМИД 1518049 .
- Эльдра П. Соломон; Линда Р. Берг; Дайана В. Мартин (2007). Биология, 8-е издание, международное студенческое издание . Томсон Брукс/Коул. ISBN 978-0-495-31714-2 . Архивировано из оригинала 4 марта 2016 г.
- Фариселли, П.; Росси, И.; Каприотти, Э.; Касадио, Р. (2006). «WWWH дистанционного обнаружения гомологов: современное состояние» . Брифинги по биоинформатике . 8 (2): 78–87. дои : 10.1093/bib/bbl032 . ПМИД 17003074 .
- Фиск, Джон (1890). Очерки космической философии, основанной на доктринах эволюции, с критикой позитивной философии, Том 1 . Бостон и Нью-Йорк: Хоутон, Миффлин. Архивировано из оригинала 28 октября 2023 года . Проверено 16 февраля 2015 г.
- Финкель, Ричард; Кубедду, Луиджи; Кларк, Мишель (2009). Иллюстрированные обзоры Липпинкотта: фармакология (4-е изд.). Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-7155-9 . Архивировано из оригинала 28 октября 2023 г. Проверено 5 июня 2020 г.
- Кребс, Джоселин Э.; Гольдштейн, Эллиот С.; Левин, Бенджамин; Килпатрик, Стивен Т. (2012). Незаменимые гены . Издательство Джонс и Бартлетт. ISBN 978-1-4496-1265-8 .
- Фромм, Герберт Дж.; Харгроув, Марк (2012). Основы биохимии . Спрингер. ISBN 978-3-642-19623-2 . Архивировано из оригинала 28 октября 2023 г. Проверено 5 июня 2020 г.
- Хэмблин, Джейкоб Дарвин (2005). Наука в начале двадцатого века: энциклопедия . АВС-КЛИО. ISBN 978-1-85109-665-7 . Архивировано из оригинала 28 октября 2023 г. Проверено 27 июля 2015 г.
- Хелворт, Тон ван (2000). Арне Хессенбрух (ред.). Путеводитель для читателей по истории науки . Издательство Фицрой Дирборн. ISBN 978-1-884964-29-9 . Архивировано из оригинала 28 октября 2023 г. Проверено 27 июля 2015 г.
- Холмс, Фредерик Лоуренс (1987). Лавуазье и химия жизни: исследование научного творчества . Университет Висконсина Пресс. ISBN 978-0-299-09984-8 . Архивировано из оригинала 28 октября 2023 г. Проверено 27 июля 2015 г.
- Хортон, Дерек, изд. (2013). Достижения в области химии и биохимии углеводов, том 70 . Академическая пресса. ISBN 978-0-12-408112-3 . Архивировано из оригинала 28 октября 2023 г. Проверено 27 июля 2015 г.
- Хантер, Грэм К. (2000). Жизненные силы: открытие молекулярной основы жизни . Академическая пресса. ISBN 978-0-12-361811-5 . Архивировано из оригинала 28 октября 2023 г. Проверено 5 июня 2020 г.
- Карп, Джеральд (2009). Клеточная и молекулярная биология: концепции и эксперименты . Джон Уайли и сыновья. ISBN 978-0-470-48337-4 .
- Кауфман, Джордж Б.; Чулджян, Стивен Х. (2001). «Фридрих Вёлер (1800–1882) к двухсотлетию со дня его рождения». Химический педагог . 6 (2): 121–133. дои : 10.1007/s00897010444a . S2CID 93425404 .
- Кляйнкауф, Хорст; Дёрен, Ганс фон; Янике Лотар (1988). Корни современной биохимии: закорючка Фрица Липпмана и ее последствия . Уолтер де Грюйтер и компания, с. 116. ИСБН 978-3-11-085245-5 . Архивировано из оригинала 28 октября 2023 г. Проверено 27 июля 2015 г.
- Ноулз, младший (1980). «Реакции переноса фосфорила, катализируемые ферментами». Ежегодный обзор биохимии . 49 : 877–919. дои : 10.1146/annurev.bi.49.070180.004305 . ПМИД 6250450 . S2CID 7452392 .
- Мецлер, Дэвид Эверетт; Мецлер, Кэрол М. (2001). Биохимия: химические реакции живых клеток . Том. 1. Академическая пресса. ISBN 978-0-12-492540-3 .
- Миллер Дж; Спулмен Скотт (2012). Наука об окружающей среде: биоразнообразие является важнейшей частью природного капитала Земли . Cengage Обучение . ISBN 978-1-133-70787-5 . Архивировано из оригинала 13 апреля 2023 г. Проверено 4 января 2016 г.
- Нильсен, Форрест Х. (1999). «Ультраследовые минералы». У Мориса Э. Шилса; и др. (ред.). Современное питание в здоровье и болезнях . Балтимор: Уильямс и Уилкинс. стр. 283–303. hdl : 10113/46493 .
- Пит, Алиса (2012). Маркс, Аллан; Либерман Майкл А. (ред.). Основная медицинская биохимия Маркса (Либерман, Основная медицинская биохимия Маркса) (4-е изд.). Липпинкотт Уильямс и Уилкинс. ISBN 978-1-60831-572-7 . Архивировано из оригинала 28 октября 2023 г. Проверено 5 июня 2020 г.
- Рейнер-Кэнхэм, Марелин Ф.; Рейнер-Кэнхэм, Марелин; Рейнер-Кэнхэм, Джеффри (2005). Женщины в химии: их меняющиеся роли от времен алхимии до середины двадцатого века . Фонд химического наследия. ISBN 978-0-941901-27-7 .
- Рохас-Руис, Фернандо А.; Варгас-Мендес, Леонор Ю.; Кузнецов, Владимир В. (2011). «Проблемы и перспективы химической биологии, успешной междисциплинарной области естественных наук» . Молекулы . 16 (3): 2672–2687. дои : 10.3390/molecules16032672 . ПМК 6259834 . ПМИД 21441869 .
- Сенгер, Вольфрам (1984). Принципы структуры нуклеиновых кислот . Нью-Йорк: Springer-Verlag. ISBN 978-0-387-90762-8 . Архивировано из оригинала 28 октября 2023 г. Проверено 5 июня 2020 г.
- Слабо, Майкл Р.; Сигер, Спенсер Л. (2013). Органика и биохимия сегодня (6-е изд.). Пасифик Гроув: Брукс Коул. ISBN 978-1-133-60514-0 . Архивировано из оригинала 28 октября 2023 г. Проверено 5 июня 2020 г.
- Шервуд, Лорали; Кландорф, Хиллар; Янси, Пол Х. (2012). Физиология животных: от генов к организмам . Cengage Обучение. ISBN 978-0-8400-6865-1 .
- Страйер Л., Берг Дж.М., Тимочко Дж.Л. (2007). Биохимия (6-е изд.). Сан-Франциско: WH Freeman. ISBN 978-0-7167-8724-2 .
- Тропп, Бертон Э. (2012). Молекулярная биология (4-е изд.). Джонс и Бартлетт Обучение. ISBN 978-1-4496-0091-4 . Архивировано из оригинала 28 октября 2023 г. Проверено 5 июня 2020 г.
- ЮНИСЕФ (2010). Факты из жизни (PDF) (4-е изд.). Нью-Йорк: Детский фонд ООН. ISBN 978-92-806-4466-1 . Архивировано (PDF) из оригинала 9 октября 2022 г.
- Улвелинг, Дэмиен; Франкастель, Клэр; Юбе, Флоран (2011). «Когда один лучше двух: РНК с двойными функциями» (PDF) . Биохимия . 93 (4): 633–644. дои : 10.1016/j.biochi.2010.11.004 . ПМИД 21111023 . S2CID 22165949 . Архивировано (PDF) из оригинала 9 октября 2022 г.
- Варки А., Каммингс Р., Эско Дж., Джессика Ф., Харт Дж., Март Дж. (1999). Основы гликобиологии . Лабораторный пресс Колд-Спринг-Харбор. ISBN 978-0-87969-560-6 . Архивировано из оригинала 28 октября 2023 г. Проверено 5 июня 2020 г.
- Фут, Д; Фут, Дж. Г. (2005). Биохимия (3-е изд.). Хобокен, Нью-Джерси: John Wiley & Sons Inc. ISBN 978-0-471-19350-0 . Архивировано из оригинала 11 сентября 2007 года.
- Уайтинг, GC (1970). «Сахарики» . В AC Hulme (ред.). Биохимия фруктов и продуктов из них . Том. 1. Лондон и Нью-Йорк: Академическая пресса. ISBN 978-0-12-361201-4 .
- Зиесак, Анн-Катрин; Крам Ханс-Роберт (1999). Издательство Уолтера де Грюйтера, 1749–1999 гг . Уолтер де Грюйтер и Ко. ISBN 978-3-11-016741-2 . Архивировано из оригинала 28 октября 2023 г. Проверено 27 июля 2015 г.
- Эшкрофт, Стив. «Профессор сэр Филип Рэндл; исследователь метаболизма: [1-е издание]». Независимый . ПроКвест 311080685 .
Дальнейшее чтение [ править ]
- Фрутон, Джозеф С. Белки, ферменты, гены: взаимодействие химии и биологии . Издательство Йельского университета: Нью-Хейвен, 1999. ISBN 0-300-07608-8
- Кейт Робертс, Мартин Рафф, Брюс Альбертс, Питер Уолтер, Джулиан Льюис и Александр Джонсон, Молекулярная биология клетки
- 4-е издание, Routledge, март 2002 г., твердый переплет, 1616 стр. ISBN 0-8153-3218-1
- 3-е издание, Гарланд, 1994 г., ISBN 0-8153-1620-8
- 2-е издание, Гарланд, 1989 г., ISBN 0-8240-3695-6
- Колер, Роберт. От медицинской химии к биохимии: создание биомедицинской дисциплины . Издательство Кембриджского университета, 1982.
- Маджио, Лорен А.; Виллинский, Джон М.; Стейнберг, Райан М.; Митчен, Дэниел; Васс, Джозеф Л.; Донг, Тин (2017). «Arc.Ask3.Ru как ворота к биомедицинским исследованиям: относительное распределение и использование цитат в английской Википедии» . ПЛОС ОДИН . 12 (12): e0190046. Бибкод : 2017PLoSO..1290046M . дои : 10.1371/journal.pone.0190046 . ПМЦ 5739466 . ПМИД 29267345 .
Внешние ссылки [ править ]
- «Биохимическое общество» .
- Виртуальная библиотека биохимии, молекулярной биологии и клеточной биологии
- Биохимия, 5-е изд. Полный текст Берга, Тимочко и Страйера любезно предоставлен NCBI .
- SystemsX.ch – Швейцарская инициатива в области системной биологии
- Полный текст вводного учебника по биохимии Кевина и Индиры «Биохимия».




