Цикл лимонной кислоты

Цикл лимонной кислоты , также известный как цикл Кребса , цикл Сента-Дьёрдьи-Кребса или цикл ТСА (цикл трикарбоновых кислот). [1] [2] — это серия биохимических реакций, направленных на высвобождение энергии, запасенной в питательных веществах, посредством окисления ацетил -КоА, полученного из углеводов , жиров и белков . Высвободившаяся химическая энергия доступна в форме АТФ . Цикл Кребса используется организмами , которые дышат (в отличие от организмов, которые ферментируют ) для выработки энергии посредством анаэробного или аэробного дыхания . Кроме того, цикл обеспечивает предшественников некоторых аминокислот , а также восстановителя НАДН , которые используются во многих других реакциях. Его центральное значение для многих биохимических путей позволяет предположить, что он был одним из самых ранних компонентов метаболизма . [3] [4] Несмотря на то, что это называется «циклом», метаболитам не обязательно следовать только одним конкретным маршрутом; были признаны по крайней мере три альтернативных сегмента цикла лимонной кислоты. [5]
Название этого метаболического пути происходит от лимонной кислоты ( трикарбоновой кислоты , часто называемой цитратом, поскольку ионизированная форма преобладает при биологическом pH). [6] ), который потребляется, а затем регенерируется в ходе этой последовательности реакций для завершения цикла. В цикле расходуются ацетат (в форме ацетил-КоА) и вода , снижается НАД. + НАДН с выделением углекислого газа. НАДН, вырабатываемый в ходе цикла лимонной кислоты, подается на путь окислительного фосфорилирования (транспорта электронов). Конечным результатом этих двух тесно связанных путей является окисление питательных веществ с получением полезной химической энергии в форме АТФ.
В эукариотических клетках цикл лимонной кислоты происходит в матриксе митохондрий . В прокариотических клетках, таких как бактерии, у которых отсутствуют митохондрии, последовательность реакций цикла лимонной кислоты осуществляется в цитозоле, при этом градиент протонов для производства АТФ проходит через поверхность клетки ( плазматическую мембрану ), а не через внутреннюю мембрану митохондрии .
На каждую молекулу пирувата (в результате гликолиза) общий выход энергосодержащих соединений цикла трикарбоновых кислот составляет три НАДН, один ФАДН 2 и один ГТФ . [7]
Открытие
[ редактировать ]Некоторые компоненты и реакции цикла лимонной кислоты были установлены в 1930-х годах в результате исследований Альберта Сент-Дьёрдьи , получившего Нобелевскую премию по физиологии и медицине в 1937 году специально за открытия, относящиеся к фумаровой кислоте , компоненту цикла. . [8] Это открытие он сделал, изучая грудную мышцу голубя. Поскольку эта ткань хорошо сохраняет свою окислительную способность после разрушения в мясорубке Латапи и высвобождения в водные растворы, грудная мышца голубя была очень хорошо подготовлена для изучения окислительных реакций. [9] Сам цикл лимонной кислоты был окончательно идентифицирован в 1937 году Гансом Адольфом Кребсом и Уильямом Артуром Джонсоном в Университете Шеффилда . [10] за что первый получил Нобелевскую премию по физиологии и медицине в 1953 году и в честь которого этот цикл иногда называют «циклом Кребса». [11]
Обзор
[ редактировать ]Этот раздел нуждается в дополнительных цитатах для проверки . ( август 2022 г. ) |

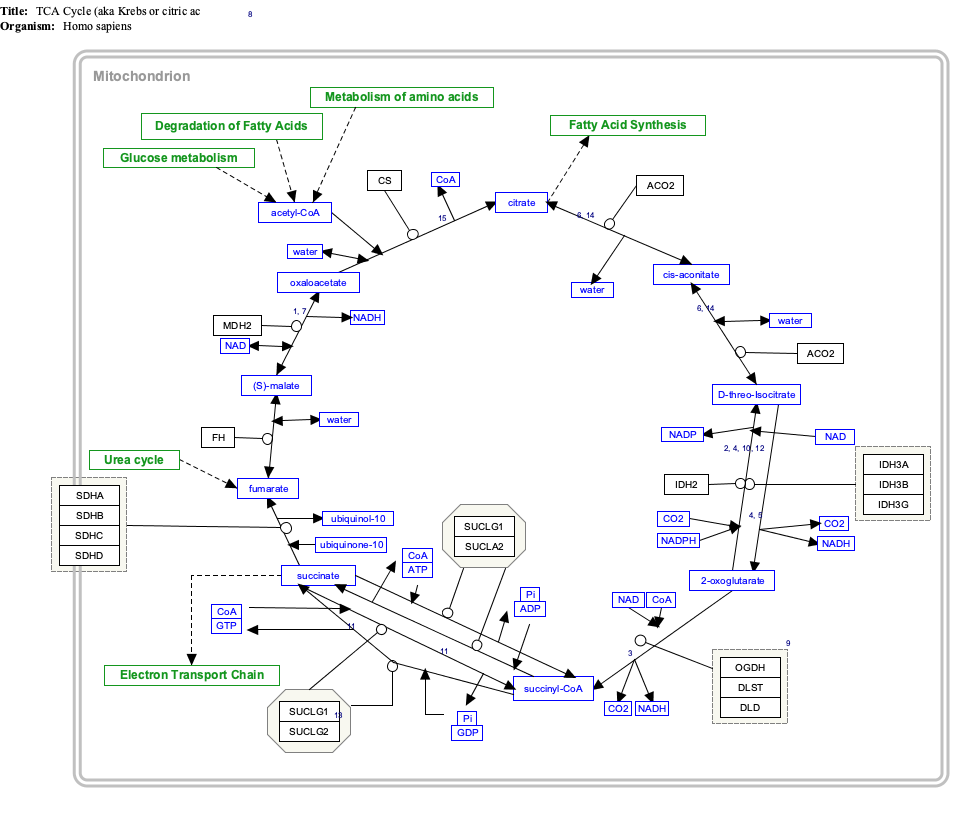
Цикл лимонной кислоты представляет собой метаболический путь , который соединяет углеводный , жировой и белковый обмен . Реакции . цикла осуществляются восемью ферментами , которые полностью окисляют ацетат (двууглеродную молекулу) в форме ацетил-КоА до двух молекул углекислого газа и воды В результате катаболизма сахаров, жиров и белков образуется двухуглеродный органический продукт ацетил-КоА, который вступает в цикл лимонной кислоты. Реакции цикла также преобразуют три эквивалента никотинамидадениндинуклеотида (НАД + ) на три эквивалента восстановленного НАД + (NADH), один эквивалент флавинадениндинуклеотида (FAD) на один эквивалент FADH 2 и по одному эквиваленту гуанозиндифосфата (GDP) и неорганического фосфата (P i ) на один эквивалент гуанозинтрифосфата (GTP). НАДН и ФАДН 2 , генерируемые циклом лимонной кислоты, в свою очередь, используются в пути окислительного фосфорилирования для генерации богатого энергией АТФ.
Одним из основных источников ацетил-КоА является расщепление сахаров путем гликолиза , в результате которого образуется пируват , который, в свою очередь, декарбоксилируется комплексом пируватдегидрогеназы с образованием ацетил-КоА в соответствии со следующей схемой реакции:
Продукт этой реакции, ацетил-КоА, является отправной точкой цикла лимонной кислоты. Ацетил-КоА также можно получить путем окисления жирных кислот . Ниже схематично представлен цикл:
- Цикл лимонной кислоты начинается с переноса двухуглеродной ацетильной группы от ацетил-КоА к четырехуглеродному акцепторному соединению (оксалоацетату) с образованием шестиуглеродного соединения (цитрата).
- Затем цитрат претерпевает ряд химических превращений, теряя две карбоксильные группы в виде CO 2 . Углероды, потерянные в виде CO 2, происходят из оксалоацетата, а не непосредственно из ацетил-КоА. Углероды, пожертвованные ацетил-КоА, становятся частью углеродной цепи оксалоацетата после первого витка цикла лимонной кислоты. Потеря углерода, пожертвованного ацетил-КоА, в виде CO 2 требует нескольких оборотов цикла лимонной кислоты. Однако из-за роли цикла лимонной кислоты в анаболизме они не могут быть потеряны, поскольку многие промежуточные соединения цикла лимонной кислоты также используются в качестве предшественников для биосинтеза других молекул. [12]
- Большая часть электронов, ставших доступными на окислительных этапах цикла, переносится на НАД. + , образуя НАДН. На каждую ацетильную группу, вступающую в цикл лимонной кислоты, образуется три молекулы НАДН. Цикл лимонной кислоты включает серию окислительно-восстановительных реакций в митохондриях. [ нужны разъяснения ] [13]
- Кроме того, электроны со стадии окисления сукцината передаются сначала на кофактор FAD сукцинатдегидрогеназы, восстанавливая его до FADH 2 и, в конечном итоге, до убихинона (Q) в митохондриальной мембране , восстанавливая его до убихинола (QH 2 ), который является субстратом. цепи переноса электрона на уровне Комплекса III .
- На каждые НАДН и ФАДН 2 , образующиеся в цикле трикарбоновых кислот, при окислительном фосфорилировании образуется 2,5 и 1,5 молекулы АТФ соответственно.
- В конце каждого цикла четырехуглеродный оксалоацетат регенерируется, и цикл продолжается.
Шаги
[ редактировать ]Цикл лимонной кислоты состоит из десяти основных этапов, как описано ниже. В цикл непрерывно подается новый углерод в виде ацетил-КоА , поступающий на шаг 0 в табл. [14]
| Тип реакции | Субстраты | Фермент | Продукты | Комментарий | |
|---|---|---|---|---|---|
| 0 / 10 | Альдольная конденсация | Оксалоацетат + Ацетил-КоА + H 2 O | Цитратсинтаза | Цитрат + КоА-SH | 4C необратимо, удлиняет оксалоацетат до молекулы 6C. |
| 1 | Обезвоживание | Цитрат | Аконитаза | цис - Аконитат + H 2 O | обратимая изомеризация |
| 2 | Увлажнение | цис -Аконитат + H 2 O | Изоцитрат | ||
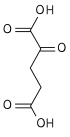
| 3 | Окисление | Изоцитрат + НАД + | Изоцитратдегидрогеназа | Оксалосукцинат + НАДН + Н + | генерирует НАДН (эквивалент 2,5 АТФ) |
| 4 | Декарбоксилирование | оксалосукцинат | α-кетоглутарат + CO 2 | лимитирующая скорость, необратимая стадия, генерирует молекулу 5C | |
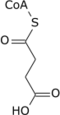
| 5 | окислительный декарбоксилирование | α-Кетоглутарат + НАД + + КоА-Ш | α-кетоглутарат дегидрогеназа , тиаминпирофосфат , липоевая кислота , Mg++,транссукцинитаза | Сукцинил-КоА + НАДН + Н + + СО 2 | необратимая стадия, генерирует НАДН (эквивалент 2,5 АТФ), регенерирует цепь 4С (исключая КоА) |
| 6 | уровень субстрата фосфорилирование | Сукцинил-КоА + ВВП + P i | Сукцинил-КоА-синтетаза | Сукцинат + КоА-SH + ГТФ | или АДФ → АТФ вместо ВВП→ГТП, [15] генерирует 1 АТФ или эквивалент. Реакция конденсации GDP и + Pi O , необходимую для гидролиз сукцинил -КоА включает H 2 сбалансированного уравнения. |
| 7 | Окисление | Сукцинат + убихинон (Q) | Сукцинатдегидрогеназа | Фумарат + убихинол (QH 2 ) | использует FAD в качестве простетической группы (FAD → FADH 2 на первой стадии реакции) в ферменте. [15] Эти два электрона позже передаются в QH 2 во время Комплекса II ETC, где они генерируют эквивалент 1,5 АТФ. |
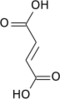
| 8 | Увлажнение | Фумарат + H 2 O | Фумараза | Л - Больной | Гидратация двойной связи CC |
| 9 | Окисление | L -Малат + НАД + | Малатдегидрогеназа | Оксалоацетат + НАДН + Н + | обратимый (фактически равновесие благоприятствует малату), генерирует НАДН (эквивалент 2,5 АТФ) |
| 10 / 0 | Альдольная конденсация | Оксалоацетат + Ацетил-КоА + H 2 O | Цитратсинтаза | Цитрат + КоА-SH | Это то же самое, что и шаг 0, и цикл перезапускается. Реакция необратима и приводит к расширению оксалоацетата 4C до молекулы 6C. |
Два углерода атома окисляются до CO 2 , энергия этих реакций передается на другие метаболические процессы через ГТФ (или АТФ), а также в виде электронов в НАДН и QH 2 . НАДН, образующийся в цикле лимонной кислоты, позже может быть окислен (пожертвовать свои электроны), чтобы стимулировать синтез АТФ в процессе, называемом окислительным фосфорилированием . [6] FADH 2 ковалентно связан с сукцинатдегидрогеназой , ферментом, который действует как в цикле лимонной кислоты, так и в митохондриальной цепи переноса электронов при окислительном фосфорилировании. Таким образом, FADH 2 облегчает перенос электронов на кофермент Q , который является конечным акцептором электронов реакции, катализируемой комплексом сукцинат:убихинон оксидоредуктаза, а также действует как промежуточное соединение в цепи переноса электронов . [15]
Митохондрии животных, включая человека, обладают двумя сукцинил-КоА- синтетазами: одна, которая производит ГТФ из ВВП, и другая, которая производит АТФ из АДФ. [16] Растения имеют тип, который производит АТФ (АДФ-образующую сукцинил-КоА-синтетазу). [14] Некоторые ферменты цикла могут быть слабо связаны в мультиферментный белковый комплекс внутри митохондриального матрикса . [17]
ГТФ, образуемый ГДФ-образующей сукцинил-КоА-синтетазой, может быть использован нуклеозид-дифосфаткиназой для образования АТФ (катализируемая реакция: ГТФ + АДФ → ГДФ + АТФ). [15]
Продукты
[ редактировать ]Продуктами первого витка цикла являются один ГТФ (или АТФ ), три НАДН , один ФАДН 2 и два СО 2 .
Поскольку две молекулы образуются из каждой молекулы глюкозы ацетил-КоА , на каждую молекулу глюкозы требуется два цикла. Таким образом, в конце двух циклов продуктами являются: два ГТФ, шесть НАДН, два ФАДН 2 и четыре СО 2 . [18]
| Описание | Реагенты | Продукты |
|---|---|---|
| Сумма всех реакций цикла лимонной кислоты равна: | Ацетил-КоА + 3 СУДД + + ФАД + ВВП + P i + 2 H 2 O | → КоА-SH + 3 НАДН + ФАДН 2 + 3 Н + + ГТФ + 2 СО 2 |
| Объединив реакции, происходящие во время окисления пирувата, с реакциями, происходящими во время цикла лимонной кислоты, получается следующая общая реакция окисления пирувата: | Pyruvate ion + 4 NAD + + ФАД + ВВП + P i + 2 H 2 O | → 4 ПРОМЫВКА + ФАДХ 2 + 4 Ч + + ГТФ + 3 СО 2 |
| Объединив приведенную выше реакцию с реакциями, протекающими в ходе гликолиза , получают следующую общую реакцию окисления глюкозы (без учета реакций в дыхательной цепи): | Глюкоза + 10 НАД + + 2 ФАД + 2 АДФ + 2 ВВП + 4 П i + 2 H 2 O | → 10 НАДН + 2 ФАДН 2 + 10 Н + + 2 АТФ + 2 ГТФ + 6 СО 2 |
Вышеуказанные реакции являются сбалансированными, если Pi представляет собой H 2 PO 4 − ион, ADP и ВВП ADP 2− и ВВП 2− ионы соответственно, а АТФ и ГТФ — АТФ 3− и ГТП 3− ионы соответственно.
Общее количество молекул АТФ, полученных после полного окисления одной глюкозы в гликолизе, цикле трикарбоновой кислоты и окислительном фосфорилировании , оценивается в пределах 30–38. [19]
Эффективность
[ редактировать ]Теоретический максимальный выход АТФ при окислении одной молекулы глюкозы при гликолизе, цикле лимонной кислоты и окислительном фосфорилировании составляет 38 (при условии, что на эквивалент НАДН приходится 3 молярных эквивалента АТФ, а на ФАДН 2 — 2 молярных эквивалента АТФ ). У эукариот два эквивалента НАДН и два эквивалента АТФ образуются при гликолизе , который происходит в цитоплазме . При транспортировке с использованием глицеринфосфатного челнока, а не малатно-аспартатного челнока , транспорт двух из этих эквивалентов НАДН в митохондрии эффективно потребляет два эквивалента АТФ, тем самым снижая чистое производство АТФ до 36. Кроме того, неэффективность окислительного фосфорилирования из-за Утечка протонов через митохондриальную мембрану и проскальзывание АТФ-синтазы /протонного насоса обычно снижает выход АТФ из НАДН и ФАДН 2 до значений, меньших теоретического максимального выхода. [19] Таким образом, наблюдаемые выходы приближаются к ~2,5 АТФ на НАДН и ~1,5 АТФ на ФАДН 2 , что еще больше снижает общее чистое производство АТФ примерно до 30. [20] Оценка общего выхода АТФ с учетом недавно пересмотренного соотношения протонов к АТФ дает оценку 29,85 АТФ на молекулу глюкозы. [21]
Вариация
[ редактировать ]Хотя цикл лимонной кислоты в целом очень консервативен, существует значительная вариабельность ферментов, обнаруженных у разных таксонов. [22] (обратите внимание, что диаграммы на этой странице относятся к варианту пути млекопитающих).
Между эукариотами и прокариотами существуют некоторые различия. Превращение D- трео -изоцитрата в 2-оксоглутарат у эукариот катализируется НАД. + -зависимый EC 1.1.1.41 , тогда как прокариоты используют НАДФ + -зависимый ЕС 1.1.1.42 . [23] Аналогично, превращение ( S )-малата в оксалоацетат у эукариот катализируется НАД. + -зависимый EC 1.1.1.37 , тогда как большинство прокариот используют хинон-зависимый фермент EC 1.1.5.4 . [24]
Стадией со значительной вариабельностью является превращение сукцинил-КоА в сукцинат. Большинство организмов используют EC 6.2.1.5 , сукцинат-КоА-лигазу (АДФ-образующую) (несмотря на название, фермент действует на пути образования АТФ). У млекопитающих также действует GTP-образующий фермент сукцинат-КоА-лигаза (GDP-образующая) ( EC 6.2.1.4 ). Уровень использования каждой изоформы зависит от ткани. [25] У некоторых бактерий, продуцирующих ацетат, таких как Acetobacter aceti , это превращение катализирует совершенно другой фермент – EC 2.8.3.18 , сукцинил-КоА:ацетат-КоА-трансфераза. Этот специализированный фермент связывает цикл ТСА с метаболизмом ацетата в этих организмах. [26] Некоторые бактерии, такие как Helicobacter pylori , используют для этого преобразования еще один фермент – сукцинил-КоА:ацетоацетат-КоА-трансферазу ( EC 2.8.3.5 ). [27]
Некоторая вариабельность существует и на предыдущем этапе – превращении 2-оксоглутарата в сукцинил-КоА. Хотя большинство организмов используют вездесущий НАД + -зависимая 2-оксоглутаратдегидрогеназа, некоторые бактерии используют ферредоксин-зависимую 2-оксоглутаратсинтазу ( EC 1.2.7.3 ). [28] Другие организмы, включая облигатно автотрофные и метанотрофные бактерии и археи, полностью обходят сукцинил-КоА и превращают 2-оксоглутарат в сукцинат через сукцинат-полуальдегид , используя EC 4.1.1.71 , 2-оксоглутаратдекарбоксилазу, и EC 1.2.1.79 , сукцинат-полуальдегиддегидрогеназу. . [29]
При раке происходят существенные метаболические нарушения , которые обеспечивают пролиферацию опухолевых клеток, и, следовательно, могут накапливаться метаболиты, способствующие онкогенезу , называемые онко- метаболитами . [30] Среди наиболее охарактеризованных онкометаболитов - 2-гидроксиглутарат , который образуется в результате гетерозиготной мутации усиления функции (в частности, неоморфной ) в изоцитратдегидрогеназе (которая при нормальных обстоятельствах катализирует окисление изоцитрата (IDH ) в оксалосукцинат , который затем спонтанно декарбоксилирует). до альфа-кетоглутарата происходит дополнительная стадия восстановления , как обсуждалось выше, в этом случае после образования альфа-кетоглутарата через НАДФН с образованием 2-гидроксиглутарата), и, следовательно, ИДГ считается онкогеном . В физиологических условиях 2-гидроксиглутарат является второстепенным продуктом нескольких метаболических путей, что является ошибкой, но легко превращается в альфа-кетоглутарат с помощью ферментов гидроксиглутаратдегидрогеназы ( L2HGDH и D2HGDH ). [31] но не имеет известной физиологической роли в клетках млекопитающих; Следует отметить, что при раке 2-гидроксиглутарат, вероятно, является терминальным метаболитом, поскольку эксперименты по мечению изотопов клеточных линий колоректального рака показывают, что его превращение обратно в альфа-кетоглутарат слишком мало для измерения. [32] При раке 2-гидроксиглутарат служит конкурентным ингибитором ряда ферментов, которые облегчают реакции через альфа-кетоглутарат в альфа-кетоглутарат-зависимых диоксигеназах . Эта мутация приводит к нескольким важным изменениям в метаболизме клетки. Во-первых, поскольку происходит дополнительное восстановление, катализируемое НАДФН, это может способствовать истощению клеточных запасов НАДФН, а также снижению уровня альфа-кетоглутарата, доступного клетке. В частности, истощение НАДФН является проблематичным, поскольку НАДФН сильно разделен и не может свободно диффундировать между органеллами в клетке. Он вырабатывается в основном посредством пентозофосфатного пути в цитоплазме. Истощение НАДФН приводит к усилению окислительного стресса внутри клетки, поскольку он является необходимым кофактором в производстве GSH , и этот окислительный стресс может привести к повреждению ДНК. Также происходят изменения на генетическом и эпигенетическом уровне за счет функции лизиндеметилаз гистонов (KDM) и ферменты транслокации десять-одиннадцать (ТЕТ); обычно ТЕТ гидроксилируют 5-метилцитозины , чтобы подготовить их к деметилированию. Однако в отсутствие альфа-кетоглутарата это невозможно, и, следовательно, происходит гиперметилирование клеточной ДНК, способствующее эпителиально-мезенхимальному переходу (ЕМТ) и ингибированию клеточной дифференцировки. Аналогичное явление наблюдается для семейства KDM Jumonji C, которым требуется гидроксилирование для деметилирования эпсилон-аминометильной группы. [33] Кроме того, неспособность пролилгидроксилаз катализировать реакции приводит к стабилизации индуцируемого гипоксией фактора альфа , что необходимо для ускорения деградации последнего (поскольку в условиях низкого содержания кислорода не будет адекватного субстрата для гидроксилирования). Это приводит к псевдогипоксическому фенотипу раковой клетки, который способствует ангиогенезу , метаболическому перепрограммированию, росту клеток и миграции . [ нужна ссылка ]
Регулирование
[ редактировать ]Аллостерическая регуляция метаболитами . Регуляция цикла лимонной кислоты во многом определяется ингибированием продукта и доступностью субстрата. Если бы циклу разрешили протекать бесконтрольно, большое количество метаболической энергии могло бы быть потрачено впустую на перепроизводство восстановленных коферментов, таких как НАДН и АТФ. Основным возможным субстратом цикла является АДФ, который преобразуется в АТФ. Снижение количества АДФ вызывает накопление предшественника НАДН, который, в свою очередь, может ингибировать ряд ферментов. НАДН, продукт всех дегидрогеназ цикла лимонной кислоты, за исключением сукцинатдегидрогеназы , ингибирует пируватдегидрогеназу , изоцитратдегидрогеназу , α-кетоглутаратдегидрогеназу , а также цитратсинтазу . Ацетил-КоА ингибирует пируватдегидрогеназу , тогда как сукцинил-КоА ингибирует альфа-кетоглутаратдегидрогеназу и цитратсинтазу . При тестировании in vitro с ферментами ТСА АТФ ингибирует цитратсинтазу и α-кетоглутаратдегидрогеназу ; однако уровни АТФ не изменяются более чем на 10% in vivo между отдыхом и энергичными упражнениями. Нет никаких известных аллостерический механизм, который может объяснить большие изменения скорости реакции от аллостерического эффектора, концентрация которого изменяется менее чем на 10%. [6]
Цитрат используется для ингибирования по принципу обратной связи, поскольку он ингибирует фосфофруктокиназу , фермент, участвующий в гликолизе , который катализирует образование фруктозо-1,6-бисфосфата , предшественника пирувата. Это предотвращает постоянную высокую скорость потока при накоплении цитрата и уменьшении количества субстрата для фермента. [34]
Регуляция кальцием . Кальций также используется в качестве регулятора цикла лимонной кислоты. Уровни кальция в митохондриальном матриксе могут достигать десятков микромолярных уровней во время клеточной активации. [35] Он активирует фосфатазу пируватдегидрогеназы , которая, в свою очередь, активирует комплекс пируватдегидрогеназы . Кальций также активирует изоцитратдегидрогеназу и α-кетоглутаратдегидрогеназу . [36] Это увеличивает скорость реакции на многих этапах цикла и, следовательно, увеличивает поток на протяжении всего пути. [ нужна ссылка ]
Транскрипционная регуляция . Существует связь между интермедиатами цикла лимонной кислоты и регуляцией факторов, индуцируемых гипоксией ( HIF ). HIF играет роль в регуляции кислородного гомеостаза и является фактором транскрипции, который воздействует на ангиогенез , ремоделирование сосудов , утилизацию глюкозы , транспорт железа и апоптоз . HIF синтезируется конститутивно, и гидроксилирование по крайней мере одного из двух критических остатков пролина опосредует их взаимодействие с комплексом убиквитинлигазы E3 фон Хиппель-Линдау , который нацеливает их на быструю деградацию. Эту реакцию катализируют пролил-4-гидроксилазы . Фумарат и сукцинат были идентифицированы как мощные ингибиторы пролилгидроксилазы, что приводит к стабилизации HIF. [37]
Основные метаболические пути, сходящиеся в цикле лимонной кислоты
[ редактировать ]Несколько катаболических путей сходятся в цикле лимонной кислоты. Большинство этих реакций добавляют промежуточные продукты в цикл лимонной кислоты и поэтому известны как анаплеротические реакции , от греческого значения «наполнение». Они увеличивают количество ацетил-КоА, которое способен переносить цикл, увеличивая способность митохондрий осуществлять дыхание, если в противном случае это является ограничивающим фактором. Процессы, которые удаляют промежуточные продукты из цикла, называются «катаплеротическими» реакциями. [38]
В этом и следующем разделах промежуточные соединения цикла лимонной кислоты выделены курсивом, чтобы отличить их от других субстратов и конечных продуктов.
пирувата Молекулы , образующиеся в результате гликолиза, через активно транспортируются внутреннюю мембрану митохондрий в матрикс. Здесь они могут окисляться и соединяться с коферментом А с образованием СО 2 , ацетил-КоА и НАДН , как и в обычном цикле. [39]
Однако пируват также может карбоксилироваться пируваткарбоксилазой с образованием оксалоацетата . Эта последняя реакция «восполняет» количество оксалоацетата в цикле лимонной кислоты и, следовательно, является анаплеротической реакцией, увеличивая способность цикла метаболизировать ацетил-КоА , когда энергетические потребности тканей (например, мышц ) внезапно возрастают из-за активности. [40]
В цикле лимонной кислоты все промежуточные соединения (например , цитрат , изоцитрат , альфа-кетоглутарат , сукцинат , фумарат , малат и оксалоацетат ) регенерируются во время каждого цикла цикла. Таким образом, добавление большего количества любого из этих промежуточных продуктов в митохондрии означает, что это дополнительное количество сохраняется в цикле, увеличивая количество всех других промежуточных продуктов по мере превращения одного в другое. Следовательно, добавление любого из них в цикл имеет анаплеротический эффект, а его удаление – катаплеротический эффект. Эти анаплеротические и катаплеротические реакции в течение цикла будут увеличивать или уменьшать количество оксалоацетата, доступного для соединения с ацетил-КоА с образованием лимонной кислоты . Это, в свою очередь, увеличивает или уменьшает скорость производства АТФ митохондриями и, следовательно, доступность АТФ для клетки. [40]
С другой стороны, ацетил-КоА , получаемый в результате окисления пирувата или бета-окисления , жирных кислот является единственным топливом, вступающим в цикл лимонной кислоты. С каждым оборотом цикла одна молекула ацетил-КоА расходуется на каждую молекулу оксалоацетата, присутствующую в митохондриальном матриксе, и никогда не регенерируется. Именно окисление ацетатной части ацетил-КоА приводит к образованию CO 2 и воды, при этом высвобождаемая энергия улавливается в форме АТФ. [40] Три этапа бета-окисления напоминают этапы, которые происходят при производстве оксалоацетата из сукцината в цикле ТСА. Ацил-КоА окисляется до транс-еноил-КоА, тогда как ФАД восстанавливается до ФАДН 2 , что аналогично окислению сукцината до фумарата. После этого транс-еноил-КоА гидратируется по двойной связи до бета-гидроксиацил-КоА, точно так же, как фумарат гидратируется до малата. Наконец, бета-гидроксиацил-КоА окисляется до бета-кетоацил-КоА, тогда как НАД+ восстанавливается до НАДН, что происходит по тому же процессу, что и окисление малата до оксалоацетата . [41]
В печени карбоксилирование цитозольного пирувата во внутримитохондриальный оксалоацетат является ранним этапом глюконеогенного пути, который превращает лактат и дезаминированный аланин в глюкозу. [39] [40] под влиянием высокого уровня глюкагона и/или адреналина в крови. [40] Здесь добавление оксалоацетата к митохондриям не имеет общего анаплеротического эффекта, поскольку другой промежуточный продукт цикла лимонной кислоты ( малат ) немедленно удаляется из митохондрии и превращается в цитозольный оксалоацетат, который в конечном итоге превращается в глюкозу в процессе, который почти обратный гликолизу . [40]
При катаболизме белков белки расщепляются протеазами на составляющие их аминокислоты. Их углеродные скелеты (т.е. дезаминированные аминокислоты) могут либо вступать в цикл лимонной кислоты в качестве промежуточных продуктов (например, альфа-кетоглутарат, полученный из глутамата или глутамина), оказывая анаплеротическое действие на цикл, либо, в случае лейцина , изолейцина. , лизин , фенилаланин , триптофан и тирозин превращаются в ацетил-КоА , который можно сжечь до CO 2 и воды или использовать для образования кетоновых тел , которые также могут сжигаться только в тканях, отличных от печени, где они образуются. или выводится через мочу или дыхание. [40] Эти последние аминокислоты поэтому называются «кетогенными» аминокислотами, тогда как те, которые входят в цикл лимонной кислоты в качестве промежуточных продуктов, могут быть удалены только катаплеротически, вступая в глюконеогенный путь через малат , который транспортируется из митохондрий для превращения в цитозольный оксалоацетат и, в конечном итоге, в цитозольный оксалоацетат. в глюкозу . Это так называемые «глюкогенные» аминокислоты. Деаминированные аланин, цистеин, глицин, серин и треонин превращаются в пируват и, следовательно, могут вступать в цикл трикарбоновых кислот либо в виде оксалоацетата (анаплеротическая реакция), либо в виде ацетил-КоА, который утилизируется в виде CO 2 и воды. [40]
При катаболизме жиров триглицериды гидролизуются , расщепляя их на жирные кислоты и глицерин . В печени глицерин может превращаться в глюкозу посредством дигидроксиацетонфосфата и глицеральдегид-3-фосфата путем глюконеогенеза . В скелетных мышцах глицерин используется в гликолизе путем превращения глицерина в глицерин-3-фосфат , затем в дигидроксиацетонфосфат (DHAP), а затем в глицеральдегид-3-фосфат. [42]
Во многих тканях, особенно в сердце и скелетных мышцах , жирные кислоты расщепляются посредством процесса, известного как бета-окисление , что приводит к выработке митохондриального ацетил-КоА , который может использоваться в цикле лимонной кислоты. Бета-окисление жирных кислот с нечетным числом метиленовых мостиков приводит к образованию пропионил-КоА , который затем превращается в сукцинил-КоА и поступает в цикл лимонной кислоты в качестве анаплеротического промежуточного продукта. [43]
Суммарная энергия, полученная от полного распада одной (шестиуглеродной) молекулы глюкозы путем гликолиза , образования 2 молекул ацетил-КоА , их катаболизма в цикле трикарбоновых кислот и окислительного фосфорилирования равна примерно 30 молекулам АТФ , у эукариот . Число молекул АТФ, образующихся в результате бета-окисления 6-углеродного сегмента цепи жирной кислоты и последующего окисления образующихся 3-х молекул ацетил-КоА, составляет 40. [ нужна ссылка ]
Промежуточные продукты цикла лимонной кислоты служат субстратами для процессов биосинтеза.
[ редактировать ]В этом подзаголовке, как и в предыдущем, промежуточные соединения ТСА выделены курсивом .
Некоторые из промежуточных продуктов цикла лимонной кислоты используются для синтеза важных соединений, которые оказывают значительное катаплеротическое воздействие на цикл. [40] Ацетил-КоА не может транспортироваться из митохондрии. Чтобы получить цитозольный ацетил-КоА, цитрат удаляется из цикла лимонной кислоты и переносится через внутреннюю мембрану митохондрий в цитозоль. Там он расщепляется АТФ-цитратлиазой на ацетил-КоА и оксалоацетат. Оксалоацетат возвращается в митохондрии в виде малата (а затем превращается обратно в оксалоацетат для переноса большего количества ацетил-КоА из митохондрии). [44] Цитозольный ацетил-КоА используется для синтеза жирных кислот и производства холестерина . Холестерин , в свою очередь, может использоваться для синтеза стероидных гормонов , солей желчных кислот и витамина D. [39] [40]
Углеродный скелет многих заменимых аминокислот состоит из промежуточных продуктов цикла лимонной кислоты. Чтобы превратить их в аминокислоты, альфа-кетокислоты, образующиеся из промежуточных продуктов цикла лимонной кислоты, должны приобрести свои аминогруппы из глутамата в реакции переаминирования , в которой пиридоксальфосфат является кофактором. В этой реакции глутамат превращается в альфа-кетоглутарат , который является промежуточным продуктом цикла лимонной кислоты. Промежуточными продуктами, которые могут обеспечить углеродный скелет для синтеза аминокислот, являются оксалоацетат , который образует аспартат и аспарагин ; и альфа-кетоглутарат , который образует глютамин , пролин и аргинин . [39] [40]
Из этих аминокислот аспартат и глютамин используются вместе с атомами углерода и азота из других источников для образования пуринов , которые используются в качестве оснований в ДНК и РНК , а также в АТФ , АМФ , ГТФ , НАД , ФАД и КоА . [40]
Пиримидины ) частично состоят из аспартата (производного оксалоацетата . Пиримидины, тимин , цитозин и урацил образуют основания, комплементарные пуриновым основаниям в ДНК и РНК, а также являются компонентами CTP , UMP , UDP и UTP . [40]
Большинство атомов углерода в порфиринах происходят из промежуточного продукта цикла лимонной кислоты, сукцинил-КоА . Эти молекулы являются важным компонентом гемопротеинов , таких как гемоглобин , миоглобин и различные цитохромы . [40]
Во время глюконеогенеза митохондриальный оксалоацетат восстанавливается до малата , который затем транспортируется из митохондрий и снова окисляется до оксалоацетата в цитозоле. Цитозольный оксалоацетат затем декарбоксилируется до фосфоенолпирувата с помощью фосфоенолпируваткарбоксикиназы , что является лимитирующей стадией превращения почти всех глюконеогенных предшественников (таких как глюкогенные аминокислоты и лактат) в глюкозу в печени и почках . [39] [40]
Поскольку цикл лимонной кислоты участвует как в катаболических , так и в анаболических процессах, он известен как амфиболический путь.Эван MWDuo Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [§ 1]
- ^ Интерактивную карту маршрутов можно редактировать на WikiPathways: «TCACycle_WP78» .
Глюкоза питает цикл ТСА через циркулирующий лактат.
[ редактировать ]Метаболическая таких роль лактата хорошо известна как топливо для тканей , митохондриальных цитопатий, как цитопатия DPH , и научной области онкологии ( опухоли ). В классическом цикле Кори мышцы производят лактат, который затем поглощается печенью для глюконеогенеза . Новые исследования показывают, что лактат можно использовать в качестве источника углерода для цикла ТСА. [45]
Эволюция
[ редактировать ]Считается, что компоненты цикла трикарбоновой кислоты произошли от анаэробных бактерий и что сам цикл трикарбоновых кислот мог развиваться более одного раза. [46] Это может даже предшествовать биозу: субстраты, по-видимому, вступают в большинство реакций спонтанно в присутствии персульфатных радикалов. [47] Теоретически существует несколько альтернатив циклу TCA; однако цикл ТСА представляется наиболее эффективным. Если несколько альтернатив ТЦА развивались независимо, все они, похоже, слились в цикл ТЦА. [48] [49]
См. также
[ редактировать ]- Цикл Кальвина
- Глиоксилатный цикл
- Обратный (редуктивный) цикл Кребса
- Цикл Кребса (простой английский)
Ссылки
[ редактировать ]- ^ Ловенштейн Дж. М. (1969). Методы энзимологии, Том 13: Цикл лимонной кислоты . Бостон: Академическая пресса. ISBN 978-0-12-181870-8 .
- ^ Кей Дж., Вайцман П.Д. (1987). Цикл лимонной кислоты Кребса: полвека и все еще продолжается . Лондон: Биохимическое общество. стр. 25 . ISBN 978-0-904498-22-6 .
- ^ Вагнер А (2014). Прибытие сильнейшего (Первое изд.). ПингвинЙорк. п. 100. ИСБН 978-1-59184-646-8 .
- ^ Лейн Н (2009). Восхождение жизни: десять великих изобретений эволюции . Нью-Йорк: WW Norton & Co. ISBN 978-0-393-06596-1 .
- ^ Чинопулос С (август 2013 г.). «В какую сторону поворачивается цикл лимонной кислоты во время гипоксии? Критическая роль комплекса α-кетоглутаратдегидрогеназы» (PDF) . Журнал нейробиологических исследований . 91 (8): 1030–1043. дои : 10.1002/jnr.23196 . ПМИД 23378250 .
- ^ Jump up to: а б с Воет Д., Воет Дж.Г. (2004). Биохимия (3-е изд.). Нью-Йорк: John Wiley & Sons, Inc., с. 615.
- ^ Либерман М (2013). Основная медицинская биохимия Маркса: клинический подход . Маркс, Аллан Д., Пит, Алиса (Четвертое изд.). Филадельфия: Wolters Kluwer Health/Lippincott Williams & Wilkins. ISBN 978-1-60831-572-7 . OCLC 769803483 .
- ^ «Нобелевская премия по физиологии и медицине 1937 года» . Нобелевский фонд . Проверено 26 октября 2011 г.
- ^ Чандрамана, Судип. (2014). Инклюзивный рост и расширение прав и возможностей молодежи: модель развития для амбициозной Индии . Журнал науки, технологий и менеджмента. 7. 52–62.
- ^ Кребс Х.А., Джонсон В.А. (апрель 1937 г.). «Метаболизм кетоновых кислот в тканях животных» . Биохимический журнал . 31 (4): 645–60. дои : 10.1042/bj0310645 . ПМК 1266984 . ПМИД 16746382 .
- ^ «Нобелевская премия по физиологии и медицине 1953 года» . Нобелевский фонд . Проверено 26 октября 2011 г.
- ^ Вулф Р.Р., Джахур Ф. (февраль 1990 г.). «Восстановление меченого CO2 во время инфузии ацетата, меченного C-1 и C-2: значение для индикаторных исследований окисления субстрата» . Американский журнал клинического питания . 51 (2): 248–52. дои : 10.1093/ajcn/51.2.248 . ПМИД 2106256 .
- ^ Берг Дж. М., Тимочко Дж. Л., Страйер Л. (2002). «Цикл лимонной кислоты». Биохимия (5-е изд.). У. Х. Фриман. ISBN 0-7167-3051-0 .
- ^ Jump up to: а б Джонс Р.К., Бьюкенен Б.Б., Груиссем В. (2000). Биохимия и молекулярная биология растений (1-е изд.). Роквилл, Мэриленд: Американское общество физиологов растений. ISBN 978-0-943088-39-6 .
- ^ Jump up to: а б с д Страйер Л., Берг Дж., Тимочко Дж.Л. (2002). Биохимия . Сан-Франциско: WH Freeman. ISBN 978-0-7167-4684-3 .
- ^ Джонсон Дж.Д., Мехус Дж.Г., Тьюс К., Милавец Б.И., Ламбет Д.О. (октябрь 1998 г.). «Генетические доказательства экспрессии АТФ- и ГТФ-специфических сукцинил-КоА-синтетаз у многоклеточных эукариот» . Журнал биологической химии . 273 (42): 27580–6. дои : 10.1074/jbc.273.42.27580 . ПМИД 9765291 .
- ^ Барнс С.Дж., Вайцман П.Д. (июнь 1986 г.). «Организация ферментов цикла лимонной кислоты в мультиферментный кластер» . Письма ФЭБС . 201 (2): 267–70. Бибкод : 1986FEBSL.201..267B . дои : 10.1016/0014-5793(86)80621-4 . ПМИД 3086126 . S2CID 43052163 .
- ^ «Цикл лимонной кислоты» . Ханская академия . Проверено 10 августа 2021 г.
- ^ Jump up to: а б Портер Р.К., Бренд, доктор медицинских наук (сентябрь 1995 г.). «Митохондриальная протонная проводимость и соотношение H+/O не зависят от скорости транспорта электронов в изолированных гепатоцитах» . Биохимический журнал . 310 (2): 379–82. дои : 10.1042/bj3100379 . ПМЦ 1135905 . ПМИД 7654171 .
- ^ Страйер Л., Берг Дж.М., Тимочко Дж.Л. (2002). «Раздел 18.6: Регуляция клеточного дыхания регулируется в первую очередь потребностью в АТФ» . Биохимия . Сан-Франциско: WH Freeman. ISBN 978-0-7167-4684-3 .
- ^ Богатый пиар (декабрь 2003 г.). «Молекулярный механизм дыхательной цепи Кейлина» . Труды Биохимического общества . 31 (Часть 6): 1095–105. дои : 10.1042/BST0311095 . ПМИД 14641005 . S2CID 32361233 .
- ^ «Варианты цикла лимонной кислоты в MetaCyc» .
- ^ Сахара Т., Такада Ю., Такеучи Ю., Ямаока Н., Фукунага Н. (март 2002 г.). «Клонирование, секвенирование и экспрессия гена, кодирующего мономерную изоцитратдегидрогеназу азотфиксирующей бактерии Azotobacter vinelandii» . Бионауки, биотехнологии и биохимия . 66 (3): 489–500. дои : 10.1271/bbb.66.489 . ПМИД 12005040 . S2CID 12950388 .
- ^ ван дер Рест М.Э., Фрэнк С., Моленаар Д. (декабрь 2000 г.). «Функции мембранассоциированных и цитоплазматических малатдегидрогеназ в цикле лимонной кислоты Escherichia coli» . Журнал бактериологии . 182 (24): 6892–9. дои : 10.1128/jb.182.24.6892-6899.2000 . ПМК 94812 . ПМИД 11092847 .
- ^ Ламбет Д.О., Тьюс К.Н., Адкинс С., Фрелих Д., Милавец Б.И. (август 2004 г.). «Экспрессия двух сукцинил-КоА-синтетаз с различной нуклеотидной специфичностью в тканях млекопитающих» . Журнал биологической химии . 279 (35): 36621–4. дои : 10.1074/jbc.M406884200 . ПМИД 15234968 .
- ^ Маллинз Э.А., Франсуа Ж.А., Каппок Т.Дж. (июль 2008 г.). «Специализированный цикл лимонной кислоты, требующий сукцинил-коэнзима А (СоА): ацетат-КоА-трансферазы (АарС), придает устойчивость к уксусной кислоте ацидофилу Acetobacter aceti» . Журнал бактериологии . 190 (14): 4933–40. дои : 10.1128/JB.00405-08 . ПМК 2447011 . ПМИД 18502856 .
- ^ Кортези-Теулаз И.Е., Бергонцелли Г.Е., Генри Х., Бахманн Д., Шордере Д.Ф., Блюм А.Л. и др. (октябрь 1997 г.). «Клонирование и характеристика сукцинил-КоА:ацетоацетат-КоА-трансферазы Helicobacter pylori, нового прокариотического члена семейства КоА-трансфераз» . Журнал биологической химии . 272 (41): 25659–67. дои : 10.1074/jbc.272.41.25659 . ПМИД 9325289 .
- ^ Бон А.Д., Гарфорт С.Дж., Вильчез К., Джейкобс В.Р. (ноябрь 2009 г.). «Альфа-кетоглутаратферредоксиноксидоредуктаза анаэробного типа завершает окислительный цикл трикарбоновых кислот микобактерии туберкулеза» . ПЛОС Патогены . 5 (11): e1000662. дои : 10.1371/journal.ppat.1000662 . ПМЦ 2773412 . ПМИД 19936047 .
- ^ Чжан С., Брайант Д.А. (декабрь 2011 г.). «Цикл трикарбоновых кислот у цианобактерий». Наука . 334 (6062): 1551–3. Бибкод : 2011Sci...334.1551Z . дои : 10.1126/science.1210858 . ПМИД 22174252 . S2CID 206536295 .
- ^ Данг Л, Су С.М. (июнь 2017 г.). «Мутация изоцитратдегидрогеназы и (R)-2-гидроксиглутарат: от фундаментального открытия к разработке терапии» . Ежегодный обзор биохимии . 86 (1): 305–331. doi : 10.1146/annurev-biochem-061516-044732 . ПМИД 28375741 .
- ^ Йонг С., Стюарт Г.Д., Фрезза С. (март 2020 г.). «Онкометаболиты при раке почки» . Обзоры природы. Нефрология . 16 (3): 156–172. дои : 10.1038/s41581-019-0210-z . ПМК 7030949 . ПМИД 31636445 .
- ^ Гельман С.Дж., Махье Н.Г., Чо К., Ллуфрио Э.М., Венцевич Т.А., Патти Г.Дж. (декабрь 2015 г.). «Доказательства того, что 2-гидроксиглутарат с трудом метаболизируется в клетках колоректальной карциномы» . Рак и обмен веществ . 3 (1): 13. дои : 10.1186/s40170-015-0139-z . ПМЦ 4665876 . ПМИД 26629338 .
- ^ Ротили Д., Май А. (июнь 2011 г.). «Нацеливание на деметилазы гистонов: новый путь борьбы с раком» . Гены и рак . 2 (6): 663–79. дои : 10.1177/1947601911417976 . ПМК 3174264 . ПМИД 21941621 .
- ^ Нельсон Д.Л., Кокс М.М., Хоскинс А.А., Ленинджер А.Л. (2021). Ленингерские принципы биохимии (Восьмое изд.). Нью-Йорк, штат Нью-Йорк: Macmillan International, Высшее образование. ISBN 978-1-319-22800-2 .
- ^ Иванников М.В., Маклауд Г.Т. (июнь 2013 г.). «Уровни свободного Ca²⁺ в митохондриях и их влияние на энергетический обмен в окончаниях двигательных нервов дрозофилы» . Биофизический журнал . 104 (11): 2353–61. Бибкод : 2013BpJ...104.2353I . дои : 10.1016/j.bpj.2013.03.064 . ПМЦ 3672877 . ПМИД 23746507 .
- ^ Дентон Р.М., Рэндл П.Дж., Бриджес Б.Дж., Купер Р.Х., Керби А.Л., Паск Х.Т. и др. (октябрь 1975 г.). «Регуляция пируватдегидрогеназы млекопитающих» . Молекулярная и клеточная биохимия . 9 (1): 27–53. дои : 10.1007/BF01731731 . ПМИД 171557 . S2CID 27367543 .
- ^ Койвунен П., Хирсиля М., Ремес А.М., Хасинен И.Е., Кивирикко К.И., Мюллюхарью Дж. (февраль 2007 г.). «Ингибирование гидроксилаз индуцируемого гипоксией фактора (HIF) промежуточными продуктами цикла лимонной кислоты: возможные связи между клеточным метаболизмом и стабилизацией HIF» . Журнал биологической химии . 282 (7): 4524–32. дои : 10.1074/jbc.M610415200 . ПМИД 17182618 .
- ^ Оуэн О.Э., Калхан С.К., Хэнсон Р.В. (2002). «Ключевая роль анаплероза и катаплероза в функции цикла лимонной кислоты» . Журнал биологической химии . 277 (34): 30409–30412. дои : 10.1074/jbc.r200006200 . ПМИД 12087111 .
- ^ Jump up to: а б с д и Воет Д., Воет Дж.Г., Пратт К.В. (2006). Основы биохимии (2-е изд.). John Wiley and Sons, Inc., стр. 547, 556 . ISBN 978-0-471-21495-3 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот Страйер Л. (1995). «Цикл лимонной кислоты». Биохимия (Четвертое изд.). Нью-Йорк: WH Freeman and Company. стр. 509–527, 569–579, 614–616, 638–641, 732–735, 739–748, 770–773. ISBN 978-0-7167-2009-6 .
- ^ Гарретт Р.Х., Гришэм К.М. (2013). Биохимия (5-е изд.). Бельмонт, Калифорния: Брукс/Коул, Cengage Learning. стр. 623–625, 771–773. ISBN 978-1-133-10629-6 . OCLC 777722371 .
- ^ ван Холл Г., Саккетти М., Родегран Г., Салтин Б. (сентябрь 2002 г.). «Метаболизм жирных кислот и глицерина в скелетных мышцах человека во время отдыха, физических упражнений и восстановления» . Журнал физиологии . 543 (Часть 3): 1047–1058. дои : 10.1113/jphysicalol.2002.023796 . ПМК 2290548 . ПМИД 12231658 .
- ^ Халарнкар П.П., Бломквист Г.Дж. (1989). «Сравнительные аспекты метаболизма пропионата». Сравнительная биохимия и физиология. Б. Сравнительная биохимия . 92 (2): 227–31. дои : 10.1016/0305-0491(89)90270-8 . ПМИД 2647392 .
- ^ Ферре П., Фуфель Ф (2007). «Фактор транскрипции SREBP-1c и липидный гомеостаз: клиническая перспектива». Гормональные исследования . 68 (2): 72–82. doi : 10.1159/000100426 (неактивен 10 июля 2024 г.). ПМИД 17344645 .
этот процесс графически представлен на стр. 73.
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на июль 2024 г. ( ссылка ) - ^ Хуэй С., Гергурович Дж.М., Моршер Р.Дж., Ян С., Тенг Икс, Лу В. и др. (ноябрь 2017 г.). «Глюкоза питает цикл ТСА через циркулирующий лактат» . Природа . 551 (7678): 115–118. Бибкод : 2017Natur.551..115H . дои : 10.1038/nature24057 . ПМЦ 5898814 . ПМИД 29045397 .
- ^ Гест Х (1987). «Эволюционные корни цикла лимонной кислоты у прокариот». Симпозиум Биохимического общества . 54 : 3–16. ПМИД 3332996 .
- ^ Келлер М.А., Кампьют Д., Харрисон С.А., Ралсер М. (13 марта 2017 г.) [13 августа 2016 г.]. «Сульфатные радикалы создают неферментативный предшественник цикла Кребса» . Экология и эволюция природы . 1 (4): 0083. Бибкод : 2017NatEE...1...83K . дои : 10.1038/s41559-017-0083 . ПМЦ 5455955 . ПМИД 28584880 . 83.
- ^ Мелендес-Эвиа Э., Уодделл Т.Г., Касканте М. (сентябрь 1996 г.). «Загадка цикла лимонной кислоты Кребса: сборка частей химически возможных реакций и оппортунизм в разработке метаболических путей в ходе эволюции» (PDF) . Журнал молекулярной эволюции . 43 (3): 293–303. Бибкод : 1996JMolE..43..293M . дои : 10.1007/BF02338838 . ПМИД 8703096 . S2CID 19107073 . Архивировано (PDF) из оригинала 12 августа 2017 г.
- ^ Эбенхё О, Генрих Р. (январь 2001 г.). «Эволюционная оптимизация метаболических путей. Теоретическая реконструкция стехиометрии систем, продуцирующих АТФ и НАДН» (PDF) . Бюллетень математической биологии . 63 (1): 21–55. дои : 10.1006/bulm.2000.0197 . ПМИД 11146883 . S2CID 44260374 . Архивировано (PDF) из оригинала 8 мая 2003 г.