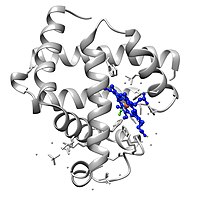
Миоглобин
| МБ | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | MB , PVALB, миоглобгин, миоглобин, миоглобин | |||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 160000 ; МГИ : 96922 ; Гомологен : 3916 ; GeneCards : МБ ; ОМА : MB – ортологи | |||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
Миоглобин (обозначение Mb или MB ) представляет собой и кислородсвязывающий белок железо- , обнаруженный в сердечной и скелетной мышечной ткани позвоночных в целом и почти у всех млекопитающих. [5] [6] [7] [8] [9] Миоглобин является отдаленным родственником гемоглобина . По сравнению с гемоглобином миоглобин имеет более высокое сродство к кислороду и не имеет кооперативного связывания с кислородом, как гемоглобин. [8] [10] Миоглобин состоит из неполярных аминокислот в ядре глобулина, где гемовая группа нековалентно связана с окружающим полипептидом миоглобина. У человека миоглобин обнаруживается в кровотоке только после повреждения мышц . [11] [12] [13]
Высокие концентрации миоглобина в мышечных клетках позволяют организмам задерживать дыхание на более длительный период времени. Ныряющие млекопитающие, такие как киты и тюлени, имеют мышцы с особенно высоким содержанием миоглобина. [13] Миоглобин содержится в мышцах типа I, типа II A и типа II B; хотя во многих старых текстах миоглобин описывается как не встречающийся в гладких мышцах , это оказалось ошибочным: миоглобин также имеется в гладкомышечных клетках. [14]
Миоглобин был первым белком, трехмерная структура которого была обнаружена с помощью рентгеновской кристаллографии . [15] Об этом достижении сообщили в 1958 году Джон Кендрю и его коллеги. [16] За это открытие Кендрю разделил Нобелевскую премию по химии 1962 года с Максом Перуцем . [17] [18] Несмотря на то, что это один из наиболее изученных белков в биологии, его физиологическая функция еще окончательно не установлена: мыши, генетически модифицированные без миоглобина, могут быть жизнеспособными и плодовитыми, но демонстрируют множество клеточных и физиологических адаптаций для преодоления его потери. Наблюдая за этими изменениями у мышей с истощением миоглобина, было высказано предположение, что функция миоглобина связана с увеличением транспорта кислорода в мышцы и накоплением кислорода; кроме того, он служит поглотителем активных форм кислорода . [19]
У человека миоглобин кодируется MB геном . [20]
Миоглобин может принимать формы оксимиоглобина (MbO 2 ), карбоксимиоглобина (MbCO) и метмиоглобина (met-Mb), аналогично гемоглобину, принимающего формы оксигемоглобина (HbO 2 ), карбоксигемоглобина (HbCO) и метгемоглобина (met-Hb). [21]
Отличия от гемоглобина
[ редактировать ]Как и гемоглобин, миоглобин представляет собой цитоплазматический белок, который связывает кислород с помощью гемовой группы. Он содержит только одну группу глобулинов, тогда как гемоглобин их четыре. Хотя его гемовая группа идентична гемовой группе Hb, Mb имеет более высокое сродство к кислороду, чем гемоглобин, но меньшую общую способность хранения кислорода. [22] Новейшее открытие показывает, что миоглобин облегчает диффузию кислорода вниз по градиенту, улучшая транспорт кислорода в митохондриях. [ нужна ссылка ]
Роль в кухне
[ редактировать ]Миоглобин содержит гемы — пигменты , отвечающие за цвет красного мяса . Цвет мяса частично определяется степенью окисления миоглобина. В свежем мясе атом железа находится в степени окисления двухвалентного железа (+2), связанный с молекулой кислорода (O 2 ). мясо Хорошо приготовленное становится коричневым, потому что атом железа теперь находится в степени окисления трехвалентного железа (+3), потеряв электрон. Если мясо подверглось воздействию нитритов , оно останется розовым, потому что атом железа связан с NO, оксидом азота (это справедливо, например, для солонины или вяленой ветчины ). Мясо на гриле также может иметь красновато-розовое «кольцо дыма», которое возникает из-за связывания гем-центра с окисью углерода . [23] Сырое мясо, упакованное в атмосфере угарного газа, также имеет такое же розовое «кольцо дыма» по тем же принципам. Примечательно, что поверхность этого сырого мяса также имеет розовый цвет, который обычно ассоциируется у потребителей со свежим мясом. Этот искусственно вызванный розовый цвет может сохраняться, как сообщается, до одного года. [24] Hormel и Cargill (мясоперерабатывающие компании в США) используют этот процесс упаковки мяса, а мясо, обработанное таким образом, присутствует на потребительском рынке с 2003 года. Сообщается, что [25]
Альтернативы мясу использовали различные способы воссоздания «мясного» вкуса, связанного с миоглобином. Impossible Foods использует леггемоглобин , гемсодержащий глобин из корневых клубеньков сои , вырабатываемый в виде рекомбинантного белка в дрожжах Komagataella («Pichia Pastoris»). [26] [27] Компания Motif FoodWorks производит рекомбинантный бычий миоглобин с использованием Komagataella , дрожжей [28] считается GRAS FDA. [29] Moolec Science разработала соевые бобы , которые производят свиной миоглобин в своих семенах, под названием «Piggy Sooy»; он был одобрен Министерством сельского хозяйства США в апреле 2024 года. [30]
Роль в болезни
[ редактировать ]Миоглобин высвобождается из поврежденной мышечной ткани, которая содержит очень высокие концентрации миоглобина. [31] Высвободившийся миоглобин попадает в кровоток, где высокий уровень может указывать на рабдомиолиз . Миоглобин фильтруется почками , но токсичен для эпителия почечных канальцев и поэтому может вызвать острое повреждение почек . [32] Токсичным является не сам миоглобин (он является протоксином ) , а ферригематная часть, диссоциирующая от миоглобина в кислых средах (например, кислая моча, лизосомы ). [ нужна ссылка ]
Миоглобин является чувствительным маркером повреждения мышц, что делает его потенциальным маркером сердечного приступа у пациентов с болью в груди . [33] Однако повышенный уровень миоглобина имеет низкую специфичность для острого инфаркта миокарда (ОИМ) , поэтому CK-MB , сердечный тропонин , ЭКГ и клинические признаки. для постановки диагноза следует учитывать [34]
Структура и связь
[ редактировать ]Миоглобин принадлежит к суперсемейству белков глобинов и, как и другие глобины, состоит из восьми альфа-спиралей, соединенных петлями. Миоглобин содержит 153 аминокислоты. [35]
Миоглобин содержит порфириновое кольцо с железом в центре. Проксимальная группа гистидина (His- 64 группа гистидина (His-93) прикреплена непосредственно к железу, а дистальная ) находится вблизи противоположной поверхности. [35] Дистальный имидазол не связан с железом, но доступен для взаимодействия с субстратом O 2 . Это взаимодействие способствует связыванию O 2 , но не монооксида углерода (CO), который все еще связывается примерно в 240 раз сильнее, чем O 2 . [ нужна ссылка ]
Связывание O 2 вызывает существенные структурные изменения в центре Fe, который сжимается по радиусу и перемещается в центр кармана N4. Связывание O 2 вызывает «спиновое спаривание»: пятикоординатная дезокси-форма железа является высокоспиновой , а шестикоординатная окси-форма является низкоспиновой и диамагнитной . [ нужна ссылка ]
- Молекулярно-орбитальное описание взаимодействия Fe-O 2 в миоглобине. [36]
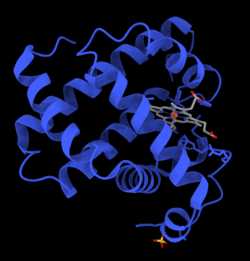
- Это изображение молекулы оксигенированного миоглобина. На изображении показано структурное изменение, когда кислород связывается с атомом железа простетической группы гема. Атомы кислорода окрашены в зеленый цвет, атом железа — в красный, а гемовая группа — в синий цвет.
- Миоглобин
Синтетические аналоги
[ редактировать ]Многие модели миоглобина были синтезированы в рамках широкого интереса к дикислородным комплексам переходных металлов . Хорошо известным примером является порфирин для частокола , который состоит из железистого комплекса пространственно объемистого производного тетрафенилпорфирина . [37] В присутствии имидазольного лиганда этот двухвалентный комплекс обратимо связывает О 2 . Подложка O 2 имеет изогнутую геометрию, занимая шестое положение железного центра. Ключевым свойством этой модели является медленное образование μ-оксо-димера, который представляет собой неактивное состояние дижелеза. В природе такие пути дезактивации подавляются белковым матриксом, препятствующим тесному сближению комплексов Fe-порфирина. [38]

Порфириновый комплекс железа в виде частокола с осевыми координационными центрами, занятыми метилимидазолом (зеленый) и дикислородом . Группы R фланкируют сайт связывания O 2 .
См. также
[ редактировать ]- Цитоглобин
- Гемоглобин
- гемопротеин
- Нейроглобин
- Фитоглобин
- Миоглобинурия – наличие миоглобина в моче.
- Ишемически-реперфузионное повреждение аппендикулярного опорно-двигательного аппарата
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000198125 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000018893 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Ордвей, Джорджия, Гарри Диджей (сентябрь 2004 г.). «Миоглобин: незаменимый гемопротеин в поперечнополосатых мышцах» . Журнал экспериментальной биологии . 207 (Часть 20): 3441–6. дои : 10.1242/jeb.01172 . ПМИД 15339940 .
- ^ Уик М.Р., Хорник Дж.Л. (2011). «Иммуногистология новообразований мягких тканей и костей». Диагностическая иммуногистохимия . Эльзевир. стр. 83–136. дои : 10.1016/b978-1-4160-5766-6.00008-x . ISBN 978-1-4160-5766-6 .
Миоглобин представляет собой белок массой 17,8 кДа, который содержится в сердечной и скелетных мышцах и образует комплексы с молекулами железа.
- ^ Фехер Дж (2017). «Перенос кислорода и углекислого газа». Количественная физиология человека . Эльзевир. стр. 656–664. дои : 10.1016/b978-0-12-800883-6.00064-1 . ISBN 978-0-12-800883-6 .
Мышечные волокна с высокой окислительной способностью содержат много миоглобина. В мышцах он выполняет две функции: сохраняет кислород для использования во время тяжелых упражнений и усиливает диффузию через цитозоль , перенося кислород. Связывая O2, миоглобин (Mb) обеспечивает второй путь диффузии O2 через цитозоль клетки.
- ^ Перейти обратно: а б Уилсон М.Т., Ридер Б.Дж. (2006). «МИОГЛОБИН». Энциклопедия респираторной медицины . Эльзевир. стр. 73–76. дои : 10.1016/b0-12-370879-6/00250-7 . ISBN 978-0-12-370879-3 .
Миоглобин (Mb) представляет собой гемсодержащий глобулярный белок, который в изобилии содержится в миоцитах сердца и скелетных мышц.
- ^ Бончик Ю.С. (2007). «Периоперационная гипоксия». Осложнения при анестезии . Эльзевир. стр. 193–199. дои : 10.1016/b978-1-4160-2215-2.50052-1 . ISBN 978-1-4160-2215-2 .
Миоглобин служит одновременно буфером O2 и хранилищем O2 в мышцах. Все известные миоглобины позвоночных и субъединицы β-гемоглобина сходны по структуре, но миоглобин более активно связывает О2 при низком Ро2 (рис. 47-5), поскольку он является мономером (т. е. не претерпевает значительных конформационных изменений при оксигенации). Таким образом, миоглобин остается полностью насыщенным при напряжении О2 от 15 до 30 мм рт. ст. и выгружает свой О2 в митохондрии мышц только при очень низком напряжении О2.
- ^ Хардисон RC (декабрь 2012 г.). «Эволюция гемоглобина и его генов» . Колд Спринг Харб Перспектив Мед . 2 (12): а011627. doi : 10.1101/cshperspect.a011627 . ПМК 3543078 . ПМИД 23209182 .
- ^ Чунг М.Дж., Браун Д.Л. (июль 2018 г.). «Диагностика острого инфаркта миокарда». В Брауне Д.Л. (ред.). Электронная книга «Сердечная интенсивная терапия» . стр. 91–98.e3. дои : 10.1016/B978-0-323-52993-8.00009-6 . ISBN 9780323529938 . S2CID 260507329 .
Однако миоглобин неспецифичен для некроза миокарда, особенно при наличии повреждения скелетных мышц и почечной недостаточности .
- ^ Сехон Н., Павлин ВФ (2019). «Биомаркеры, помогающие оценить боль в груди». Биомаркеры сердечно-сосудистых заболеваний . Эльзевир. стр. 115–128. дои : 10.1016/b978-0-323-54835-9.00011-9 . ISBN 978-0-323-54835-9 . S2CID 59548142 .
миоглобин неспецифичен для гибели сердечных миоцитов, и его уровни могут повышаться при заболеваниях почек , а также при повреждении скелетных мышц.
- ^ Перейти обратно: а б Нельсон Д.Л., Кокс М.М. (2000). Ленингерские принципы биохимии (3-е изд.). Нью-Йорк: Издательство Worth. п. 206. ИСБН 0-7167-6203-Х . (Ссылка на книги Google — издание 2008 года)
- ^ Цю Ю, Саттон Л, Риггс А.Ф. (сентябрь 1998 г.). «Идентификация миоглобина в гладких мышцах человека» . Журнал биологической химии . 273 (36): 23426–32. дои : 10.1074/jbc.273.36.23426 . ПМИД 9722578 .
- ^ (США) Национальный научный фонд: Хронология банка данных белков (21 января 2004 г.) . Проверено 17.03.2010.
- ^ Кендрю Дж.К., Бодо Дж., Динцис Х.М., Пэрриш Р.Г., Вайкофф Х., Филлипс, округ Колумбия (март 1958 г.). «Трехмерная модель молекулы миоглобина, полученная методом рентгеноструктурного анализа». Природа . 181 (4610): 662–6. Бибкод : 1958Natur.181..662K . дои : 10.1038/181662a0 . ПМИД 13517261 . S2CID 4162786 .
- ^ Стоддарт С. (1 марта 2022 г.). «Структурная биология: как белки получили крупный план» . Знающий журнал . doi : 10.1146/knowable-022822-1 . Проверено 25 марта 2022 г.
- ^ Нобелевская премия по химии 1962 г.
- ^ Гарри Диджей, Канатус С.Б., Маммен П.П. (2007). «Молекулярное понимание функциональной роли миоглобина» . Гипоксия и кровообращение . Достижения экспериментальной медицины и биологии. Том. 618. Спрингер. стр. 181–93 . дои : 10.1007/978-0-387-75434-5_14 . ISBN 978-0-387-75433-8 . ПМИД 18269197 .
- ^ Акабоши Э (1985). «Клонирование гена миоглобина человека». Джин . 33 (3): 241–9. дои : 10.1016/0378-1119(85)90231-8 . ПМИД 2989088 .
- ^ Харви Дж.В. (2008). «Метаболизм железа и его нарушения». Клиническая биохимия домашних животных . Эльзевир. стр. 259–285. дои : 10.1016/b978-0-12-370491-7.00009-x . ISBN 978-0-12-370491-7 .
Миоглобин — белок, связывающий кислород, расположенный преимущественно в мышцах. Миоглобин служит локальным резервуаром кислорода, который может временно обеспечивать кислород, когда доставка кислорода в кровь недостаточна в периоды интенсивной мышечной активности. Железо внутри гемовой группы должно находиться в состоянии Fe+2, чтобы связывать кислород. Если железо окисляется до состояния Fe+3, образуется метмиоглобин.
- ^ Уилсон М.Т., Ридер Б.Дж. (2006). «Миоглобин». В Лоране Г.Ж., Шапиро С.Д. (ред.). Энциклопедия респираторной медицины . Оксфорд: Академическая пресса. стр. 73–76. дои : 10.1016/b0-12-370879-6/00250-7 . ISBN 978-0-12-370879-3 .
- ^ МакГи Х (2004). О еде и кулинарии: наука и знания кухни . Нью-Йорк: Скрибнер. п. 148. ИСБН 0-684-80001-2 .
- ^ Фракеса М.Дж., Баррето А.С. (сентябрь 2011 г.). «Подход с использованием газовых смесей для увеличения срока хранения мяса индейки при упаковке в модифицированной атмосфере: влияние угарного газа» . Птицеводство . 90 (9): 2076–84. дои : 10.3382/ps.2011-01366 . ПМИД 21844276 .
- ^ «Мясные компании защищают использование угарного газа» . Бизнес . Миннеаполис Стар Трибьюн. Ассошиэйтед Пресс. 30 октября 2007 г. Архивировано из оригинала 25 декабря 2013 г. Проверено 11 февраля 2013 г.
- ^ Шелтон К., Наджера К., Аджредини С., Наварро Дж., Франгиас Т. (апрель 2020 г.). «Молекулярная магия постного мяса: структурные сходства и последовательности между соевым леггемоглобином и бычьим глобином» . Журнал ФАСЭБ . 34 (S1): 1. doi : 10.1096/fasebj.2020.34.s1.04866 .
- ^ Бандоим Л. (20 декабря 2019 г.). «Что решение FDA относительно соевого леггемоглобина означает для невозможного бургера» . Форбс . Проверено 4 марта 2020 г.
- ^ « «Изменитель правил игры во вкусе альтернатив мясу...» Motif FoodWorks выпустит белок, связывающий гем, обеспечивающий «вкус и аромат настоящего мяса» » . foodnavigator-usa.com . 17 сентября 2021 г.
- ^ «Касательно: Уведомление GRAS № GRN 001001» . FDA.gov . 03.12.2021.
- ^ «Moolec становится первой компанией по молекулярному сельскому хозяйству, получившей одобрение Министерства сельского хозяйства США на растительные животные белки» . Яху Финанс . 22 апреля 2024 г.
- ^ Берридж Б.Р., Ван Влит Дж.Ф., Герман Э. (2013). «Сердечная, сосудистая и скелетно-мышечная системы». Справочник Гашека и Руссо по токсикологической патологии . Эльзевир. стр. 1567–1665. дои : 10.1016/b978-0-12-415759-0.00046-7 . ISBN 978-0-12-415759-0 .
Миоглобин представляет собой низкомолекулярный гемовый белок, связывающий кислород, который содержится исключительно в клетках сердца и скелетных мышц. В крови миоглобин связывается преимущественно с глобулинами плазмы, комплексом, который фильтруется почками. Если концентрация в плазме превышает связывающую способность плазмы (1,5 мг/дл у человека), миоглобин начинает появляться в моче. Высокие концентрации миоглобина могут изменить цвет мочи на темно-красно-коричневый.
- ^ Нака Т., Джонс Д., Болдуин И., Фили Н., Бейтс С., Гоэль Х. и др. (апрель 2005 г.). «Клиренс миоглобина посредством сверхвысокопоточной гемофильтрации в случае тяжелого рабдомиолиза: отчет о случае» . Критическая помощь . 9 (2): Р90-5. дои : 10.1186/cc3034 . ПМК 1175920 . ПМИД 15774055 .
- ^ Вебер М., Рау М., Мадленер К., Эльзессер А., Банкович Д., Митрович В. и др. (ноябрь 2005 г.). «Диагностическая ценность новых иммуноанализов для определения сердечных маркеров cTnI, миоглобина и массы CK-MB». Клиническая биохимия . 38 (11): 1027–30. doi : 10.1016/j.clinbiochem.2005.07.011 . ПМИД 16125162 .
- ^ Дасгупта А., Вахед А. (2014). «Сердечные маркеры». Клиническая химия, иммунология и лабораторный контроль качества . Эльзевир. стр. 127–144. дои : 10.1016/b978-0-12-407821-5.00008-5 . ISBN 978-0-12-407821-5 .
Миоглобин — это гем-белок, обнаруженный как в скелетных, так и в сердечной мышце. Миоглобин обычно высвобождается в кровообращение уже через 1 час после инфаркта миокарда... Миоглобин имеет плохую клиническую специфичность из-за присутствия больших количеств миоглобина в скелетных мышцах. Некоторые исследования предлагают добавить тест на миоглобин к тесту на тропонин I для повышения диагностической ценности [4]. Миоглобин, будучи небольшим белком, выводится с мочой, а высокий уровень миоглобина в сыворотке крови наблюдается у пациентов с острой почечной недостаточностью ( уремическим синдромом ). Острая почечная недостаточность также является осложнением рабдомиолиза.
- ^ Перейти обратно: а б Универсальный белковый ресурс, номер доступа P02144 в UniProt .
- ^ Драго РС (1980). «Свободнорадикальные реакции систем переходных металлов». Обзоры координационной химии . 32 (2): 97–110. дои : 10.1016/S0010-8545(00)80372-0 .
- ^ Коллман Дж. П., Брауман Дж. И., Халберт Т. Р., Суслик К. С. (октябрь 1976 г.). «Природа связывания O2 и CO с металлопорфиринами и гемовыми белками» . Труды Национальной академии наук Соединенных Штатов Америки . 73 (10): 3333–7. Бибкод : 1976PNAS...73.3333C . дои : 10.1073/pnas.73.10.3333 . ПМК 431107 . ПМИД 1068445 .
- ^ Липпард С.Дж., Берг Дж.М. (1994). Основы бионеорганической химии . Милл-Вэлли, Калифорния: Университетские научные книги. ISBN 0-935702-73-3 .
Дальнейшее чтение
[ редактировать ]- Коллман Дж.П., Булатов Р., Сандерленд С.Дж., Фу Л. (февраль 2004 г.). «Функциональные аналоги цитохром-с-оксидазы, миоглобина и гемоглобина». Химические обзоры . 104 (2): 561–88. дои : 10.1021/cr0206059 . ПМИД 14871135 .
- Ридер Б.Дж., Свистуненко Д.А., Купер С.Э., Уилсон М.Т. (декабрь 2004 г.). «Радикальная и окислительно-восстановительная химия миоглобина и гемоглобина: от исследований in vitro до патологии человека». Антиоксиданты и окислительно-восстановительная сигнализация . 6 (6): 954–66. дои : 10.1089/ars.2004.6.954 . ПМИД 15548893 .
- Шлипер Г., Ким Дж.Х., Молоявый А., Якоби С., Лауссманн Т., Флёгель У. и др. (апрель 2004 г.). «Адаптация мыши с нокаутом миоглобина к гипоксическому стрессу». Американский журнал физиологии. Регуляторная, интегративная и сравнительная физиология . 286 (4): Р786-92. дои : 10.1152/ajpregu.00043.2003 . ПМИД 14656764 . S2CID 24831969 .
- Такано Т. (март 1977 г.). «Структура миоглобина, уточненная с разрешением 2-0 А. II. Структура дезоксимиоглобина кашалота». Журнал молекулярной биологии . 110 (3): 569–84. дои : 10.1016/S0022-2836(77)80112-5 . ПМИД 845960 .
- Рой А., Сен С., Чакраборти А.С. (февраль 2004 г.). «Неферментативное гликирование in vitro усиливает роль миоглобина как источника окислительного стресса». Свободные радикальные исследования . 38 (2): 139–46. дои : 10.1080/10715160310001638038 . ПМИД 15104207 . S2CID 11631439 .
- Стюарт Дж. М., Блейкли Дж. А., Карпович П. А., Каланджи Э., Тэтчер Б. Дж., Мартин Б. М. (март 2004 г.). «Необычайно слабое связывание кислорода, физические свойства, частичная последовательность, скорость автоокисления и потенциальный сайт фосфорилирования миоглобина белухи (Delphinapterus leucas)». Сравнительная биохимия и физиология Б . 137 (3): 401–12. дои : 10.1016/j.cbpc.2004.01.007 . ПМИД 15050527 .
- Ву Дж., Уэйнрайт Л.М., Пул Р.К. (2003). Микробные глобины . Достижения микробной физиологии. Том. 47. С. 255–310. дои : 10.1016/S0065-2911(03)47005-7 . ISBN 9780120277476 . ПМИД 14560666 .
- Мирчета С., Синьор А.В., Бернс Дж.М., Коссинс А.Р., Кэмпбелл К.Л., Беренбринк М. (июнь 2013 г.). «Эволюция способности млекопитающих к нырянию, прослеживаемая по чистому поверхностному заряду миоглобина». Наука . 340 (6138): 1234192. doi : 10.1126/science.1234192 . ПМИД 23766330 . S2CID 9644255 . . Также см. статью Proteopedia об этом открытии.
Внешние ссылки
[ редактировать ]- Интернет-менделевское наследование у человека (OMIM): 160 000 генетик человека
- Белок миоглобин
- Рекомендуемая молекула RCSB PDB
- «Какой отруб старше? (Это вопрос с подвохом)» , The New York Times , 21 февраля 2006 г., статья об использовании в мясной промышленности угарного газа, чтобы мясо выглядело красным.
- «Реакция магазинов на отчеты о мясе» , The New York Times , 1 марта 2006 г., статья об использовании угарного газа для придания мясу свежего вида.
- Обзор всей структурной информации, доступной в PDB для UniProt : P02144 (Человеческий миоглобин) в PDBe-KB .





![Молекулярно-орбитальное описание взаимодействия Fe-O2 в миоглобине.[36]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/34/MbO2MO.png/200px-MbO2MO.png)