Гистидин
 Скелетная формула гистидина ( цвиттер-ионная форма) | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Гистидин | |||
| Другие имена 2-Амино-3-(1H - имидазол-4-ил)пропановая кислота | |||
| Идентификаторы | |||
3D model ( JSmol ) |
| ||
| 84088 | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Лекарственный Банк | |||
| Информационная карта ECHA | 100.000.678 | ||
| Номер ЕС |
| ||
| 83042 | |||
| КЕГГ | |||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| C6H9N3OC6H9N3O2 | |||
| Молярная масса | 155.157 g·mol −1 | ||
| 4,19 г/100 г при 25 °C [1] | |||
| Опасности | |||
| NFPA 704 (огненный алмаз) | |||
| Страница дополнительных данных | |||
| Гистидин (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Гистидин (символ His или H ) [2] , незаменимая аминокислота которая используется в биосинтезе белков . Он содержит α-аминогруппу (которая находится в протонированном состоянии –NH 3 + образуются в биологических условиях ), группа карбоновой кислоты (которая находится в депротонированном –COO − образуют в биологических условиях) и боковую цепь имидазола (которая частично протонирована), что классифицирует его как положительно заряженную аминокислоту при физиологическом pH . Первоначально считалось, что он необходим только для младенцев, но теперь, как показали долгосрочные исследования, он необходим и для взрослых. [3] Он кодируется кодонами CAU и CAC.
Гистидин был впервые выделен Альбрехтом Косселем и Свеном Густавом Хедином в 1896 году. [4] Название происходит от его открытия в тканях, от ἱστός histós «ткань». [2] Он также является , жизненно предшественником гистамина важного воспалительного агента в иммунных реакциях. Ацильный радикал – гистидил .
Свойства боковой цепи имидазола
[ редактировать ]Сопряженная кислота (протонированная форма) имидазола боковой цепи в гистидине имеет p K a приблизительно 6,0. Таким образом, при pH ниже 6 имидазольное кольцо в основном протонируется (как описано уравнением Хендерсона-Хассельбаха ). Образующееся имидазолиевое кольцо несет две связи NH и имеет положительный заряд. Положительный заряд одинаково распределен между обоими атомами азота и может быть представлен двумя одинаково важными резонансными структурами . символ Hip . Иногда для этой протонированной формы вместо обычного His используется [5] [6] [7] При pH выше 6 один из двух протонов теряется. Оставшийся протон имидазольного кольца может располагаться на любом азоте, образуя так называемые таутомеры N1-H или N3-H . Таутомер N3-H показан на рисунке выше. В таутомере N1-H NH находится ближе к основной цепи. Эти нейтральные таутомеры, также называемые Nδ и Nε, иногда обозначаются символами Hid и Hie соответственно. [5] [6] [7] Имидазольное/имидазолиевое кольцо гистидина является ароматическим при всех значениях pH. [8] При определенных условиях все три ионообразующие группы гистидина могут быть заряжены, образуя катион гистидиния. [9]
Кислотно-основные свойства боковой цепи имидазола имеют отношение к каталитическому механизму многих ферментов . [10] В каталитических триадах основной азот гистидина отрывает протон от серина , треонина или цистеина , чтобы активировать его как нуклеофила . В гистидиновом челноке протонов гистидин используется для быстрого переноса протонов. Он может сделать это, отделив протон от его основного азота, чтобы образовать положительно заряженный промежуточный продукт, а затем использовать другую молекулу, буфер, для извлечения протона из его кислого азота. В карбоангидразах гистидиновый протонный челнок используется для быстрого переноса протонов от молекулы воды, связанной с цинком, для быстрой регенерации активной формы фермента. В спиралях E и F гемоглобина гистидин влияет на связывание дикислорода, а также монооксида углерода . Это взаимодействие увеличивает сродство Fe(II) к O2, но дестабилизирует связывание CO, который связывается с гемоглобином лишь в 200 раз сильнее по сравнению с 20 000 раз сильнее со свободным гемом .
Таутомерия и кислотно-основные свойства боковой цепи имидазола охарактеризованы 15 N-ЯМР-спектроскопия. два 15 Химические сдвиги N аналогичны (около 200 частей на миллион по отношению к азотной кислоте по сигма-шкале, где увеличение экранирования соответствует увеличению химического сдвига ). Спектральные измерения ЯМР показывают, что химический сдвиг N1-H падает незначительно, тогда как химический сдвиг N3-H падает значительно (около 190 против 145 м.д.). Это изменение указывает на то, что таутомер N1-H является предпочтительным, возможно, из-за водородной связи с соседним аммонием . Экранирование в N3 существенно снижается из-за парамагнитного эффекта второго порядка, который включает в себя разрешенное по симметрии взаимодействие между неподеленной парой азота и возбужденными π*-состояниями ароматического кольца . При pH > 9 химические сдвиги N1 и N3 составляют примерно 185 и 170 м.д. [11]
Лиганд
[ редактировать ]

Гистидин образует комплексы со многими ионами металлов. Боковая цепь имидазола остатка гистидина обычно служит лигандом в металлопротеинах . Одним из примеров является аксиальное основание, прикрепленное к Fe в миоглобине и гемоглобине. Полигистидиновые метки (из шести или более последовательных остатков H) используются для очистки белков путем связывания с колонками с никелем или кобальтом с микромолярным сродством. [12] Было показано , что природные полигистидиновые пептиды, обнаруженные в яде гадюки Atheris sqamigera , связывают Zn(2+), Ni(2+) и Cu(2+) и влияют на функцию металлопротеаз яда. [13]
Метаболизм
[ редактировать ]Биосинтез
[ редактировать ]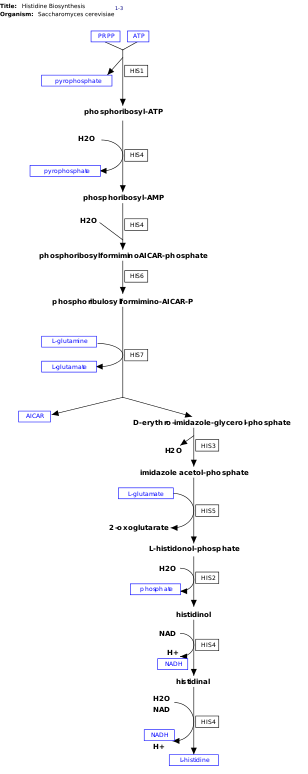
L -Гистидин — незаменимая аминокислота, которая не синтезируется de novo в организме человека. [14] Люди и другие животные должны потреблять гистидин или гистидинсодержащие белки. Биосинтез гистидина широко изучен у прокариот, таких как E. coli . Синтез гистидина в E. coli включает восемь генных продуктов (His1, 2, 3, 4, 5, 6, 7 и 8) и происходит в десять стадий. Это возможно, поскольку продукт одного гена способен катализировать более чем одну реакцию. Например, как показано на пути, His4 катализирует 4 различных этапа пути. [15]
Гистидин синтезируется из фосфорибозилпирофосфата (PRPP), который образуется из рибозо-5-фосфата под действием рибозо-фосфатдифосфокиназы по пентозофосфатному пути . Первой реакцией биосинтеза гистидина является конденсация PRPP и аденозинтрифосфата (АТФ) под действием фермента АТФ-фосфорибозилтрансферазы . АТФ-фосфорибозилтрансфераза обозначена на изображении His1. [15] Продукт гена His4 затем гидролизует продукт конденсации фосфорибозил-АТФ с образованием фосфорибозил-АМФ (PRAMP), что является необратимым этапом. Затем His4 катализирует образование фосфорибозилформиминоAICAR-фосфата, который затем преобразуется в фосфорибулозилформимино-AICAR-P с помощью продукта гена His6. [16] His7 расщепляет фосфорибулозилформимино-AICAR-P с образованием d- эритроимидазолглицеринфосфат. После этого His3 образует имидазолацетолфосфат, высвобождая воду. Затем His5 делает L- гистидинол-фосфат, который затем гидролизуется His2 с образованием гистидинола . His4 катализирует окисление l -гистидинол с образованием l -гистидиналь, аминоальдегид. На последнем этапе l -гистидинальный преобразуется в л -гистидин. [16] [17]
Путь биосинтеза гистидина изучен у гриба Neurospora crassa и обнаружен ген ( His-3 ), кодирующий мультиферментный комплекс , сходный с геном His4 бактерии E. coli . [18] Генетическое исследование N. crassa гистидина мутантов показало, что отдельные активности мультиферментного комплекса происходят в дискретных, смежных участках His-3 генетической карты , что позволяет предположить, что различные активности мультиферментного комплекса кодируются отдельно друг от друга. [18] Однако были также обнаружены мутанты, у которых отсутствовали все три активности одновременно, что позволяет предположить, что некоторые мутации вызывают потерю функции комплекса в целом.
Так же, как животные и микроорганизмы, растениям для роста и развития необходим гистидин. [10] Микроорганизмы и растения схожи в том, что они могут синтезировать гистидин. [19] Оба синтезируют гистидин из биохимического промежуточного продукта фосфорибозилпирофосфата. В целом биосинтез гистидина у растений и микроорганизмов очень похож. [20]
Регуляция биосинтеза
[ редактировать ]Для своего существования этому пути требуется энергия, поэтому присутствие АТФ активирует первый фермент пути, АТФ-фосфорибозилтрансферазу (показана как His1 на изображении справа). АТФ-фосфорибозилтрансфераза — это фермент, определяющий скорость, который регулируется посредством ингибирования по обратной связи, что означает, что он ингибируется в присутствии продукта — гистидина. [21]
Деградация
[ редактировать ]Гистидин — одна из аминокислот, которая может превращаться в промежуточные соединения цикла трикарбоновых кислот (ТСА) (также известного как цикл лимонной кислоты). [22] Гистидин вместе с другими аминокислотами, такими как пролин и аргинин, принимает участие в дезаминировании — процессе, при котором удаляется его аминогруппа. У прокариот гистидин сначала превращается в уроканат под действием гистидазы. Затем уроканаза превращает уроканат в 4-имидазолона-5-пропионат. Имидазолонпропионаза катализирует реакцию образования формиминоглутамата (FIGLU) из 4-имидазолона-5-пропионата. [23] Форминогруппа переносится на тетрагидрофолат , а оставшиеся пять атомов углерода образуют глутамат. [22] В целом эти реакции приводят к образованию глутамата и аммиака. [24] Затем глутамат может быть дезаминирован глутаматдегидрогеназой или трансаминирован с образованием α-кетоглутарата. [22]
Превращение в другие биологически активные амины
[ редактировать ]- Аминокислота гистидин является предшественником гистамина , амина, вырабатываемого в организме и необходимого для воспаления. [25]
- Фермент гистидин-аммиаклиаза превращает гистидин в аммиак и урокановую кислоту . Дефицит этого фермента присутствует при редком метаболическом расстройстве гистидинемии , при котором уроканиновая ацидурия является ключевым диагностическим признаком.
- Гистидин может быть преобразован в 3-метилгистидин , который служит биомаркером повреждения скелетных мышц, с помощью определенных метилтрансферазы . ферментов [26]
- Гистидин также является предшественником карнозина биосинтеза , дипептида, обнаруженного в скелетных мышцах. [27]
- У Actinomycetota и мицелиальных грибов, таких как Neurospora crassa , гистидин может превращаться в антиоксидант эрготионеин . [28]

Требования
[ редактировать ]Совет по продовольствию и питанию (FNB) Института медицины США установил рекомендуемые диетические нормы (RDA) для незаменимых аминокислот в 2002 году. Гистидин для взрослых от 19 лет и старше составляет 14 мг/кг массы тела в день. [29] Дополнительный гистидин исследуется на предмет использования при различных состояниях, включая неврологические расстройства, атопический дерматит, метаболический синдром, диабет, уремическую анемию, язвы, воспалительные заболевания кишечника, злокачественные новообразования и нарушение мышечной деятельности во время напряженных физических упражнений. [30]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ http://prowl.rockefeller.edu/aainfo/solub.htm [ нужна полная цитата ]
- ^ Jump up to: а б «Номенклатура и символика аминокислот и пептидов» . Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983. Архивировано из оригинала 9 октября 2008 года . Проверено 5 марта 2018 г.
- ^ Коппл, доктор медицинских наук; Свендсайд, Мэн (1975). «Доказательства того, что гистидин является незаменимой аминокислотой у нормального человека и человека с хронической уремией» . Журнал клинических исследований . 55 (5): 881–91. дои : 10.1172/JCI108016 . ПМК 301830 . ПМИД 1123426 .
- ^ Викери, Хьюберт Брэдфорд; Ливенворт, Чарльз С. (1 августа 1928 г.). «О разделении гистидина и аргинина» (PDF) . Журнал биологической химии . 78 (3): 627–635. дои : 10.1016/S0021-9258(18)83967-9 . ISSN 0021-9258 .
- ^ Jump up to: а б Ким, Микьям Оливия; Николс, Сара Э.; Ван, Йи; Маккаммон, Дж. Эндрю (март 2013 г.). «Влияние протонирования гистидина и ротамерных состояний на виртуальный скрининг RmlC M. Tuberculosis» . Журнал компьютерного молекулярного дизайна . 27 (3): 235–246. Бибкод : 2013JCAMD..27..235K . дои : 10.1007/s10822-013-9643-9 . ISSN 0920-654X . ПМЦ 3639364 . ПМИД 23579613 .
- ^ Jump up to: а б «ГИСТИДИН» . ambermd.org . Проверено 12 мая 2022 г.
- ^ Jump up to: а б Докаиниш, Хишам М.; Китао, Акио (05 августа 2016 г.). «Вычислительное определение состояния протонирования гистидина в (6-4) ферменте фотолиазы и его влияние на стадию протонирования» . АКС-катализ . 6 (8): 5500–5507. дои : 10.1021/acscatal.6b01094 . ISSN 2155-5435 . S2CID 88813605 .
- ^ Мрозек, Агнешка; Каролак-Войцеховска, Янина; Кич-Кононович, Катажина (2003). «Пятичленные гетероциклы. Часть III. Ароматичность 1,3-имидазола в 5+n гетеробициклических молекулах». Журнал молекулярной структуры . 655 (3): 397–403. Бибкод : 2003JMoSt.655..397M . дои : 10.1016/S0022-2860(03)00282-5 .
- ^ Новиков Антон П.; Сафонов Алексей Владимирович; Герман Константин Евгеньевич; Григорьев Михаил С. (01 декабря 2023 г.). «Какие взаимодействия мы можем получить при переходе от цвиттер-ионов к «дриттерным» ионам: взаимодействия анион-анион C–O⋯Re(O4) и Re–O⋯Re(O4) составляют структурное различие между перренатом и пертехнетатом L-гистидиния» . CrystEngComm . 26 : 61–69. дои : 10.1039/D3CE01164J . ISSN 1466-8033 . S2CID 265572280 .
- ^ Jump up to: а б Ингл, Роберт А. (2011). «Биосинтез гистидина» . Книга «Арабидопсис» . 9 : e0141. дои : 10.1199/tab.0141 . ПМК 3266711 . ПМИД 22303266 .
- ^ Робертс, Джон Д. (2000). Азбука FT-ЯМР . Саусалито, Калифорния: Университетские научные книги. стр. 258–9. ISBN 978-1-891389-18-4 .
- ^ Борнхорст, JA; Фальке, Джей-Джей (2000). «Очистка белков с использованием полигистидиновых аффинных меток». Применение химерных генов и гибридных белков. Часть A: Экспрессия генов и очистка белков . Методы энзимологии. Том. 326. стр. 245–254. дои : 10.1016/s0076-6879(00)26058-8 . ISBN 978-0-12-182227-9 . ISSN 0076-6879 . ПМК 2909483 . ПМИД 11036646 .
- ^ Уотли, Джоанна; Симоновский, Эяль; Барбоза, Нуно; Сподзея, Марта; Вечорек, Роберт; Родзевич-Мотовидло, Сильвия; Миллер, Ифат; Козловский, Хенрик (17 августа 2015 г.). «Фрагмент пептидного пептида африканской гадюки Poly-His Tag эффективно связывает ионы металлов и сворачивается в α-спиральную структуру» . Неорганическая химия . 54 (16): 7692–7702. doi : 10.1021/acs.inorgchem.5b01029 . ISSN 1520-510X . ПМИД 26214303 .
- ^ Карта биохимических путей Рош Карта биохимических путей Рош
- ^ Jump up to: а б Алифано, П; Фани, Р; Лио, П; Ласкано, А; Баззикалупо, М; Карломаньо, MS; Бруни, CB (1 марта 1996 г.). «Путь биосинтеза гистидина и гены: структура, регуляция и эволюция» . Микробиологические обзоры . 60 (1): 44–69. дои : 10.1128/ММБР.60.1.44-69.1996 . ISSN 0146-0749 . ПМК 239417 . ПМИД 8852895 .
- ^ Jump up to: а б Кулис-Хорн, Роберт К.; Персике, Маркус; Калиновский, Йорн (01 января 2014 г.). «Биосинтез гистидина, его регуляция и биотехнологическое применение у Corynebacterium glutamicum» . Микробная биотехнология . 7 (1): 5–25. дои : 10.1111/1751-7915.12055 . ISSN 1751-7915 . ПМЦ 3896937 . ПМИД 23617600 .
- ^ Адамс, Э. (1 ноября 1955 г.). «L-Гистидинал, биосинтетический предшественник гистидина» . Журнал биологической химии . 217 (1): 325–344. дои : 10.1016/S0021-9258(19)57184-8 . ISSN 0021-9258 . ПМИД 13271397 .
- ^ Jump up to: а б Ахмед А. Организация области гистидина-3 Neurospora. Мол Ген Генет. 1968;103(2):185-93. дои: 10.1007/BF00427145. ПМИД 4306011
- ^ «Понимание генетики» . сайт Genetics.thetech.org . Архивировано из оригинала 25 мая 2016 г. Проверено 19 мая 2016 г.
- ^ Степанский А.; Леустек, Т. (1 марта 2006 г.). «Биосинтез гистидина в растениях». Аминокислоты . 30 (2): 127–142. дои : 10.1007/s00726-005-0247-0 . ISSN 0939-4451 . ПМИД 16547652 . S2CID 23733445 .
- ^ Ченг, Юнсонг; Чжоу, Юньцзяо; Ян, Лей; Чжан, Чэнлинь; Сюй, Цинъян; Се, Сисянь; Чен, Нин (01 мая 2013 г.). «Модификация генов пути биосинтеза гистидина и влияние на выработку L-гистидина в Corynebacterium Glutamicum». Биотехнологические письма . 35 (5): 735–741. дои : 10.1007/s10529-013-1138-1 . ISSN 1573-6776 . ПМИД 23355034 . S2CID 18380727 .
- ^ Jump up to: а б с Серия обзоров совета директоров (BRS) - Биохимия, молекулярная биология и генетика (пятое издание): Суонсон, Ким, Глюксман
- ^ Кут, Дж. Г.; Хассалл, Х. (1 марта 1973 г.). «Разрушение L-гистидина, имидазолил-L-лактата и имидазолилпропионата Pseudomonas testosteroni» . Биохимический журнал . 132 (3): 409–422. дои : 10.1042/bj1320409 . ISSN 0264-6021 . ПМЦ 1177604 . ПМИД 4146796 .
- ^ Мелер, А.Х.; Табор, Х. (1 апреля 1953 г.). «Дезаминирование гистидина с образованием уроканиновой кислоты в печени» . Журнал биологической химии . 201 (2): 775–784. дои : 10.1016/S0021-9258(18)66234-9 . ISSN 0021-9258 . ПМИД 13061415 .
- ^ Андерсен, Хьялте Х.; Эльберлинг, Йеспер; Арендт-Нильсен, Ларс (1 сентября 2015 г.). «Человеческие суррогатные модели гистаминергического и негистаминэргического зуда» (PDF) . Acta Dermato-Venereologica . 95 (7): 771–777. дои : 10.2340/00015555-2146 . ISSN 1651-2057 . ПМИД 26015312 .
- ^ «3-Метилгистидин» . ХМДБ Версия 4.0 . База данных метаболомов человека. 20 декабря 2017 года . Проверено 25 декабря 2017 г.
- ^ Дераве, Вим; Эверарт, Инге; Бекман, Сэм; Баге, Одри (01 марта 2010 г.). «Метаболизм карнозина в мышцах и добавки бета-аланина в связи с физическими упражнениями и тренировками» . Спортивная медицина . 40 (3): 247–263. дои : 10.2165/11530310-000000000-00000 . hdl : 1854/LU-897781 . ISSN 1179-2035 . ПМИД 20199122 . S2CID 7661250 .
- ^ Фэйи, Роберт С. (2001). «Новые тиолы прокариотов». Ежегодный обзор микробиологии . 55 : 333–56. дои : 10.1146/annurev.micro.55.1.333 . ПМИД 11544359 .
- ^ Медицинский институт (2002). «Белки и аминокислоты» . Справочная норма потребления энергии, углеводов, клетчатки, жиров, жирных кислот, холестерина, белков и аминокислот . Вашингтон, округ Колумбия: Издательство национальных академий. стр. 589–768. дои : 10.17226/10490 . ISBN 978-0-309-08525-0 .
- ^ Голечек, Милан (22 марта 2020 г.). «Гистидин в здоровье и болезнях: метаболизм, физиологическое значение и использование в качестве добавки» . Питательные вещества . 12 (3): 848. дои : 10.3390/nu12030848 . ISSN 2072-6643 . ПМК 7146355 . ПМИД 32235743 .