Рибозофосфатдифосфокиназа
| Рибозофосфатдифосфокиназа | |||
|---|---|---|---|
 Фосфорибозилпирофосфатсинтаза 1, гексамер, человек | |||
| Идентификаторы | |||
| Номер ЕС. | 2.7.6.1 | ||
| Номер CAS. | 9031-46-3 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| фосфорибозилпирофосфатсинтетаза 1 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ПРПС1 | ||
| ген NCBI | 5631 | ||
| HGNC | 9462 | ||
| МОЙ БОГ | 311850 | ||
| RefSeq | НМ_002764 | ||
| ЮниПрот | P60891 | ||
| Другие данные | |||
| Номер ЕС | 2.7.6.1 | ||
| Локус | Хр. Х q21-q27 | ||
| |||
| фосфорибозилпирофосфатсинтетаза 2 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ПРПС2 | ||
| ген NCBI | 5634 | ||
| HGNC | 9465 | ||
| МОЙ БОГ | 311860 | ||
| RefSeq | НМ_002765 | ||
| ЮниПрот | P11908 | ||
| Другие данные | |||
| Номер ЕС | 2.7.6.1 | ||
| Локус | Хр. X pter-q21 | ||
| |||
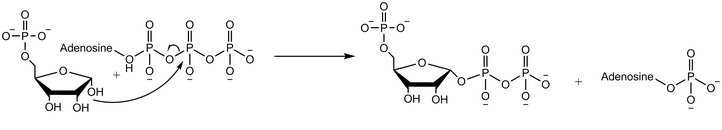
Рибозофосфатдифосфокиназа (или фосфорибозилпирофосфатсинтетаза или рибозофосфатпирофосфокиназа ) представляет собой фермент , который превращает рибозо-5-фосфат в фосфорибозилпирофосфат (PRPP). [1] [2] Он классифицируется по EC 2.7.6.1 .
Фермент участвует в синтезе нуклеотидов ( пуринов и пиримидинов ), кофакторов НАД и НАДФ , а также аминокислот гистидина и триптофана . [1] [2] [3] связывая эти процессы биосинтеза с пентозофосфатным путем, из которого образуется субстрат рибозо-5-фосфат. Рибозо-5-фосфат вырабатывается шунтирующим путем HMP из глюкозо-6-фосфата . Продукт фосфорибозилпирофосфат действует как важный компонент пути утилизации пуринов и синтеза пуринов de novo . Дисфункция фермента, таким образом, может подорвать пуриновый метаболизм . Рибозофосфатпирофосфокиназа существует у бактерий, растений и животных, и существует три изоформы рибозофосфатпирофосфокиназы человека. [2] У человека гены, кодирующие фермент, расположены на Х-хромосоме . [2]
Механизм реакции
[ редактировать ]
Рибозофосфатдифосфокиназа переносит дифосфорильную группу от Mg-АТФ (Mg2+, координированный с АТФ) на рибозо-5-фосфат. [2] Ферментативная реакция начинается со связывания рибозо-5-фосфата, за которым следует связывание Mg-АТФ с ферментом. В переходном состоянии при связывании обоих субстратов происходит перенос дифосфата. Фермент сначала высвобождает АМФ, а затем высвобождает продукт фосфорибозилпирофосфат. [4] Эксперименты с использованием воды, меченной кислородом 18, показывают, что механизм реакции протекает с нуклеофильной атакой аномерной гидроксильной группы рибозо-5-фосфата на бета-фосфор АТФ в реакции SN2 . [5]
Структура
[ редактировать ]
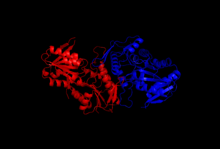
Исследования кристаллизации и рентгеновской дифракции выяснили структуру фермента, который был выделен с помощью методов клонирования, экспрессии белка и очистки. Одна субъединица рибозофосфатдифосфокиназы состоит из 318 аминокислот; активный ферментный комплекс состоит из трех гомодимеров (или шести субъединиц, гексамера). Структура одной субъединицы представляет собой пятицепочечный параллельный бета-лист (центральное ядро), окруженный четырьмя альфа-спиралями в N-концевом домене и пятью альфа-спиралями в C-концевом домене , с двумя короткими антипараллельными бета-листами, простирающимися из ядра. [2] Каталитический сайт фермента связывает АТФ и рибозо-5-фосфат. Гибкая петля (Phe92–Ser108), пирофосфатсвязывающая петля (Asp171–Gly174) и область флага (Val30–Ile44 из соседней субъединицы) составляют сайт связывания АТФ, расположенный на границе между двумя доменами одной субъединицы. Гибкая петля названа так из-за большой изменчивости ее конформации. [6] Сайт связывания рибозо-5-фосфата состоит из остатков Asp220–Thr228, расположенных в С-концевом домене одной субъединицы. [2] [6] Аллостерический сайт, связывающий АДФ, состоит из аминокислотных остатков трех субъединиц. [2]
Функция
[ редактировать ]Продукт этой реакции, фосфорибозилпирофосфат (PRPP), используется во многих биосинтеза ( de novo и утилизации путях ). PRPP обеспечивает сахар рибозы в синтезе de novo пуринов и пиримидинов, используемых в нуклеотидных основаниях, образующих РНК и ДНК . PRPP реагирует с оротатом с образованием оротидилата, который может быть преобразован в уридилат (UMP). UMP затем может быть преобразован в нуклеотид цитидинтрифосфат (CTP). В результате реакции PRPP, глютамина и аммиака образуется 5-фосфорибозил-1-амин, предшественник инозината ( ИМФ), который в конечном итоге может быть преобразован в аденозинтрифосфат (АТФ) или гуанозинтрифосфат (ГТФ). PRPP играет роль в путях спасения пуринов, реагируя со свободными пуриновыми основаниями с образованием аденилата, гуанилата и инозината. [7] [8] PRPP также используется в синтезе НАД : реакция PRPP с никотиновой кислотой дает промежуточный мононуклеотид никотиновой кислоты. [9]
Регулирование
[ редактировать ]Для активности рибозофосфатдифосфокиназы требуется Mg2+; фермент действует только на АТФ , координируемый с Mg2+. Рибозофосфатдифосфокиназа регулируется фосфорилированием и аллостерией. Он активируется фосфатом и ингибируется АДФ ; предполагается, что фосфат и АДФ конкурируют за один и тот же регуляторный сайт. В нормальных концентрациях фосфат активирует фермент, связываясь с его аллостерическим регуляторным участком. Однако показано, что при высоких концентрациях фосфат оказывает ингибирующее действие, конкурируя с субстратом рибозо-5-фосфатом за связывание в активном центре. АДФ является ключевым аллостерическим ингибитором рибозофосфатдифосфокиназы. Было показано, что при более низких концентрациях субстрата рибозо-5-фосфата АДФ может конкурентно ингибировать фермент. Рибозо-фосфатпирофосфокиназа также ингибируется некоторыми из ее последующих продуктов биосинтеза. [2] [6]
Роль в болезни
[ редактировать ]Поскольку ее продукт является ключевым соединением во многих путях биосинтеза, рибозофосфатдифосфокиназа участвует в некоторых редких заболеваниях и Х-сцепленных рецессивных заболеваниях . Мутации, которые приводят к сверхактивности (повышению активности фермента или нарушению регуляции фермента), приводят к перепроизводству пурина и мочевой кислоты. Симптомы сверхактивности включают подагру , нейросенсорную тугоухость, [10] слабый мышечный тонус (гипотония), нарушение координации мышц (атаксия), наследственная периферическая нейропатия, [11] и расстройства нервно-психического развития. [12] [13] [14] Мутации, которые приводят к потере функции рибозофосфатдифосфокиназы, приводят к болезни Шарко-Мари-Тута и синдрому Артса . [15]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Висентин Л.П., Хаснайн С., Галлин В. (июль 1977 г.). «Рибосомальный белок S1/S1A у бактерий» . ФЭБС Летт . 79 (2): 258–63. Бибкод : 1977FEBSL..79..258V . дои : 10.1016/0014-5793(77)80799-0 . ПМИД 330231 . S2CID 38926849 .
- ^ Перейти обратно: а б с д и ж г час я Ли С., Лу Ю, Пэн Б., Дин Дж. (январь 2007 г.). «Кристаллическая структура человеческой фосфорибозилпирофосфатсинтетазы 1 обнаруживает новый аллостерический сайт» . Биохим. Дж . 401 (1): 39–47. дои : 10.1042/BJ20061066 . ПМЦ 1698673 . ПМИД 16939420 .
- ^ Тан В., Ли X, Чжу Z, Тонг С., Ли X, Чжан X, Тенг М, Ню Л (май 2006 г.). «Экспрессия, очистка, кристаллизация и предварительный рентгеноструктурный анализ человеческой фосфорибозилпирофосфатсинтетазы 1 (PRS1)» . Acta Crystallographica Раздел F. 62 (Часть 5): 432–4. дои : 10.1107/S1744309106009067 . ПМК 2219982 . ПМИД 16682768 .
- ^ Фокс И.Х., Келли В.Н. (апрель 1972 г.). «Человеческая фосфорибозилпирофосфатсинтетаза. Кинетический механизм и ингибирование конечного продукта» . Ж. Биол. Хим . 247 (7): 2126–31. дои : 10.1016/S0021-9258(19)45500-2 . ПМИД 4335863 .
- ^ Миллер Г.А., Розенцвейг С., Свитцер Р.Л. (декабрь 1975 г.). «Исследование кислорода-18 механизма переноса пирофосфорильной группы, катализируемого фосфорибозилпирофосфатсинтетазой». Арх. Биохим. Биофиз . 171 (2): 732–6. дои : 10.1016/0003-9861(75)90086-7 . ПМИД 173242 .
- ^ Перейти обратно: а б с Эриксен Т.А., Кадзиола А., Бентсен А.К., Харлоу К.В., Ларсен С. (апрель 2000 г.). «Структурная основа функции фосфорибозилпирофосфатсинтетазы Bacillus subtilis». Нат. Структура. Биол . 7 (4): 303–8. дои : 10.1038/74069 . ПМИД 10742175 . S2CID 23115108 .
- ^ Фокс И.Х., Келли В.Н. (март 1971 г.). «Фосфорибозилпирофосфат у человека: биохимическое и клиническое значение». Энн. Стажер. Мед . 74 (3): 424–33. дои : 10.7326/0003-4819-74-3-424 . ПМИД 4324023 .
- ^ Джереми М. Берг; Джон Л. Тимочко; Люберт Страйер; Грегори Дж. Гатто младший (2012). Биохимия (7-е изд.). Нью-Йорк: WH Freeman. ISBN 978-1429229364 .
- ^ Ронгво А., Андрис Ф., Ван Гул Ф., Лео О. (июль 2003 г.). «Реконструкция метаболизма НАД у эукариот». Биоэссе . 25 (7): 683–90. дои : 10.1002/bies.10297 . ПМИД 12815723 .
- ^ Лю Х, Хан Д, Ли Дж, Хан Б, Оуян Х, Ченг Дж, Ли Х, Цзинь З, Ван Ю, Битнер-Глинджич М, Конг Х, Сюй Х, Кантарджиева А, Иви Р.Д., Зейдман С.Э., Зейдман Дж., Ду ЛЛ, Чен ЗЮ, Дай П, Тэн М, Ян Д, Юань Х (январь 2010 г.). «Мутации потери функции в гене PRPS1 вызывают тип несиндромальной Х-сцепленной нейросенсорной глухоты, DFN2» . Являюсь. Дж. Хум. Жене . 86 (1): 65–71. дои : 10.1016/j.ajhg.2009.11.015 . ПМК 2801751 . ПМИД 20021999 .
- ^ Ким Х.Дж., Сон К.М., Шай М.Е., Краевски К.М., Хван М., Пак Дж.Х., Чан С.И., Вон Х.Х., Чхве БО, Хонг Ш., Ким Би.Дж., Су Ю.Л., Ки К.С., Ли С.И., Ким Ш., Ким Дж.В. (сентябрь 2007 г.) ). «Мутации в PRPS1, который кодирует фермент фосфорибозилпирофосфатсинтетазу, критически важный для биосинтеза нуклеотидов, вызывают наследственную периферическую невропатию с потерей слуха и оптической невропатией (cmtx5)» . Являюсь. Дж. Хум. Жене . 81 (3): 552–8. дои : 10.1086/519529 . ПМК 1950833 . ПМИД 17701900 .
- ^ Беккер М.А., Смит П.Р., Тейлор В., Мустафи Р., Свитцер Р.Л. (ноябрь 1995 г.). «Генетическая и функциональная основа сверхактивности фосфорибозилпирофосфатсинтетазы, устойчивой к пуриновым нуклеотидам» . Дж. Клин. Инвестируйте . 96 (5): 2133–41. дои : 10.1172/JCI118267 . ПМК 185862 . ПМИД 7593598 .
- ^ Зореф Э., Де Врис А., Сперлинг О. (ноябрь 1975 г.). «Мутантная фосфорибозилпирофосфатсинтетаза, устойчивая к обратной связи, связанная с перепроизводством пуринов и подагрой. Фосфорибозилпирофосфат и метаболизм пуринов в культивируемых фибробластах» . Дж. Клин. Инвестируйте . 56 (5): 1093–9. дои : 10.1172/JCI108183 . ПМК 301970 . ПМИД 171280 .
- ^ «Сверхактивность фосфорибозилпирофосфатсинтетазы» . Национальный центр биомедицинских коммуникаций Листера Хилла . Проверено 25 февраля 2014 г.
- ^ Синофзик М., Мюллер Фом Хаген Дж., Хаак Т.Б., Вильгельм С., Линдиг Т., Бек-Вёдль С., Набуурс С.Б., ван Куиленбург А.Б., де Брауэр А.П., Шёльс Л. (2014). «Х-сцепленная болезнь Шарко-Мари-Тута, синдром Артса и прелингвальная несиндромальная глухота образуют континуум заболевания: данные из семьи с новой мутацией PRPS1» . Orphanet J Редкий дис . 9 (1): 24. дои : 10.1186/1750-1172-9-24 . ПМЦ 3931488 . ПМИД 24528855 .
Внешние ссылки
[ редактировать ]- Унипрот - Рибозофосфатпирофосфокиназа 1
- Запись GeneReviews/NIH/NCBI/UW о невропатии Шарко-Мари-Тута X типа 5
- Записи OMIM о невропатии Шарко-Мари-Тута X типа 5
- Запись GeneReviews/NCBI/NIH/UW о синдроме искусств
- Запись GeneReviews/NIH/NCBI/UW о сверхактивности фосфорибозилпирофосфатсинтетазы (PRS)
- Запись GeneReviews/NCBI/NIH/UW о несиндромальной потере слуха и глухоте DFNX1
- Фосфорибозил + пирофосфат + синтетаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)