Терминальная дезоксинуклеотидилтрансфераза
| ДНТТ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | DNTT , TDT, ДНК-нуклеотидиллексотрансфераза, терминальная дезоксинуклеотидилтрансфераза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 187410 ; МГИ : 98659 ; Гомологен : 3014 ; GeneCards : DNTT ; ОМА : ДНТТ - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Терминальная дезоксинуклеотидилтрансфераза ( TdT ), также известная как ДНК-нуклеотидилексотрансфераза ( DNTT ) или терминальная трансфераза , представляет собой специализированную ДНК-полимеразу, экспрессируемую в незрелых, пре-B, пре-Т -лимфоидных клетках и клетках острого лимфобластного лейкоза /лимфомы. TdT добавляет N-нуклеотиды к V, D и J экзонам генов TCR и BCR во время рекомбинации генов антител , обеспечивая феномен многообразия соединений . У человека терминальная трансфераза кодируется DNTT геном . [ 5 ] [ 6 ] Являясь членом семейства X ферментов ДНК-полимеразы , он работает совместно с полимеразой λ и полимеразой μ, которые принадлежат к одному и тому же семейству ферментов-полимераз X. Разнообразие, внесенное TdT, сыграло важную роль в эволюции иммунной системы позвоночных, значительно увеличив разнообразие антигенных рецепторов, которыми клетка оснащена для борьбы с патогенами. Исследования с использованием мышей, нокаутных по TdT, обнаружили резкое сокращение (в 10 раз) разнообразия Т-клеточных рецепторов (TCR) по сравнению с таковым в нормальных системах или системах дикого типа. Большее разнообразие TCR, которым оснащен организм, приводит к большей устойчивости к инфекции. [ 7 ] [ 8 ] Хотя TdT была одной из первых ДНК-полимераз, идентифицированных у млекопитающих в 1960 году, [ 9 ] она остается одной из наименее изученных из всех ДНК-полимераз. [ 7 ] В 2016–2018 годах было обнаружено, что TdT демонстрирует поведение, зависящее от транс- шаблона, в дополнение к более широко известному поведению, независимому от шаблона. [ 10 ] [ 11 ]
TdT отсутствует в ЗКП печени плода , что значительно ухудшает разнообразие соединений в В-клетках в течение эмбрионального периода. [ 12 ]
Функция и регулирование
[ редактировать ]Обычно TdT катализирует добавление нуклеотидов к 3'-концу молекулы ДНК . В отличие от большинства ДНК-полимераз, она не требует матрицы. Предпочтительным субстратом этого фермента является 3'-конец , но он также может добавлять нуклеотиды к тупым или утопленным 3'-концам. Кроме того, TdT является единственной полимеразой, которая, как известно, катализирует синтез полимеров ДНК длиной 2–15 нуклеотидов из свободных нуклеотидов в растворе in vivo . [ 13 ] In vitro такое поведение катализирует общее образование полимеров ДНК без определенной длины. [ 14 ] Предполагается, что фрагменты ДНК длиной 2–15 нуклеотидов, полученные in vivo, действуют в сигнальных путях, связанных с механизмом репарации и/или рекомбинации ДНК. [ 13 ] двухвалентного катиона Как и многим полимеразам, TdT требует кофактора . [ 15 ] однако TdT уникален своей способностью использовать более широкий спектр катионов, таких как мг 2+ , Мин. 2+ , Зн 2+ и Ко 2+ . [ 15 ] Скорость ферментативной активности зависит от доступных двухвалентных катионов и добавляемого нуклеотида. [ 16 ]
TdT экспрессируется главным образом в первичных лимфоидных органах, таких как тимус и костный мозг. Регуляция его экспрессии происходит несколькими путями. К ним относятся белок-белковые взаимодействия, подобные взаимодействиям с TdIF1. TdIF1 — еще один белок, который взаимодействует с TdT, ингибируя его функцию, маскируя область связывания ДНК полимеразы TdT. Регуляция экспрессии TdT также существует на уровне транскрипции, при этом на регуляцию влияют факторы, специфичные для стадии, и происходит ограничительным образом. [ 7 ] [ 17 ] [ 18 ] Хотя экспрессия обычно происходит в первичных лимфоидных органах, недавние работы показали, что стимуляция антигеном может привести к вторичной экспрессии TdT наряду с другими ферментами, необходимыми для перестройки генов за пределами тимуса для Т-клеток. [ 19 ] Пациенты с острым лимфобластным лейкозом значительно перепроизводят TdT. [ 16 ] Клеточные линии, полученные от этих пациентов, послужили одним из первых источников чистого ТдТ и привели к открытию различий в активности между человеческими и бычьими изоформами. [ 16 ]
Механизм
[ редактировать ]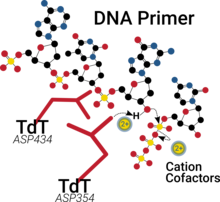
Подобно многим полимеразам , каталитический сайт TdT имеет два двухвалентных катиона в своем пальмовом домене, которые способствуют связыванию нуклеотидов, помогают снизить pK a 3'-OH-группы и, в конечном итоге, облегчают выход образующегося побочного продукта пирофосфата. [ 20 ] [ 21 ]
Изоформная вариация
[ редактировать ]Несколько изоформ TdT наблюдались у мышей, крупного рогатого скота и человека. На сегодняшний день два варианта идентифицированы у мышей, а три — у людей. [ 22 ]
Два варианта сплайсинга, идентифицированные у мышей, названы в соответствии с их длиной: TdTS состоит из 509 аминокислот, а TdTL, более длинный вариант, состоит из 529 аминокислот. Различия между TdTS и TdTL возникают за пределами областей, связывающих ДНК и нуклеотиды. То, что разница в 20 аминокислот влияет на ферментативную активность, является спорным: некоторые утверждают, что модификации TdTL придают экзонуклеазную активность, в то время как другие утверждают, что TdTL и TdTS имеют почти идентичную in vitro активность . Кроме того, сообщается, что TdTL может модулировать каталитическую активность TdTS in vivo посредством неизвестного механизма. Предполагается, что это помогает регулировать роль TdT в рекомбинации V(D)J. [ 23 ]
Изоформы TdT человека имеют три варианта TdTL1, TdTL2 и TdTS. TdTL1 широко экспрессируется в линиях лимфоидных клеток, тогда как TdTL2 преимущественно экспрессируется в нормальных малых лимфоцитах. Оба локализуются в ядре при экспрессии [ 24 ] и оба обладают 3'->5' экзонуклеазной активностью. [ 25 ] Напротив, изоформы TdTS не обладают экзонуклеазной активностью и осуществляют необходимую элонгацию во время рекомбинации V(D)J. [ 25 ] Поскольку аналогичная экзонуклеазная активность, предполагаемая в мышином TdTL, обнаружена в TdTL человека и быка, некоторые постулируют, что изоформы TdTL быка и человека регулируют изоформы TdTS таким же образом, как это было предложено у мышей. [ 23 ] Кроме того, некоторые предполагают, что TdTL1 может участвовать в регуляции активности TdTL2 и/или TdTS.
Роль в рекомбинации V(D)J
[ редактировать ]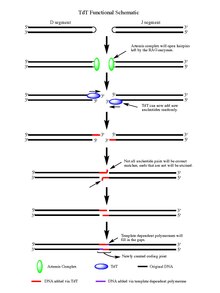
Под действием ферментов RAG 1/2 в расщепленной двухцепочечной ДНК остаются шпильковые структуры на конце каждого сегмента ДНК, созданного в результате расщепления. Обе шпильки открываются комплексом Артемиды , который при фосфорилировании обладает эндонуклеазной активностью, обеспечивая свободные 3'-ОН-концы для действия TdT. Как только комплекс Артемиды выполнит свою работу и добавит палиндромные нуклеотиды (P-нуклеотиды) к вновь открытым шпилькам ДНК, все готово для того, чтобы TdT выполнил свою работу. TdT теперь может прийти и добавить N-нуклеотиды к существующим P-нуклеотидам в направлении от 5' к 3', в котором, как известно, функционируют полимеразы. В среднем к каждому 3'-концу, образующемуся в результате действия комплекса Артемиды, добавляются 2-5 случайных пар оснований. Количество добавленных оснований достаточно для того, чтобы два вновь синтезированных сегмента оцДНК подверглись микрогомологическому выравниванию во время негомологичного соединения концов в соответствии с обычными паттернами спаривания оснований Уотсона-Крика (AT, CG). Отсюда неспаренные нуклеотиды вырезаются экзонуклеазой, такой как комплекс Артемида (который обладает экзонуклеазной активностью в дополнение к эндонуклеазной активности), а затем зависимые от матрицы полимеразы могут заполнить пробелы, наконец, создавая новый кодирующий сустав под действием лигазы для объединения сегменты. Хотя TdT не различает четыре пары оснований при добавлении их к N-нуклеотидным сегментам, он продемонстрировал смещение в пользу гуанина и цитозина . пары оснований [ 7 ]
Зависимая от шаблона активность
[ редактировать ]
В зависимости от матрицы TdT может включать нуклеотиды через разрывы цепей в двухцепочечной ДНК способом, называемым транс, в отличие от механизма in cis , обнаруженного в большинстве полимераз. Оптимально это происходит при разрыве одной пары оснований между нитями и в меньшей степени при увеличении разрыва. Этому способствует участок TdT, называемый Loop1, который выборочно исследует короткие разрывы в двухцепочечной ДНК. Кроме того, открытие этой шаблонно-зависимой активности привело к более убедительным механистическим гипотезам относительно того, как распределение длин добавлений N-областей возникает при рекомбинации V(D)J. [ 26 ]

Полимераза μ и полимераза λ проявляют аналогичную синтетическую активность, зависимую от транс -матрицы, что и TdT, но без аналогичной зависимости от нижестоящей двухцепочечной ДНК. [ 27 ] Кроме того, было обнаружено, что полимераза λ проявляет аналогичную синтетическую активность, независимую от матрицы. Известно, что наряду с активностью терминальной трансферазы он также работает более общим образом, зависящим от шаблона. [ 28 ] Сходство между TdT и полимеразой μ позволяет предположить, что они тесно связаны эволюционно. [ 26 ]
Использование
[ редактировать ]Терминальная трансфераза находит применение в молекулярной биологии . Его можно использовать в RACE для добавления нуклеотидов, которые затем можно использовать в качестве матрицы для праймера в последующей ПЦР . Его также можно использовать для добавления нуклеотидов, меченных изотопами , например, в анализе TUNEL ( терминальная дезоксинуклеотидилтрансфераза d U TP Nick End . радиоактивными L abeling) для демонстрации апоптоза (который частично маркируется фрагментированной ДНК) ). Он также используется в иммунофлуоресцентном анализе для диагностики острого лимфобластного лейкоза . [ 29 ]
В иммуногистохимии и проточной цитометрии антитела к TdT можно использовать для демонстрации присутствия незрелых Т- и В-клеток и плюрипотентных гемопоэтических стволовых клеток, содержащих антиген, тогда как зрелые лимфоидные клетки всегда TdT-отрицательны. Хотя TdT-положительные клетки обнаруживаются в небольших количествах в здоровых лимфатических узлах и миндалинах, злокачественные клетки острого лимфобластного лейкоза также являются TdT-положительными, и поэтому антитела можно использовать как часть панели для диагностики этого заболевания и диагностики. отличить ее, например, от мелкоклеточных опухолей детского возраста. [ 30 ]
TdT также недавно нашел применение в синтезе олигонуклеотидов De Novo с привязанными аналогами TdT-dNTP, способными удлинять праймер на 1 нт за раз. [ 31 ] Другими словами, фермент TdT продемонстрировал способность создавать синтетическую ДНК, добавляя по одной букве к последовательности праймера.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000107447 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000025014 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Изобе М., Хюбнер К., Эриксон Дж., Петерсон Р.К., Боллум Ф.Дж., Чанг Л.М. и др. (сентябрь 1985 г.). «Хромосомная локализация гена терминальной дезоксинуклеотидилтрансферазы человека в области 10q23-q25» . Труды Национальной академии наук Соединенных Штатов Америки . 82 (17): 5836–40. Бибкод : 1985PNAS...82.5836I . дои : 10.1073/pnas.82.17.5836 . ПМК 390648 . ПМИД 3862101 .
- ^ Ян-Фенг Т.Л., Ландау Н.Р., Балтимор Д., Франк У (1986). «Ген терминальной дезоксинуклеотидилтрансферазы расположен на хромосоме 10 человека (10q23----q24) и на хромосоме 19 мыши». Цитогенетика и клеточная генетика . 43 (3–4): 121–6. дои : 10.1159/000132309 . ПМИД 3467897 .
- ^ Jump up to: а б с д Мотеа Э.А., Бердис А.Дж. (май 2010 г.). «Терминальная дезоксинуклеотидилтрансфераза: история ошибочной ДНК-полимеразы» . Biochimica et Biophysical Acta (BBA) - Белки и протеомика . 1804 (5): 1151–66. дои : 10.1016/j.bbapap.2009.06.030 . ПМК 2846215 . ПМИД 19596089 .
- ^ Хайфар С.М., Хикман Х.Д., Ирвин К.Р., Чарке Д.С., Беннинк Дж.Р., Юделл Дж.В. (июль 2008 г.). «Терминальная дезоксинуклеотидилтрансфераза устанавливает и расширяет иерархию иммунодоминирования противовирусных CD8+ Т-клеток» . Журнал иммунологии . 181 (1): 649–59. дои : 10.4049/jimmunol.181.1.649 . ПМЦ 2587314 . ПМИД 18566432 .
- ^ Боллум Ф.Дж. (август 1960 г.). «Полимераза тимуса теленка» . Журнал биологической химии . 235 (8): 2399–403. дои : 10.1016/S0021-9258(18)64634-4 . ПМИД 13802334 .
- ^ Гуж Дж., Розарио С., Ромен Ф., Пуатвен Ф., Беген П., Деларю М. (апрель 2015 г.). «Структурная основа нового механизма соединения и выравнивания ДНК при репарации ДНК эукариот DSB» . Журнал ЭМБО . 34 (8): 1126–42. дои : 10.15252/embj.201489643 . ПМК 4406656 . ПМИД 25762590 .
- ^ Лок Дж., Деларю М. (декабрь 2018 г.). «Концевая дезоксинуклеотидилтрансфераза: история нешаблонной ДНК-полимеразы, способной образовывать мостики ДНК и матричный синтез между цепями» (PDF) . Современное мнение в области структурной биологии . 53 : 22–31. дои : 10.1016/j.sbi.2018.03.019 . ПМИД 29656238 . S2CID 4882661 .
- ^ Харди Р. (2008). «Глава 7: Развитие и биология B-лимфоцитов». В Поле В. (ред.). Фундаментальная иммунология (книга) (6-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. стр. 237–269. ISBN 978-0-7817-6519-0 .
- ^ Jump up to: а б Рамадан К., Шевелев И.В., Мага Г., Хюбшер У (май 2004 г.). «Синтез ДНК de novo с помощью ДНК-полимеразы человека лямбда, ДНК-полимеразы мю и терминальной дезоксирибонуклеотидилтрансферазы». Журнал молекулярной биологии . 339 (2): 395–404. дои : 10.1016/j.jmb.2004.03.056 . ПМИД 15136041 .
- ^ Боллум Ф.Дж., Чанг Л.М., Циапалис С.М., Дорсон Дж.В. (1974). «[8] Ферменты, полимеризующие нуклеотиды, из вилочковой железы теленка». Ферменты, полимеризующие нуклеотиды из вилочковой железы теленка . Методы энзимологии. Том. 29. С. 70–81. дои : 10.1016/0076-6879(74)29010-4 . ISBN 9780121818920 . ПМИД 4853390 .
- ^ Jump up to: а б Чанг Л.М., Боллум Ф.Дж. (апрель 1970 г.). «Доксинуклеотид-полимеризующие ферменты вилочковой железы теленка. IV. Ингибирование терминальной дезоксинуклеотидилтрансферазы металлическими лигандами» . Труды Национальной академии наук Соединенных Штатов Америки . 65 (4): 1041–8. Бибкод : 1970PNAS...65.1041C . дои : 10.1073/pnas.65.4.1041 . ПМК 283020 . ПМИД 4985880 .
- ^ Jump up to: а б с Дейбель М.Р., Коулман М.С. (май 1980 г.). «Биохимические свойства очищенной терминальной дезоксинуклеотидилтрансферазы человека» . Журнал биологической химии . 255 (9): 4206–12. дои : 10.1016/S0021-9258(19)85653-3 . ПМИД 7372675 .
- ^ Черрье М., Д'Андон М.Ф., Ружон Ф., Дуайен Н. (февраль 2008 г.). «Идентификация нового цис-регуляторного элемента терминального гена дезоксинуклеотидилтрансферазы в 5'-области мышиного локуса». Молекулярная иммунология . 45 (4): 1009–17. дои : 10.1016/j.molimm.2007.07.027 . ПМИД 17854898 .
- ^ Кубота Т., Маэдзава С., Койвай К., Хаяно Т., Койвай О. (август 2007 г.). «Идентификация функциональных доменов в TdIF1 и его механизм ингибирования активности TdT» . Гены в клетки . 12 (8): 941–59. дои : 10.1111/j.1365-2443.2007.01105.x . ПМИД 17663723 . S2CID 25530793 .
- ^ Чжан Ю, Ши М, Вэнь Ц, Луо В, Ян Цз, Чжоу М и др. (01.01.2012). «Антигенная стимуляция индуцирует рекомбинационную активацию гена 1 и экспрессию терминальной дезоксинуклеотидилтрансферазы в мышиной Т-клеточной гибридоме». Клеточная иммунология . 274 (1–2): 19–25. дои : 10.1016/j.cellimm.2012.02.008 . ПМИД 22464913 .
- ^ Вашиштха А.К., Ван Дж., Кенигсберг WH (сентябрь 2016 г.). «Различные двухвалентные катионы изменяют кинетику и точность ДНК-полимераз» . Журнал биологической химии . 291 (40): 20869–20875. дои : 10.1074/jbc.R116.742494 . ПМК 5076500 . ПМИД 27462081 .
- ^ Деларю М., Буле Ж.Б., Лескар Дж., Эксперт-Безансон Н., Журдан Н., Сукумар Н. и др. (февраль 2002 г.). «Кристаллические структуры независимой от матрицы ДНК-полимеразы: мышиная концевая дезоксинуклеотидилтрансфераза» . Журнал ЭМБО . 21 (3): 427–39. дои : 10.1093/emboj/21.3.427 . ПМЦ 125842 . ПМИД 11823435 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Стинберг М.Л., Локхандвала М.Ф., Джандхьяла Б.С. (1988). «Нарушения транспорта натрия как причинный фактор усиленного перелива норадреналина у крыс со спонтанной гипертензией». Клиническая и экспериментальная гипертония, Часть А. 10 (5): 833–41. дои : 10.1080/07300077.1988.11878788 . ПМИД 2846215 .
- ^ Jump up to: а б Шмольдт А., Бенте Х.Ф., Хаберланд Г. (сентябрь 1975 г.). «Метаболизм дигитоксина микросомами печени крысы» . Биохимическая фармакология . 24 (17): 1639–41. дои : 10.1016/0006-2952(75)90094-5 . hdl : 10033/333424 . ПМИД 10 .
- ^ Тайский TH, Кирни Дж. Ф. (сентябрь 2004 г.). «Различные и противоположные активности сплайсинговых вариантов терминальной дезоксинуклеотидилтрансферазы человека» . Журнал иммунологии . 173 (6): 4009–19. doi : 10.4049/jimmunol.173.6.4009 . ПМИД 15356150 . S2CID 40193319 .
- ^ Jump up to: а б Тайский TH, Кирни Дж. Ф. (2005). Изоформы терминальной дезоксинуклеотидилтрансферазы: аспекты развития и функции . Достижения иммунологии. Том. 86. стр. 113–36. дои : 10.1016/S0065-2776(04)86003-6 . ISBN 9780120044863 . ПМИД 15705420 .
- ^ Jump up to: а б Бланд Р.Д., Кларк Т.Л., Харден Л.Б. (февраль 1976 г.). «Быстрая инфузия бикарбоната натрия и альбумина недоношенным детям из группы высокого риска вскоре после рождения: контролируемое проспективное исследование». Американский журнал акушерства и гинекологии . 124 (3): 263–7. дои : 10.1016/0002-9378(76)90154-x . ПМИД 2013 .
- ^ Мартин М.Дж., Бланко Л. (июль 2014 г.). «Принятие решений во время NHEJ: сеть взаимодействий в Polμ человека, вовлеченная в распознавание субстрата и соединение концов» . Исследования нуклеиновых кислот . 42 (12): 7923–34. дои : 10.1093/nar/gku475 . ПМК 4081086 . ПМИД 24878922 .
- ^ Мага Г., Рамадан К., Локателли Г.А., Шевелев И., Спадари С., Хюбшер У. (январь 2005 г.). «Удлинение ДНК под действием лямбда-полимеразы ДНК человека и активность терминальной трансферазы по-разному координируются пролиферирующим клеточным ядерным антигеном и репликационным белком А» . Журнал биологической химии . 280 (3): 1971–81. дои : 10.1074/jbc.M411650200 . ПМИД 15537631 . S2CID 43322190 .
- ^ Фабер Дж., Кантарджян Х., Робертс М.В., Китинг М., Фрейрих Э., Альбитар М. (январь 2000 г.). «Терминальный дезоксинуклеотидилтрансферазно-отрицательный острый лимфобластный лейкоз». Архивы патологии и лабораторной медицины . 124 (1): 92–7. дои : 10.5858/2000-124-0092-TDTNAL . ПМИД 10629138 .
- ^ Леонг А.С., Купер К., Леонг Ф.Дж. (2003). Руководство по диагностической цитологии (2-е изд.). Greenwich Medical Media, Ltd., стр. 413–414. ISBN 1-84110-100-1 .
- ^ Паллюк С., Арлоу Д.Х., де Ронд Т., Бартел С., Канг Дж.С., Бектор Р. и др. (август 2018 г.). «Синтез ДНК de novo с использованием полимеразно-нуклеотидных конъюгатов» . Природная биотехнология . 36 (7): 645–650. дои : 10.1038/nbt.4173 . ОСТИ 1461176 . ПМИД 29912208 . S2CID 49271982 .
Дальнейшее чтение
[ редактировать ]- О'Мэлли Д.П., Орази А. (август 2006 г.). «Терминальные дезоксинуклеотидилтрансферазо-положительные клетки в селезенке, аппендиксе и кистах жаберной щели у педиатрических пациентов». Гематологическая . 91 (8): 1139–40. ПМИД 16885057 .
- Ямасита Н., Симадзаки Н., Ибе С., Канеко Р., Танабэ А., Тойомото Т. и др. (июль 2001 г.). «Концевая дезоксинуклеотидилтрансфераза напрямую взаимодействует с новым ядерным белком, гомологичным p65». Гены в клетки . 6 (7): 641–52. дои : 10.1046/j.1365-2443.2001.00449.x . ПМИД 11473582 . S2CID 19573920 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - Чанг Л.М., Боллум Ф.Дж. (1986). «Молекулярная биология терминальной трансферазы». Критические обзоры CRC по биохимии . 21 (1): 27–52. дои : 10.3109/10409238609113608 . ПМИД 3524991 .
- Маэзава С., Хаяно Т., Койвай К., Фукусима Р., Куда К., Кубота Т. и др. (май 2008 г.). «Bood POZ, содержащий ген типа 2, является человеческим аналогом дрожжевого Btb3p и способствует деградации терминальной дезоксинуклеотидилтрансферазы» . Гены в клетки . 13 (5): 439–57. дои : 10.1111/j.1365-2443.2008.01179.x . ПМИД 18429817 . S2CID 9698107 .
- Таплин М.Е., Франц М.Е., Каннинг С., Ритц Дж., Блумберг Р.С., Балк С.П. (март 1996 г.). «Доказательства против развития Т-клеток в слизистой оболочке кишечника взрослого человека, основанные на отсутствии экспрессии терминальной дезоксинуклеотидилтрансферазы» . Иммунология . 87 (3): 402–7. дои : 10.1046/j.1365-2567.1996.496571.x . ПМК 1384108 . ПМИД 8778025 .
- Группа А, Ли Ю, Роуленд С, Новотны П., Хинрикс А.Л., Смемо С. и др. (январь 2006 г.). «Сканирование хромосомы 10 идентифицирует новый локус, показывающий сильную связь с болезнью Альцгеймера с поздним началом» . Американский журнал генетики человека . 78 (1): 78–88. дои : 10.1086/498851 . ПМК 1380225 . ПМИД 16385451 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - Дворжак М.Н., Фрич Г., Фрёшль Г., Принц Д., Гаднер Х. (ноябрь 1998 г.). «Четырехцветное проточно-цитометрическое исследование терминальных дезоксинуклеотидилтрансфераз-положительных лимфоидных предшественников в детском костном мозге: экспрессия CD79a предшествует CD19 в раннем онтогенезе B-клеток». Кровь . 92 (9): 3203–9. дои : 10.1182/blood.V92.9.3203 . ПМИД 9787156 .
- Фудзита К., Симадзаки Н., Охта Й., Кубота Т., Ибе С., Тодзи С. и др. (июнь 2003 г.). «Концевая дезоксинуклеотидилтрансфераза образует тройной комплекс с новым белком ремоделирования хроматина массой 82 кДа и коровым гистоном» . Гены в клетки . 8 (6): 559–71. дои : 10.1046/j.1365-2443.2003.00656.x . ПМИД 12786946 . S2CID 25223336 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - Кубота Т., Маэдзава С., Койвай К., Хаяно Т., Койвай О. (август 2007 г.). «Идентификация функциональных доменов в TdIF1 и его механизм ингибирования активности TdT» . Гены в клетки . 12 (8): 941–59. дои : 10.1111/j.1365-2443.2007.01105.x . ПМИД 17663723 . S2CID 25530793 .
- Сузуки Ю, Ёситомо-Накагава К, Маруяма К, Суяма А, Сугано С (октябрь 1997 г.). «Создание и характеристика библиотеки кДНК, обогащенной по полной длине и по 5'-концу». Джин . 200 (1–2): 149–56. дои : 10.1016/S0378-1119(97)00411-3 . ПМИД 9373149 .
- Бриджес С.Л. (август 1998 г.). «Частое добавление N и клональное родство среди легких цепей лямбда иммуноглобулина, экспрессируемых в синовиальных оболочках и PBL при ревматоидном артрите, а также влияние использования сегмента гена V лямбда на длину CDR3» . Молекулярная медицина . 4 (8): 525–53. дои : 10.1007/BF03401757 . ПМК 2230400 . ПМИД 9742508 .
- Лю Л., МакГавран Л., Ловелл М.А., Вэй Кью, Джеймисон Б.А., Уильямс С.А. и др. (июнь 2004 г.). «Неположительная терминальная дезоксинуклеотидилтрансфераза при педиатрическом предшественнике B-лимфобластного лейкоза» . Американский журнал клинической патологии . 121 (6): 810–5. doi : 10.1309/QD18-PPV1-NH3T-EUTF . ПМИД 15198352 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - Ян Б., Гэти К.Н., Коулман М.С. (апрель 1994 г.). «Мутационный анализ остатков в нуклеотидсвязывающем домене терминальной дезоксинуклеотидилтрансферазы человека» . Журнал биологической химии . 269 (16): 11859–68. дои : 10.1016/S0021-9258(17)32652-2 . ПМИД 8163485 .
- Тайский TH, Кирни Дж. Ф. (сентябрь 2004 г.). «Различные и противоположные активности сплайсинговых вариантов терминальной дезоксинуклеотидилтрансферазы человека» . Журнал иммунологии . 173 (6): 4009–19. doi : 10.4049/jimmunol.173.6.4009 . ПМИД 15356150 . S2CID 40193319 .
- Симадзаки Н., Фудзита К., Койвай О. (март 2002 г.). «[Экспрессия и функция терминальной дезоксинуклеотидилтрансферазы и открытие новой ДНК-полимеразы мю]». Сэйкагаку. Журнал Японского биохимического общества . 74 (3): 227–32. ПМИД 11974916 .
- Махаджан К.Н., Митчелл Б.С. (сентябрь 2003 г.). «Роль человеческого Pso4 в репарации ДНК млекопитающих и ассоциации с терминальной дезоксинуклеотидилтрансферазой» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (19): 10746–51. Бибкод : 2003PNAS..10010746M . дои : 10.1073/pnas.1631060100 . ЧВК 196874 . ПМИД 12960389 .
- Махаджан К.Н., Ганги-Петерсон Л., Соршер Д.Х., Ван Дж., Гати К.Н., Махаджан Н.П. и др. (ноябрь 1999 г.). «Ассоциация терминальной дезоксинуклеотидилтрансферазы с Ku» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (24): 13926–31. Бибкод : 1999PNAS...9613926M . дои : 10.1073/pnas.96.24.13926 . ПМК 24167 . ПМИД 10570175 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - Ибе С., Фудзита К., Тойомото Т., Симадзаки Н., Канеко Р., Танабэ А. и др. (сентябрь 2001 г.). «Концевая дезоксинуклеотидилтрансфераза отрицательно регулируется путем прямого взаимодействия с ядерным антигеном пролиферирующей клетки» . Гены в клетки . 6 (9): 815–24. дои : 10.1046/j.1365-2443.2001.00460.x . ПМИД 11554927 . S2CID 19287230 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка )
Внешние ссылки
[ редактировать ]- Терминальная + дезоксирибонуклеотидилтрансфераза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)



