Пантотенат киназа
| Пантотенат киназа | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 2.7.1.33 | ||
| Номер CAS. | 9026-48-6 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
Пантотенаткиназа ( EC 2.7.1.33 , PanK; CoaA) является первым ферментом на пути биосинтеза кофермента А (КоА). Он фосфорилирует пантотенат (витамин В 5 ) с образованием 4'-фосфопантотената за счет молекулы аденозинтрифосфата ( АТФ ) . Это лимитирующая скорость биосинтеза КоА. [1] [2]
![[2]](http://upload.wikimedia.org/wikipedia/commons/3/34/Mechanism_os_pantothenate_kinase.png)
КоА является необходимым кофактором во всех живых организмах. Он действует как основной переносчик ацильной группы во многих важных клеточных процессах, таких как цикл лимонной кислоты ( цикл трикарбоновых кислот ) и жирных кислот метаболизм . Следовательно, пантотенаткиназа является ключевым регуляторным ферментом пути биосинтеза КоА. [3]
Типы
[ редактировать ]Были идентифицированы три различных типа PanK — PanK-I (обнаружен у бактерий), PanK-II (в основном обнаружен у эукариот, но также и у стафилококков ) и PanK-III, также известный как CoaX (обнаружен у бактерий). Эукариотические ферменты PanK-II часто встречаются в виде разных изоформ, таких как PanK1, PanK2, PanK3 и PanK4. У человека несколько изоформ PanK экспрессируются четырьмя генами. Ген PANK1 кодирует формы PanK1α и PanK1β, а PANK2 и PANK3 кодируют PanK2 и PanK3 соответственно. [4] Четыре основные изоформы, обнаруженные у млекопитающих, имеют различную субклеточную локализацию. PanK1α является ядерным, а PanK1β и PanK3 — цитозольным. У мышей PanK2 также является цитозольным, тогда как у человека этот фермент является митохондриальным и ядерным. [5] Распределение этих изоформ в тканях также варьируется. В моделях на мышах PanK1 является преобладающим видом в сердце, печени и бурой жировой ткани, а также в почках. PanK2 и PanK3 более выражены в головном мозге и скелетных мышцах, а PanK3 особенно высок в кишечнике и белой жировой ткани. [6]
Структура
[ редактировать ]ПанК-II
[ редактировать ]
PanK-II содержит два белковых домена , как показано на рисунке 1. Каждый домен A и домен A' имеют петлю, богатую глицином (последовательность GXXXXGKS; петля P ), которая характерна для нуклеотидов сайтов связывания ; Предполагается , что именно здесь АТФ . связывается [7] расположен между остатками 95 и 102 домена А
Два АТФ сайта связывания демонстрируют кооперативное поведение . Интерфейс димеризации состоит из двух длинных спиралей, по одной от каждого мономера, которые взаимодействуют друг с другом. С -концевые концы спиралей удерживаются вместе за счет ван-дер-ваальсовых взаимодействий между остатками валина и метионина каждого мономера. Середина спиралей прикреплена водородными связями между аспарагина остатками . На N- конце каждая спираль расширяется и образует пучок из четырех спиралей с двумя более короткими спиралями. Этот пучок состоит из гидрофобного ядра, образованного неполярными остатками, которые используют силы Ван-дер-Ваальса для дальнейшей стабилизации димера. [4]
В активном центре пантотенат ориентируется за счет водородных связей между пантотенатом и боковыми цепями остатков аспартата, тирозина, гистидина, тирозина и аспарагина. [8] Остатки аспарагина, гистидина и аргинина участвуют в катализе.
Изоформы PanK-II человека PanK1α, PanK1β, PanK2 и PanK3 имеют общее, высоко гомологичное каталитическое ядро, состоящее примерно из 355 остатков. [4] PanK1α и PanK1β кодируются геном PANK1 и имеют один и тот же каталитический домен из 363 аминокислот, кодируемых экзонами со 2 по 7. Транскрипт PanK1α начинается с экзона 1α, который кодирует регуляторный домен из 184 остатков на N-конце . Эта область обеспечивает ингибирование по принципу обратной связи с помощью свободного КоА и ацил-КоА и регуляцию с помощью ацетил-КоА и малонил-КоА . С другой стороны, транскрипт PanK1β начинается с экзона 1β, который образует N-конец из 10 остатков, который не включает регуляторный домен обратной связи. [9]
ПанК-III
[ редактировать ]
PanK-III также содержит два белковых домена , и ключевые каталитические остатки PanK-II консервативны. Мономерные звенья PanK-II и PanK-III практически идентичны, но имеют совершенно разные димерные сборки. Исследование структур Staphylococcus aureus типа II и Pseudomonas aeruginosa типа III показывает, что мономер PanK-II имеет петлевой участок, отсутствующий в мономере PanK-III, а мономер PanK-III имеет отсутствующий петлевой участок. из мономера ПанК-II. [10] Это незначительное изменение имеет решающее отличие в интерфейсе димеризации, в котором спирали димера PanK-II скручиваются друг вокруг друга, а спирали димера PanK-III взаимодействуют под углом 70 ° (рис. 2). [11]
В результате этого различия в интерфейсе димеризации между PanK-II и PanK-III конформации сайтов связывания субстрата для АТФ и пантотената также различны. [12] [13]
Каталитический механизм
[ редактировать ]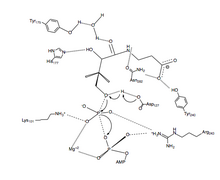
ПанК-II
[ редактировать ]Предлагаемый механизм реакции переноса фосфорила PanK-II представляет собой согласованный механизм с диссоциативным переходным состоянием .
Во-первых, АТФ связывается в канавке связывания, образованной остатками Р-петли и близлежащими остатками. Здесь консервативный лизин ( Lys-101 ) является ключевым остатком, необходимым для связывания АТФ . [14] [15] Кроме того, боковые цепи остатков Lys-101 , Ser-102 , Glu-199 и Arg-243 ориентируют нуклеотид в канавке связывания. Пантотенат Asp связывается и ориентируется путем образования взаимодействий водородных связей с остатками -127 , Tyr-240 , Asn-282 , Tyr-175 и His-177 . [8] Когда и АТФ , и пантотенат связаны, Asp-127 C1 депротонирует гидроксильную группу пантотената . Затем кислород из пантотената атакует γ-фосфат связанного АТФ . Здесь стабилизация заряда β- и γ-фосфатных групп достигается за счет Arg-243 , Lys-101 и координированного Mg. 2+ ион. [16] В этом согласованном механизме плоский фосфоран γ-фосфата переносится непосредственно на атакующий кислород пантотената . [8] Наконец, 4'-фосфопантотенат диссоциирует от PanK, а затем от ADP .
Регуляция пантотенаткиназы
[ редактировать ]ПанК-II
[ редактировать ]Регуляция пантотенаткиназы необходима для контроля внутриклеточной концентрации КоА . [17] Пантотенаткиназа регулируется посредством ингибирования по принципу обратной связи с помощью КоА и его тиоэфиров (т.е. ацетил-КоА , малонил-КоА ). [18] Ингибирование человеческих изоформ PanK ацетил-КоА существенно различается. PanK1β ингибируется наименее сильно, со значением IC50 около 5 мкМ, тогда как PanK2 ингибируется наиболее сильно с IC50 около 0,1 мкМ. [6]
КоА ингибирует активность PanK путем конкурентного связывания с сайтом связывания АТФ и предотвращения связывания АТФ с Lys-101. [14] [15] Хотя КоА связывается в том же сайте, что и АТФ , они связываются в разных ориентациях, а их адениновые фрагменты взаимодействуют с ферментом с помощью неперекрывающихся наборов остатков. His-177, Phe-247 и Arg-106 необходимы для КоА распознавания , но не для АТФ , и хотя Asn-43 и His-307 взаимодействуют с адениновым основанием АТФ , His-177 и Phe-247 взаимодействуют с аденином. база КоА . [16] Обе молекулы используют Lys-101 для нейтрализации заряда соответствующих фосфодиэфиров.
Неэстерифицированный КоА обладает более сильным ингибирующим действием, чем его тиоэфиры. Это явление лучше всего объясняется плотным прилеганием тиоловой группы к окружающим ароматическим остаткам Phe-244 , Phe-259 , Tyr-262 и Phe-252 . Свободный КоА подходит оптимально, но когда ацильная группа присоединяется к КоА , стерические препятствия затрудняют взаимодействие тиоэфира с Phe-252 . Таким образом, ингибирование тиоэфирами менее эффективно, чем ингибирование неэстерифицированным КоА . [16]
Удаление PanK1 нарушает метаболические пути, включая окисление жирных кислот и глюконеогенез . ПанК1 -/- мышиные модели в голодном состоянии демонстрируют нарушение глюконеогенеза, что указывает на нарушение этого пути. Кроме того, уровни КоА значительно снижаются между PanK1 -/- и мыши дикого типа. Это снижение содержания КоА также, по-видимому, коррелирует с нарушением окисления жирных кислот. Более высокие уровни длинноцепочечных ацилкарнитинов наблюдались у PanK1. -/- мышей, что указывает на более низкую способность к окислению жирных кислот у этих мышей. [19]

Поскольку PanK2 настолько сильно ингибируется ацетил-КоА, распространенным метаболитом в митохондриях, этот фермент, вероятно, не был бы активен в физиологических условиях без активаторов. [6] Пальмитоилкарнитин и другие длинноцепочечные ацилкарнитины могут обратить вспять ингибирование ацетил-КоА и активировать PanK2 без присутствия ацетил-КоА. Пальмитоил-карнитин конкурирует с ацетил-КоА. [20] Активация PanK2 пальмитоилкарнитином и другими длинноцепочечными ацилкарнитинами проливает свет на регуляторные пути этого фермента: в нормальных условиях PanK2, вероятно, ингибируется высокими уровнями ацетил-КоА. Без производства КоА окисление жирных кислот снижается, что приводит к увеличению содержания длинноцепочечных ацилкарнитинов. [19] Эти ацилкарнитины могут затем уменьшить ингибирование ацетил-КоА, активируя PanK2 и увеличивая биосинтез КоА. PanK3 также активируется пальмитоилкарнитином и другими длинноцепочечными ацилкарнитинами, включая олеоилкарнитин. [21]
ПанК-III
[ редактировать ]Описанное выше регулирование соответствует PanK-II. ПанК-III устойчив к торможению по обратной связи. [10] [12] [13]
Гены
[ редактировать ]У людей:
Ген PANK2 кодирует PanK2, который регулирует образование КоА в митохондриях — центрах производства энергии клетки. [22] Мутация PANK2 является причиной нейродегенерации, связанной с пантотенаткиназой (PKAN), ранее называемой синдромом Халлервордена-Шпатца. Это редкое заболевание проявляется глубокой дистонией, спастичностью и часто приводит к летальному исходу.
Существует множество мутаций PanK2, которые приводят к PKAN. При обзоре нескольких распространенных мутаций было обнаружено, что некоторые из этих мутаций не вызывают серьезного снижения каталитической активности PanK2, что указывает на то, что потеря каталитической функции этого фермента не является полной ответственностью за это заболевание. [23]
Ссылки
[ редактировать ]- ^ Робишоу Дж. Д., Беркич Д., Нили Дж. Р. (сентябрь 1982 г.). «Скороограничивающая стадия и контроль синтеза кофермента А в сердечной мышце» . Журнал биологической химии . 257 (18): 10967–72. дои : 10.1016/S0021-9258(18)33918-8 . ПМИД 7107640 .
- ^ Перейти обратно: а б Ян К., Эйобо Ю., Бранд Л.А., Мартыновски Д., Томчик Д., Штраус Э., Чжан Х. (август 2006 г.). «Кристаллическая структура пантотенаткиназы типа III: понимание механизма биосинтетического фермента незаменимого кофермента А, повсеместно распространенного в бактериях» . Журнал бактериологии . 188 (15): 5532–40. дои : 10.1128/JB.00469-06 . ПМК 1540032 . ПМИД 16855243 .
- ^ Леонарди Р., Чжан Ю.М., Rock CO, Джековски С. (01.03.2005). «Коэнзим А: снова в действии». Прогресс в исследованиях липидов . 44 (2–3): 125–53. дои : 10.1016/j.plipres.2005.04.001 . ПМИД 15893380 .
- ^ Перейти обратно: а б с Хонг Б.С., Сенистерра Г., Рабе В.М., Ведади М., Леонарди Р., Чжан Ю.М., Рок КО, Джековски С., Парк Х.В. (сентябрь 2007 г.). «Кристаллические структуры пантотенаткиназ человека. Понимание аллостерической регуляции и мутаций, связанных с нейродегенеративными расстройствами» . Журнал биологической химии . 282 (38): 27984–93. дои : 10.1074/jbc.M701915200 . ПМИД 17631502 .
- ^ Альфонсо-Пеккьо, Адольфо; Гарсия, Мэтью; Леонарди, Роберта; Джековский, Сюзанна (2012). «Компартментализация пантотенаткиназ млекопитающих» . ПЛОС ОДИН . 7 (11): е49509. дои : 10.1371/journal.pone.0049509 . ISSN 1932-6203 . ПМК 3496714 . ПМИД 23152917 .
- ^ Перейти обратно: а б с Дэнси, Лоррейн Э.; Ривз, Стейси; Миллер, Карен; Зано, Стивен П.; Фрэнк, Мэтью; Пейт, Кэролайн; Ван, Джина; Яковски, Сюзанна (август 2014 г.). «Физиологическая роль пантотенаткиназ» . Труды Биохимического общества . 42 (4): 1033–1036. дои : 10.1042/BST20140096 . ISSN 1470-8752 . ПМЦ 4948118 . ПМИД 25109998 .
- ^ Сарасте М., Сиббальд П.Р., Виттингхофер А. (ноябрь 1990 г.). «Р-петля - общий мотив в АТФ- и ГТФ-связывающих белках». Тенденции биохимических наук . 15 (11): 430–4. дои : 10.1016/0968-0004(90)90281-F . ПМИД 2126155 .
- ^ Перейти обратно: а б с Айви Р.А., Чжан Ю.М., Вирга К.Г., Хевенер К., Ли Р.Э., Рок КО, Джековски С., Парк Х.В. (август 2004 г.). «Структура тройного комплекса пантотенат-киназа.ADP.пантотенат показывает взаимосвязь между сайтами связывания субстрата, аллостерического регулятора и антиметаболитов» . Журнал биологической химии . 279 (34): 35622–9. дои : 10.1074/jbc.M403152200 . ПМИД 15136582 .
- ^ Rock CO, Карим М.А., Чжан Ю.М., Джековски С. (2002). «Ген мышиной пантотенаткиназы (Pank1) кодирует два дифференциально регулируемых изофермента пантотенаткиназы». Джин . 291 (1–2): 35–43. дои : 10.1016/S0378-1119(02)00564-4 . ПМИД 12095677 .
- ^ Перейти обратно: а б Ян К., Штраус Э., Уэрта С., Чжан Х. (февраль 2008 г.). «Структурная основа связывания субстрата и каталитический механизм пантотенаткиназы типа III». Биохимия . 47 (5): 1369–80. дои : 10.1021/bi7018578 . ПМИД 18186650 .
- ^ Хун Б.С., Юн М.К., Чжан Ю.М., Чонан С., Рок CO, Уайт С.В., Джековски С., Парк Х.В., Леонарди Р. (август 2006 г.). «Прокариотические пантотенаткиназы типа II и типа III: одна и та же складка мономера создает димеры с различными каталитическими свойствами» . Структура . 14 (8): 1251–61. дои : 10.1016/j.str.2006.06.008 . ПМИД 16905099 .
- ^ Перейти обратно: а б Бренд LA, Strauss E (май 2005 г.). «Характеристика новой изоформы пантотенаткиназы Helicobacter pylori» . Журнал биологической химии . 280 (21): 20185–8. дои : 10.1074/jbc.C500044200 . ПМИД 15795230 .
- ^ Перейти обратно: а б Чоудри А.Е., Мандичак Т.Л., Броски Дж.П., Эгольф Р.В., Кинсленд С., Бегли Т.П., Зеефельд М.А., Ку Т.В., Браун Дж.Р., Залакаин М., Ратнам К. (июнь 2003 г.). «Ингибиторы пантотенаткиназы: новые антибиотики при стафилококковых инфекциях» . Антимикробные средства и химиотерапия . 47 (6): 2051–5. doi : 10.1128/AAC.47.6.2051-2055.2003 . ПМЦ 155856 . ПМИД 12760898 .
- ^ Перейти обратно: а б Сонг В.Дж., Джековски С. (октябрь 1994 г.). «Кинетика и регуляция пантотенаткиназы Escherichia coli» . Журнал биологической химии . 269 (43): 27051–8. дои : 10.1016/S0021-9258(18)47124-4 . ПМИД 7929447 .
- ^ Перейти обратно: а б Сонг В.Дж., Джековски С. (октябрь 1992 г.). «Клонирование, секвенирование и экспрессия гена пантотенаткиназы (КоаА) Escherichia coli» . Журнал бактериологии . 174 (20): 6411–7. дои : 10.1128/jb.174.20.6411-6417.1992 . ПМК 207592 . ПМИД 1328157 .
- ^ Перейти обратно: а б с Юн М., Пак К.Г., Ким Дж.И., Рок СО, Джековски С., Пак Х.В. (сентябрь 2000 г.). «Структурная основа регуляции пантотенаткиназы Escherichia coli по принципу обратной связи с помощью кофермента А» . Журнал биологической химии . 275 (36): 28093–9. дои : 10.1074/jbc.M003190200 . ПМИД 10862768 .
- ^ Джековски С., Rock CO (декабрь 1981 г.). «Регуляция биосинтеза кофермента А» . Журнал бактериологии . 148 (3): 926–32. дои : 10.1128/jb.148.3.926-932.1981 . ПМК 216294 . ПМИД 6796563 .
- ^ Rock CO, Park HW, Джековски С. (июнь 2003 г.). «Роль регуляции пантотенаткиназы (КоаА) по принципу обратной связи в контроле уровня кофермента А в Escherichia coli» . Журнал бактериологии . 185 (11): 3410–5. дои : 10.1128/JB.185.11.3410-3415.2003 . ПМК 155388 . ПМИД 12754240 .
- ^ Перейти обратно: а б Леонарди, Роберта; Рег, Джерольд Э.; Рок, Чарльз О.; Джековский, Сюзанна (14 июня 2010 г.). «Пантотенаткиназа 1 необходима для поддержания метаболического перехода от состояния сытости к состоянию натощак» . ПЛОС ОДИН . 5 (6): е11107. Бибкод : 2010PLoSO...511107L . дои : 10.1371/journal.pone.0011107 . ISSN 1932-6203 . ПМЦ 2885419 . ПМИД 20559429 .
- ^ Леонарди, Роберта; Рок, Чарльз О.; Джековский, Сюзанна; Чжан, Юн-Мэй (30 января 2007 г.). «Активация митохондриальной пантотенаткиназы 2 человека пальмитоилкарнитином» . Труды Национальной академии наук . 104 (5): 1494–1499. дои : 10.1073/pnas.0607621104 . ISSN 0027-8424 . ПМЦ 1785270 . ПМИД 17242360 .
- ^ Леонарди, Роберта; Чжан, Юн-Мэй; Юн, Ми-Гён; Чжоу, Руобинг; Цзэн, Фу-Юэ; Линь, Вэньвэй; Кюи, Джимми; Чен, Таошэн; Рок, Чарльз О.; Уайт, Стивен В.; Джековский, Сюзанна (27 августа 2010 г.). «Модуляция активности пантотенаткиназы 3 с помощью малых молекул, которые взаимодействуют с субстратом/аллостерическим регуляторным доменом» . Химия и биология . 17 (8): 892–902. doi : 10.1016/j.chembiol.2010.06.006 . ISSN 1074-5521 . ПМЦ 2929395 . ПМИД 20797618 .
- ^ «Ген PANK2» . Домашний справочник по генетике . 22 февраля 2016 г. Проверено 29 февраля 2016 г.
- ^ Чжан, Юн-Мэй; Рок, Чарльз О.; Яковски, Сюзанна (6 января 2006 г.). «Биохимические свойства изоформ пантотенаткиназы 2 человека и мутации, связанные с нейродегенерацией, связанной с пантотенаткиназой» . Журнал биологической химии . 281 (1): 107–114. дои : 10.1074/jbc.M508825200 . ISSN 0021-9258 . ПМИД 16272150 .
Внешние ссылки
[ редактировать ]- Пантотенат + киназа в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- ЭК 2.7.1.33