Витамин Д
| Витамин Д | |
|---|---|
| Класс препарата | |
 Холекальциферол ( D3 ) | |
| Идентификаторы классов | |
| Синонимы | Кальциферолы |
| Использовать | Рахит , остеопороз , дефицит витамина D. |
| код АТС | A11CC |
| Биологическая цель | рецептор витамина D |
| Клинические данные | |
| Drugs.com | MedFacts Натуральные продукты |
| Внешние ссылки | |
| МеШ | D014807 |
| Юридический статус | |
| В Викиданных | |
Витамин D представляет собой группу жирорастворимых секостероидов, ответственных за увеличение кишечной абсорбции кальция , магния и фосфатов , а также за многие другие биологические эффекты. [1] [2] У человека наиболее важными соединениями этой группы являются витамин D3 ( холекальциферол ) и витамин D2 ( эргокальциферол ) . [2] [3]
Основным природным источником витамина D является синтез холекальциферола в нижних слоях эпидермиса кожи посредством фотохимической реакции с ультрафиолетовым излучением B (УФ-В) от воздействия солнечных лучей или ламп УФ-В . [1] Холекальциферол и эргокальциферол можно принимать с пищей и добавками . [1] [2] Лишь немногие продукты, например мясо жирной рыбы, естественным образом содержат значительное количество витамина D. [2] [4] В США и других странах коровье молоко и заменители молока растительного происхождения обогащены витамином D, как и многие хлопья для завтрака. [1] Грибы, подвергающиеся воздействию ультрафиолетового света, содержат полезное количество витамина D2 . [2] [5] Диетические рекомендации обычно предполагают, что весь витамин D человек принимает перорально, поскольку воздействие солнца на население варьируется, а рекомендации относительно безопасного количества пребывания на солнце неопределенны, учитывая связанный с этим риск рака кожи . [2]
Витамин D, поступающий с пищей или синтезируемый кожей, биологически неактивен. Он активируется двумя этапами гидроксилирования белковых ферментов : первый в печени и второй в почках. [1] [3] Поскольку витамин D может синтезироваться в достаточных количествах большинством млекопитающих, если они получают достаточно солнечного света, он не является необходимым и, следовательно, технически не является витамином . Вместо этого его можно рассматривать как гормон , активация прогормона витамина D приводит к образованию активной формы кальцитриола , который затем оказывает воздействие через ядерный рецептор в нескольких местах. [6]
Холекальциферол превращается в печени в кальцифедиол (25-гидроксихолекальциферол); эргокальциферол превращается в 25-гидроксиэргокальциферол. [1] Эти два метаболита витамина D (называемые 25-гидроксивитамином D или 25(OH)D) измеряются в сыворотке крови для определения статуса витамина D у человека. [7] [8] Кальцифедиол далее гидроксилируется почками и некоторыми клетками иммунной системы с образованием кальцитриола (1,25-дигидроксихолекальциферола), биологически активной формы витамина D. [9] [10] Кальцитриол циркулирует в крови как гормон, играя важную роль в регулировании концентрации кальция и фосфатов , а также способствуя здоровому росту и ремоделированию костей. [1] Кальцитриол также оказывает и другие эффекты, в том числе на рост клеток, нервно-мышечные и иммунные функции, а также на уменьшение воспаления. [2]
Витамин D играет важную роль в кальция . гомеостазе и метаболизме [1] Его открытие произошло благодаря попыткам найти пищевые вещества, которых не хватает детям, больным рахитом (детская форма остеомаляции ). [11] Добавки витамина D назначаются для лечения или профилактики остеомаляции и рахита. [1] Доказательства других последствий приема добавок витамина D для здоровья у людей с избытком витамина D противоречивы. [2] Влияние добавок витамина D на смертность неясно, при этом один метаанализ обнаружил небольшое снижение смертности среди пожилых людей. [12] За исключением профилактики рахита и остеомаляции в группах высокого риска, польза от добавок витамина D для опорно-двигательного аппарата или общего состояния здоровья может быть незначительной. [13] [14] [15]
Типы
[ редактировать ]| Имя | Химический состав | Структура |
|---|---|---|
| Витамин Д 1 | Смесь молекулярных соединений эргокальциферола с люмистеролом , 1:1 | |
| Витамин Д 2 | эргокальциферол (из эргостерина ) |  |
| Витамин Д 3 | холекальциферол (изготовлен из 7-дегидрохолестерина в коже). |  |
| Витамин Д 4 | 22-дигидроэргокальциферол |  |
| Витамин Д 5 | ситокальциферол (изготовлен из 7-дегидроситостерина ) |  |
Существует несколько форм ( витамеров ) витамина D. [1] Двумя основными формами являются витамин D2 или эргокальциферол и витамин D3 или холекальциферол. [1] Витамин D без нижнего индекса относится либо к D2, либо к D3 , либо к обоим, и известен под общим названием кальциферол. [ нужна ссылка ]
Витамин D2 был химически охарактеризован в 1931 году. В 1935 году была определена химическая структура витамина D3 и показано, что он образуется в результате ультрафиолетового облучения 7-дегидрохолестерина. Химическая номенклатура форм витамина D была рекомендована в 1981 г. [16] но альтернативные названия остаются широко распространенными. [3]
С химической точки зрения различные формы витамина D представляют собой секостероиды , то есть стероиды, у которых одна из связей в стероидных кольцах разорвана. [17] Структурное различие между витамином D2 и витамином D3 заключается в боковой цепи , которая содержит двойную связь между атомами углерода 22 и 23, а также в метильной группе на атоме углерода 24 в витамине D2 . [3] множество аналогов витамина D. Синтезировано [3]
Биология
[ редактировать ]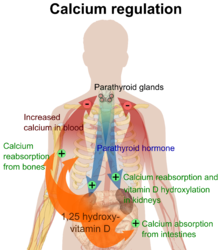
Активный метаболит витамина D кальцитриол опосредует свои биологические эффекты путем связывания с рецептором витамина D (VDR), который преимущественно расположен в ядрах клеток-мишеней. [1] [17] Связывание кальцитриола с VDR позволяет VDR действовать как фактор транскрипции , который модулирует экспрессию генов транспортных белков (таких как TRPV6 и кальбиндин ), которые участвуют в абсорбции кальция в кишечнике. [19] Рецептор витамина D принадлежит к ядерных рецепторов суперсемейству рецепторов стероидных/тиреоидных гормонов , а VDR экспрессируются клетками большинства органов , включая мозг, сердце, кожу, половые железы, простату и грудь.
Активация VDR в клетках кишечника, костей, почек и паращитовидных желез приводит к поддержанию уровня кальция и фосфора в крови (с помощью паратиреоидного гормона и кальцитонина ) и поддержанию содержания костной ткани. [1] [20]
Одна из наиболее важных ролей витамина D заключается в поддержании баланса кальция в скелете путем содействия абсорбции кальция в кишечнике, содействия резорбции костей за счет увеличения количества остеокластов , поддержания уровня кальция и фосфатов для формирования костей и обеспечения правильного функционирования паратиреоидного гормона для поддержания сыворотки. уровень кальция. [1] Дефицит витамина D может привести к снижению минеральной плотности костей и повышенному риску снижения плотности костей ( остеопороза ) или переломов костей , поскольку недостаток витамина D изменяет минеральный обмен в организме. [1] [21] Таким образом, витамин D также имеет решающее значение для ремоделирования костей , поскольку он является мощным стимулятором резорбции кости . [21]
VDR регулирует пролиферацию и дифференцировку клеток . Витамин D также влияет на иммунную систему, а VDR экспрессируются в нескольких лейкоцитах , включая моноциты и активированные Т- и В-клетки . [22] In vitro витамин D увеличивает экспрессию гена тирозингидроксилазы в надпочечников клетках мозгового вещества и влияет на синтез нейротрофических факторов , синтазы оксида азота и глутатиона . [23]
Экспрессия рецепторов витамина D снижается с возрастом. [1]
Дефицит
[ редактировать ]Диета с недостаточным содержанием витамина D в сочетании с недостаточным пребыванием на солнце вызывает дефицит витамина D, который определяется как уровень 25(OH)D в крови ниже 12 нг/мл (30 нмоль/литр), тогда как недостаточность витамина D – это дефицит витамина D в крови. Уровень OH)D 12–20 нг/мл (30–50 нмоль/л). [2] [24] По оценкам, один миллиард взрослых людей во всем мире либо испытывают недостаток витамина D, либо его дефицит. [25] в том числе в развитых странах Европы. [26] Тяжелый дефицит витамина D у детей, редкое заболевание в развитых странах, вызывает размягчение и ослабление растущих костей и состояние, называемое рахитом . [27]
Дефицит витамина D встречается во всем мире у пожилых людей и остается распространенным среди детей и взрослых. [28] [29] [25] Дефицит приводит к нарушению минерализации костей и повреждению костей, что приводит к заболеваниям, размягчающим кости. [30] включая рахит у детей и остеомаляцию у взрослых. Низкий уровень кальцифедиола в крови (25-гидроксивитамина D) может быть результатом избегания солнца. [31] Being deficient in Vitamin D can cause the absorption of dietary calcium to fall from the normal fraction (between 60 and 80 percent) to as little as 15 percent.[20]
Dark-skinned people living in temperate climates have been shown to have low vitamin D levels.[32][33][34] Dark-skinned people are less efficient at making vitamin D because melanin in the skin hinders vitamin D synthesis.[35] Vitamin D deficiency is common in Hispanic and African-Americans in the United States, with levels dropping significantly in the winter.[24] This is due to the levels of melanin in the skin, as it acts as a natural protectant from sun exposure.[24]
Vitamin D deficiency is associated with increased risk of development of various types of cancer, including melanoma.[36]
Bone health
[edit]Rickets
[edit]Rickets, a childhood disease, is characterized by impeded growth and soft, weak, deformed long bones that bend and bow under their weight as children start to walk. Rickets typically appears between 3 and 18 months of age.[37] Cases continue to be reported in North American and other Western Countries and is primarily seen in breastfed infants and those with darker skin complexions.[37] This condition is characterized by bow legs,[30] which can be caused by calcium or phosphorus deficiency, as well as a lack of vitamin D; in the 21st century, it is largely found in low-income countries in Africa, Asia, or the Middle East[38] and in those with genetic disorders such as pseudo-vitamin-D-deficiency rickets.[39]
Maternal vitamin D deficiency may cause overt bone disease from before birth and impairment of bone quality after birth.[40][41] Nutritional rickets exists in countries with intense year-round sunlight such as Nigeria and can occur without vitamin D deficiency.[42][43]
Although rickets and osteomalacia are now rare in the United Kingdom, outbreaks have happened in some immigrant communities in which people with osteomalacia included women with seemingly adequate daylight outdoor exposure wearing Western clothing.[44] Having darker skin and reduced exposure to sunshine did not produce rickets unless the diet deviated from a Western omnivore pattern characterized by high intakes of meat, fish, and eggs.[45][46][47] The dietary risk factors for rickets include abstaining from animal foods.[44][48]
Vitamin D deficiency remains the main cause of rickets among young infants in most countries because breast milk is low in vitamin D and social customs and climatic conditions can prevent adequate sun exposure. In sunny countries such as Nigeria, South Africa, and Bangladesh, where rickets occurs among older toddlers and children, it has been attributed to low dietary calcium intakes, which are characteristic of cereal-based diets with limited access to dairy products.[47]
Rickets was formerly a major public health problem among the US population. In Denver, almost two-thirds of 500 children had mild rickets in the late 1920s.[49] An increase in the proportion of animal protein[48][50] in the 20th century American diet coupled with increased consumption of milk[51][52] fortified with relatively small quantities of vitamin D coincided with a dramatic decline in the number of rickets cases.[20] Also, in the United States and Canada, vitamin D-fortified milk, infant vitamin supplements, and vitamin supplements have helped to eradicate the majority of cases of rickets for children with fat malabsorption conditions.[30]
Osteomalacia and osteoporosis
[edit]Osteomalacia is a disease in adults that results from vitamin D deficiency.[1] Characteristics of this disease are softening of the bones, leading to bending of the spine, proximal muscle weakness, bone fragility, and increased risk for fractures.[1] Osteomalacia reduces calcium absorption and increases calcium loss from bone, which increases the risk for bone fractures. Osteomalacia is usually present when 25-hydroxyvitamin D levels are less than about 10 ng/mL.[53] Although the effects of osteomalacia are thought to contribute to chronic musculoskeletal pain, there is no persuasive evidence of lower vitamin D levels in people with chronic pain[54] or that supplementation alleviates chronic nonspecific musculoskeletal pain.[55] Osteomalacia progress to osteoporosis, a condition of reduced bone mineral density with increased bone fragility and risk of bone fractures. Osteoporosis can be a long-term effect of calcium and/or vitamin D insufficiency, the latter contributing by reducing calcium absorption.[2]
Use of supplements
[edit]Supplementation with vitamin D is a reliable method for preventing or treating rickets.[1] On the other hand, the effects of vitamin D supplementation on non-skeletal health are uncertain.[56][57] A review did not find any effect from supplementation on the rates of non-skeletal disease, other than a tentative decrease in mortality in the elderly.[58] Vitamin D supplements do not alter the outcomes for myocardial infarction, stroke or cerebrovascular disease, cancer, bone fractures or knee osteoarthritis.[14][59]
A US Institute of Medicine (IOM) report states: "Outcomes related to cancer, cardiovascular disease and hypertension, and diabetes and metabolic syndrome, falls and physical performance, immune functioning and autoimmune disorders, infections, neuropsychological functioning, and preeclampsia could not be linked reliably with intake of either calcium or vitamin D, and were often conflicting."[60]: 5 Some researchers claim the IOM was too definitive in its recommendations and made a mathematical mistake when calculating the blood level of vitamin D associated with bone health.[61] Members of the IOM panel maintain that they used a "standard procedure for dietary recommendations" and that the report is solidly based on the data.[61]
Mortality, all-causes
[edit]Vitamin D3 supplementation has been tentatively found to lead to a reduced risk of death in the elderly,[12][58] but the effect has not been deemed pronounced, or certain enough, to make taking supplements recommendable.[14] Other forms (vitamin D2, alfacalcidol, and calcitriol) do not appear to have any beneficial effects with regard to the risk of death.[12] High blood levels appear to be associated with a lower risk of death, but it is unclear if supplementation can result in this benefit.[62] Both an excess and a deficiency in vitamin D appear to cause abnormal functioning and premature aging.[63][64][65] The relationship between serum calcifediol concentrations and all-cause mortality is "U-shaped": mortality is elevated at high and low calcifediol levels, relative to moderate levels.[60] Harm from vitamin D appears to occur at a lower vitamin D level in the dark skinned Canadian and United States populations which have been studied than in the light skinned Canadian and United States populations which have been studied. Whether this is so with dark skinned populations in other parts of the world is unknown.[60]: 435
Bone health
[edit]In general, no good evidence supports the commonly held belief that vitamin D supplements can help prevent osteoporosis.[14] Its general use for prevention of this disease in those without vitamin D deficiency is thus likely not needed.[13] For older people with osteoporosis, taking vitamin D with calcium may help prevent hip fractures, but it also slightly increases the risk of stomach and kidney problems.[66] A study found that supplementation with 800 IU or more daily, in those older than 65 years was "somewhat favorable in the prevention of hip fracture and non-vertebral fracture".[67] The effect is small or none for people living independently.[68][69] Low serum vitamin D levels have been associated with falls, and low bone mineral density.[70] Taking extra vitamin D, however, does not appear to change the risk.[71]
Athletes who are vitamin D deficient are at an increased risk of stress fractures and/or major breaks, particularly those engaging in contact sports. The greatest benefit with supplementation is seen in athletes who are deficient (25(OH)D serum levels <30 ng/mL), or severely deficient (25(OH)D serum levels <25 ng/mL). Incremental decreases in risks are observed with rising serum 25(OH)D concentrations plateauing at 50 ng/mL with no additional benefits seen in levels beyond this point.[72]
A 2020 Cochrane systematic review has found limited evidence that vitamin D plus calcium, but not independently can improve healing in children with nutritional rickets, but the evidence was not conclusive for reducing fractures.[73]
The US Food and Drug Administration (FDA) has required manufacturers to declare the amount of vitamin D on nutrition facts labels, as "nutrients of public health significance", since May 2016. By a proposed deadline extension, some manufacturers had until 1 July 2021, to comply.[74]
Cancer
[edit]Potential associations have been found between low vitamin D levels and the risk of developing several types of cancer.[36][75][76] Meta-analyses of observational studies have found reduced risk of cancer incidence related to vitamin D intake and 25(OH)D levels, particularly for colorectal cancer, although the strength of the associations was classified as weak.[76][77] Vitamin D receptor and SNAI2 are found to be involved in the metastastic process of osteosarcoma.[78] While randomized controlled trials have not confirmed that vitamin D supplements reduce the risk of cancer incidence, the relative risk of cancer deaths was lower by up to 16% in several meta-analyses.[79][77]
Low levels of 25-hydroxyvitamin D, a routinely used marker for vitamin D, have been suggested as a contributing factor in increasing the risk the development and progression of various types of cancer, including melanoma. Vitamin D requires activation by cytochrome P450 (CYP) enzymes to become active and bind to the VDR. Specifically, CYP27A1, CYP27B1, and CYP2R1 are involved in the activation of vitamin D, while CYP24A1 and CYP3A4 are responsible for the degradation of the active vitamin D. CYP24A1, the primary catabolic enzyme of calcitriol, is overexpressed in melanoma tissues and cells. This overexpression could lead to lower levels of active vitamin D in tissues, potentially promoting the development and progression of melanoma. Several drug classes and natural health products can modulate vitamin D-related CYP enzymes, potentially causing lower levels of vitamin D and its active metabolites in tissues, suggesting that maintaining adequate vitamin D levels, that is, avoiding vitamin D deficiency, either through dietary supplements or by modulating CYP metabolism, could be beneficial in decreasing the risk of melanoma development.[36]
Cardiovascular disease
[edit]Vitamin D supplementation is not associated with a reduced risk of stroke, cerebrovascular disease, myocardial infarction, or ischemic heart disease.[14][80][81] Supplementation does not lower blood pressure in the general population.[82][83][84]
Immune system
[edit]Infectious diseases
[edit]In general, vitamin D functions to activate the innate and dampen the adaptive immune systems with antibacterial, antiviral and anti-inflammatory effects.[85][86] Low levels of vitamin D appear to be a risk factor for tuberculosis,[87] and historically it was used as a treatment.[88]
Vitamin D supplementation in low doses (400 to 1000 IU/day) may slightly decrease the overall risk of acute respiratory tract infections.[89] The benefits were found in young children and adolescents (ages 1 up to 16 years) and were not confirmed with higher doses (>1000 IU per day or more).[89] Vitamin D supplementation substantially reduces the rate of moderate or severe exacerbations of COPD in people with baseline 25(OH)D levels under 25nmol/L, but not in those with less severe deficiency.[90]
Asthma
[edit]Vitamin D supplementation does not help prevent asthma attacks or alleviate their symptoms.[91]
Inflammatory bowel disease
[edit]Low levels of vitamin D are associated with two major forms of human inflammatory bowel disease: Crohn's disease and ulcerative colitis.[92] Deficiencies in vitamin D have been linked to the severity of the case of inflammatory bowel disease, however, whether vitamin D deficiency causes inflammatory bowel disease or is a symptom of the disease is not clear.[93]
There is some evidence that vitamin D supplementation therapy for people with inflammatory bowel disease may be associated with improvements in scores for clinical inflammatory bowel disease activity and biochemical markers.[94][93] Vitamin D treatment may be associated with less frequent relapse of symptoms in IBD.[93] It is not clear if this treatment improves the person's quality of life or what the clinical response to vitamin D treatment.[93] The ideal treatment regime and dose of vitamin D therapy has not been well enough studied.[93]
Other conditions
[edit]Diabetes
[edit]A meta-analysis reported that vitamin D supplementation significantly reduced the risk of type 2 diabetes for non-obese people with prediabetes.[95] Another meta-analysis reported that vitamin D supplementation significantly improved glycemic control [homeostatic model assessment-insulin resistance (HOMA-IR)], hemoglobin A1C (HbA1C), and fasting blood glucose (FBG) in individuals with type 2 diabetes.[96] In prospective studies, high versus low level of vitamin D was respectively associated with significant decrease in risk of type 2 diabetes, combined type 2 diabetes and prediabetes, and prediabetes.[97] A 2011 Cochrane systematic review examined one study that showed vitamin D together with insulin maintained levels of fasting C-peptide after 12 months better than insulin alone. However, it is important to highlight that the studies available to be included in this review presented considerable flaws in quality and design.[98]
Attention deficit hyperactivity disorder (ADHD)
[edit]A meta-analysis of observational studies showed that children with ADHD have lower vitamin D levels, and that there was a small association between low vitamin D levels at the time of birth and later development of ADHD.[99] Several small, randomized controlled trials of vitamin D supplementation indicated improved ADHD symptoms such as impulsivity and hyperactivity.[100]
Depression
[edit]Clinical trials of vitamin D supplementation for depressive symptoms have generally been of low quality and show no overall effect, although subgroup analysis showed supplementation for participants with clinically significant depressive symptoms or depressive disorder had a moderate effect.[101]
Cognition and dementia
[edit]A systematic review of clinical studies found an association between low vitamin D levels with cognitive impairment and a higher risk of developing Alzheimer's disease. However, lower vitamin D concentrations are also associated with poor nutrition and spending less time outdoors. Therefore, alternative explanations for the increase in cognitive impairment exist and hence a direct causal relationship between vitamin D levels and cognition could not be established.[102]
Schizophrenia
[edit]Trials have demonstrated lower vitamin D levels are highly prevalent in people with schizophrenia, particularly those with acute episodes.[103]
Pregnancy
[edit]Low levels of vitamin D in pregnancy are associated with gestational diabetes, pre-eclampsia, and small (for gestational age) infants.[104] Although taking vitamin D supplements during pregnancy raises blood levels of vitamin D in the mother at term,[105] the full extent of benefits for the mother or baby is unclear.[104][105][106] Pregnant women who take an adequate amount of vitamin D during gestation may experience a lower risk of pre-eclampsia[107] and positive immune effects.[108] Vitamin D supplementation is also likely to reduce the risk of gestational diabetes, undersized babies[107] and of their poor rate of growth.[109] Pregnant women often do not take the recommended amount of vitamin D.[108]
Weight loss
[edit]Though hypothesized that vitamin D supplementation may be an effective treatment for obesity apart from calorie restriction, one systematic review found no association of supplementation with body weight or fat mass.[110] A 2016 meta-analysis found that circulating vitamin D status was improved by weight loss, indicating that fat mass may be inversely associated with blood levels of vitamin D.[111]
Allowable health claims
[edit]Governmental regulatory agencies stipulate for the food and dietary supplement industries certain health claims as allowable as statements on packaging.
European Food Safety Authority
- normal function of the immune system[112]
- normal inflammatory response[112]
- normal muscle function[112]
- reduced risk of falling in people over age 60[113]
US Food and Drug Administration (FDA)
- "Adequate calcium and vitamin D, as part of a well balanced diet, along with physical activity, may reduce the risk of osteoporosis."[114]
- "Adequate calcium and regular exercise may help to achieve strong bones in children and adolescents and may reduce the risk of osteoporosis in older adults. An adequate intake of vitamin D is also necessary."[115]
Other possible agencies with claim guidance: Japan FOSHU[116] and Australia-New Zealand.[117]
Dietary intake
[edit]| United Kingdom | ||
| Age group | Intake (μg/day) | Maximum intake (μg/day)[118] |
|---|---|---|
| Breast-fed infants 0–12 months | 8.5 – 10 | 25 |
| Formula-fed infants (<500 mL/d) | 10 | 25 |
| Children 1 – 10 years | 10 | 50 |
| Children >10 and adults | 10 | 100 |
| United States | ||
| Age group | RDA (IU/day) | (μg/day)[60] |
| Infants 0–6 months | 400* | 10 |
| Infants 6–12 months | 400* | 10 |
| 1–70 years | 600 | 15 |
| Adults > 70 years | 800 | 20 |
| Pregnant/Lactating | 600 | 15 |
| Age group | Tolerable upper intake level (IU/day) | (μg/day) |
| Infants 0–6 months | 1,000 | 25 |
| Infants 6–12 months | 1,500 | 37.5 |
| 1–3 years | 2,500 | 62.5 |
| 4–8 years | 3,000 | 75 |
| 9+ years | 4,000 | 100 |
| Pregnant/lactating | 4,000 | 100[60] |
| Canada | ||
| Age group | RDA (IU)[119] | Tolerable upper intake (IU)[119] |
| Infants 0–6 months | 400* | 1,000 |
| Infants 7–12 months | 400* | 1,500 |
| Children 1–3 years | 600 | 2,500 |
| Children 4–8 years | 600 | 3,000 |
| Children and adults 9–70 years | 600 | 4,000 |
| Adults > 70 years | 800 | 4,000 |
| Pregnancy & lactation | 600 | 4,000 |
| Australia and New Zealand | ||
| Age group | Adequate Intake (μg)[117] | Upper Level of Intake (μg)[117] |
| Infants 0–12 months | 5* | 25 |
| Children 1–18 years | 5* | 80 |
| Adults 19–50 years | 5* | 80 |
| Adults 51–70 years | 10* | 80 |
| Adults > 70 years | 15* | 80 |
| European Food Safety Authority | ||
| Age group | Adequate Intake (μg)[120] | Tolerable upper limit (μg)[121] |
| Infants 0–12 months | 10 | 25 |
| Children 1–10 years | 15 | 50 |
| Children 11–17 years | 15 | 100 |
| Adults | 15 | 100 |
| Pregnancy & Lactation | 15 | 100 |
| * Adequate intake, no RDA/RDI yet established | ||
Recommended levels
[edit]Various institutions have proposed different recommendations for the amount of daily intake[122] of vitamin D. These vary according to precise definition, age, pregnancy or lactation, and the extent assumptions are made regarding skin synthesis of vitamin D.[118][60][119][117][120]Conversion: 1 μg (microgram) = 40 IU (international unit).[118]
United Kingdom
[edit]The UK National Health Service (NHS) recommends that people at risk of vitamin D deficiency, breast-fed babies, formula-fed babies taking less than 500 ml/day, and children aged 6 months to 4 years, should take daily vitamin D supplements throughout the year to ensure sufficient intake.[118] This includes people with limited skin synthesis of vitamin D, who are not often outdoors, are frail, housebound, living in a care home, or usually wearing clothes that cover up most of the skin, or with dark skin, such as having an African, African-Caribbean or south Asian background. Other people may be able to make adequate vitamin D from sunlight exposure from April to September. The NHS and Public Health England recommend that everyone, including those who are pregnant and breastfeeding, consider taking a daily supplement containing 10 μg (400 IU) of vitamin D during autumn and winter because of inadequate sunlight for vitamin D synthesis.[123]
United States
[edit]The dietary reference intake for vitamin D issued in 2010 by the Institute of Medicine (IoM) (renamed National Academy of Medicine in 2015), superseded previous recommendations which were expressed in terms of adequate intake. The recommendations were formed assuming the individual has no skin synthesis of vitamin D because of inadequate sun exposure. The reference intake for vitamin D refers to total intake from food, beverages and supplements, and assumes that calcium requirements are being met.[60]: 5 The tolerable upper intake level (UL)[124] is defined as "the highest average daily intake of a nutrient that is likely to pose no risk of adverse health effects for nearly all persons in the general population."[60]: 403 Although ULs are believed to be safe, information on the long-term effects is incomplete and these levels of intake are not recommended for long-term consumption.[60]: 403 : 433
For US food and dietary supplement labeling purposes, the amount in a serving is expressed as a percent of Daily Value (%DV). For vitamin D labeling purposes, 100% of the daily value was 400 IU (10 μg), but in May 2016, it was revised to 800 IU (20 μg) to bring it into agreement with the recommended dietary allowance (RDA).[125][126] Compliance with the updated labeling regulations was required by 1 January 2020 for manufacturers with US$10 million or more in annual food sales, and by 1 January 2021 for manufacturers with lower volume food sales.[74][127] A table of the old and new adult daily values is provided at Reference Daily Intake.
Canada
[edit]Health Canada published recommended dietary intakes (DRIs) and tolerable upper intake levels (ULs) for vitamin D based on the jointly commissioned and funded Institute of Medicine 2010 report.[60][119]
Australia and New Zealand
[edit]Australia and New Zealand published nutrient reference values including guidelines for dietary vitamin D intake in 2006.[117] About a third of Australians have vitamin D deficiency.[128][129]
European Union
[edit]The European Food Safety Authority (EFSA) in 2016[120] reviewed the current evidence, finding the relationship between serum 25(OH)D concentration and musculoskeletal health outcomes is widely variable. They considered that average requirements and population reference intakes values for vitamin D cannot be derived, and that a serum 25(OH)D concentration of 50 nmol/L was a suitable target value. For all people over the age of 1, including women who are pregnant or lactating, they set an adequate intake of 15 μg/day (600 IU).[120]
The EFSA reviewed safe levels of intake in 2012,[121] setting the tolerable upper limit for adults at 100 μg/day (4000 IU), a similar conclusion as the IOM.
The Swedish National Food Agency recommends a daily intake of 10 μg (400 IU) of vitamin D3 for children and adults up to 75 years, and 20 μg (800 IU) for adults 75 and older.[130]
Non-government organisations in Europe have made their own recommendations. The German Society for Nutrition recommends 20 μg.[131] The European Menopause and Andropause Society recommends postmenopausal women consume 15 μg (600 IU) until age 70, and 20 μg (800 IU) from age 71. This dose should be increased to 100 μg (4,000 IU) in some patients with very low vitamin D status or in case of co-morbid conditions.[132]
Sources
[edit]Although vitamin D is present naturally in only a few foods,[2] it is commonly added as a fortification in manufactured foods. In some countries, staple foods are artificially fortified with vitamin D.[133]
Natural sources
[edit]| Animal sources | |||
| Source[134] | IU/g | Irregular | |
|---|---|---|---|
| Cooked egg yolk | 0.7 | 44 IU for a 61g egg | |
| Beef liver, cooked, braised | 0.5 | ||
| Fish liver oils, such as cod liver oil | 100 | 450 IU per teaspoon (4.5 g) | |
| Fatty fish species | |||
| Salmon, pink, cooked, dry heat | 5.2 | ||
| Mackerel, Pacific and jack, mixed species, cooked, dry heat | 4.6 | ||
| Tuna, canned in oil | 2.7 | ||
| Sardines, canned in oil, drained | 1.9 | ||
| Fungal sources | |||
| Source | μg/g | IU/g | |
|---|---|---|---|
| Cladonia arbuscula (lichen), thalli, dry[135] | vitamin D3 | 0.67–2.04 | 27–82 |
| vitamin D2 | 0.22–0.55 | 8.8–22 | |
| Agaricus bisporus (common mushroom): D2 + D3 | |||
| Portobello | Raw | 0.003 | 0.1 |
| Exposed to ultraviolet light | 0.11 | 4.46 | |
| Crimini | Raw | 0.001 | 0.03 |
| Exposed to ultraviolet light | 0.32 | 12.8 | |
In general, vitamin D3 is found in animal source foods, particularly fish, meat, offal, egg and dairy.[136]Vitamin D2 is found in fungi and is produced by ultraviolet irradiation of ergosterol.[137] The vitamin D2 content in mushrooms and Cladina arbuscula, a lichen, increases with exposure to ultraviolet light,[135][138] and is stimulated by industrial ultraviolet lamps for fortification.[137] The United States Department of Agriculture reports D2 and D3 content combined in one value.
Food fortification
[edit]Manufactured foods fortified with vitamin D include some fruit juices and fruit juice drinks, meal replacement energy bars, soy protein-based beverages, certain cheese and cheese products, flour products, infant formulas, many breakfast cereals, and milk.[139][140]
In 2016 in the United States, the Food and Drug Administration (FDA) amended food additive regulations for milk fortification,[141] stating that vitamin D3 levels not exceed 42 IU vitamin D per 100 g (400 IU per US quart) of dairy milk, 84 IU of vitamin D2 per 100 g (800 IU per quart) of plant milks, and 89 IU per 100 g (800 IU per quart) in plant-based yogurts or in soy beverage products.[142][143][144] Plant milks are defined as beverages made from soy, almond, rice, among other plant sources intended as alternatives to dairy milk.[145]
While some studies have found that vitamin D3 raises 25(OH)D blood levels faster and remains active in the body longer,[146][147] others contend that vitamin D2 sources are equally bioavailable and effective as D3 for raising and sustaining 25(OH)D.[137][148][149]
Food preparation
[edit]Vitamin D content in typical foods is reduced variably by cooking. Boiled, fried and baked foods retained 69–89% of original vitamin D.[150]
Recommended serum levels
[edit]
Recommendations on recommended 25(OH)D serum levels vary across authorities, and vary based on factors like age.[2] US labs generally report 25(OH)D levels in ng/mL.[153] Other countries often use nmol/L.[153] One ng/mL is approximately equal to 2.5 nmol/L.[154]
A 2014 review concluded that the most advantageous serum levels for 25(OH)D for all outcomes appeared to be close to 30 ng/mL (75 nmol/L).[155] The optimal vitamin D levels are still controversial and another review concluded that ranges from 30 to 40 ng/mL (75 to 100 nmol/L) were to be recommended for athletes.[156] Part of the controversy is because numerous studies have found differences in serum levels of 25(OH)D between ethnic groups; studies point to genetic as well as environmental reasons behind these variations.[157] Supplementation to achieve these standard levels could cause harmful vascular calcification.[34]
A 2012 meta-analysis showed that the risk of cardiovascular diseases increases when blood levels of vitamin D are lowest in a range of 8 to 24 ng/mL (20 to 60 nmol/L), although results among the studies analyzed were inconsistent.[158]
In 2011 an IOM committee concluded a serum 25(OH)D level of 20 ng/mL (50 nmol/L) is needed for bone and overall health. The dietary reference intakes for vitamin D are chosen with a margin of safety and 'overshoot' the targeted serum value to ensure the specified levels of intake achieve the desired serum 25(OH)D levels in almost all persons. No contributions to serum 25(OH)D level are assumed from sun exposure and the recommendations are fully applicable to people with dark skin or negligible exposure to sunlight. The Institute found serum 25(OH)D concentrations above 30 ng/mL (75 nmol/L) are "not consistently associated with increased benefit". Serum 25(OH)D levels above 50 ng/mL (125 nmol/L) may be cause for concern. However, some people with serum 25(OH)D between 30 and 50 ng/mL (75 nmol/L-125 nmol/L) will also have inadequate vitamin D.[60]
Excess
[edit]Vitamin D toxicity is rare.[25] It is caused by supplementing with high doses of vitamin D rather than sunlight. The threshold for vitamin D toxicity has not been established; however, according to some research:
- 100 μg/day (4k IU), have been show to not cause toxic levels. ages 9–71[159]
- 240 μg/day (10k IU), over 5 months have been shown not to cause toxicity.[25]
- 1250 μg/day (50k IU) over several months can increase serum 25-hydroxyvitamin D levels to 150 ng/mL.[25][160]
Those with certain medical conditions, such as primary hyperparathyroidism,[161] are far more sensitive to vitamin D and develop hypercalcemia in response to any increase in vitamin D nutrition, while maternal hypercalcemia during pregnancy may increase fetal sensitivity to effects of vitamin D and lead to a syndrome of intellectual disability and facial deformities.[161][162]
Idiopathic infantile hypercalcemia is caused by a mutation of the CYP24A1 gene, leading to a reduction in the degradation of vitamin D. Infants who have such a mutation have an increased sensitivity to vitamin D and in case of additional intake a risk of hypercalcaemia.[163][164] The disorder can continue into adulthood.[165]
A review published in 2015 noted that adverse effects have been reported only at 25(OH)D serum concentrations above 200 nmol/L.[156]
Published cases of toxicity involving hypercalcemia in which the vitamin D dose and the 25-hydroxy-vitamin D levels are known all involve an intake of ≥40,000 IU (1,000 μg) per day.[161]
Those who are pregnant or breastfeeding should consult a doctor before taking a vitamin D supplement. The FDA advised manufacturers of liquid vitamin D supplements that droppers accompanying these products should be clearly and accurately marked for 400 international units (1 IU is the biological equivalent of 25 ng cholecalciferol/ergocalciferol). In addition, for products intended for infants, the FDA recommends the dropper hold no more than 400 IU.[166] For infants (birth to 12 months), the tolerable upper limit (maximum amount that can be tolerated without harm) is set at 25 μg/day (1,000 IU). One thousand micrograms per day in infants has produced toxicity within one month.[160] After being commissioned by the Canadian and American governments, the Institute of Medicine (IOM) as of 30 November 2010[update], has increased the tolerable upper limit (UL) to 2,500 IU per day for ages 1–3 years, 3,000 IU per day for ages 4–8 years and 4,000 IU per day for ages 9–71+ years (including pregnant or lactating women).[159]
Calcitriol itself is auto-regulated in a negative feedback cycle, and is also affected by parathyroid hormone, fibroblast growth factor 23, cytokines, calcium, and phosphate.[167]
A study published in 2017 assessed the prevalence of high daily intake levels of supplemental vitamin D among adults ages 20+ in the United States, based on publicly available NHANES data from 1999 through 2014. Its data shows the following:
- Over 18% of the population exceeds the NIH daily recommended allowance (RDA) of 600–800 IU,[2] by taking over 1000 IU, which suggests intentional supplement intake.[168]
- Over 3% of the population exceeds the NIH daily tolerable upper intake level (UL) of 4000 IU,[2] above which level the risk of toxic effects increases.[169][168]
- The percentage of the population taking over 1000 IU/day, as well as the percentage taking over 4000 IU/day, have both increased since 1999, according to trend analysis.[168]
Effect of excess
[edit]Vitamin D overdose causes hypercalcemia, which is a strong indication of vitamin D toxicity – this can be noted with an increase in urination and thirst. If hypercalcemia is not treated, it results in excess deposits of calcium in soft tissues and organs such as the kidneys, liver, and heart, resulting in pain and organ damage.[25][30][170]
The main symptoms of vitamin D overdose are hypercalcemia including anorexia, nausea, and vomiting. These may be followed by polyuria, polydipsia, weakness, insomnia, nervousness, pruritus and ultimately kidney failure. Furthermore, proteinuria, urinary casts, azotemia, and metastatic calcification (especially in the kidneys) may develop.[160] Other symptoms of vitamin D toxicity include intellectual disability in young children, abnormal bone growth and formation, diarrhea, irritability, weight loss, and severe depression.[25][170]
Vitamin D toxicity is treated by discontinuing vitamin D supplementation and restricting calcium intake. Kidney damage may be irreversible. Exposure to sunlight for extended periods of time does not normally cause vitamin D toxicity. The concentrations of vitamin D precursors produced in the skin reach an equilibrium, and any further vitamin D produced is degraded.[161]
Biosynthesis
[edit]Synthesis of vitamin D in nature is dependent on the presence of UV radiation and subsequent activation in the liver and in the kidneys. Many animals synthesize vitamin D3 from 7-dehydrocholesterol, and many fungi synthesize vitamin D2 from ergosterol.[137][171]
Interactive pathway
[edit]Click on icon in lower right corner to open.
Click on genes, proteins and metabolites below to link to respective articles. [§ 1]
- ^ The interactive pathway map can be edited at WikiPathways: "VitaminDSynthesis_WP1531".
Photochemistry
[edit]

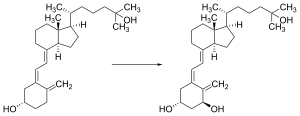
The transformation that converts 7-dehydrocholesterol to vitamin D3 occurs in two steps.[172][173] First, 7-dehydrocholesterol is photolyzed by ultraviolet light in a 6-electron conrotatory ring-opening electrocyclic reaction; the product is previtamin D3. Second, previtamin D3 spontaneously isomerizes to vitamin D3 (cholecalciferol) in an antarafacial sigmatropic [1,7] hydride shift. At room temperature, the transformation of previtamin D3 to vitamin D3 in an organic solvent takes about 12 days to complete. The conversion of previtamin D3 to vitamin D3 in the skin is about 10 times faster than in an organic solvent.[174]
The conversion from ergosterol to vitamin D2 follows a similar procedure, forming previtamin D2 by photolysis, which isomerizes to vitamin D2 (ergocalciferol).[175] The transformation of previtamin D2 to vitamin D2 in methanol has a rate comparable to that of previtamin D3. The process is faster in white button mushrooms.[137]: fig. 3
Synthesis in the skin
[edit]
Vitamin D3 is produced photochemically from 7-dehydrocholesterol in the skin of most vertebrate animals, including humans.[176] The precursor of vitamin D3, 7-dehydrocholesterol is produced in relatively large quantities. 7-Dehydrocholesterol reacts with UVB light at wavelengths of 290–315 nm.[177] These wavelengths are present in sunlight, as well as in the light emitted by the UV lamps in tanning beds (which produce ultraviolet primarily in the UVA spectrum, but typically produce 4% to 10% of the total UV emissions as UVB, some tanning beds can use only separate UVB light bulbs specifically for vitamin D production). Exposure to light through windows is insufficient because glass almost completely blocks UVB light.[178]
Adequate amounts of vitamin D can be produced with moderate sun exposure to the face, arms and legs (for those with the least melanin), averaging 5–30 minutes twice per week, or approximately 25% of the time for minimal sunburn. The darker the skin on the Fitzpatrick scale and the weaker the sunlight, the more minutes of exposure are needed. It also depends on parts of body exposed, all three factors affect minimal erythema dose (MED).[179] Vitamin D overdose from UV exposure is impossible: the skin reaches an equilibrium where the vitamin D degrades as fast as it is created.[25][180]
The skin consists of two primary layers: the inner layer called the dermis, and the outer, thinner epidermis. Vitamin D is produced in the keratinocytes of two innermost strata of the epidermis, the stratum basale and stratum spinosum, which also are able to produce calcitriol and express the VDR.[181]
Evolution
[edit]Vitamin D can be synthesized only by a photochemical process. Its production from sterols would have started very early in the evolution of life around the origin of photosynthesis, possibly helping to prevent DNA damage by absorbing UVB, making vitamin D an inactive end product. The familiar vitamin D endocrine machinery containing vitamin D receptor (VDR), various CYP450 enzymes for activation and inactivation, and a vitamin D binding protein (DBP) is found in vertebrates only. Primitive marine vertebrates are thought to absorb calcium from the ocean into their skeletons and eat plankton rich in vitamin D, although the function in those without a calcified cartilage is unclear.[182] Phytoplankton in the ocean (such as coccolithophore and Emiliania huxleyi) have been photosynthesizing vitamin D for more than 500 million years.
Land vertebrates required another source of vitamin D other than plants for their calcified skeletons. They had to either ingest it or be exposed to sunlight to photosynthesize it in their skin.[171][174] Land vertebrates have been photosynthesizing vitamin D for more than 350 million years.[183]
In birds and fur-bearing mammals, fur or feathers block UV rays from reaching the skin. Instead, vitamin D is created from oily secretions of the skin deposited onto the feathers or fur, and is obtained orally during grooming.[184] However, some animals, such as the naked mole-rat, are naturally cholecalciferol-deficient, as serum 25-OH vitamin D levels are undetectable.[185] Dogs and cats are practically incapable of vitamin D synthesis due to high activity of 7-dehydrocholesterol reductase, but get vitamin D from prey animals.[186]
Industrial synthesis
[edit]Vitamin D3 (cholecalciferol) is produced industrially by exposing 7-dehydrocholesterol to UVB and UVC light, followed by purification.[187][137] The 7-dehydrocholesterol is a natural substance in fish organs, especially the liver,[188] in wool grease (lanolin) from sheep and in some plants,[189] and lichen (Cladonia rangiferina).[190][191] Vitamin D2 (ergocalciferol) is produced in a similar way using ergosterol from yeast or mushrooms as a starting material.[187][137]
Mechanism of action
[edit]Metabolic activation
[edit]
Vitamin D is carried via the blood to the liver, where it is converted into the prohormone calcifediol. Circulating calcifediol may then be converted into calcitriol – the biologically active form of vitamin D – in the kidneys.[192]
Whether synthesized in the skin or ingested, vitamin D is hydroxylated in the liver at position 25 (upper right of the molecule) to form 25-hydroxycholecalciferol (calcifediol or 25(OH)D).[3] This reaction is catalyzed by the microsomal enzyme vitamin D 25-hydroxylase, the product of the CYP2R1 human gene, and expressed by hepatocytes.[193] Once made, the product is released into the plasma, where it is bound to an α-globulin carrier protein named the vitamin D-binding protein.[194]
Calcifediol is transported to the proximal tubules of the kidneys, where it is hydroxylated at the 1-α position (lower right of the molecule) to form calcitriol (1,25-dihydroxycholecalciferol, 1,25(OH)2D).[1] The conversion of calcifediol to calcitriol is catalyzed by the enzyme 25-hydroxyvitamin D3 1-alpha-hydroxylase, which is the product of the CYP27B1 human gene.[1] The activity of CYP27B1 is increased by parathyroid hormone, and also by low calcium or phosphate.[1] Following the final converting step in the kidney, calcitriol is released into the circulation. By binding to vitamin D-binding protein, calcitriol is transported throughout the body, including to the intestine, kidneys, and bones.[17] Calcitriol is the most potent natural ligand of the vitamin D receptor, which mediates most of the physiological actions of vitamin D.[1][192] In addition to the kidneys, calcitriol is also synthesized by certain other cells, including monocyte-macrophages in the immune system. When synthesized by monocyte-macrophages, calcitriol acts locally as a cytokine, modulating body defenses against microbial invaders by stimulating the innate immune system.[192]
Inactivation
[edit]The activity of calcifediol and calcitriol can be reduced by hydroxylation at position 24 by vitamin D3 24-hydroxylase, forming secalciferol and calcitetrol, respectively.[3]
Difference between substrates
[edit]Vitamin D2 (ergocalciferol) and vitamin D3 (cholecalciferol) share a similar mechanism of action as outlined above.[3] Metabolites produced by vitamin D2 are named with an er- or ergo- prefix to differentiate them from the D3-based counterparts (sometimes with a chole- prefix).[16]
- Metabolites produced from vitamin D2 tend to bind less well to the vitamin D-binding protein.[3]
- Vitamin D3 can alternatively be hydroxylated to calcifediol by sterol 27-hydroxylase (CYP27A1), but vitamin D2 cannot.[3]
- Ergocalciferol can be directly hydroxylated at position 24 by CYP27A1.[3] This hydroxylation also leads to a greater degree of inactivation: the activity of calcitriol decreases to 60% of original after 24-hydroxylation,[195] whereas ercalcitriol undergoes a 10-fold decrease in activity on conversion to ercalcitetrol.[196]
It is disputed whether these differences lead to a measurable drop in efficacy (see § Food fortification).
Intracellular mechanisms
[edit]Calcitriol enters the target cell and binds to the vitamin D receptor in the cytoplasm. This activated receptor enters the nucleus and binds to vitamin D response elements (VDRE) which are specific DNA sequences on genes.[1] Transcription of these genes is stimulated and produces greater levels of the proteins which mediate the effects of vitamin D.[3]
Some reactions of the cell to calcitriol appear to be too fast for the classical VDRE transcription pathway, leading to the discovery of various non-genomic actions of vitamin D. The membrane-bound PDIA3 likely serves as an alternate receptor in this pathway.[197] The classical VDR may still play a role.[198]
History
[edit]Vitamin D was discovered in 1922 following on from previous research.[199] American researchers Elmer McCollum and Marguerite Davis in 1914[11] discovered a substance in cod liver oil which later was called "vitamin A". British doctor Edward Mellanby noticed dogs that were fed cod liver oil did not develop rickets and concluded vitamin A, or a closely associated factor, could prevent the disease. In 1922, Elmer McCollum tested modified cod liver oil in which the vitamin A had been destroyed.[11] The modified oil cured the sick dogs, so McCollum concluded the factor in cod liver oil which cured rickets was distinct from vitamin A. He called it vitamin D because he thought it was the fourth vitamin to be named.[200][201] It was not initially realized that vitamin D can be synthesized by humans (in the skin) through exposure to UV light, and therefore is technically not a vitamin, but rather can be considered to be a hormone.
In 1925,[11] it was established that when 7-dehydrocholesterol is irradiated with light, a form of a fat-soluble substance is produced (now known as D3). Alfred Fabian Hess stated: "Light equals vitamin D."[202] Adolf Windaus, at the University of Göttingen in Germany, received the Nobel Prize in Chemistry in 1928 for his work on the constitution of sterols and their connection with vitamins.[203] In 1929, a group at NIMR in Hampstead, London, were working on the structure of vitamin D, which was still unknown, as well as the structure of steroids. A meeting took place with J.B.S. Haldane, J.D. Bernal, and Dorothy Crowfoot to discuss possible structures, which contributed to bringing a team together. X-ray crystallography demonstrated the sterol molecules were flat, not as proposed by the German team led by Windaus. In 1932, Otto Rosenheim and Harold King published a paper putting forward structures for sterols and bile acids which found immediate acceptance.[204] The informal academic collaboration between the team members Robert Benedict Bourdillon, Otto Rosenheim, Harold King, and Kenneth Callow was very productive and led to the isolation and characterization of vitamin D.[205] At this time, the policy of the Medical Research Council was not to patent discoveries, believing the results of medical research should be open to everybody. In the 1930s, Windaus clarified further the chemical structure of vitamin D.[206]
In 1923, American biochemist Harry Steenbock at the University of Wisconsin demonstrated that irradiation by ultraviolet light increased the vitamin D content of foods and other organic materials.[207] After irradiating rodent food, Steenbock discovered the rodents were cured of rickets. Using US$300 of his own money, Steenbock patented his invention. His irradiation technique was used for foodstuffs, most notably for milk. By the expiration of his patent in 1945, rickets had been all but eliminated in the US.[208]
In 1969, a specific binding protein for vitamin D called the vitamin D receptor was identified.[209] Shortly thereafter, the conversion of vitamin D to calcifediol and then to calcitriol, the biologically active form, was confirmed.[9][10][210] The photosynthesis of vitamin D3 in skin via previtamin D3 and its subsequent metabolism was described in 1980.[211]
Research
[edit]There is conflicting evidence about the benefits of interventions with vitamin D. Supplementation of between 800 and 1,000 IU is safe, but higher levels leading to blood levels of more than 50 ng/mL (125 nmol/L) may cause adverse effects.[2][212]
The US Office of Dietary Supplements established a Vitamin D Initiative over 2004–18 to track current research and provide education to consumers.[213] As of 2022, the role of vitamin D in the prevention and treatment of diabetes, glucose intolerance, hypertension, multiple sclerosis, and other medical conditions remains under preliminary research.[2]
Some preliminary studies link low vitamin D levels with disease later in life.[214] One meta-analysis found a decrease in mortality in elderly people.[12] Another meta-analysis covering over 350,000 people concluded that vitamin D supplementation in unselected community-dwelling individuals does not reduce skeletal (total fracture) or non-skeletal outcomes (myocardial infarction, ischemic heart disease, stroke, cerebrovascular disease, cancer) by more than 15%, and that further research trials with similar design are unlikely to change these conclusions.[14] As of 2022, there is insufficient evidence for an effect of vitamin D supplementation on the risk of cancer.[2][215][216] A 2019 meta-analysis found a small increase in risk of stroke when calcium and vitamin D supplements were taken together.[217]
COVID-19
[edit]As of September 2022[update] the US National Institutes of Health state there is insufficient evidence to recommend for or against using vitamin D supplementation to prevent or treat COVID-19.[218] The UK National Institute for Health and Care Excellence (NICE) does not recommend to offer a vitamin D supplement to people solely to prevent or treat COVID-19.[219][220] Both organizations included recommendations to continue the previous established recommendations on vitamin D supplementation for other reasons, such as bone and muscle health, as applicable. Both organizations noted that more people may require supplementation due to lower amounts of sun exposure during the pandemic.[218][219]
Several systematic reviews and meta-analyses of multiple studies have described the associations of vitamin D deficiency with adverse outcomes in COVID-19.[221][222][223][224][225][226] In the largest analysis, with data from 76 observational studies including almost two million adults, vitamin D deficiency or insufficiency significantly increased the susceptibility to becoming infected with COVID-19 and having severe COVID-19, with odds ratios of 1.5 and 1.9 respectively, but these findings had high risk of bias and heterogeneity. A two-fold greater mortality was found, but this analysis was less robust.[226] These findings confirm smaller, earlier analyses,[222][223][224][225] one of which, in reporting that people with COVID-19 tend to have lower 25(OH)D levels than healthy subjects, stated that the trend for associations with health outcomes was limited by the low quality of the studies and by the possibility of reverse causality mechanisms.[224]
Метаанализ трех исследований по влиянию перорального приема витамина D или кальцифедиола показал более низкую в отделения интенсивной терапии частоту госпитализаций (ОРИТ) ( отношение шансов : 0,36) по сравнению с теми, кто не принимал добавки, но без изменения смертности. [227] A Cochrane review, also of three studies, found the evidence for the effectiveness of vitamin D supplementation for the treatment of COVID-19 to be very uncertain.[228] Они обнаружили существенную клиническую и методологическую гетерогенность в трех включенных исследованиях, главным образом из-за различных стратегий приема добавок, составов витамина D (один с использованием кальцифедиола), статуса до лечения и сообщаемых результатов. [228] Другой метаанализ показал, что использование высоких доз витамина D у людей с COVID-19 не основано на убедительных доказательствах, хотя добавки кальцифедиола могут оказывать защитное действие при госпитализации в отделения интенсивной терапии. [224]
Другие животные
[ редактировать ]Рыба
[ редактировать ]Рыба не синтезирует витамин D в естественных условиях и зависит от пищевых источников. Как и у млекопитающих, витамин D3 более биодоступен, чем витамин D2 . [229] В отличие от млекопитающих, обе стадии гидроксилирования от витамина D3 до активной формы 1,25-гидроксивитамина D3 происходят в печени, поэтому уровень 25-гидроксивитамина D3 в плазме не является точным показателем уровня витамина D3 . [229]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т в v В х «Витамин Д» . Информационный центр по микроэлементам, Институт Лайнуса Полинга, Университет штата Орегон, Корваллис. 11 февраля 2021 года. Архивировано из оригинала 8 апреля 2015 года . Проверено 14 марта 2022 г.
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д «Витамин Д» . Управление пищевых добавок, Национальные институты здравоохранения США. 12 августа 2022 года. Архивировано из оригинала 9 апреля 2021 года . Проверено 22 февраля 2022 г.
- ^ Jump up to: а б с д и ж г час я дж к л Бикле Д.Д. (март 2014 г.). «Метаболизм витамина D, механизм действия и клиническое применение» . Химия и биология . 21 (3): 319–29. doi : 10.1016/j.chembiol.2013.12.016 . ПМК 3968073 . ПМИД 24529992 .
- ^ Леманн У., Гессинг Х.Р., Хирш Ф., Мюллер-Белеке А., Гудбрандсен О.А., Уеланд П.М. и др. (октябрь 2015 г.). «Эффективность потребления рыбы в отношении статуса витамина D: метаанализ рандомизированных контролируемых исследований» . Американский журнал клинического питания . 102 (4): 837–47. дои : 10.3945/ajcn.114.105395 . ПМИД 26354531 .
- ^ Кардуэлл, Гленн и др. «Обзор грибов как потенциального источника пищевого витамина D». Питательные вещества об. 10,10 1498. 13 окт. 2018, doi:10.3390/nu10101498
- ^ Норман А.В. (август 2008 г.). «От витамина D к гормону D: основы эндокринной системы витамина D, необходимые для хорошего здоровья» . Американский журнал клинического питания . 88 (2): 491С–9С. дои : 10.1093/ajcn/88.2.491S . ПМИД 18689389 .
- ^ «Тест на витамин Д» . Лабораторные тесты онлайн (США) . Американская ассоциация клинической химии. Архивировано из оригинала 7 ноября 2017 года . Проверено 23 июня 2013 г.
- ^ Холлис Б.В. (январь 1996 г.). «Оценка нутритивного и гормонального статуса витамина D: что измерять и как это делать». Кальцифицированная ткань International . 58 (1): 4–5. дои : 10.1007/BF02509538 . ПМИД 8825231 . S2CID 35887181 .
- ^ Jump up to: а б Холик М.Ф., Шнос Х.К., ДеЛука Х.Ф. (апрель 1971 г.). «Идентификация 1,25-дигидроксихолекальциферола, формы витамина D3 , метаболически активной в кишечнике» . Труды Национальной академии наук Соединенных Штатов Америки . 68 (4): 803–4. Бибкод : 1971PNAS...68..803H . дои : 10.1073/pnas.68.4.803 . ПМК 389047 . ПМИД 4323790 .
- ^ Jump up to: а б Норман А.В., Миртл Дж.Ф., Миджетт Р.Дж., Новицкий Х.Г., Уильямс В., Попьяк Г. (июль 1971 г.). «1,25-дигидроксихолекальциферол: идентификация предполагаемой активной формы витамина D 3 в кишечнике». Наука . 173 (3991): 51–4. Бибкод : 1971Sci...173...51N . дои : 10.1126/science.173.3991.51 . ПМИД 4325863 . S2CID 35236666 .
- ^ Jump up to: а б с д Вольф Г. (июнь 2004 г.). «Открытие витамина D: вклад Адольфа Виндауса» . Журнал питания . 134 (6): 1299–302. дои : 10.1093/jn/134.6.1299 . ПМИД 15173387 .
- ^ Jump up to: а б с д Белакович Г., Глууд Л.Л., Николова Д., Уитфилд К., Веттерслев Дж., Симонетти Р.Г. и др. (январь 2014 г.). «Добавка витамина D для профилактики смертности у взрослых». Кокрейновская база данных систематических обзоров (Систематический обзор). 1 (1): CD007470. дои : 10.1002/14651858.CD007470.pub3 . ПМИД 24414552 .
- ^ Jump up to: а б Рид И.Р., Болланд М.Дж., Грей А. (январь 2014 г.). «Влияние добавок витамина D на минеральную плотность костей: систематический обзор и метаанализ». Ланцет . 383 (9912): 146–55. дои : 10.1016/s0140-6736(13)61647-5 . ПМИД 24119980 . S2CID 37968189 .
- ^ Jump up to: а б с д и ж Болланд М.Дж., Грей А., Гэмбл Г.Д., Рид И.Р. (апрель 2014 г.). «Влияние добавок витамина D на исходы со стороны скелета, сосудов или рака: последовательный метаанализ исследования». «Ланцет». Диабет и эндокринология (метаанализ). 2 (4): 307–20. дои : 10.1016/S2213-8587(13)70212-2 . ПМИД 24703049 .
- ^ «The Lancet Diabetes & Endocrinology: Добавки витамина D у взрослых не предотвращают переломы, падения и не улучшают минеральную плотность костей» . ЭврекАлерт! . Архивировано из оригинала 24 марта 2022 года . Проверено 23 февраля 2022 г.
Авторы приходят к выводу, что нет особых причин использовать добавки витамина D для поддержания или улучшения здоровья опорно-двигательного аппарата, за исключением профилактики редких заболеваний, таких как рахит и остеомаляция, в группах высокого риска, которые могут быть вызваны дефицитом витамина D после длительного отсутствия воздействие солнечных лучей.
- ^ Jump up to: а б «Объединенная комиссия IUPAC-IUB по биохимической номенклатуре (JCBN): Номенклатура витамина D. Рекомендации 1981 г.» . Европейский журнал биохимии . 124 (2): 223–7. Май 1982 г. doi : 10.1111/j.1432-1033.1982.tb06581.x . ПМИД 7094913 .
- ^ Jump up to: а б с Флот JC, Shapses SA (2020). «Витамин Д». В BP Marriott, DF Birt, VA Stallings, AA Yates (ред.). Современные знания в области питания, одиннадцатое издание . Лондон, Великобритания: Academic Press (Elsevier). стр. 93–114. ISBN 978-0-323-66162-1 .
- ^ Борон В.Ф., Булпаеп Э.Л. (29 марта 2016 г.). Электронная книга по медицинской физиологии . Elsevier Науки о здоровье. ISBN 978-1-4557-3328-6 . Архивировано из оригинала 19 марта 2023 года . Проверено 9 апреля 2017 г.
- ^ Бульон Р., Ван Кромфо С., Кармели Дж. (февраль 2003 г.). «Кишечная абсорбция кальция: молекулярные механизмы, опосредованные витамином D». Журнал клеточной биохимии . 88 (2): 332–9. дои : 10.1002/jcb.10360 . ПМИД 12520535 . S2CID 9853381 .
- ^ Jump up to: а б с Холик М.Ф. (декабрь 2004 г.). «Солнечный свет и витамин D для здоровья костей и профилактики аутоиммунных заболеваний, рака и сердечно-сосудистых заболеваний» . Американский журнал клинического питания . 80 (6 доп.): 1678S–88S. дои : 10.1093/ajcn/80.6.1678S . PMID 15585788 .
- ^ Jump up to: а б Bell TD, Demay MB, Burnett-Bowie SA (сентябрь 2010 г.). «Биология и патология контроля витамина D в костях» . Журнал клеточной биохимии . 111 (1): 7–13. дои : 10.1002/jcb.22661 . ПМК 4020510 . ПМИД 20506379 .
- ^ Уоткинс Р.Р., Лемонович Т.Л., Салата Р.А. (май 2015 г.). «Обновленная информация о связи дефицита витамина D с распространенными инфекционными заболеваниями». Канадский журнал физиологии и фармакологии . 93 (5): 363–8. дои : 10.1139/cjpp-2014-0352 . ПМИД 25741906 .
- ^ Пухач Э., Штумпф В.Е., Стаховяк Е.К., Стаховяк М.К. (февраль 1996 г.). «Витамин D увеличивает экспрессию гена тирозингидроксилазы в клетках мозгового вещества надпочечников». Исследования мозга. Молекулярные исследования мозга . 36 (1): 193–6. дои : 10.1016/0169-328X(95)00314-I . ПМИД 9011759 .
- ^ Jump up to: а б с Холик М.Ф., Бинкли, Северная Каролина, Бишофф-Феррари Х.А., Гордон К.М., Хэнли Д.А., Хини Р.П. и др. (июль 2011 г.). «Оценка, лечение и профилактика дефицита витамина D: руководство по клинической практике Общества эндокринологов» . Журнал клинической эндокринологии и метаболизма . 96 (7): 1911–30. дои : 10.1210/jc.2011-0385 . ПМИД 21646368 .
- ^ Jump up to: а б с д и ж г час Холик М.Ф. (июль 2007 г.). «Дефицит витамина D». Медицинский журнал Новой Англии . 357 (3): 266–81. дои : 10.1056/NEJMra070553 . ПМИД 17634462 . S2CID 18566028 .
- ^ Кэшман К.Д., Даулинг К.Г., Шкрабакова З., Гонсалес-Гросс М., Валтуэнья Дж., Де Хенау С. и др. (апрель 2016 г.). «Дефицит витамина D в Европе: пандемия?» . Американский журнал клинического питания . 103 (4): 1033–44. дои : 10.3945/ajcn.115.120873 . ПМЦ 5527850 . ПМИД 26864360 .
- ^ «Рахит» . Национальная служба здравоохранения . 8 марта 2012 года. Архивировано из оригинала 11 октября 2017 года . Проверено 9 июля 2012 года .
- ^ Маннс К.Ф., Шоу Н., Кили М., Спекер Б.Л., Тэчер Т.Д., Озоно К. и др. (февраль 2016 г.). «Рекомендации глобального консенсуса по профилактике и лечению пищевого рахита» . Журнал клинической эндокринологии и метаболизма . 101 (2): 394–415. дои : 10.1210/jc.2015-2175 . ПМЦ 4880117 . ПМИД 26745253 .
- ^ Эриксен Э.Ф., Глеруп Х (2002). «Дефицит витамина D и старение: последствия для общего состояния здоровья и остеопороза». Биогеронтология . 3 (1–2): 73–7. дои : 10.1023/А:1015263514765 . ПМИД 12014847 . S2CID 22112344 .
- ^ Jump up to: а б с д Браун Дж. Э., Айзекс Дж., Кринк Б., Лехтенберг Э., Мерто М. (28 июня 2013 г.). Питание на протяжении жизненного цикла . Cengage Обучение. ISBN 978-1-285-82025-5 . Архивировано из оригинала 19 марта 2023 года . Проверено 9 апреля 2017 г.
- ^ Шенмейкерс I, Голдберг Г.Р., Прентис А. (июнь 2008 г.). «Изобилие солнечного света и дефицит витамина D» . Британский журнал питания . 99 (6): 1171–3. дои : 10.1017/S0007114508898662 . ПМЦ 2758994 . ПМИД 18234141 .
- ^ Лоу, Н.М., Бходжани I (июнь 2017 г.). «Особые соображения относительно витамина D у южноазиатского населения Великобритании» . Терапевтические достижения в области заболеваний опорно-двигательного аппарата . 9 (6): 137–44. дои : 10.1177/1759720X17704430 . ПМК 5466148 . ПМИД 28620422 .
- ^ О'Коннор М.Ю., Торесон С.К., Рэмси Н.Л., Рикс М., Самнер А.Е. (2013). «Неопределенное значение низкого уровня витамина D у населения африканского происхождения: обзор литературы по костям и кардиометаболизму» . Прогресс в сердечно-сосудистых заболеваниях . 56 (3): 261–9. дои : 10.1016/j.pcad.2013.10.015 . ПМК 3894250 . ПМИД 24267433 .
- ^ Jump up to: а б Фридман Б.И., Регистр TC (июнь 2012 г.). «Влияние расы и генетики на метаболизм витамина D, здоровье костей и сосудов» . Обзоры природы. Нефрология . 8 (8): 459–66. дои : 10.1038/nrneph.2012.112 . ПМЦ 10032380 . ПМИД 22688752 . S2CID 29026212 .
- ^ Халид А.Т., Мур К.Г., Холл С., Олабопо Ф., Розарио Н.Л., Холик М.Ф. и др. (сентябрь 2017 г.). «Полезность определения типа кожи, реагирующей на солнце, и индекса меланина для выявления дефицита витамина D» . Педиатрические исследования . 82 (3): 444–51. дои : 10.1038/пр.2017.114 . ПМК 5570640 . ПМИД 28467404 .
- ^ Jump up to: а б с Бен-Элтрики М., Гейл Э.Дж., Парас Дж.М., Ньяме-Аддо Л., Чабра М., Деб С. (апрель 2024 г.). «Витамин D при меланоме: потенциальная роль ферментов цитохрома P450» . Жизнь . 14 (4): 510. Бибкод : 2024Life...14..510B . дои : 10.3390/life14040510 . ПМК 11050855 . ПМИД 38672780 .
 В эту статью включен текст из этого источника, доступного по лицензии CC BY 4.0 .
В эту статью включен текст из этого источника, доступного по лицензии CC BY 4.0 . - ^ Jump up to: а б Вагнер К.Л., Грир Ф.Р. (ноябрь 2008 г.). «Профилактика рахита и дефицита витамина D у новорожденных, детей и подростков». Педиатрия . 122 (5): 1142–52. дои : 10.1542/пед.2008-1862 . ПМИД 18977996 . S2CID 342161 .
- ^ Лерх С., Мейснер Т. (октябрь 2007 г.). Лерх С. (ред.). «Мероприятия по профилактике алиментарного рахита у доношенных детей» . Кокрановская база данных систематических обзоров . 2010 (4): CD006164. дои : 10.1002/14651858.CD006164.pub2 . ПМЦ 8990776 . ПМИД 17943890 .
- ^ Заргар А.Х., Митал А., Вани А.И., Лавей Б.А., Масуди С.Р., Башир М.И. и др. (июнь 2000 г.). «Рахит с псевдовитамином D — отчет с Индийского субконтинента» . Последипломный медицинский журнал . 76 (896): 369–72. дои : 10.1136/pmj.76.896.369 . ПМК 1741602 . ПМИД 10824056 .
- ^ Элидрисси АТ (сентябрь 2016 г.). «Возвращение врожденного рахита: упускаем ли мы оккультные случаи?». Calcified Tissue International (обзор). 99 (3): 227–36. дои : 10.1007/s00223-016-0146-2 . ПМИД 27245342 . S2CID 14727399 .
- ^ Патерсон Ч.Р., Аюб Д. (октябрь 2015 г.). «Врожденный рахит из-за дефицита витамина D у матерей». Клиническое питание (обзор). 34 (5): 793–8. дои : 10.1016/j.clnu.2014.12.006 . ПМИД 25552383 .
- ^ Орамасионву Дж.Э., Тэчер Т.Д., Пэм С.Д., Петтифор Дж.М., Абрамс С.А. (август 2008 г.). «Адаптация абсорбции кальция при лечении алиментарного рахита у нигерийских детей» (PDF) . Британский журнал питания . 100 (2): 387–92. дои : 10.1017/S0007114507901233 . ПМИД 18197991 . S2CID 15406992 .
- ^ Фишер П.Р., Рахман А., Симма Дж.П., Кьяу-Мьинт Т.О., Кабир А.Р., Талукдер К. и др. (октябрь 1999 г.). «Пищевой рахит без дефицита витамина D в Бангладеш» . Журнал тропической педиатрии . 45 (5): 291–3. дои : 10.1093/тропей/45.5.291 . ПМИД 10584471 .
- ^ Jump up to: а б Данниган М.Г., Хендерсон Дж.Б. (ноябрь 1997 г.). «Эпидемиологическая модель приватного рахита и остеомаляции» . Труды Общества питания . 56 (3): 939–56. дои : 10.1079/PNS19970100 . ПМИД 9483661 .
- ^ Робертсон И., Форд Дж.А., Макинтош В.Б., Данниган М.Г. (январь 1981 г.). «Роль зерновых в этиологии пищевого рахита: урок Ирландского национального исследования питания 1943-8» . Британский журнал питания . 45 (1): 17–22. дои : 10.1079/BJN19810073 . ПМИД 6970590 .
- ^ Клементс М.Р. (1989). «Проблема рахита у азиатов Великобритании». Журнал человеческого питания и диетологии . 2 (2): 105–16. дои : 10.1111/j.1365-277X.1989.tb00015.x .
- ^ Jump up to: а б Петтифор Дж. М. (декабрь 2004 г.). «Пищевой рахит: дефицит витамина D, кальция или того и другого?» . Американский журнал клинического питания . 80 (6 Доп.): 1725С–9С. дои : 10.1093/ajcn/80.6.1725S . ПМИД 15585795 .
- ^ Jump up to: а б Данниган М.Г., Хендерсон Дж.Б., Хоул DJ, Барбара Мавер Э., Берри Дж.Л. (декабрь 2005 г.). «Потребление мяса снижает риск пищевого рахита и остеомаляции» . Британский журнал питания . 94 (6): 983–91. дои : 10.1079/BJN20051558 . ПМИД 16351777 .
- ^ Вейк М.Т. (ноябрь 1967 г.). «История рахита в США» . Американский журнал клинического питания . 20 (11): 1234–41. дои : 10.1093/ajcn/20.11.1234 . ПМИД 4862158 .
- ^ Гаррисон Р.Х., Сомер Э. (1997). Справочник по питанию . МакГроу-Хилл. ISBN 978-0-87983-826-3 . Архивировано из оригинала 19 марта 2023 года . Проверено 9 апреля 2017 г.
- ^ Дюпюи EM (1 февраля 2002 г.). Идеальная пища природы: как молоко стало напитком Америки . Нью-Йорк Пресс. ISBN 978-0-8147-1938-1 . Архивировано из оригинала 19 марта 2023 года . Проверено 9 апреля 2017 г.
- ^ Тигарден Д., Лайл Р.М., Пру В.Р., Джонстон К.С., Уивер К.М. (май 1999 г.). «Предыдущее употребление молока связано с большей плотностью костей у молодых женщин» . Американский журнал клинического питания . 69 (5): 1014–7. дои : 10.1093/ajcn/69.5.1014 . ПМИД 10232644 .
- ^ Холик М.Ф. (март 2006 г.). «Высокая распространенность недостаточности витамина D и последствия для здоровья» . Труды клиники Мэйо . 81 (3): 353–73. дои : 10.4065/81.3.353 . ПМИД 16529140 .
- ^ Штраубе С., Эндрю Мур Р., Дерри С., Маккуэй Х.Дж. (январь 2009 г.). «Витамин D и хроническая боль». Боль . 141 (1–2): 10–3. дои : 10.1016/j.pain.2008.11.010 . ПМИД 19084336 . S2CID 17244398 .
- ^ Гайквад М., Ванлинт С., Миттинити М., Мозли Г.Л., Стокс Н. (май 2017 г.). «Облегчает ли прием витамина D хроническую неспецифическую скелетно-мышечную боль? Систематический обзор и метаанализ» . Клиническая ревматология . 36 (5): 1201–08. дои : 10.1007/s10067-016-3205-1 . ПМИД 26861032 . S2CID 30189971 .
- ^ Чунг М., Балк Э.М., Брендель М., Ип С., Лау Дж., Ли Дж. и др. (август 2009 г.). «Витамин D и кальций: систематический обзор последствий для здоровья» . Отчет о доказательствах/оценка технологий (183): 1–420. ПМЦ 4781105 . ПМИД 20629479 .
- ^ Теодорату Э., Цулаки И., Згага Л., Иоаннидис Дж. П. (апрель 2014 г.). «Витамин D и многочисленные последствия для здоровья: общий обзор систематических обзоров и метаанализ наблюдательных исследований и рандомизированных исследований» . БМЖ . 348 :g2035. дои : 10.1136/bmj.g2035 . ПМЦ 3972415 . ПМИД 24690624 .
- ^ Jump up to: а б Отье П., Бониоль М., Пизо С., Мулли П. (январь 2014 г.). «Статус витамина D и плохое здоровье: систематический обзор». «Ланцет». Диабет и эндокринология . 2 (1): 76–89. дои : 10.1016/S2213-8587(13)70165-7 . ПМИД 24622671 .
- ^ Хусейн С., Сингх А., Ахтар М., Наджми А.К. (сентябрь 2017 г.). «Добавка витамина D для лечения остеоартрита коленного сустава: систематический обзор рандомизированных контролируемых исследований». Международная ревматология . 37 (9): 1489–98. дои : 10.1007/s00296-017-3719-0 . ПМИД 28421358 . S2CID 23994681 .
- ^ Jump up to: а б с д и ж г час я дж к Медицинский институт (2011). «8. Последствия и особые опасения» . Росс AC, Тейлор CL, Яктин А.Л., Дель Валле HB (ред.). Рекомендуемая диетическая норма кальция и витамина D. Сборник национальных академий: отчеты, финансируемые национальными институтами здравоохранения. Пресса национальных академий. дои : 10.17226/13050 . ISBN 978-0-309-16394-1 . ПМИД 21796828 . S2CID 58721779 . Архивировано из оригинала 26 января 2021 года . Проверено 17 сентября 2017 г.
- ^ Jump up to: а б Максмен А (июль 2011 г.). «Советы по питанию: лемма о витамине D» (PDF) . Природа . 475 (7354): 23–5. дои : 10.1038/475023а . ПМИД 21734684 . Архивировано (PDF) из оригинала 3 августа 2020 г. Проверено 17 ноября 2011 г.
- ^ Шотткер Б., Джорд Р., Писи А., Торанд Б., Янсен Э.Х., Грут Л. и др. (Консорциум по вопросам здоровья старения: Сеть когорт в Европе и США) (июнь 2014 г.). «Витамин D и смертность: метаанализ данных отдельных участников большого консорциума когортных исследований из Европы и США» . БМЖ . 348 (17 июня 16): g3656. дои : 10.1136/bmj.g3656 . ПМК 4061380 . ПМИД 24938302 .
- ^ Туохимаа П. (март 2009 г.). «Витамин D и старение». Журнал биохимии стероидов и молекулярной биологии . 114 (1–2): 78–84. дои : 10.1016/j.jsbmb.2008.12.020 . ПМИД 19444937 . S2CID 40625040 .
- ^ Туохимаа П., Кейсала Т., Минасян А., Качат Дж., Калуефф А. (декабрь 2009 г.). «Витамин D, нервная система и старение». Психонейроэндокринология . 34 (Приложение 1): С278–86. doi : 10.1016/j.psyneuen.2009.07.003 . ПМИД 19660871 . S2CID 17462970 .
- ^ Маня Х., Акасака-Маня К., Эндо Т. (июль 2010 г.). «Дефицит белка клото и старение» . Международная гериатрия и геронтология . 10 (Приложение 1): С80-7. дои : 10.1111/j.1447-0594.2010.00596.x . ПМИД 20590845 . S2CID 36692930 .
- ^ Авенелл А., Мак Дж.К., О'Коннелл Д. (апрель 2014 г.). «Витамин D и аналоги витамина D для профилактики переломов у женщин в постменопаузе и пожилых мужчин» . Кокрановская база данных систематических обзоров . 4 (4): CD000227. дои : 10.1002/14651858.CD000227.pub4 . ПМК 7032685 . ПМИД 24729336 .
- ^ Бишофф-Феррари Х.А., Уиллетт В.К., Орав Э.Дж., Орай Э.Дж., Липс П., Менье П.Дж. и др. (июль 2012 г.). «Объединенный анализ требований к дозе витамина D для профилактики переломов» (PDF) . Медицинский журнал Новой Англии . 367 (1): 40–9. дои : 10.1056/NEJMoa1109617 . hdl : 1871/48765 . ПМИД 22762317 . S2CID 24338997 . Архивировано (PDF) из оригинала 15 декабря 2020 г. Проверено 17 июля 2019 г.
- ^ Чунг М., Ли Дж., Терасава Т., Лау Дж., Трикалинос Т.А. (декабрь 2011 г.). «Витамин D с добавками кальция или без них для профилактики рака и переломов: обновленный метаанализ для Целевой группы профилактических служб США». Анналы внутренней медицины . 155 (12): 827–38. дои : 10.7326/0003-4819-155-12-201112200-00005 . ПМИД 22184690 . S2CID 22380502 .
- ^ Чжао Дж.Г., Цзэн XT, Ван Дж., Лю Л. (декабрь 2017 г.). «Связь между приемом добавок кальция или витамина D и частотой переломов у пожилых людей, проживающих в общественных местах: систематический обзор и метаанализ» . ДЖАМА . 318 (24): 2466–2482. дои : 10.1001/jama.2017.19344 . ПМК 5820727 . ПМИД 29279934 .
- ^ Крэнни А., Хорсли Т., О'Доннелл С., Вейлер Х., Пуил Л., Оой Д. и др. (август 2007 г.). «Эффективность и безопасность витамина D для здоровья костей» . Доказательный отчет/оценка технологии (158): 1–235. ПМЦ 4781354 . ПМИД 18088161 .
- ^ Болланд М.Дж., Грей А., Гэмбл Г.Д., Рид И.Р. (июль 2014 г.). «Прием витамина D и падения: пробный последовательный метаанализ». «Ланцет». Диабет и эндокринология . 2 (7): 573–80. дои : 10.1016/S2213-8587(14)70068-3 . ПМИД 24768505 .
- ^ Шулер Ф.Д., Вингейт М.К., Мур Г.Х., Джангарра К. (ноябрь 2012 г.). «Польза витамина D для здоровья в спорте» . Спортивное здоровье . 4 (6): 496–501. дои : 10.1177/1941738112461621 . ПМК 3497950 . ПМИД 24179588 .
- ^ Чибузор М.Т., Грэм-Калио Д., Осаджи Д.О., Меремикву М.М. и др. (Кокрейновская группа по метаболическим и эндокринным расстройствам) (апрель 2020 г.). «Витамин D, кальций или комбинация витамина D и кальция для лечения пищевого рахита у детей» . Кокрановская база данных систематических обзоров . 2020 (4): CD012581. дои : 10.1002/14651858.CD012581.pub2 . ПМК 7164979 . ПМИД 32303107 .
- ^ Jump up to: а б «Изменения на этикетке с информацией о пищевой ценности» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 27 мая 2016 г. Архивировано из оригинала 6 мая 2018 г. . Проверено 16 мая 2020 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Чжао Ю, Чен С, Пан В, Гао М, Хэ В, Мао Р и др. (май 2016 г.). «Сравнительная эффективность статуса витамина D в снижении риска рака мочевого пузыря: систематический обзор и сетевой метаанализ». Питание . 32 (5): 515–523. дои : 10.1016/j.nut.2015.10.023 . ПМИД 26822497 .
- ^ Jump up to: а б Эрнандес-Алонсо П., Буганем Х., Канудас С., Бесерра-Томас Н., Фернандес де ла Пуэнте М., Бабио Н. и др. (июль 2021 г.). «Уровни циркулирующего витамина D и риск колоректального рака: метаанализ и систематический обзор исследований «случай-контроль» и проспективных когортных исследований». Критические обзоры в области пищевой науки и питания . 63 (1): 1–17. дои : 10.1080/10408398.2021.1939649 . hdl : 10609/136992 . ПМИД 34224246 . S2CID 235746547 .
- ^ Jump up to: а б Слейтер Дж.Д., Мэнсон Дж.Э., Скрэгг Р. (январь 2021 г.). «Витамин D и клинические последствия рака: обзор метаанализа» . JBMR Плюс . 5 (1): е10420. дои : 10.1002/jbm4.10420 . ПМЦ 7839823 . ПМИД 33553987 .
- ^ Серафин Дж., Ригер С., Хьюисон М., Капобьянко Э., Лиссе Т.С. (июль 2023 г.). «Влияние витамина D на рак: мини-обзор» . J Стероид Биохим Мол Биол . 231 : 106308. дои : 10.1016/j.jsbmb.2023.106308 . ПМЦ 10330295 . ПМИД 37054849 .
- ^ Кеум Н., Ли Д.Х., Гринвуд, округ Колумбия, Мэнсон Дж.Э., Джованнуччи Э. (май 2019 г.). «Добавка витамина D и общая заболеваемость и смертность от рака: метаанализ рандомизированных контролируемых исследований» . Анналы онкологии . 30 (5): 733–743. дои : 10.1093/annonc/mdz059 . ПМК 6821324 . ПМИД 30796437 .
- ^ Барбарави М., Хейри Б., Заид Ю., Барбарави О., Диллон Х., Суэйд Б. и др. (август 2019 г.). «Добавка витамина D и риск сердечно-сосудистых заболеваний у более чем 83 000 человек в 21 рандомизированном клиническом исследовании: метаанализ» . JAMA Кардиология . 4 (8): 765–76. дои : 10.1001/jamacardio.2019.1870 . ПМК 6584896 . ПМИД 31215980 .
- ^ Нуди М., Краковски Г., Гахрамани М., Рузие М., Фой А.Дж. (2020). «Добавка витамина D, сердечные заболевания и инсульт: систематический обзор и мета-регрессионный анализ» . Int J Cardiol Heart Vasc . 28 : 100537. doi : 10.1016/j.ijcha.2020.100537 . ПМК 7240168 . ПМИД 32462077 .
- ^ Беверидж Л.А., Струтерс А.Д., Хан Ф., Джорд Р., Скрэгг Р., Макдональд Х.М. и др. (май 2015 г.). «Влияние добавок витамина D на артериальное давление: систематический обзор и метаанализ с учетом индивидуальных данных пациентов» . JAMA Внутренняя медицина . 175 (5): 745–54. doi : 10.1001/jamainternmed.2015.0237 . ПМК 5966296 . ПМИД 25775274 .
- ^ Чжан Д., Ченг С., Ван Ю., Сунь Х., Ю С., Сюэ Ю. и др. (2020). «Влияние витамина D на артериальное давление и гипертонию у населения в целом: обновленный метаанализ когортных исследований и рандомизированных контролируемых исследований» . Предыдущий Хронический Дис . 17 : Е03. дои : 10.5888/pcd17.190307 . ПМЦ 6977781 . ПМИД 31922371 .
- ^ Аббуд М., Аль Анути Ф., Папандреу Д. (2021). «Статус витамина D и артериальное давление у детей и подростков: систематический обзор наблюдательных исследований» . Систематические обзоры . 10 (1): 60. дои : 10.1186/s13643-021-01584-x . ПМЦ 7898425 . ПМИД 33618764 .
- ^ Хьюисон М (2011). «Витамин D и врожденный и адаптивный иммунитет». Витамины и иммунная система . Витамины и гормоны. Том. 86. Академическая пресса. стр. 23–62. дои : 10.1016/B978-0-12-386960-9.00002-2 . ISBN 978-0-12-386960-9 . ПМИД 21419266 .
- ^ Епископ Э., Исмаилова А., Димело С.К., Хьюисон М., Уайт Дж.Х. (август 2020 г.). «Витамин D и иммунная регуляция: антибактериальное, противовирусное, противовоспалительное действие» . JBMR Плюс . 5 (1): е10405. дои : 10.1002/jbm4.10405 . ПМЦ 7461279 . ПМИД 32904944 .
- ^ Нноахам К.Е., Кларк А. (февраль 2008 г.). «Низкий уровень витамина D в сыворотке и туберкулез: систематический обзор и метаанализ». Международный журнал эпидемиологии . 37 (1): 113–9. CiteSeerX 10.1.1.513.3969 . дои : 10.1093/ije/dym247 . ПМИД 18245055 .
- ^ Луонг К., Нгуен Л.Т. (июнь 2011 г.). «Влияние витамина D при лечении туберкулеза». Американский журнал медицинских наук . 341 (6): 493–8. дои : 10.1097/MAJ.0b013e3182070f47 . ПМИД 21289501 . S2CID 18802134 .
- ^ Jump up to: а б «Экспресс-обзор SACN: витамин D и острые инфекции дыхательных путей» . Общественное здравоохранение Англии . Архивировано из оригинала 14 января 2021 года . Проверено 6 января 2021 г.
- ^ Джоллифф Д.А., Гринберг Л., Хупер Р.Л., Матиссен С., Рафик Р., де Йонг Р.Т. и др. (апрель 2019 г.). «Витамин D для предотвращения обострений ХОБЛ: систематический обзор и метаанализ данных отдельных участников рандомизированных контролируемых исследований» . Торакс . 74 (4): 337–345. doi : 10.1136/thoraxjnl-2018-212092 . ПМИД 30630893 . S2CID 58548871 .
- ^ Уильямсон А., Мартино А.Р., Шейх А., Джоллифф Д., Гриффитс С.Дж. (февраль 2023 г.). «Витамин D для лечения астмы» . Cochrane Database Syst Rev. 2023 (2): CD011511. дои : 10.1002/14651858.CD011511.pub3 . ПМЦ 9899558 . ПМИД 36744416 .
- ^ Дель Пинто Р., Пьетропаоли Д., Чандар А.К., Ферри С., Коминелли Ф. (ноябрь 2015 г.). «Связь между воспалительным заболеванием кишечника и дефицитом витамина D: систематический обзор и метаанализ» . Воспалительные заболевания кишечника . 21 (11): 2708–2717. doi : 10.1097/MIB.0000000000000546 . ПМЦ 4615394 . ПМИД 26348447 .
- ^ Jump up to: а б с д и Уоллес С., Гордон М., Синопулу В., Лимкеткай Б.Н. и др. (Кокрейновская группа Gut) (октябрь 2023 г.). «Витамин D для лечения воспалительных заболеваний кишечника». Кокрановская база данных систематических обзоров . 2023 (10): CD011806. дои : 10.1002/14651858.CD011806.pub2 . ПМЦ 10542962. ПМИД 37781953 .
- ^ Гузман-Прадо Ю., Самсон О., Сигал Дж.П., Лимди Дж.К., Хайи Б. (май 2020 г.). «Терапия витамином D у взрослых с воспалительными заболеваниями кишечника: систематический обзор и метаанализ». Воспалительные заболевания кишечника . 26 (12): 1819–1830. дои : 10.1093/ibd/izaa087 . PMID 32385487 .
- ^ Чжан Ю, Тан Х, Тан Дж, Ли Дж, Чонг В, Хай Ю и др. (июль 2020 г.). «Влияние добавок витамина D на профилактику диабета 2 типа у пациентов с преддиабетом: систематический обзор и метаанализ» . Уход при диабете . 43 (7): 1650–58. дои : 10.2337/dc19-1708 . ПМИД 33534730 . S2CID 219897727 .
- ^ Сахеби Р., Резаи М., Эмадзаде М., Салехи М., Тайефи М., Паризаде С.М. и др. (февраль 2019 г.). «Влияние добавок витамина D на показатели гликемического контроля у иранских диабетиков: систематический обзор и метаанализ». Дополнительные методы лечения в клинической практике . 34 : 294–304. дои : 10.1016/j.ctcp.2018.12.009 . ПМИД 30712741 . S2CID 57479957 .
- ^ Мохаммади С., Хаджашеми З., Саней П. (июнь 2021 г.). «Уровни витамина D в сыворотке в связи с диабетом 2 типа и предиабетом у взрослых: систематический обзор и метаанализ зависимости эпидемиологических исследований от дозы». Критические обзоры в области пищевой науки и питания . 2 (29): 8178–8198. дои : 10.1080/10408398.2021.1926220 . ПМИД 34076544 . S2CID 235295924 .
- ^ Брофи С., Дэвис Х., Маннан С., Брант Х., Уильямс Р. (сентябрь 2011 г.). «Вмешательства при латентном аутоиммунном диабете (ЛАДА) у взрослых» . Кокрановская база данных систематических обзоров . 2011 (9): CD006165. дои : 10.1002/14651858.cd006165.pub3 . ПМК 6486159 . ПМИД 21901702 .
- ^ Хошбахт Ю., Бидаки Р., Салехи-Абаргуэй А. (январь 2018 г.). «Статус витамина D и синдром дефицита внимания с гиперактивностью: систематический обзор и метаанализ наблюдательных исследований» . Достижения в области питания . 9 (1): 9–20. doi : 10.1093/advances/nmx002 . ПМК 6333940 . ПМИД 29438455 .
- ^ Ган Дж., Галер П., Ма Д., Чен С., Сюн Т. (ноябрь 2019 г.). «Влияние добавок витамина D на синдром дефицита внимания/гиперактивности: систематический обзор и метаанализ рандомизированных контролируемых исследований». Журнал детской и подростковой психофармакологии . 29 (9): 670–87. дои : 10.1089/кап.2019.0059 . PMID 31368773 . S2CID 199054851 .
- ^ Шаффер Дж.А., Эдмондсон Д., Уоссон Л.Т., Фальзон Л., Хомма К., Эзеоколи Н. и др. (апрель 2014 г.). «Добавка витамина D при симптомах депрессии: систематический обзор и метаанализ рандомизированных контролируемых исследований» . Психосоматическая медицина . 76 (3): 190–6. doi : 10.1097/psy.0000000000000044 . ПМК 4008710 . ПМИД 24632894 .
- ^ Балион С., Гриффит Л.Е., Стрифлер Л., Хендерсон М., Паттерсон С., Хекман Г. и др. (сентябрь 2012 г.). «Витамин D, когнитивные функции и деменция: систематический обзор и метаанализ» . Неврология . 79 (13): 1397–405. дои : 10.1212/WNL.0b013e31826c197f . ПМЦ 3448747 . ПМИД 23008220 .
- ^ Юксель Р.Н., Алтунсой Н., Тикир Б., Чинги Кюлюк М., Унал К., Гока С. и др. (декабрь 2014 г.). «Корреляция между общими уровнями витамина D и психотической психопатологией у пациентов с шизофренией: терапевтические последствия дополнительного увеличения витамина D» . Терапевтические достижения в психофармакологии . 4 (6): 268–75. дои : 10.1177/2045125314553612 . ПМК 4257987 . ПМИД 25489478 .
- ^ Jump up to: а б Агаджафари Ф, Нагулесапиллай Т, Ронксли П.Е., Tough SC, О'Бейрн М., Раби Д.М. (март 2013 г.). «Связь между уровнем 25-гидроксивитамина D в сыворотке крови матери и исходами беременности и новорожденности: систематический обзор и метаанализ наблюдательных исследований» . БМЖ . 346 : ф1169. дои : 10.1136/bmj.f1169 . ПМИД 23533188 .
- ^ Jump up to: а б Паласиос С., Де-Регил Л.М., Ломбардо Л.К., Пенья-Росас Ж.П. (ноябрь 2016 г.). «Добавка витамина D во время беременности: обновленный метаанализ материнских исходов» . Журнал биохимии стероидов и молекулярной биологии . 164 : 148–55. дои : 10.1016/j.jsbmb.2016.02.008 . ПМЦ 5357731 . ПМИД 26877200 .
- ^ Рот Д.Э., Люнг М., Месфин Э., Камар Х., Уоттерворт Дж., Папп Э. (ноябрь 2017 г.). «Добавка витамина D во время беременности: состояние доказательств систематического обзора рандомизированных исследований» . БМЖ . 359 : j5237. дои : 10.1136/bmj.j5237 . ПМК 5706533 . ПМИД 29187358 .
- ^ Jump up to: а б Паласиос С., Костюк Л.К., Пенья-Росас Ж.П. (июль 2019 г.). «Добавка витамина D женщинам во время беременности» . Кокрановская база данных систематических обзоров . 2019 (7): CD008873. дои : 10.1002/14651858.CD008873.pub4 . ПМЦ 3747784 . ПМИД 31348529 .
- ^ Jump up to: а б Вагнер К.Л., Тейлор С.Н., Даводу А., Джонсон Д.Д., Холлис Б.В. (март 2012 г.). «Витамин D и его роль во время беременности в достижении оптимального здоровья матери и плода» . Питательные вещества . 4 (3): 208–30. дои : 10.3390/nu4030208 . ПМК 3347028 . ПМИД 22666547 .
- ^ Би В.Г., Нуйт А.М., Вейлер Х., Ледюк Л., Сантамария К., Вэй С.К. (июль 2018 г.). «Связь между приемом добавок витамина D во время беременности и ростом, заболеваемостью и смертностью потомства: систематический обзор и метаанализ» . JAMA Педиатрия . 172 (7): 635–45. doi : 10.1001/jamapediatrics.2018.0302 . ПМК 6137512 . ПМИД 29813153 .
- ^ Патхак К., Соарес М.Дж., Калтон Э.К., Чжао Ю., Халлетт Дж. (июнь 2014 г.). «Добавка витамина D и состояние массы тела: систематический обзор и метаанализ рандомизированных контролируемых исследований». Обзоры ожирения . 15 (6): 528–37. дои : 10.1111/обр.12162 . ПМИД 24528624 . S2CID 8660739 .
- ^ Маллард С.Р., Хоу А.С., Хоутон, Лос-Анджелес (октябрь 2016 г.). «Статус витамина D и потеря веса: систематический обзор и метаанализ рандомизированных и нерандомизированных контролируемых исследований по снижению веса» . Американский журнал клинического питания . 104 (4): 1151–1159. дои : 10.3945/ajcn.116.136879 . ПМИД 27604772 .
- ^ Jump up to: а б с Группа Европейского агентства по безопасности пищевых продуктов (EFSA) по диетическим продуктам, питанию и аллергии (NDA) (2010). «Научное заключение об обосновании утверждений о пользе для здоровья, связанных с витамином D и нормальной функцией иммунной системы и воспалительной реакцией (ID 154, 159), поддержанием нормальной функции мышц (ID 155) и поддержанием нормальной сердечно-сосудистой функции (ID 159) в соответствии с согласно Статье 13(1) Регламента (ЕС) № 1924/2006». Журнал EFSA . 8 (2): 1468–85. дои : 10.2903/j.efsa.2010.1468 .
- ^ Группа Европейского агентства по безопасности пищевых продуктов (EFSA) по диетическим продуктам, питанию и аллергии (NDA) (2011). «Научное заключение об обосновании заявления о вреде для здоровья, связанного с витамином D и риском падения в соответствии со статьей 14 Регламента (ЕС) № 1924/2006» (PDF) . Журнал EFSA . 9 (9): 2382–2400. дои : 10.2903/j.efsa.2011.2382 . Архивировано (PDF) из оригинала 20 августа 2019 г. Проверено 20 августа 2019 г.
- ^ «Руководство для промышленности: Руководство по маркировке пищевых продуктов» . Управление по контролю за продуктами и лекарствами (FDA). Январь 2013. Архивировано из оригинала 22 декабря 2020 года . Проверено 17 июля 2019 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Научное резюме Министерства здравоохранения Канады по заявлениям США о вреде кальция и остеопороза» . Управление пищевых продуктов Бюро диетологии, отдел товаров для здоровья и пищевых продуктов Министерства здравоохранения Канады. 1 мая 2000 года. Архивировано из оригинала 3 декабря 2016 года . Проверено 29 января 2012 г.
- ^ «Система регулирования претензий на медицинское обслуживание в Японии» (PDF) . Японское агентство по делам потребителей, отдел маркировки пищевых продуктов. 1 июня 2011 г. Архивировано из оригинала (PDF) 6 марта 2012 г. . Проверено 29 января 2012 г.
- ^ Jump up to: а б с д и Справочные значения питательных веществ для Австралии и Новой Зеландии, включая рекомендуемые нормы потребления продуктов питания . Канберра: Национальный совет по здравоохранению и медицинским исследованиям. 2006. ISBN 1-86496-243-7 . Архивировано из оригинала 3 марта 2023 года . Проверено 19 марта 2023 г.
- ^ Jump up to: а б с д «Витамины и минералы – Витамин D» . Национальная служба здравоохранения . 3 августа 2020 года. Архивировано из оригинала 30 октября 2017 года . Проверено 15 ноября 2020 г.
- ^ Jump up to: а б с д «Витамин D и кальций: обновленные рекомендуемые нормы потребления» . Питание и здоровое питание . Здоровье Канады. 5 декабря 2008 г. Архивировано из оригинала 14 июня 2017 г. Проверено 28 апреля 2018 г.
- ^ Jump up to: а б с д Группа экспертов EFSA по диетическим продуктам, питанию и аллергии (NDA) (29 июня 2016 г.). «Диетические нормативы витамина D» . Журнал EFSA . 14 (10): e04547. дои : 10.2903/j.efsa.2016.4547 . hdl : 11380/1228918 .
- ^ Jump up to: а б Группа EFSA по диетическим продуктам, питанию и аллергии (NDA) (2012). «Научное мнение о допустимом верхнем уровне потребления витамина D» . Журнал EFSA (представлена рукопись). 10 (7): 2813. doi : 10.2903/j.efsa.2012.2813 . HDL : 2434/257871 .
- ^ «Офис БАД – Витамин D» . Управление пищевых добавок Национального института здравоохранения . Архивировано из оригинала 23 июля 2020 года . Проверено 14 апреля 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «PHE публикует новые рекомендации по витамину D» . Общественное здравоохранение Англии. 21 июля 2016 г. Архивировано из оригинала 3 января 2021 г. Проверено 15 ноября 2020 г.
- ^ «Витамин Д» . Источник питания . 18 сентября 2012 г. Архивировано из оригинала 13 апреля 2022 г. . Проверено 14 апреля 2022 г.
- ^ «Федеральный реестр, 27 мая 2016 г. Маркировка пищевых продуктов: пересмотренная версия этикеток с информацией о пищевой ценности и пищевых добавках. Страница FR 33982» (PDF) . Архивировано (PDF) из оригинала 8 августа 2016 года . Проверено 20 августа 2019 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Справочник по дневной норме базы данных этикеток пищевых добавок (DSLD)» . База данных этикеток пищевых добавок (DSLD) . Архивировано из оригинала 7 апреля 2020 года . Проверено 16 мая 2020 г.
- ^ «Отраслевые ресурсы об изменениях на этикетке с указанием пищевой ценности» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 21 декабря 2018 г. Архивировано из оригинала 25 декабря 2020 г. Проверено 16 мая 2020 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Саллех А (12 июня 2012 г.). «Обогащение продуктов питания витамином D на столе» . Австралийская радиовещательная корпорация. Архивировано из оригинала 22 декабря 2020 года . Проверено 12 июня 2012 г.
- ^ «Австралийское медицинское обследование: биомедицинские результаты по питательным веществам, 2011–2012 годы» . Австралийское статистическое бюро . 21 декабря 2011 г. Архивировано из оригинала 10 марта 2023 г. . Проверено 19 марта 2023 г.
- ^ «Витамин D (перевод)» (на шведском языке). Шведское национальное продовольственное агентство . Архивировано из оригинала 26 октября 2020 года . Проверено 19 октября 2018 г.
- ^ Потребность в витамине D при отсутствии эндогенного синтеза Немецкое общество питания, январь 2012 г.
- ^ Перес-Лопес Ф.Р., Бринкат М., Эрел К.Т., Тремольер Ф., Гамбаччиани М., Ламбриноудаки И. и др. (январь 2012 г.). «Заявление о позиции EMAS: Витамин D и здоровье в постменопаузе» . Зрелость . 71 (1): 83–8. дои : 10.1016/j.maturitas.2011.11.002 . ПМИД 22100145 .
- ^ Постоянный комитет Института медицины (США) по научной оценке эталонного рациона питания (1997). DRI, Нормы потребления с пищей: кальций, фосфор, магний, витамин D и фторид . Вашингтон, округ Колумбия: Издательство Национальной академии. п. 250. дои : 10.17226/5776 . ISBN 978-0-309-06350-0 . ПМИД 23115811 . Архивировано из оригинала 2 апреля 2015 года . Проверено 11 апреля 2010 г.
- ^ «Поиск стандартной эталонной версии 27 в Национальной базе данных по питательным веществам» . Министерство сельского хозяйства США, Служба сельскохозяйственных исследований. 2014. Архивировано из оригинала 19 апреля 2014 года . Проверено 12 июня 2015 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Jump up to: а б Ван Т., Бенгтссон Г., Кернефельт И., Бьёрн Л.О. (сентябрь 2001 г.). «Провитамины и витамины D 2 и D 3 у видов Cladina в широтном градиенте: возможная корреляция с уровнями УФ-излучения» . Журнал фотохимии и фотобиологии B: Биология . 62 (1–2): 118–22. дои : 10.1016/S1011-1344(01)00160-9 . ПМИД 11693362 . Архивировано из оригинала 28 мая 2020 года . Проверено 31 октября 2018 г.
- ^ Шмид А., Вальтер Б (июль 2013 г.). «Содержание природного витамина D в продуктах животного происхождения» . Достижения в области питания . 4 (4): 453–62. дои : 10.3945/ан.113.003780 . ПМЦ 3941824 . ПМИД 23858093 .
- ^ Jump up to: а б с д и ж г Киган Р.Дж., Лу З., Богуш Дж.М., Уильямс Дж.Э., Холик М.Ф. (январь 2013 г.). «Фотобиология витамина D в грибах и его биодоступность у человека» . Дерматоэндокринология . 5 (1): 165–76. дои : 10.4161/derm.23321 . ПМЦ 3897585 . ПМИД 24494050 .
- ^ Хайтовиц Д.Б. (2009). «Витамин D в грибах» (PDF) . Лаборатория данных о питательных веществах, Министерство сельского хозяйства США. Архивировано (PDF) из оригинала 1 февраля 2021 года . Проверено 16 апреля 2018 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ де Лурдес Саманиего-Ваескен М, Алонсо-Аперте Э, Варела-Морейрас Г (2012). «Обогащение продуктов питания витаминами сегодня» . Исследования продуктов питания и питания . 56 : 5459. дои : 10.3402/fnr.v56i0.5459 . ПМК 3319130 . ПМИД 22481896 .
- ^ Спиро А., Баттрисс Дж.Л. (декабрь 2014 г.). «Витамин D: обзор статуса и потребления витамина D в Европе» . Бюллетень по питанию . 39 (4): 322–350. дои : 10.1111/nbu.12108 . ПМК 4288313 . ПМИД 25635171 .
- ^ «Витамин D в молоке и его заменители» . Управление по контролю за продуктами и лекарствами (FDA). 15 июля 2016 г. Архивировано из оригинала 22 декабря 2020 г. . Проверено 22 февраля 2017 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Федеральный реестр: Пищевые добавки, разрешенные для прямого добавления в пищу для потребления человеком; Витамин D2» . Управление по контролю за продуктами и лекарствами, Министерство здравоохранения и социальных служб США. 18 июля 2016 года. Архивировано из оригинала 22 декабря 2020 года . Проверено 22 февраля 2017 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «§172.379 Витамин D2» . Электронный свод федеральных правил. Архивировано из оригинала 22 декабря 2020 года . Проверено 16 июля 2019 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «§172.380 Витамин D3» . Электронный свод федеральных правил. Архивировано из оригинала 22 декабря 2020 года . Проверено 16 июля 2019 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Альтернатива молочному молоку» . особланко . 16 января 2020 года. Архивировано из оригинала 22 декабря 2020 года . Проверено 20 января 2020 г.
- ^ Трипкович Л (2013). «Витамин D2 против витамина D3 : они одно и то же?». Бюллетень по питанию . 38 (2): 243–248. дои : 10.1111/nbu.12029 .
- ^ Альшахрани Ф, Альджохани Н (сентябрь 2013 г.). «Витамин D: дефицит, достаточность и токсичность» . Питательные вещества . 5 (9): 3605–16. дои : 10.3390/nu5093605 . ПМЦ 3798924 . ПМИД 24067388 .
- ^ Бьянкуццо Р.М., Кларк Н., Рейц Р.Э., Трэвисон Т.Г., Холик М.Ф. (март 2013 г.). «Концентрация 1,25-дигидроксивитамина D2 и 1,25-дигидроксивитамина D3 в сыворотке крови в ответ на прием витамина D2 и витамина D3» . Журнал клинической эндокринологии и метаболизма . 98 (3): 973–9. дои : 10.1210/jc.2012-2114 . ПМК 3590486 . ПМИД 23386645 .
- ^ Борель П., Кайо Д., Кано, Нью-Джерси (2015). «Биодоступность витамина D: современное состояние» (PDF) . Критические обзоры в области пищевой науки и питания . 55 (9): 1193–205. дои : 10.1080/10408398.2012.688897 . ПМИД 24915331 . S2CID 9818323 . Архивировано (PDF) из оригинала 13 июля 2021 года . Проверено 27 апреля 2021 г.
- ^ Якобсен Дж., Кнутсен П. (апрель 2014 г.). «Стабильность витамина D в пищевых продуктах при приготовлении». Пищевая химия . 148 : 170–5. doi : 10.1016/j.foodchem.2013.10.043 . ПМИД 24262542 .
- ^ Валь Д.А., Купер С., Эбелинг П.Р., Эггерсдорфер М., Хильгер Дж., Хоффманн К. и др. (29 августа 2012 г.). «Глобальное представление статуса витамина D у здорового населения» (PDF) . Архив остеопороза . 7 (1–2): 155–172. дои : 10.1007/s11657-012-0093-0 . hdl : 11343/220606 . ПМИД 23225293 . S2CID 207300035 . Архивировано из оригинала 19 марта 2023 года . Проверено 20 августа 2019 г.
- ^ Валь Д.А., Купер С., Эбелинг П.Р., Эггерсдорфер М., Хильгер Дж., Хоффманн К. и др. (1 февраля 2013 г.). «Глобальное представление статуса витамина D у здорового населения: ответ на комментарий Саади». Архив остеопороза . 8 (1–2): 122. doi : 10.1007/s11657-013-0122-7 . ПМИД 23371520 . S2CID 5929230 .
- ^ Jump up to: а б «Уровни 25(OH)D в нг/мл» . здоровье, Гарвардское образование / . 19 декабря 2016 г. Архивировано из оригинала 2 января 2020 г. . Проверено 2 января 2020 г.
- ^ «конвертер нмоль» . конец памятки . Архивировано из оригинала 2 февраля 2020 года . Проверено 5 января 2020 г.
- ^ Бишофф-Феррари ХА (2008). «Оптимальный уровень 25-гидроксивитамина D в сыворотке для различных результатов в отношении здоровья». Солнечный свет, витамин D и рак кожи (обзор). Достижения экспериментальной медицины и биологии. Том. 810. Спрингер. стр. 500–25. дои : 10.1007/978-0-387-77574-6_5 . ISBN 978-0-387-77573-9 . ПМИД 25207384 .
- ^ Jump up to: а б Далквист Д.Т., Дитер Б.П., Келе М.С. (2015). «Вероятное эргогенное влияние витамина D на спортивные результаты и восстановление» . Журнал Международного общества спортивного питания (обзор). 12:33 . doi : 10.1186/s12970-015-0093-8 . ПМЦ 4539891 . ПМИД 26288575 .
- ^ Энгельман С.Д., Фингерлин Т.Э., Лангефельд С.Д., Хикс П.Дж., Рич С.С., Вагенкнехт Л.Е. и др. (сентябрь 2008 г.). «Генетические и экологические детерминанты уровней 25-гидроксивитамина D и 1,25-дигидроксивитамина D у латиноамериканцев и афроамериканцев» . Журнал клинической эндокринологии и метаболизма . 93 (9): 3381–8. дои : 10.1210/jc.2007-2702 . ПМЦ 2567851 . ПМИД 18593774 .
- ^ Ван Л., Сонг Ю., Мэнсон Дж.Э., Пильц С., Марц В., Михаэльссон К. и др. (ноябрь 2012 г.). «Циркуляция 25-гидроксивитамина D и риск сердечно-сосудистых заболеваний: метаанализ проспективных исследований» . Кровообращение: качество сердечно-сосудистой системы и результаты . 5 (6): 819–29. дои : 10.1161/CIRCOUTCOMES.112.967604 . ПМК 3510675 . ПМИД 23149428 .
- ^ Jump up to: а б Росс А.К., Мэнсон Дж.Э., Абрамс С.А., Алоя Дж.Ф., Брэннон П.М., Клинтон С.К. и др. (январь 2011 г.). «Отчет Института медицины о потреблении кальция и витамина D с пищей за 2011 год: что нужно знать клиницистам» . Журнал клинической эндокринологии и метаболизма . 96 (1): 53–8. дои : 10.1210/jc.2010-2704 . ПМК 3046611 . ПМИД 21118827 .
- ^ Jump up to: а б с Витамин D в «Руководства по диагностике и терапии Merck» Профессиональном издании
- ^ Jump up to: а б с д Вит Р. (май 1999 г.). «Добавки витамина D, концентрации 25-гидроксивитамина D и безопасность» (PDF) . Американский журнал клинического питания . 69 (5): 842–56. дои : 10.1093/ajcn/69.5.842 . ПМИД 10232622 . Архивировано (PDF) из оригинала 3 июля 2012 года . Проверено 30 января 2011 г.
- ^ Верхние допустимые пределы потребления витаминов и минералов (PDF) . Европейское агентство по безопасности пищевых продуктов . Декабрь 2006 г. ISBN. 978-92-9199-014-6 . Архивировано (PDF) из оригинала 6 мая 2019 года . Проверено 27 февраля 2011 г.
- ^ Шлингманн К.П., Кауфманн М., Вебер С., Ирвин А., Гус С., Джон У. и др. (август 2011 г.). «Мутации CYP24A1 и идиопатическая детская гиперкальциемия» . Медицинский журнал Новой Англии . 365 (5): 410–21. дои : 10.1056/NEJMoa1103864 . ПМИД 21675912 .
- ^ Де Паолис Э., Скальоне Г.Л., Де Бонис М., Минуччи А., Каполуонго Э. (октябрь 2019 г.). «Генетические дефекты CYP24A1 и SLC34A1, связанные с идиопатической детской гиперкальциемией: от генотипа к фенотипу» . Клиническая химия и лабораторная медицина . 57 (11): 1650–1667. дои : 10.1515/cclm-2018-1208 . PMID 31188746 .
- ^ Теббен П.Дж., Сингх Р.Дж., Кумар Р. (октябрь 2016 г.). «Гиперкальциемия, опосредованная витамином D: механизмы, диагностика и лечение» . Эндокринные обзоры . 37 (5): 521–547. дои : 10.1210/er.2016-1070 . ПМК 5045493 . ПМИД 27588937 .
- ^ «Предупреждения FDA по правильному добавлению витамина D для младенцев» (пресс-релиз). Управление по контролю за продуктами и лекарствами (FDA). 15 июня 2010 г. Архивировано из оригинала 12 января 2017 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Олмос-Ортис А., Авила Э., Дюран-Карбахаль М., Диас Л. (январь 2015 г.). «Регуляция биосинтеза и активности кальцитриола: фокус на гестационный дефицит витамина D и неблагоприятные исходы беременности» . Питательные вещества . 7 (1): 443–80. дои : 10.3390/nu7010443 . ПМЦ 4303849 . ПМИД 25584965 .
- ^ Jump up to: а б с Руни М.Р., Харнак Л., Мичос Э.Д., Огилви Р.П., Семпос К.Т., Лутси П.Л. (июнь 2017 г.). «Тенденции в использовании высоких доз витамина D, превышающих 1000 или 4000 международных единиц в день, 1999–2014 гг.» . ДЖАМА . 317 (23): 2448–2450. дои : 10.1001/jama.2017.4392 . ПМЦ 5587346 . ПМИД 28632857 .
- ^ Комитет Института медицины (США) по пересмотру рекомендуемого потребления витамина D и кальция с пищей (2011 г.). Росс AC, Тейлор CL, Яктин А.Л., Дель Валле Х.Б. (ред.). Рекомендуемая диетическая норма кальция и витамина D. Сборник национальных академий: отчеты, финансируемые национальными институтами здравоохранения. Вашингтон (округ Колумбия): Издательство национальных академий (США). ПМИД 21796828 . Архивировано из оригинала 29 января 2016 года . Проверено 7 июля 2012 года .
- ^ Jump up to: а б Инсел П., Росс Д., Бернштейн М., МакМахон К. (18 марта 2015 г.). Открытие питания . Издательство Джонс и Бартлетт. ISBN 978-1-284-06465-0 . Архивировано из оригинала 19 марта 2023 года . Проверено 9 апреля 2017 г.
- ^ Jump up to: а б Холик М.Ф. (1992). «Эволюционная биология и патология витамина D» . J Nutr Sci Витаминол (Токио) . Спецификация №: 79–83. дои : 10.3177/jnsv.38.special_79 . ПМИД 1297827 .
- ^ Холик М.Ф. (апрель 1987 г.). «Фотосинтез витамина D в коже: влияние переменных окружающей среды и образа жизни». Труды Федерации . 46 (5): 1876–82. ПМИД 3030826 .
- ^ Делука HF (январь 2014 г.). «История открытия витамина D и его активных метаболитов» . Отчеты BoneKey . 3 : 479. дои : 10.1038/bonekey.2013.213 . ПМЦ 3899558 . ПМИД 24466410 .
- ^ Jump up to: а б Холик М.Ф. (март 2004 г.). «Витамин D: значение в профилактике рака, диабета 1 типа, болезней сердца и остеопороза» . Американский журнал клинического питания . 79 (3): 362–71. дои : 10.1093/ajcn/79.3.362 . ПМИД 14985208 .
- ^ Эйли СК, Уильямс Д.Х. (1975). «Фотолитическое производство витамина D. Препаративное значение фотосенсибилизатора». Журнал Химического общества, Химические коммуникации (20): 858a. дои : 10.1039/C3975000858A .
- ^ Крисси С.Д., Анж К.Д., Якобсен К.Л., Слифка К.А., Боуэн П.Е., Стацевич-Сапунцакис М. и др. (январь 2003 г.). «Концентрация липидов, метаболитов витамина D, ретинола, ретиниловых эфиров, токоферолов и некоторых каротиноидов в сыворотке крови у двенадцати видов диких кошачьих, содержащихся в неволе, в четырех зоопарках» . Журнал питания . 133 (1): 160–6. дои : 10.1093/jn/133.1.160 . ПМИД 12514284 .
- ^ Холик МФ (2018). «Глава 4: Фотобиология витамина D». В Фельдман Д., Пайк Дж.В., Бульон Р., Джованнуччи Э., Гольцман Д., Хьюисон М. (ред.). Витамин D: Том 1: Биохимия, физиология и диагностика (4-е изд.). Лондон, Великобритания: Академическая пресса. ISBN 978-0-12-809965-0 .
- ^ Холик МФ (2020). «Солнечный свет, УФ-излучение, витамин D и рак кожи: сколько солнечного света нам нужно?». Солнечный свет, витамин D и рак кожи . Достижения экспериментальной медицины и биологии. Том. 1268. Спрингер. стр. 19–36. дои : 10.1007/978-3-030-46227-7_2 . ISBN 978-3-030-46226-0 . ПМИД 32918212 . S2CID 221636019 .
108 ссылок
- ^ Янг А.Р., Морган К.А., Харрисон Г.И., Лоуренс К.П., Петерсен Б., Вульф Х.К. и др. (октябрь 2021 г.). «Пересмотренный спектр действия синтеза витамина D под воздействием субэритемного УФ-излучения у людей in vivo» . Труды Национальной академии наук Соединенных Штатов Америки . 118 (40). Бибкод : 2021PNAS..11815867Y . дои : 10.1073/pnas.2015867118 . ПМК 8501902 . ПМИД 34580202 .
- ^ Холик М.Ф. (февраль 2002 г.). «Витамин D: недооцененный гормон D-света, который важен для здоровья скелета и клеток». Современное мнение в эндокринологии, диабете и ожирении . 9 (1): 87–98. дои : 10.1097/00060793-200202000-00011 . S2CID 87725403 .
- ^ Бикле Д.Д. (март 2010 г.). «Витамин D и кожа». Журнал костного и минерального обмена . 28 (2): 117–30. дои : 10.1007/s00774-009-0153-8 . ПМИД 20107849 . S2CID 6072459 .
- ^ Бульон Р., Суда Т. (январь 2014 г.). «Витамин D: гомеостаз кальция и костей в ходе эволюции» . Отчеты BoneKey . 3 : 480. дои : 10.1038/bonekey.2013.214 . ПМЦ 3899559 . ПМИД 24466411 .
- ^ Холик МФ (1 апреля 2010 г.). Решение с витамином D: трехэтапная стратегия лечения наших наиболее распространенных проблем со здоровьем . Издательская группа «Пингвин». ISBN 978-1-101-22293-5 . Архивировано из оригинала 19 марта 2023 года . Проверено 19 марта 2023 г.
- ^ Агарвал СК, Стаут СД (28 июня 2011 г.). Потеря костной массы и остеопороз: антропологическая перспектива . Springer Science & Business Media. ISBN 978-1-4419-8891-1 . Архивировано (PDF) из оригинала 29 января 2006 г.
Высокие концентрации 25(OH)D и относительно высокие потребности обезьян и мартышек в витамине D понятны в свете их биологии: площадь поверхности их тела относительно массы обычно больше, чем у обезьян. для людей, и они заядлые грумеры, потребляющие внутрь витамин D, вырабатываемый из масел, выделяемых кожей в мех. Хотя большая часть витамина D, вырабатываемого кожей человека, всасывается напрямую, птицы и пушные звери получают большую часть витамина D перорально, во время ухода за собой (Bicknell and Prescott, 1946; Carpenter and Zhao, 1999). Витамин D вырабатывается из маслянистых выделений кожи и шерсти. Пероральное употребление выделений из кожи, подвергшихся воздействию УФ-излучения, является способом, которым многие животные приобретают «питательное вещество» — витамин D. Хотя Фрейзер (1983) утверждает, что абсорбция витамина D через кожу может быть более естественной, то, что мы знаем от животных, указывает на то, что пероральное употребление витамина D может быть более естественным. одинаково физиологично. Поскольку витамин D можно извлечь из человеческого пота и кожных выделений, подвергшихся воздействию УФ-излучения (Bicknell and Prescott, 1946), разумно предположить, что древние люди также получали часть витамина D через рот, облизывая кожу.
- ^ Яхав С., Буффенштейн Р. (январь 1993 г.). «Добавка холекальциферола изменяет функцию кишечника и улучшает усвояемость у подземного обитателя, голого землекопа (Heterocephalus glaber), когда он питается морковной диетой» . Британский журнал питания . 69 (1): 233–41. дои : 10.1079/BJN19930025 . ПМИД 8384476 .
- ^ Зафалон Р.В., Рисолия Л.В., Педринелли В., Вендрамини Т.Х., Родригес Р.Б., Амарал А.Р. и др. (январь 2020 г.). «Метаболизм витамина D у собак и кошек и его связь с заболеваниями, не связанными с костным метаболизмом» . Журнал физиологии животных и питания животных . 104 (1): 322–42. дои : 10.1111/jpn.13259 . ПМИД 31803981 .
- ^ Jump up to: а б Холик М.Ф. (ноябрь 2005 г.). «Эпидемия витамина D и ее последствия для здоровья» (PDF) . Журнал питания . 135 (11): 2739С–2748С. дои : 10.1093/jn/135.11.2739S . ПМИД 16251641 . Архивировано (PDF) из оригинала 18 ноября 2017 года . Проверено 24 ноября 2011 г.
[Витамин D3] производится в промышленных масштабах путем экстракции 7-дегидрохолестерина из шерстяного жира с последующим облучением и очисткой UVB [...] [Витамин D2] производится в промышленных масштабах путем облучения и последующей очистки эргостерина, экстрагированного из дрожжей.
- ^ Такеучи А., Окано Т., Саямото М., Савамура С., Кобаяши Т., Мотосуги М. и др. (февраль 1986 г.). «Распределение в тканях 7-дегидрохолестерина, витамина D3 и 25-гидроксивитамина D3 у некоторых видов рыб» . Журнал диетологии и витаминологии . 32 (1): 13–22. дои : 10.3177/jnsv.32.13 . ПМИД 3012050 . Архивировано из оригинала 1 ноября 2018 года . Проверено 20 августа 2019 г.
- ^ Япельт Р.Б., Якобсен Дж. (май 2013 г.). «Витамин D в растениях: обзор возникновения, анализа и биосинтеза» . Границы в науке о растениях . 4 : 136. дои : 10.3389/fpls.2013.00136 . ПМК 3651966 . ПМИД 23717318 .
- ^ Геринг Х (ноябрь 2018 г.). «Витамин D в природе: продукт синтеза и/или деградации компонентов клеточной мембраны». Биохимия. Биохимия . 83 (11): 1350–1357. дои : 10.1134/S0006297918110056 . ПМИД 30482146 . S2CID 53437216 .
- ^ Бьёрн ЛО, Ван Т (2000). «Витамин D в экологическом контексте». Международный журнал циркумполярного здоровья . 59 (1): 26–32. ISSN 1239-9736 . ПМИД 10850004 .
- ^ Jump up to: а б с Адамс Дж. С., Хьюисон М. (февраль 2010 г.). «Обновление витамина D» . Журнал клинической эндокринологии и метаболизма . 95 (2): 471–8. дои : 10.1210/jc.2009-1773 . ПМК 2840860 . ПМИД 20133466 .
- ^ Ченг Дж.Б., Левин М.А., Bell NH, Мангельсдорф DJ, Рассел Д.В. (май 2004 г.). «Генетические доказательства того, что человеческий фермент CYP2R1 является ключевой 25-гидроксилазой витамина D» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (20): 7711–5. Бибкод : 2004PNAS..101.7711C . дои : 10.1073/pnas.0402490101 . ПМК 419671 . ПМИД 15128933 .
- ^ Лэнг CJ, Кук Н.Э. (2004). «Раздел I: Глава 8: Белок, связывающий витамин D» . В Фельдман Д., Глориё Ф.Х., Пайк Дж.В. (ред.). Витамин Д. Том. 1 (2-е изд.). Академическая пресса. стр. 117–134. ISBN 978-0-12-252687-9 . Архивировано из оригинала 19 марта 2023 года . Проверено 9 апреля 2017 г.
- ^ Холик М.Ф., Кляйнер-Босаллер А., Шнос Х.К., Кастен П.М., Бойл И.Т., ДеЛука Х.Ф. (октябрь 1973 г.). «1,24,25-Тригидроксивитамин D3. Метаболит витамина D3, эффективный на кишечнике» . Журнал биологической химии . 248 (19): 6691–6. дои : 10.1016/S0021-9258(19)43408-X . ПМИД 4355503 .
- ^ Хорст Р.Л., Рейнхардт Т.А., Рамберг К.Ф., Кошевски Н.Дж., Наполи Дж.Л. (июль 1986 г.). «24-Гидроксилирование 1,25-дигидроксиэргокальциферола. Однозначный процесс дезактивации» . Журнал биологической химии . 261 (20): 9250–6. дои : 10.1016/S0021-9258(18)67647-1 . ПМИД 3013880 .
- ^ Доруди М., Шварц З., Боян Б.Д. (март 2015 г.). «Мембранно-опосредованное действие 1,25-дигидроксивитамина D3: обзор роли белка, активирующего фосфолипазу А2, и Ca (2+) / кальмодулин-зависимой протеинкиназы II» . Журнал биохимии стероидов и молекулярной биологии . 147 : 81–84. дои : 10.1016/j.jsbmb.2014.11.002 . ПМЦ 4323845 . ПМИД 25448737 .
- ^ Привет CS, Ферранте А (март 2016 г.). «Негеномное действие витамина D» . Питательные вещества . 8 (3): 135. дои : 10.3390/nu8030135 . ПМЦ 4808864 . ПМИД 26950144 .
- ^ Джонс Дж. (апрель 2022 г.). «100 ЛЕТ ВИТАМИНА D: Исторические аспекты витамина D» . Эндокринные связи . 11 (4). дои : 10.1530/EC-21-0594 . ПМЦ 9066576 . ПМИД 35245207 .
- ^ Карере С (25 июля 2007 г.). «Вековая детская болезнь снова в силе» . Торонто Стар . Архивировано из оригинала 17 мая 2008 года . Проверено 24 августа 2010 г.
- ^ МакКлин, Бади А.М. (28 января 1964 г.). «Витамин А, витамин D, хрящи, кости и зубы» . Витамины и гормоны . Том. 21. Академическая пресса. стр. 51–52. ISBN 978-0-12-709821-0 . Архивировано из оригинала 19 марта 2023 года . Проверено 19 марта 2023 г.
- ^ «История витамина D» . Калифорнийский университет в Риверсайде. 2011. Архивировано из оригинала 16 октября 2017 года . Проверено 9 мая 2014 г.
- ^ «Адольф Виндаус – Биография» . Нобелевская премия.org. 25 марта 2010 г. Архивировано из оригинала 24 июля 2018 г. . Проверено 25 марта 2010 г.
- ^ Розенхайм О, Кинг Х (1932). «Кольцевая система стеринов и желчных кислот. Часть II». Дж. Хим. Технол. Биотехнология . 51 (47): 954–7. дои : 10.1002/jctb.5000514702 .
- ^ Аскью Ф.А., Бурдиллон Р.Б., Брюс Х.М., Кэллоу Р.К., Сент-Л. Филпот Дж., Вебстер Т.А. (1932). «Кристаллический витамин Д» . Труды Лондонского королевского общества. Серия Б, содержащая статьи биологического характера . 109 (764): 488–506. дои : 10.1098/rspb.1932.0008 . JSTOR 81571 .
- ^ Хирш А.Л. (2011). «Промышленные аспекты витамина D» . В Feldman DJ, Pike JW, Adams JS (ред.). Витамин Д. Академическая пресса. п. 73. ИСБН 978-0-12-387035-3 . Архивировано из оригинала 19 марта 2023 года . Проверено 19 марта 2023 г.
- ^ Зиедонис А.А., Мауэри, округ Колумбия, Нельсон Р.Р., Бхавен Н.С. (2004). Башня из слоновой кости и промышленные инновации: передача технологий между университетами и промышленностью до и после принятия Закона Бэя-Доула в США . Стэнфордские бизнес-книги. стр. 39–40. ISBN 978-0-8047-4920-6 . Архивировано из оригинала 19 марта 2023 года . Проверено 19 марта 2023 г.
- ^ Маршалл Дж. (сентябрь 2010 г.). Элбридж и Стюарт: основатель компании Carnation . Издательство Кессинджер. ISBN 978-1-164-49678-6 . Архивировано из оригинала 19 марта 2023 года . Проверено 9 апреля 2017 г.
- ^ Хаусслер М.Р., Норман А.В. (январь 1969 г.). «Хромосомный рецептор метаболита витамина D» . Труды Национальной академии наук Соединенных Штатов Америки . 62 (1): 155–62. Бибкод : 1969PNAS...62..155H . дои : 10.1073/pnas.62.1.155 . ПМК 285968 . ПМИД 5253652 .
- ^ Холик М.Ф., ДеЛука Х.Ф., Авиоли Л.В. (январь 1972 г.). «Выделение и идентификация 25-гидроксихолекальциферола из плазмы человека». Архив внутренней медицины . 129 (1): 56–61. дои : 10.1001/archinte.1972.00320010060005 . ПМИД 4332591 .
- ^ Холик М.Ф., Маклафлин Дж.А., Кларк М.Б., Холик С.А., Поттс Дж.Т., Андерсон Р.Р. и др. (октябрь 1980 г.). «Фотосинтез превитамина D3 в коже человека и физиологические последствия». Наука . 210 (4466): 203–5. Бибкод : 1980Sci...210..203H . дои : 10.1126/science.6251551 . JSTOR 1685024 . ПМИД 6251551 .
- ^ Риццоли Р. (январь 2021 г.). «Добавка витамина D: пересмотр верхнего предела безопасности?» . Опыт старения Clin (обзор). 33 (1): 19–24. дои : 10.1007/s40520-020-01678-x . ПМЦ 7897606 . ПМИД 32857334 .
- ^ «Инициатива ОРВ по витамину D» . Управление пищевых добавок, Национальные институты здравоохранения США. 2018. Архивировано из оригинала 26 января 2021 года . Проверено 22 февраля 2023 г.
- ^ Пыржак Б, Витковска-Сендек Е, Краевска М, Демков У, Кучарска А.М. (2015). «Метаболические и иммунологические последствия дефицита витамина D у детей с ожирением». Метаболизм тела и упражнения . Достижения экспериментальной медицины и биологии. Том. 840. Спрингер. стр. 13–9. дои : 10.1007/5584_2014_81 . ISBN 978-3-319-10249-8 . ПМИД 25315624 . S2CID 13296456 .
- ^ «Витамин D и профилактика рака» . Национальный институт рака, Национальные институты здравоохранения США. 21 октября 2013 года. Архивировано из оригинала 13 февраля 2015 года . Проверено 15 декабря 2016 г.
- ^ Гулан, Беатрис, Стюарт, Фиона, Форд, Джон А., МакЛеннан, Грэм, Авенелл, Элисон (2018). «Рак и добавки витамина D: систематический обзор и метаанализ» . Американский журнал клинического питания . 107 (4): 652–63. дои : 10.1093/ajcn/nqx047 . ПМИД 29635490 .
- ^ Хан С.У., Хан М.У., Риаз Х., Валавор С., Чжао Д., Воан Л. и др. (август 2019 г.). «Влияние пищевых добавок и диетических вмешательств на сердечно-сосудистые исходы: общий обзор и карта доказательств» . Анналы внутренней медицины . 171 (3): 190–98. дои : 10.7326/m19-0341 . ПМЦ 7261374 . ПМИД 31284304 .
- ^ Jump up to: а б «Витамин Д» . Рекомендации по лечению коронавирусной болезни 2019 (COVID-19) . Национальные институты здравоохранения (NIH). 26 сентября 2022 г. Проверено 4 июля 2023 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Jump up to: а б Краткое руководство по COVID-19: витамин D (PDF) (Технический отчет). Национальный институт здравоохранения и передового опыта (NICE). Декабрь 2020. ISBN 978-1-4731-3942-8 . НГ187. Архивировано из оригинала 3 декабря 2021 года . Проверено 22 февраля 2021 г.
- ^ Обзоры фактических данных по использованию добавок витамина D для профилактики и лечения COVID-19 (PDF) (Отчет). Национальный институт здравоохранения и передового опыта (NICE). Декабрь 2020. Архивировано из оригинала 20 октября 2021 года . Проверено 22 февраля 2021 г.
- ^ Лю Н., Сунь Дж., Ван Х., Чжан Т., Чжао М., Ли Х. (март 2021 г.). «Низкий статус витамина D связан с исходами коронавирусной болезни в 2019 году: систематический обзор и метаанализ» . Международный журнал инфекционных заболеваний . 104 : 58–64. дои : 10.1016/j.ijid.2020.12.077 . ПМЦ 7833186 . ПМИД 33401034 .
- ^ Jump up to: а б Каземи А., Мохаммади В., Агабабаи С.К., Гользаранд М., Кларк К.С., Бабаджафари С. (октябрь 2021 г.). «Связь статуса витамина D с инфекцией SARS-CoV-2 или тяжестью COVID-19: систематический обзор и метаанализ» . Достижения в области питания . 12 (5): 1636–58. дои : 10.1093/advances/nmab012 . ПМЦ 7989595 . ПМИД 33751020 .
- ^ Jump up to: а б Петрелли Ф, Лучани А, Перего Дж, Догнини Дж, Коломбелли П.Л., Гидини А (июль 2021 г.). «Терапевтическая и прогностическая роль витамина D при инфекции COVID-19: систематический обзор и метаанализ 43 обсервационных исследований» . Журнал биохимии стероидов и молекулярной биологии . 211 : 105883. дои : 10.1016/j.jsbmb.2021.105883 . ПМЦ 7997262 . ПМИД 33775818 .
- ^ Jump up to: а б с д Бассатне А., Басбус М., Чахтура М., Эль Зейн О., Раме М., Эль-Хадж Фулейхан Дж. (июнь 2021 г.). «Связь между COVID-19 и витамином D (VIVID): систематический обзор и метаанализ» . Метаболизм (Систематический обзор). 119 : 154753. doi : 10.1016/j.metabol.2021.154753 . ПМК 7989070 . ПМИД 33774074 .
- ^ Jump up to: а б Дамасцена А.Д., Азеведо Л.М., Оливейра Т.А., Сантана Дж.Д., Перейра М. (август 2021 г.). «Дополнение к дефициту витамина D усугубляет COVID-19: систематический обзор и метаанализ». Критические обзоры в области пищевой науки и питания . 63 (4): 557–62. дои : 10.1080/10408398.2021.1951652 . ПМИД 34384300 . S2CID 236997712 .
- ^ Jump up to: а б Диссанаяке Х.А., де Сильва Н.Л., Суманатиллеке М., де Сильва С.Д., Гамаж К.К., Дематапития С. и др. (апрель 2022 г.). «Прогностическая и терапевтическая роль витамина D при COVID-19: систематический обзор и метаанализ» . Журнал клинической эндокринологии и метаболизма . 107 (5): 1484–502. doi : 10.1210/clinem/dgab892 . ПМЦ 8689831 . ПМИД 34894254 .
- ^ Шах К., Саксена Д., Маваланкар Д. (январь 2021 г.). «Добавка витамина D, COVID-19 и тяжесть заболевания: метаанализ» . QJM: Ежемесячный журнал Ассоциации врачей . 114 (3): 175–81. doi : 10.1093/qjmed/hcab009 . ПМЦ 7928587 . PMID 33486522 .
- ^ Jump up to: а б Штролейн Дж.К., Валлквист Дж., Янницци С., Миколаевска А., Метцендорф М.И., Бенстоем С. и др. (май 2021 г.). «Добавка витамина D для лечения COVID-19: живой систематический обзор» . Кокрановская база данных систематических обзоров . 2021 (5): CD015043. дои : 10.1002/14651858.CD015043 . ПМЦ 8406457 . ПМИД 34029377 . S2CID 235202971 .
- ^ Jump up to: а б Ченг К., Хуан Ю, Ван С., Али В., Карроу Н.А. (сентябрь 2023 г.). «Физиологическая функция витамина D3 в рыбе» . Обзоры в разделе Аквакультура . 15 (4): 1732–1748. Бибкод : 2023RvAq...15.1732C . дои : 10.1111/raq.12814 . ISSN 1753-5123 .