Язвенный колит
| Язвенный колит | |
|---|---|
 | |
| Эндоскопическое изображение толстой кишки, пораженной язвенным колитом. Внутренняя поверхность толстой кишки пятнистая, местами разорванная. Легкая и среднетяжелая форма заболевания. | |
| Специальность | Гастроэнтерология |
| Симптомы | Боль в животе , диарея с примесью крови , потеря веса , лихорадка , анемия . [1] обезвоживание , потеря аппетита, утомляемость , язвы на коже, позывы к дефекации, невозможность дефекации, несмотря на позывы, боль в прямой кишке [2] |
| Complications | Megacolon, inflammation of the eye, joints, or liver, colon cancer[1][3] |
| Usual onset | 15–30 years or >60 years[1] |
| Duration | Long term[1] |
| Causes | Unknown[1] |
| Diagnostic method | Colonoscopy with tissue biopsies[1] |
| Differential diagnosis | Dysentery, Crohn's disease, ischemic colitis[4] |
| Treatment | Dietary changes, medication, surgery[1] |
| Medication | Sulfasalazine, mesalazine, steroids, immunosuppressants such as azathioprine, biological therapy[1] |
| Frequency | 2–299 per 100,000[5] |
| Deaths | 47,400 together with Crohn's (2015)[6] |
Язвенный колит ( ЯК ) — один из двух типов воспалительного заболевания кишечника (ВЗК), вторым типом которого является болезнь Крона . [1] Это длительное заболевание , которое приводит к воспалению и язвам толстой прямой и кишки . [1] [7] Первичными симптомами активного заболевания являются боли в животе и диарея с примесью крови ( гематохезия ). [1] потеря веса , лихорадка и анемия . Также может возникнуть [1] Часто симптомы появляются медленно и могут варьироваться от легких до тяжелых. [1] Симптомы обычно возникают периодически с периодами отсутствия симптомов между обострениями. [1] Осложнения могут включать аномальное расширение толстой кишки ( мегаколон ), воспаление глаз, суставов или печени и рак толстой кишки . [1] [3]
Причина ЯК неизвестна. [1] Теории включают дисфункцию иммунной системы , генетику , изменения в нормальных кишечных бактериях и факторы окружающей среды. [1] [8] Показатели, как правило, выше в развитых странах, причем некоторые полагают, что это результат меньшего воздействия кишечных инфекций или западной диеты и образа жизни. [7] [9] Удаление аппендикса в раннем возрасте может быть защитным. [9] Диагноз обычно ставится с помощью колоноскопии с биопсией тканей . [1]
Several medications are used to treat symptoms and bring about and maintain remission, including aminosalicylates such as mesalazine or sulfasalazine, steroids, immunosuppressants such as azathioprine, and biologic therapy.[1] Removal of the colon by surgery may be necessary if the disease is severe, does not respond to treatment, or if complications such as colon cancer develop.[1] Removal of the colon and rectum generally cures the condition.[1][9]
Signs and symptoms[edit]
| Crohn's disease | Ulcerative colitis | |
|---|---|---|
| Defecation | Often porridge-like,[10] sometimes steatorrhea | Often mucus-like and with blood[10] |
| Tenesmus | Less common[10] | More common[10] |
| Fever | Common[10] | Indicates severe disease[10] |
| Fistulae | Common[11] | Seldom |
| Weight loss | Often | More seldom |
Gastrointestinal[edit]
People with ulcerative colitis usually present with diarrhea mixed with blood,[12] of gradual onset that persists for an extended period of time (weeks). It is estimated that 90% of people experience rectal bleeding (of varying severity), 90% experience watery or loose stools with increased stool frequency (diarrhea), and 75-90% of people experience bowel urgency.[13] Additional symptoms may include fecal incontinence, mucous rectal discharge, and nocturnal defecations.[12] With proctitis (inflammation of the rectum), people with UC may experience urgency or rectal tenesmus, which is the urgent desire to evacuate the bowels but with the passage of little stool.[12] Tenesmus may be misinterpreted as constipation, due to the urge to defecate despite small volume of stool passage. Bloody diarrhea and abdominal pain may be more prominent features in severe disease.[12] The severity of abdominal pain with UC varies from mild discomfort to very painful bowel movements and abdominal cramping.[14] High frequency of bowel movements, weight loss, nausea, fatigue, and fever are also common during disease flares. Chronic bleeding from the GI tract, chronic inflammation, and iron deficiency often leads to anemia, which can affect quality of life.[15]
The clinical presentation of ulcerative colitis depends on the extent of the disease process.[16] Up to 15% of individuals may have severe disease upon initial onset of symptoms.[12] A substantial proportion (up to 45%) of people with a history of UC without any ongoing symptoms (clinical remission) have objective evidence of ongoing inflammation.[17] Ulcerative colitis is associated with a generalized inflammatory process that can affect many parts of the body. Sometimes, these associated extra-intestinal symptoms are the initial signs of the disease.[18]
Extent of involvement[edit]


In contrast to Crohn's disease, which can affect areas of the gastrointestinal tract outside of the colon, ulcerative colitis is usually confined to the colon. Inflammation in ulcerative colitis is usually continuous, typically involving the rectum, with involvement extending proximally (to sigmoid colon, ascending colon, etc.).[19] In contrast, inflammation with Crohn's disease is often patchy, with so-called "skip lesions" (intermittent regions of inflamed bowel).[20]
The disease is classified by the extent of involvement, depending on how far the disease extends:[14] proctitis (rectal inflammation), left sided colitis (inflammation extending to descending colon), and extensive colitis (inflammation proximal to the descending colon).[19] Proctosigmoiditis describes inflammation of the rectum and sigmoid colon. Pancolitis describes involvement of the entire colon, extending from the rectum to the cecum. While usually associated with Crohn's disease, ileitis (inflammation of the ileum) also occurs in UC. About 17% of individuals with UC have ileitis.[21] Ileitis more commonly occurs in the setting of pancolitis (occurring in 20% of cases of pancolitis),[12] and tends to correlate with the activity of colitis. This so-called "backwash ileitis" can occur in 10–20% of people with pancolitis and is believed to be of little clinical significance.[22]
Severity of disease[edit]
In addition to the extent of involvement, UC is also characterized by severity of disease.[19] Severity of disease is defined by symptoms, objective markers of inflammation (endoscopic findings, blood tests), disease course, and the impact of the disease on day-to-day life.[19] Most patients are categorized through endoscopy and fecal calprotectin levels. Indicators of low risk for future complications in mild and moderate UC include the following parameters: exhibiting less than 6 stools daily and lack of fever/weight loss. Other indicators include lack of extraintestinal symptoms, low levels of the inflammatory markers C-reactive protein (CRP), and erythrocyte sedimentation rate (ESR), and fecal calprotectin, and later age of diagnosis (over 40 years).[23] Mild disease correlates with fewer than four stools daily; in addition, mild urgency and rectal bleeding may occur intermittently.[19] Mild disease lacks systemic signs of toxicity (e.g. fever, chills, weight changes) and exhibits normal levels of the serum inflammatory markers ESR and CRP.[23]
Moderate to severe disease correlates with more than six stools daily, frequent bloody stools and urgency.[19] Moderate abdominal pain, low-grade fever, 38 to 39 °C (100 to 102 °F), and anemia may develop.[19] ESR and CRP are usually elevated.[19]
The Mayo Score, which incorporates a combination of clinical symptoms (stool frequency and amount of rectal bleeding) with endoscopic findings and a physicians assessment of severity, is often used clinically to classify UC as mild, moderate or severe.[13]
Acute-Severe Ulcerative Colitis (ASUC) is a severe form which presents acutely and with severe symptoms. This fulminant type is associated with severe symptoms (usually diarrhea, rectal bleeding and abdominal pain) and is usually associated with systemic symptoms including fever.[13] It is associated with a high mortality rate as compared to milder forms of UC, with a 3-month and 12 month mortality rate of 0.84% and 1% respectively.[13] People with fulminant UC may have inflammation extending beyond just the mucosal layer, causing impaired colonic motility and leading to toxic megacolon. Toxic megacolon represents a medical emergency, one often treated surgically. If the serous membrane is involved, a colonic perforation may ensue, which has a 50% mortality rate in people with UC.[24] Other complications include hemorrhage, venous thromboembolism, and secondary infections of the colon including C. difficile or cytomegalovirus colitis.[13]
Ulcerative colitis may improve and enter remission.[19]
Extraintestinal manifestations and complications[edit]
| Crohn's disease | Ulcerative colitis | ||
|---|---|---|---|
| Nutrient deficiency | Higher risk | ||
| Colon cancer risk | Slight | Considerable | |
| Prevalence of extraintestinal complications[25][26][27] | |||
| Iritis/uveitis | Females | 2.2% | 3.2% |
| Males | 1.3% | 0.9% | |
| Primary sclerosing cholangitis | Females | 0.3% | 1% |
| Males | 0.4% | 3% | |
| Ankylosing spondylitis | Females | 0.7% | 0.8% |
| Males | 2.7% | 1.5% | |
| Pyoderma gangrenosum | Females | 1.2% | 0.8% |
| Males | 1.3% | 0.7% | |
| Erythema nodosum | Females | 1.9% | 2% |
| Males | 0.6% | 0.7% | |


UC is characterized by immune dysregulation and systemic inflammation, which may result in symptoms and complications outside the colon. Commonly affected organs include: eyes, joints, skin, and liver.[28] The frequency of such extraintestinal manifestations has been reported as between 6 and 47%.[29][30]
UC may affect the mouth. About 8% of individuals with UC develop oral manifestations.[31] The two most common oral manifestations are aphthous stomatitis and angular cheilitis.[31] Aphthous stomatitis is characterized by ulcers in the mouth, which are benign, noncontagious and often recurrent. Angular chelitis is characterized by redness at the corners of the mouth, which may include painful sores or breaks in the skin.[31] Very rarely, benign pustules may occur in the mouth (pyostomatitis vegetans).[31]
UC may affect the eyes manifesting in scleritis, iritis, and conjunctivitis. Patients may be asymptomatic or experience redness, burning, or itching in eyes. Inflammation may occur in the interior portion of the eye, leading to uveitis and iritis.[32] Uveitis can cause blurred vision and eye pain, especially when exposed to light (photophobia). Untreated, uveitis can lead to permanent vision loss.[32] Inflammation may also involve the white part of the eye (sclera) or the overlying connective tissue (episclera), causing conditions called scleritis and episcleritis.[33] Ulcerative colitis is most commonly associated with uveitis and episcleritis.[34]
UC may cause several joint manifestations, including a type of rheumatologic disease known as seronegative arthritis, which may affect few large joints (oligoarthritis), the vertebra (ankylosing spondylitis) or several small joints of the hands and feet (peripheral arthritis).[28] Often the insertion site where muscle attaches to bone (entheses) becomes inflamed (enthesitis). Inflammation may affect the sacroiliac joint (sacroiliitis).[18] It is estimated that around 50% of IBD patients suffer from migratory arthritis. Synovitis, or inflammation of the synovial fluid surrounding a joint, can occur for months and recur in later times but usually does not erode the joint. The symptoms of arthritis include joint pain, swelling, and effusion, and often leads to significant morbidity.[18] Ankylosing spondylitis and sacroilitis usually occur independent of bowel disease activity in UC.[13]
Ulcerative colitis may affect the skin. The most common type of skin manifestation, erythema nodosum, presents in up to 3% of UC patients. It develops as raised, tender red nodules usually appearing on the outer areas of the arms or legs, especially in the anterior tibial area (shins).[34] The nodules have diameters that measure approximately 1–5 cm. Erythema nodosum is due to inflammation of the underlying subcutaneous tissue (panniculitis), and biopsy will display focal panniculitis (although is often unnecessary in diagnosis). In contrast to joint-related manifestations, erythema nodosum often occurs alongside intestinal disease. Thus, treatment of UC can often lead to resolution of skin nodules.[35]
Another skin condition associated with UC is pyoderma gangrenosum, which presents as deep skin ulcerations. Pyoderma gangrenosum is seen in about 1% of patients with UC and its formation is usually independent of bowel inflammation.[13] Pyoderma gangrenosum is characterized by painful lesions or nodules that become ulcers which progressively grow. The ulcers are often filled with sterile pus-like material. In some cases, pyoderma gangrenosum may require injection with corticosteroids.[28] Treatment may also involve inhibitors of tumor necrosis factor (TNF), a cytokine that promotes cell survival.[35]
Other associations determined between the skin and ulcerative colitis include a skin condition known as hidradenitis suppurativa (HS). This condition represents a chronic process in which follicles become occluded leading to recurring inflammation of nodules and abscesses and even fistulas tunnels in the skin that drain fluid.[36]
Ulcerative colitis may affect the circulatory and endocrine system. UC increases the risk of blood clots in both arteries and veins;[37][38][39] painful swelling of the lower legs can be a sign of deep venous thrombosis, while difficulty breathing may be a result of pulmonary embolism (blood clots in the lungs). The risk of blood clots is about threefold higher in individuals with IBD.[38] The risk of venous thromboembolism is high in ulcerative colitis due to hypercoagulability from inflammation, especially with active or extensive disease.[37] Additional risk factors may include surgery, hospitalization, pregnancy, the use of corticosteroids and tofacitinib, a JAK inhibitor.[37]
Osteoporosis may occur related to systemic inflammation or prolonged steroid use in the treatment of UC, which increases the risk of bone fractures.[18] Clubbing, a deformity of the ends of the fingers, may occur.[18] Amyloidosis may occur, especially with severe and poorly controlled disease, which usually presents with protein in the urine (proteinuria) and nephritic syndrome.[18]
Primary sclerosing cholangitis[edit]
Ulcerative colitis (UC) has a significant association with primary sclerosing cholangitis (PSC), a progressive inflammatory disorder of small and large bile ducts. Up to 70-90% of people with primary sclerosing cholangitis have ulcerative colitis.[34] As many as 5% of people with UC may progress to develop primary sclerosing cholangitis.[28][40] PSC is more common in men, and often begins between 30 and 40 years of age.[28] It can present asymptomatically or exhibit symptoms of itchiness (pruritis) and fatigue. Other symptoms include systemic signs such as fever and night sweats. Such symptoms are often associated with a bacterial episodic version of PSC. Upon physical exam, one may discern enlarged liver contours (hepatomegaly) or enlarged spleen (splenomegaly) as well as areas of excoriation. Yellow coloring of the skin, or jaundice, may also be present due to excess of bile byproduct buildup (bilirubin) from the biliary tract.
In diagnosis, lab results often reveal a pattern indicative of biliary disease (cholestatic pattern). This is often displayed by markedly elevated alkaline phosphatase levels and milder or no elevation in liver enzyme levels. Results of endoscopic retrograde cholangiography (ERC) may show bile ducts with thicker walls, areas of dilation or narrowing. However, some patients with UC and PSC have inflammation that has significantly affected only ramified intrahepatic bile ducts of smaller diameter, also known as "small ducts", which are not visualized by ERC.[41]: 604, 609
In some cases, primary sclerosing cholangitis occurs several years before the bowel symptoms of ulcerative colitis develop.[34] PSC does not parallel the onset, extent, duration, or activity of the colonic inflammation in ulcerative colitis.[34] In addition, colectomy does not have an impact on the course of primary sclerosing cholangitis in individuals with UC.[34] PSC is associated with an increased risk of colorectal cancer and cholangiocarcinoma (bile duct cancer).[34][28] PSC is a progressive condition, and may result in cirrhosis of the liver.[28] No specific therapy has been proven to affect the long-term course of PSC.[28]
Causes[edit]
| Crohn's disease | Ulcerative colitis | |
|---|---|---|
| Smoking | Higher risk for smokers | Lower risk for smokers[19] |
| Age | Usual onset between 15 and 30 years[42] | Peak incidence between 15 and 25 years |
Ulcerative colitis is an autoimmune disease characterized by T-cells infiltrating the colon.[43] No direct causes for UC are known, but factors such as genetics, environment, and an overactive immune system play a role.[1] UC is associated with comorbidities that produce symptoms in many areas of the body outside the digestive system.
Genetic factors[edit]
A genetic component to the cause of UC can be hypothesized based on aggregation of UC in families, variation of prevalence between different ethnicities, genetic markers and linkages.[44] In addition, the identical twin concordance rate is 10%, whereas the dizygotic twin concordance rate is only 3%.[44][45] Between 8 and 14% of people with ulcerative colitis have a family history of inflammatory bowel disease.[12] In addition, people with a first degree relative with UC have a four-fold increase in their risk of developing the disease.[12]
Twelve regions of the genome may be linked to UC, including, in the order of their discovery, chromosomes 16, 12, 6, 14, 5, 19, 1, and 3,[46] but none of these loci has been consistently shown to be at fault, suggesting that the disorder is influenced by multiple genes. For example, chromosome band 1p36 is one such region thought to be linked to inflammatory bowel disease.[47] Some of the putative regions encode transporter proteins such as OCTN1 and OCTN2. Other potential regions involve cell scaffolding proteins such as the MAGUK family. Human leukocyte antigen associations may even be at work. In fact, this linkage on chromosome 6 may be the most convincing and consistent of the genetic candidates.[46]
Multiple autoimmune disorders are associated with ulcerative colitis, including celiac disease,[48] psoriasis,[49] lupus erythematosus,[50] rheumatoid arthritis,[51] episcleritis, and scleritis.[32] Ulcerative colitis is also associated with acute intermittent porphyria.[52]
Environmental factors[edit]
Many hypotheses have been raised for environmental factors contributing to the pathogenesis of ulcerative colitis, including diet, breastfeeding and medications. Breastfeeding may have a protective effect in the development of ulcerative colitis.[53][54] One study of isotretinoin found a small increase in the rate of UC.[55]
As the colon is exposed to many dietary substances which may encourage inflammation, dietary factors have been hypothesized to play a role in the pathogenesis of both ulcerative colitis and Crohn's disease. However, research does not show a link between diet and the development of ulcerative colitis. Few studies have investigated such an association; one study showed no association of refined sugar on the number of people affected of ulcerative colitis.[56] High intake of unsaturated fat and vitamin B6 may enhance the risk of developing ulcerative colitis.[57] Other identified dietary factors that may influence the development and/or relapse of the disease include meat protein and alcoholic beverages.[58][59] Specifically, sulfur has been investigated as being involved in the cause of ulcerative colitis, but this is controversial.[60] Sulfur restricted diets have been investigated in people with UC and animal models of the disease. The theory of sulfur as an etiological factor is related to the gut microbiota and mucosal sulfide detoxification in addition to the diet.[61][62][63]
As a result of a class-action lawsuit and community settlement with DuPont, three epidemiologists conducted studies on the population surrounding a chemical plant that was exposed to PFOA at levels greater than in the general population. The studies concluded that there was an association between PFOA exposure and six health outcomes, one of which being ulcerative colitis.[64]
Alternative theories[edit]
Levels of sulfate-reducing bacteria tend to be higher in persons with ulcerative colitis, which could indicate higher levels of hydrogen sulfide in the intestine. An alternative theory suggests that the symptoms of the disease may be caused by toxic effects of the hydrogen sulfide on the cells lining the intestine.[65]
Infection by Mycobacterium avium, subspecies paratuberculosis, has been proposed as the ultimate cause of both ulcerative colitis and Crohn's disease.[66]
Pathophysiology[edit]
| Crohn's disease | Ulcerative colitis | |
|---|---|---|
| Cytokine response | Associated with Th17[67] | Vaguely associated with Th2 |
An increased amount of colonic sulfate-reducing bacteria has been observed in some people with ulcerative colitis, resulting in higher concentrations of the toxic gas hydrogen sulfide. Human colonic mucosa is maintained by the colonic epithelial barrier and immune cells in the lamina propria (see intestinal mucosal barrier). The short-chain fatty acid n-butyrate gets oxidized through the beta oxidation pathway into carbon dioxide and ketone bodies. It has been shown that n-butyrate helps supply nutrients to this epithelial barrier. Studies have proposed that hydrogen sulfide plays a role in impairing this beta-oxidation pathway by interrupting the short chain acetyl-CoA dehydrogenase, an enzyme within the pathway. Furthermore, it has been suggested that the protective effect of smoking in ulcerative colitis is due to the hydrogen cyanide from cigarette smoke reacting with hydrogen sulfide to produce the non-toxic isothiocyanate, thereby inhibiting sulfides from interrupting the pathway.[68] An unrelated study suggested that the sulfur contained in red meats and alcohol may lead to an increased risk of relapse for people in remission.[65]
Other proposed mechanisms driving the pathophysiology of ulcerative colitis involve an abnormal immune response to the normal gut microbiota. This involves abnormal activity of antigen presenting cells (APCs) including dendritic cells and macrophages. Normally, dendritic cells and macrophages patrol the intestinal epithelium and phagocytose (engulf and destroy) pathogenic microorganisms and present parts of the microorganism as antigens to T-cells to stimulate differentiation and activation of the T-cells.[13] However, in ulcerative colitis, aberrant activity of dendritic cells and macrophages results in them phagocytosing bacteria of the normal gut microbiome. After ingesting the microbiome bacterium, the APCs release the cytokine TNFα which stimulates inflammatory signaling and recruits inflammatory cells to the intestines, leading to the inflammation that is characteristic of ulcerative colitis.[13] The TNF inhibitors, including infliximab, adalimumab and golimumab, are used to inhibit this step during the treatment of ulcerative colitis.[13] After phagocytosing the microbe, the APCs then enter the mesenteric lymph nodes where they present antigens to naive T-cells while also releasing the pro-inflammatory cytokines IL-12 and IL-23 which lead to T cell differentiation into Th1 and Th17 T-cells.[13] IL-12 and IL-23 signaling is blocked by the biologic ustekinumab and IL-23 is blocked by guselkumab, mirikizumab and risankizumab, medications that are used in the treatment of ulcerative colitis.[13] From the mesenteric lymph node, the T-cells then enter the intestinal lymphatic venule which provides transport to the intestinal epithelium where they mediate further inflammation characteristic of ulcerative colitis.[13] The T-cells exit the lymphatic venule via the adhesion protein mucosal vascular addressin cell adhesion molecule 1 MAdCAM-1, the ulcerative colitis biologic treatment vedolizumab inhibits T-cell migration out of the lymphatic venules by blocking binding to MAdCAM-1.[13] While the medications ozanimod and etrasimod inhibit the sphingosine-1-phosphate receptor to prevent T-cell migration into the efferent lymphatic venules.[13] Once the mature Th1 and Th17 T-cells exit the efferent lymphatic venule, they travel to the intestinal mucosa and cause further inflammation. T-cell mediated inflammation is thought to be driven by the JAK-STAT intracellular T-cell signaling pathway, leading to the transcription, translation and release of inflammatory cytokines. This T-cell JAK-STAT signaling is inhibited by the medications tofacitinib, filgotinib and upadacitinib which are used in the treatment of ulcerative colitis.[13]
Diagnosis[edit]

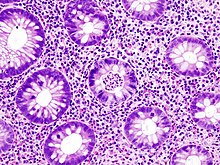
The initial diagnostic workup for ulcerative colitis consists of a complete history and physical examination, assessment of signs and symptoms, laboratory tests and endoscopy.[69] Severe UC can exhibit high erythrocyte sedimentation rate (ESR), decreased albumin (a protein produced by the liver), and various changes in electrolytes. As discussed previously, UC patients often also display elevated alkaline phosphatase. Inflammation in the intestine may also cause higher levels of fecal calprotectin or lactoferrin.[70]
Specific testing may include the following:[19][71]
- A complete blood count is done to check for anemia; thrombocytosis, a high platelet count, is occasionally seen
- Electrolyte studies and kidney function tests are done, as chronic diarrhea may be associated with hypokalemia, hypomagnesemia and kidney injury.
- Liver function tests are performed to screen for bile duct involvement: primary sclerosing cholangitis.
- Imaging such as x-ray or CT scan to evaluate for possible perforation or toxic megacolon
- Stool culture and Clostridioides difficile stool assay to rule out infectious colitis[69]
- Inflammatory markers, such as erythrocyte sedimentation rate or C-reactive protein
- Lower endoscopy to evaluate the rectum and distal large intestine (sigmoidoscopy) or entire colon and end of the small intestine (colonoscopy) for ulcers and inflammation
Although ulcerative colitis is a disease of unknown causation, inquiry should be made as to unusual factors believed to trigger the disease.[19]
The simple clinical colitis activity index was created in 1998 and is used to assess the severity of symptoms.[72]
Endoscopic[edit]

The best test for diagnosis of ulcerative colitis remains endoscopy, which is examination of the internal surface of the bowel using a flexible camera. Initially, a flexible sigmoidoscopy may be completed to establish the diagnosis.[73] The physician may elect to limit the extent of the initial exam if severe colitis is encountered to minimize the risk of perforation of the colon. However, a complete colonoscopy with entry into the terminal ileum should be performed to rule out Crohn's disease, and assess extent and severity of disease.[73] Endoscopic findings in ulcerative colitis include: erythema (redness of the mucosa), friability of the mucosa, superficial ulceration, and loss of the vascular appearance of the colon. When present, ulcerations may be confluent. Pseudopolyps may be observed.[74]
Ulcerative colitis is usually continuous from the rectum, with the rectum almost universally being involved. Perianal disease is rare. The degree of involvement endoscopically ranges from proctitis (rectal inflammation) to left sided colitis (extending to descending colon), to extensive colitis (extending proximal to descending colon).[14]
Histologic[edit]


Biopsies of the mucosa are taken during endoscopy to confirm the diagnosis of UC and differentiate it from Crohn's disease, which is managed differently clinically. Histologic findings in ulcerative colitis includes: distortion of crypt architecture, crypt abscesses, and inflammatory cells in the mucosa (lymphocytes, plasma cells, and granulocytes).[28] Unlike the transmural inflammation seen in Crohn's disease, the inflammation of ulcerative colitis is limited to the mucosa.[28]
Laboratory tests[edit]
Blood and stool tests serve primarily to assess disease severity, level of inflammation and rule out causes of infectious colitis. All individuals with suspected ulcerative colitis should have stool testing to rule out infection.[12]
A complete blood count may demonstrate anemia, leukocytosis, or thrombocytosis.[12] Anemia may be caused by inflammation or bleeding. Chronic blood loss may lead to iron deficiency as a cause for anemia, particularly microcytic anemia (small red blood cells), which can be evaluated with a serum ferritin, iron, total iron-binding capacity and transferrin saturation. Anemia may be due to a complication of treatment from azathioprine, which can cause low blood counts,[75] or sulfasalazine, which can result in folate deficiency. Thiopurine metabolites (from azathioprine) and a folate level can help.[76]
UC may cause high levels of inflammation throughout the body, which may be quantified with serum inflammatory markers, such as CRP and ESR. However, elevated inflammatory markers are not specific for UC and elevations are commonly seen in other conditions, including infection. In addition, inflammatory markers are not uniformly elevated in people with ulcerative colitis. Twenty five percent of individuals with confirmed inflammation on endoscopic evaluation have a normal CRP level.[19] Serum albumin may also be low related to inflammation, in addition to loss of protein in the GI tract associated with bleeding and colitis. Low serum levels of vitamin D are associated with UC, although the significance of this finding is unclear.[77]
Specific antibody markers may be elevated in ulcerative colitis. Specifically, perinuclear antineutrophil cytoplasmic antibodies (pANCA) are found in 70 percent of cases of UC.[19] Antibodies against Saccharomyces cerevisiae may be present, but are more often positive in Crohn's disease compared with ulcerative colitis. However, due to poor accuracy of these serolologic tests, they are not helpful in the diagnostic evaluation of possible inflammatory bowel disease.[19][28]
Several stool tests may help quantify the extent of inflammation present in the colon and rectum. Fecal calprotectin is elevated in inflammatory conditions affecting the colon, and is useful in distinguishing irritable bowel syndrome (noninflammatory) from a flare in inflammatory bowel disease.[19] Fecal calprotectin is 88% sensitive and 79% specific for the diagnosis of ulcerative colitis.[19] If the fecal calprotectin is low, the likelihood of inflammatory bowel disease are less than 1 percent.[12] Lactoferrin is an additional nonspecific marker of intestinal inflammation.[78]
Imaging[edit]
Overall, imaging tests, such as x-ray or CT scan, may be helpful in assessing for complications of ulcerative colitis, such as perforation or toxic megacolon. Bowel ultrasound (US) is a cost-effective, well-tolerated, non-invasive and readily available tool for the management of patients with inflammatory bowel disease (IBD), including UC, in clinical practice.[79] Some studies demonstrated that bowel ultrasound is an accurate tool for assessing disease activity in people with ulcerative colitis.[80][81] Imaging is otherwise of limited use in diagnosing ulcerative colitis.[12][28] Magnetic resonance imaging (MRI) is necessary to diagnose underlying PSC.[28]
Abdominal xray is often the test of choice and may display nonspecific findings in cases of mild or moderate ulcerative colitis. In circumstances of severe UC, radiographic findings may include thickening of the mucosa, often termed "thumbprinting", which indicates swelling due to fluid displacement (edema). Other findings may include colonic dilation and stool buildup evidencing constipation.[70]
Similar to xray, in mild ulcerative colitis, double contrast barium enema often shows nonspecific findings. Conversely, barium enema may display small buildups of barium in microulcerations. Severe UC can be characterized by various polyps, colonic shortening, loss of haustrae (the small bulging pouches in the colon),and narrowing of the colon. It is important to note that barium enema should not be conducted in patients exhibiting very severe symptoms as this may slow or stop stool passage through the colon causing ileus and toxic megacolon.[70]
Other methods of imaging include computed tomography (CT) and magnetic resonance imaging (MRI). Both may depict colonic wall thickening but have decreased ability to find early signs of wall changes when compared to barium enema. In cases of severe ulcerative colitis, however, they often exhibit equivalent ability to detect colonic changes.[70]
Doppler ultrasound is the last means of imaging that may be used. Similar to the imaging methods mentioned earlier, this may show some thickened bowel wall layers. In severe cases, this may show thickening in all bowel wall layers (transmural thickness).[70]
Differential diagnosis[edit]
Several conditions may present in a similar manner as ulcerative colitis and should be excluded. Such conditions include: Crohn's disease, infectious colitis, nonsteroidal anti-inflammatory drug enteropathy, and irritable bowel syndrome. Alternative causes of colitis should be considered, such as ischemic colitis (inadequate blood flow to the colon), radiation colitis (if prior exposure to radiation therapy), or chemical colitis. Pseudomembranous colitis may occur due to Clostridioides difficile infection following administration of antibiotics. Entamoeba histolytica is a protozoan parasite that causes intestinal inflammation. A few cases have been misdiagnosed as UC with poor outcomes occurring due to the use of corticosteroids.[82]
The most common disease that mimics the symptoms of ulcerative colitis is Crohn's disease, as both are inflammatory bowel diseases that can affect the colon with similar symptoms. It is important to differentiate these diseases since their courses and treatments may differ. In some cases, however, it may not be possible to tell the difference, in which case the disease is classified as indeterminate colitis.[83] Crohn's disease can be distinguished from ulcerative colitis in several ways. Characteristics that indicate Crohn's include evidence of disease around the anus (perianal disease). This includes anal fissures and abscesses as well as fistulas, which are abnormal connections between various bodily structures.[84]
Infectious colitis is another condition that may present in similar manner to ulcerative colitis. Endoscopic findings are also oftentimes similar. One can discern whether a patient has infectious colitis by employing tissue cultures and stool studies. Biopsy of the colon is another beneficial test but is more invasive.
Other forms of colitis that may present similarly include radiation and diversion colitis. Radiation colitis occurs after irradiation and often affects the rectum or sigmoid colon, similar to ulcerative colitis. Upon histology radiation colitis may indicate eosinophilic infiltrates, abnormal epithelial cells, or fibrosis. Diversion colitis, on the other hand, occurs after portions of bowel loops have been removed. Histology in this condition often shows increased growth of lymphoid tissue.
In patients who have undergone transplantation, graft versus host disease may also be a differential diagnosis. This response to transplantation often causes prolonged diarrhea if the colon is affected. Typical symptoms also include rash. Involvement of the upper gastrointestinal tract may lead to difficulty swallowing or ulceration. Upon histology, graft versus host disease may present with crypt cell necrosis and breakdown products within the crypts themselves.[85]
| Crohn's disease | Ulcerative colitis | |
|---|---|---|
| Terminal ileum involvement | Commonly | Seldom |
| Colon involvement | Usually | Always |
| Rectum involvement | Seldom | Usually (95%)[19] |
| Involvement around the anus | Common[86] | Seldom |
| Bile duct involvement | No increase in rate of primary sclerosing cholangitis | Higher rate[87] |
| Distribution of disease | Patchy areas of inflammation (skip lesions) | Continuous area of inflammation[19] |
| Endoscopy | Deep geographic and serpiginous (snake-like) ulcers | Continuous ulcer |
| Depth of inflammation | May be transmural, deep into tissues[86][46] | Shallow, mucosal |
| Stenosis | Common | Seldom |
| Granulomas on biopsy | May have non-necrotizing non-peri-intestinal crypt granulomas[86][88][89] | Non-peri-intestinal crypt granulomas not seen[90] |
Management[edit]
Standard treatment for ulcerative colitis depends on the extent of involvement and disease severity. The goal is to induce remission initially with medications, followed by the administration of maintenance medications to prevent a relapse. The concept of induction of remission and maintenance of remission is very important. The medications used to induce and maintain a remission somewhat overlap, but the treatments are different. Physicians first direct treatment to inducing remission, which involves relief of symptoms and mucosal healing of the colon's lining, and then longer-term treatment to maintain remission and prevent complications.[91]
For acute stages of the disease, a low fiber diet may be recommended.[92][93][94]
Medication[edit]
The first-line maintenance medication for ulcerative colitis in remission is mesalazine (also known as mesalamine or 5-ASA).[95][96] For patients with active disease limited to the left colon (descending colon) or proctitis, mesalazine is also the first-line agent, and a combination of suppositories and oral mesalazine may be tried. Adding corticosteroids such as prednisone is also common in active disease, especially if remission is not achieved through mesalazine monotherapy,[95][96] but they are not used in long-term treatment as their risks then outweigh their benefits. Immunosuppressive medications such as azathioprine and biological agents such as infliximab, adalimumab, ustekinumab, or vedolizumab are given in severe disease or if a patient cannot achieve remission with mesalazine and corticosteroids.[97] As an alternative to mesalazine, one of its prodrugs such as sulfasalazine may be chosen for treatment of active disease or maintenance therapy,[98] but the prodrugs have greater potential for serious side effects and have not been demonstrated to be superior to mesalazine in large trials.[99]
A formulation of budesonide was approved by the U.S. Food and Drug Administration (FDA) for treatment of active ulcerative colitis in January 2013.[100][101] In 2018, tofacitinib was approved for treatment of moderately to severely active ulcerative colitis in the United States, the first oral medication indicated for long term use in this condition.[102] The evidence on methotrexate does not show a benefit in producing remission in people with ulcerative colitis.[103] Cyclosporine is effective for severe UC[97] and tacrolimus has also shown benefits.[104][105][106][107] Etrasimod was approved for medical use in the United States in October 2023.[108]
Aminosalicylates[edit]
Sulfasalazine has been a major agent in the therapy of mild to moderate ulcerative colitis for over 50 years. In 1977, it was shown that 5-aminosalicylic acid (5-ASA, mesalazine/mesalamine) was the therapeutically active component in sulfasalazine.[109] Many 5-ASA drugs have been developed with the aim of delivering the active compound to the large intestine to maintain therapeutic efficacy but with reduction of the side effects associated with the sulfapyridine moiety in sulfasalazine. Oral 5-ASA drugs are particularly effective in inducing and in maintaining remission in mild to moderate ulcerative colitis.[110][111] Rectal suppository, foam or liquid enema formulations of 5-ASA are used for colitis affecting the rectum, sigmoid or descending colon, and have been shown to be effective especially when combined with oral treatment.[112]
Biologics[edit]
Biologic treatments such as the TNF inhibitors infliximab, adalimumab, and golimumab are commonly used to treat people with UC who are no longer responding to corticosteroids. Tofacitinib and vedolizumab can also produce good clinical remission and response rates in UC.[8] Biologics may be used early in treatment (step down approach), or after other treatments have failed to induce remission (step up approach); the strategy should be individualized.[113]
Unlike aminosalicylates, biologics can cause serious side effects such as an increased risk of developing extra-intestinal cancers,[114] heart failure; and weakening of the immune system, resulting in a decreased ability of the immune system to clear infections and reactivation of latent infections such as tuberculosis. For this reason, people on these treatments are closely monitored and are often tested for hepatitis and tuberculosis annually.[115][116]
Etrasimod, a once-daily oral sphingosine 1-phosphate (S1P) receptor modulator that selectively activates S1P receptor subtypes 1, 4, and 5 with no detectable activity on S1P 2 or 3, is in development for treatment of immune-mediated diseases, including ulcerative colitis, and was shown in 2 randomized trials to be effective and well tolerated as induction and maintenance therapy in patients with moderately to severely active ulcerative colitis.[117]
Nicotine[edit]
Unlike Crohn's disease, ulcerative colitis has a lesser chance of affecting smokers than non-smokers.[118][119] In select individuals with a history of previous tobacco use, resuming low dose smoking may improve signs and symptoms of active ulcerative colitis,[120] but it is not recommended due to the overwhelmingly negative health effects of tobacco.[121] Studies using a transdermal nicotine patch have shown clinical and histological improvement.[122] In one double-blind, placebo-controlled study conducted in the United Kingdom, 48.6% of people with UC who used the nicotine patch, in conjunction with their standard treatment, showed complete resolution of symptoms. Another randomized, double-blind, placebo-controlled, single-center clinical trial conducted in the United States showed that 39% of people who used the patch showed significant improvement, versus 9% of those given a placebo.[123] However, nicotine therapy is generally not recommended due to side effects and inconsistent results.[124][125][126]
Iron supplementation[edit]
The gradual loss of blood from the gastrointestinal tract, as well as chronic inflammation, often leads to anemia, and professional guidelines suggest routinely monitoring for anemia with blood tests repeated every three months in active disease and annually in quiescent disease.[127] Adequate disease control usually improves anemia of chronic disease, but iron deficiency anemia should be treated with iron supplements. The form in which treatment is administered depends both on the severity of the anemia and on the guidelines that are followed. Some advise that parenteral iron be used first because people respond to it more quickly, it is associated with fewer gastrointestinal side effects, and it is not associated with compliance issues.[128] Others require oral iron to be used first, as people eventually respond and many will tolerate the side effects.[127][129]
Anticholinergics[edit]
Anticholinergic drugs, more specifically muscarinic antagonists, are sometimes used to treat abdominal cramps in connection with ulcerative colitis through their calming effect on colonic peristalsis (reducing both amplitude and frequency) and intestinal tone.[130][131] Some medical authorities suggest over-the-counter anticholinergic drugs as potential helpful treatments for abdominal cramping in mild ulcerative colitis.[132] However, their use is contraindicated especially in moderate to severe disease states because of the potential for anticholinergic treatment to induce toxic megacolon in patients with colonic inflammation.[133] Toxic megacolon is a state in which the colon is abnormally distended, and may in severe or untreated cases lead to colonic perforation, sepsis, and death.[134]
Immunosuppressant therapies, infection risks and vaccinations[edit]
Many patients affected by ulcerative colitis need immunosuppressant therapies, which may be associated with a higher risk of contracting opportunistic infectious diseases.[135]Many of these potentially harmful diseases, such as Hepatitis B, Influenza, chickenpox, herpes zoster virus, pneumococcal pneumonia, or human papilloma virus, can be prevented by vaccines. Each drug used in the treatment of IBD should be classified according to the degree of immunosuppression induced in the patient. Several guidelines suggest investigating patients' vaccination status before starting any treatment and performing vaccinations against vaccine preventable diseases when required.[136][137] Compared to the rest of the population, patients affected by IBD are known to be at higher risk of contracting some vaccine-preventable diseases.[138] Patients treated with Janus kinase inhibitor showed higher risk of Shingles.[139] Nevertheless, despite the increased risk of infections, vaccination rates in IBD patients are known to be suboptimal and may also be lower than vaccination rates in the general population.[140][141]
Surgery[edit]
| Crohn's disease | Ulcerative colitis | |
|---|---|---|
| Mesalazine | Less useful[142] | More useful[142] |
| Antibiotics | Effective in long-term[143] | Generally not useful[144] |
| Surgery | Often returns following removal of affected part | Usually cured by removal of colon |
Unlike in Crohn's disease, the gastrointestinal aspects of ulcerative colitis can generally be cured by surgical removal of the large intestine, though extraintestinal symptoms may persist. This procedure is necessary in the event of: exsanguinating hemorrhage, frank perforation, or documented or strongly suspected carcinoma. Surgery is also indicated for people with severe colitis or toxic megacolon. People with symptoms that are disabling and do not respond to drugs may wish to consider whether surgery would improve the quality of life.[14]
The removal of the entire large intestine, known as a proctocolectomy, results in a permanent ileostomy – where a stoma is created by pulling the terminal ileum through the abdomen. Intestinal contents are emptied into a removable ostomy bag which is secured around the stoma using adhesive.[145]
Another surgical option for ulcerative colitis that is affecting most of the large bowel is called the ileal pouch-anal anastomosis (IPAA). This is a two- or three-step procedure. In a three-step procedure, the first surgery is a sub-total colectomy, in which the large bowel is removed, but the rectum remains in situ, and a temporary ileostomy is made. The second step is a proctectomy and formation of the ileal pouch (commonly known as a "j-pouch"). This involves removing the large majority of the remaining rectal stump and creating a new "rectum" by fashioning the end of the small intestine into a pouch and attaching it to the anus. After this procedure, a new type of ileostomy is created (known as a loop ileostomy) to allow the anastomoses to heal. The final surgery is a take-down procedure where the ileostomy is reversed and there is no longer the need for an ostomy bag. When done in two steps, a proctocolectomy – removing both the colon and rectum – is performed alongside the pouch formation and loop ileostomy. The final step is the same take-down surgery as in the three-step procedure. Time taken between each step can vary, but typically a six- to twelve-month interval is recommended between the first two steps, and a minimum of two to three months is required between the formation of the pouch and the ileostomy take-down.[14]
While the ileal pouch procedure removes the need for an ostomy bag, it does not restore normal bowel function. In the months following the final operation, patients typically experience 8–15 bowel movements a day. Over time this number decreases, with many patients reporting 4–6 bowel movements after one year post-op. While many patients have success with this procedure, there are a number of known complications. Pouchitis, inflammation of the ileal pouch resulting in symptoms similar to ulcerative colitis, is relatively common. Pouchitis can be acute, remitting, or chronic however treatment using antibiotics, steroids, or biologics can be highly effective. Other complications include fistulas, abscesses, and pouch failure. Depending on the severity of the condition, pouch revision surgery may need to be performed. In some cased the pouch may need to be de-functioned or removed and an ileostomy recreated.[146][147]
The risk of cancer arising from an ileal pouch anal anastomosis is low.[148] However, annual surveillance with pouchoscopy may be considered in individuals with risk factors for dysplasia, such as a history of dysplasia or colorectal cancer, a history of PSC, refractory pouchitis, and severely inflamed atrophic pouch mucosa.[148]
Бактериальная реколонизация
В ряде рандомизированных клинических исследований пробиотики продемонстрировали свою потенциальную эффективность в лечении язвенного колита. Было показано, что определенные типы пробиотиков, такие как Escherichia coli Nissle , вызывают ремиссию у некоторых людей на срок до года. [149]
Кокрейновский с использованием обзор контролируемых исследований различных пробиотиков обнаружил доказательства низкой достоверности того, что пробиотические добавки могут увеличить вероятность клинической ремиссии. [150] У людей, получавших пробиотики, на 73% чаще наблюдалась ремиссия заболевания и более чем в 2 раза чаще сообщалось об улучшении симптомов по сравнению с теми, кто получал плацебо, без четкой разницы в незначительных или серьезных побочных эффектах. [150] Хотя не было четких доказательств большей ремиссии при сравнении пробиотических добавок с 5-аминосалициловой кислотой лечением в качестве монотерапии , вероятность ремиссии была на 22% выше, если пробиотики использовались в сочетании с терапией 5-аминосалициловой кислотой. [150]
Неясно, помогают ли пробиотики предотвратить будущие рецидивы у людей со стабильной активностью заболевания, либо в виде монотерапии, либо в виде комбинированной терапии . [151]
Трансплантация фекальной микробиоты включает введение пробиотиков человека через фекальные клизмы. обычно требует более длительного бактериотерапевтического лечения, чем инфекция Clostridioides difficile Язвенный колит для достижения успеха , возможно, из-за времени, необходимого для заживления изъязвленного эпителия. Реакция язвенного колита потенциально очень благоприятна: в одном исследовании сообщается, что у 67,7% людей наблюдается полная ремиссия. [152] Другие исследования обнаружили пользу от трансплантации фекальной микробиоты. [153] [154] [155]
Альтернативная медицина [ править ]
При язвенном колите использовались различные методы альтернативной медицины, но результаты были противоречивыми. Терапия куркумином (куркумой) в сочетании с приемом препаратов месаламина или сульфасалазина может быть эффективной и безопасной для поддержания ремиссии у людей с неспецифическим язвенным колитом. [156] [157] Влияние терапии куркумином только на неспецифический язвенный колит неизвестен. [157]
Методы лечения с использованием каннабиса или масла каннабиса неясны. До сих пор исследования не определили его эффективность и безопасность. [158]
Лечение боли в животе [ править ]
Для лечения боли в животе у людей с язвенным колитом рассматривалось множество вмешательств, включая диету FODMAP , тренировки по релаксации , йогу , кефирную диету и лечение блокады звездчатых ганглиев . Неясно, являются ли какие-либо из них безопасными и эффективными для облегчения боли или уменьшения тревоги и депрессии . [159]
Питание [ править ]
Диета может играть роль в симптомах пациентов с язвенным колитом. [160]
Наиболее избегаемыми пациентами продуктами питания являются острая пища, молочные продукты, алкоголь, фрукты и овощи и газированные напитки; этих продуктов в основном избегают во время ремиссии и для предотвращения рецидива. В некоторых случаях, особенно в период обострений, диетические ограничения у этих пациентов могут быть очень серьезными и могут привести к ухудшению состояния питания. Некоторые пациенты склонны к самопроизвольному отказу от глютена, несмотря на отсутствие точного диагноза целиакии , поскольку считают, что глютен может усугубить желудочно-кишечные симптомы. [161]
Психическое здоровье [ править ]
Многие исследования показали, что пациенты с ВЗК сообщают о более высокой частоте депрессивных и тревожных расстройств, чем население в целом, и большинство исследований подтверждают, что у женщин с ВЗК чаще, чем у мужчин, развиваются аффективные расстройства, и показывают, что до 65% из них могут страдать депрессией. расстройство и тревожное расстройство . [162] [163]
Прогноз [ править ]
К факторам плохого прогноза относятся: возраст < 40 лет на момент постановки диагноза, обширный колит, тяжелый колит при эндоскопии, предшествующая госпитализация, повышенный уровень СРБ и низкий уровень сывороточного альбумина. [19]
или ремиссия Прогрессирование
Люди с язвенным колитом обычно имеют интермиттирующее течение, с периодами бездействия заболевания, чередующимися с «вспышками» заболевания. Люди с проктитом или левосторонним колитом обычно имеют более доброкачественное течение: только у 15% заболевание прогрессирует проксимально, а до 20% могут иметь устойчивую ремиссию при отсутствии какой-либо терапии. У части людей болезнь прогрессирует быстро. В этих случаях обычно наблюдается отсутствие реакции на лекарства, и хирургическое вмешательство часто проводится в течение первых нескольких лет от начала заболевания. [164] [165] Люди с более обширным заболеванием с меньшей вероятностью сохранят ремиссию, но скорость ремиссии не зависит от тяжести заболевания. [166] Несколько факторов риска связаны с возможной необходимостью колэктомии, в том числе: предшествующая госпитализация по поводу ЯК, обширный колит, потребность в системных стероидах, молодой возраст на момент постановки диагноза, низкий уровень сывороточного альбумина, повышенные маркеры воспаления (СРБ и СОЭ) и тяжелое воспаление, наблюдаемое во время колоноскопии. . [97] [19] В некоторых случаях необходимо хирургическое удаление толстой кишки. [19]
Колоректальный рак [ править ]
Риск колоректального рака значительно увеличивается у людей с язвенным колитом через десять лет, если поражение выходит за пределы селезеночного изгиба . Люди с обратным илеитом могут иметь повышенный риск развития колоректальной карциномы. [167] Те люди, у которых есть только проктит, обычно не имеют повышенного риска. [19] Людям рекомендуется проводить скрининговую колоноскопию со случайной биопсией для выявления дисплазии после восьми лет активности заболевания с интервалом от одного до двух лет. [168]
Смертность [ править ]
Люди с язвенным колитом находятся в аналогичном положении. [169] или, возможно, несколько повышенный общий риск смерти по сравнению с исходной популяцией. [170] Однако распределение причин смерти отличается от населения в целом. [169] Конкретные факторы риска могут предсказать худшие результаты и более высокий риск смертности у людей с язвенным колитом, включая C. difficile. инфекцию [19] и цитомегаловирусная инфекция (в результате реактивации). [171]
Эпидемиология [ править ]
Вместе с болезнью Крона по состоянию на 2015 год пострадало около 11,2 млн человек. [update]. [172] Каждый год это заболевание возникает вновь у 1–20 человек на 100 000 человек, а заболевает от 5 до 500 человек на 100 000 человек. [7] [9] Заболевание чаще встречается в Северной Америке и Европе, чем в других регионах. [9] Часто оно начинается у людей в возрасте от 15 до 30 лет или у лиц старше 60 лет. [1] Мужчины и женщины, по-видимому, страдают в равных пропорциях. [7] Это также стало более распространенным с 1950-х годов. [7] [9] В совокупности язвенный колит и болезнь Крона затрагивают около миллиона человек в Соединенных Штатах. [173] При соответствующем лечении риск смерти такой же, как и у населения в целом. [3] Первое описание язвенного колита произошло примерно в 1850-х годах. [9]
Ежегодно язвенный колит впервые возникает у 1–20 человек на 100 000 человек (заболеваемость), а общее число больных этим заболеванием составляет 5–500 на 100 000 человек (распространенность). [7] [9] В 2015 году от воспалительных заболеваний кишечника (ЯК и болезни Крона) во всем мире умерло 47 400 человек. [6] Пик развития приходится на возраст 30–40 лет. [12] второй пик развития приходится на 6-е десятилетие жизни. [174] Язвенный колит одинаково часто встречается среди мужчин и женщин. [12] [7] При соответствующем лечении риск смерти аналогичен риску смерти в общей популяции. [3] ЯК стал более распространенным с 1950-х годов. [7] [9]
Географическое распространение ЯК и болезни Крона во всем мире одинаково. [175] при этом наибольшее количество новых случаев ЯК за год обнаружено в Канаде , Новой Зеландии и Великобритании . [176] Заболевание чаще встречается в Северной Америке и Европе, чем в других регионах. [9] В целом, более высокие показатели наблюдаются в северных регионах по сравнению с южными регионами Европы. [177] и США. [178] ЯК чаще встречается в Западной Европе, чем в Восточной Европе. [179] Во всем мире распространенность ЯК варьирует от 2 до 299 на 100 000 человек. [5] В совокупности язвенный колит и болезнь Крона затрагивают около миллиона человек в Соединенных Штатах. [173]
Как и в случае с болезнью Крона, частота ЯК выше среди евреев-ашкенази и постепенно снижается у других лиц еврейского происхождения, нееврейских европеоидов, африканцев, латиноамериканцев и азиатов. [22] Аппендэктомия до 20 лет по поводу аппендицита [180] и текущее употребление табака [181] защищают от развития ЯК. [12] Однако употребление табака в прошлом связано с более высоким риском развития заболевания. [181] [12]
США [ править ]
По состоянию на 2004 год [update]Число новых случаев ЯК в США составляло от 2,2 до 14,3 на 100 000 в год. [182] Число заболевших в США в 2004 году составляло от 37 до 246 на 100 000 человек. [182]
Канада [ править ]
В Канаде в период с 1998 по 2000 год количество новых случаев в год составляло 12,9 на 100 000 населения, или 4500 новых случаев. Число пострадавших оценивается в 211 на 100 000 или 104 000 человек. [183]
Соединенное Королевство [ править ]
В Соединенном Королевстве это заболевание ежегодно развивается у 10 человек на 100 000 человек, а число заболевших составляет 243 человека на 100 000 человек. Примерно у 146 000 человек в Соединенном Королевстве был диагностирован ЯК. [184]
История [ править ]
Термин «язвенный колит» был впервые использован Сэмюэлем Уилксом в 1859 году. Этот термин вошел в общий медицинский словарь впоследствии, в 1888 году, когда Уильям Хейл-Уайт опубликовал отчет о различных случаях «язвенного колита». [185]
ЯК был первым выявленным подтипом ВЗК. [185]
Исследования [ править ]
что гельминтная терапия с использованием власоглава Trichuris suis проведенном в Айове, было показано, В рандомизированном контрольном исследовании, приносит пользу людям с язвенным колитом. [186] Терапия проверяет гигиеническую гипотезу , согласно которой отсутствие гельминтов в толстой кишке людей в развитых странах может привести к воспалению. И гельминтная терапия, и трансплантация фекальной микробиоты вызывают характерный Th2 в пораженных участках, что было неожиданным, учитывая, что считалось, что язвенный колит связан с перепроизводством Th2. ответ лейкоцитов [186]
Аликафорсен человека ICAM-1 представляет собой антисмысловой олигодезоксинуклеотид первого поколения, предназначенный для специфического связывания с информационной РНК посредством взаимодействий пар оснований Уотсона-Крика с целью подавления экспрессии ICAM-1. [187] ICAM-1 распространяет воспалительную реакцию, способствуя экстравазации и активации лейкоцитов (лейкоцитов) в воспаленную ткань. [187] Повышенная экспрессия ICAM-1 наблюдалась в воспаленной слизистой оболочке кишечника у пациентов с язвенным колитом, где избыточное производство ICAM-1 коррелировало с активностью заболевания. [188] Это говорит о том, что ICAM-1 является потенциальной терапевтической мишенью при лечении язвенного колита. [189]
Грамположительные бактерии, присутствующие в просвете, могут быть связаны с удлинением времени рецидива язвенного колита. [190]
Ряд разрабатываемых препаратов призван разрушить процесс воспаления, избирательно воздействуя на ионный канал в сигнальном каскаде воспаления, известном как KCa3.1. [191] В доклиническом исследовании на крысах и мышах ингибирование KCa3.1 нарушало выработку цитокинов Th1 IL-2 и TNF-α и уменьшало воспаление толстой кишки так же эффективно, как и сульфасалазин . [191]
Нейтрофильные внеклеточные ловушки [192] и, как следствие, деградация внеклеточного матрикса [193] были зарегистрированы в слизистой оболочке толстой кишки у больных язвенным колитом в клинической ремиссии, что указывает на участие врожденной иммунной системы в этиологии. [192]
Фексофенадин , антигистаминный препарат, используемый при лечении аллергии, в некоторых исследованиях показал себя многообещающим в качестве комбинированной терапии. [194] [195] К счастью, низкая абсорбция фексофенадина в желудочно-кишечном тракте (или высокая секреция всасывающегося лекарственного средства в желудочно-кишечном тракте) приводит к более высокой концентрации в месте воспаления. Таким образом, препарат может локально снижать секрецию гистамина вовлеченными тучными клетками желудочно-кишечного тракта и облегчать воспаление. [195]
Имеются доказательства того, что этролизумаб эффективен при язвенном колите, и по состоянию на 2016 год проводятся исследования третьей фазы. [8] [196] [197] [198] Этролизумаб представляет собой гуманизированное моноклональное антитело, которое воздействует на субъединицу β7 интегринов α4β7 и αEβ7, в конечном итоге блокируя миграцию и удержание лейкоцитов в слизистой оболочке кишечника. [197] По состоянию на начало 2022 года компания Roche прекратила клинические испытания по использованию этролизумаба для лечения язвенного колита. [199]
Тип афереза лейкоцитов , известный как адсорбционный аферез гранулоцитов и моноцитов, все еще требует крупномасштабных испытаний, чтобы определить, эффективен он или нет. [200] Результаты небольших испытаний были предварительно положительными. [201]
Известные случаи [ править ]
Ссылки [ править ]
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В "Язвенный колит" . НИДДК . Сентябрь 2014 года . Проверено 3 августа 2016 г.
- ^ "Язвенный колит" . Аутоиммунный реестр Inc. Проверено 15 июня 2022 г.
- ^ Jump up to: Перейти обратно: а б с д Вандерос М.Х., Моум Б.А., Хойвик М.Л., Ховде О. (май 2016 г.). «Прогностические факторы тяжелого клинического течения язвенного колита: результаты популяционных исследований» . Всемирный журнал желудочно-кишечной фармакологии и терапии . 7 (2): 235–241. дои : 10.4292/wjgpt.v7.i2.235 . ПМЦ 4848246 . ПМИД 27158539 .
- ^ Рунге М.С., Греганти М.А. (2008). Электронная книга Неттера по внутренним болезням . Elsevier Науки о здоровье. п. 428. ИСБН 9781437727722 .
- ^ Jump up to: Перейти обратно: а б Молодецкий Н.А., Сун И.С., Раби Д.М., Гали В.А., Феррис М., Чернофф Г. и др. (январь 2012 г.). «Увеличение заболеваемости и распространенности воспалительных заболеваний кишечника с течением времени, на основе систематического обзора» . Гастроэнтерология . 142 (1): 46–54.e42, викторина e30. дои : 10.1053/j.gastro.2011.10.001 . ПМИД 22001864 .
- ^ Jump up to: Перейти обратно: а б Ван Х., Нагави М., Аллен С., Барбер Р.М., Бхутта З.А., Картер А. и др. (GBD 2015 Смертность и причины смерти, сотрудники) (октябрь 2016 г.). «Глобальная, региональная и национальная продолжительность жизни, смертность от всех причин и смертность от конкретных причин по 249 причинам смерти, 1980–2015 гг.: систематический анализ для исследования глобального бремени болезней, 2015 г.» . Ланцет . 388 (10053): 1459–1544. дои : 10.1016/s0140-6736(16)31012-1 . ПМЦ 5388903 . ПМИД 27733281 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час Форд AC, Моайеди П., Ханауэр С.Б. (февраль 2013 г.). "Язвенный колит". БМЖ . 346 :f432. дои : 10.1136/bmj.f432 . ПМИД 23386404 . S2CID 14778938 .
- ^ Jump up to: Перейти обратно: а б с Акихо Х., Ёкояма А., Абэ С., Накадзоно Ю., Мураками М., Оцука Ю. и др. (ноябрь 2015 г.). «Перспективные биологические методы лечения язвенного колита: обзор литературы» . Всемирный журнал желудочно-кишечной патофизиологии . 6 (4): 219–227. дои : 10.4291/wjgp.v6.i4.219 . ПМЦ 4644886 . ПМИД 26600980 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж Данезе С., Фиокки С (ноябрь 2011 г.). "Язвенный колит". Медицинский журнал Новой Англии . 365 (18): 1713–1725. дои : 10.1056/NEJMra1102942 . ПМИД 22047562 .
- ^ Jump up to: Перейти обратно: а б с д и ж Internetmedicin.se > Хроническое воспалительное заболевание кишечника, ВЗК Автор: Роберт Лёфберг. Получено в октябре 2010 г. Перевод.
- ^ Ханауэр С.Б., Сэндборн В. (март 2001 г.). «Лечение болезни Крона у взрослых» . Американский журнал гастроэнтерологии . 96 (3): 635–43. doi : 10.1111/j.1572-0241.2001.3671_c.x (неактивен 31 января 2024 г.). ПМИД 11280528 . S2CID 31219115 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка ) - ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м н тот п Унгаро Р., Механдру С., Аллен П.Б., Пейрен-Бируле Л., Коломбель Дж.Ф. (апрель 2017 г.). "Язвенный колит" . Ланцет . 389 (10080): 1756–1770. дои : 10.1016/S0140-6736(16)32126-2 . ПМК 6487890 . ПМИД 27914657 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м н тот п Грос Б., Каплан Г.Г. (12 сентября 2023 г.). «Язвенный колит у взрослых: обзор». ДЖАМА . 330 (10): 951–965. дои : 10.1001/jama.2023.15389 . ПМИД 37698559 . S2CID 261696018 .
- ^ Jump up to: Перейти обратно: а б с д и Магро Ф., Джионкетти П., Элиаким Р., Ардиццоне С., Армуцци А., Баррейро-де Акоста М. и др. (июнь 2017 г.). «Третий европейский научно обоснованный консенсус по диагностике и лечению язвенного колита. Часть 1: Определения, диагностика, внекишечные проявления, беременность, наблюдение за раком, хирургия и расстройства подвздошно-анального мешка» . Журнал Крона и колита . 11 (6): 649–670. doi : 10.1093/ecco-jcc/jjx008 . ПМИД 28158501 .
- ^ Кайта С., Башир М., Али Т. (август 2015 г.). «Железодефицитная анемия при воспалительных заболеваниях кишечника» . Всемирный журнал желудочно-кишечной патофизиологии . 6 (3): 62–72. дои : 10.4291/wjgp.v6.i3.62 . ПМК 4540708 . ПМИД 26301120 .
- ^ Ханауэр С.Б. (март 1996 г.). «Воспалительное заболевание кишечника». Медицинский журнал Новой Англии . 334 (13): 841–848. дои : 10.1056/NEJM199603283341307 . ПМИД 8596552 .
- ^ Розенберг Л., Лоулор Г.О., Зенли Т., Голдсмит Дж.Д., Гиффорд А., Фалчук К.Р. и др. (2013). «Предикторы эндоскопического воспаления у больных язвенным колитом в клинической ремиссии» . Воспалительные заболевания кишечника . 19 (4): 779–784. дои : 10.1097/MIB.0b013e3182802b0e . ПМЦ 3749843 . ПМИД 23446338 .
- ^ Jump up to: Перейти обратно: а б с д и ж Колия Р., Коррадо А., Канаторе Ф.П. (декабрь 2016 г.). «Ревматологические и внекишечные проявления воспалительных заболеваний кишечника». Анналы медицины . 48 (8): 577–585. дои : 10.1080/07853890.2016.1195011 . ПМИД 27310096 . S2CID 1796160 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х Рубин Д.Т., Анантакришнан А.Н., Сигел К.А., Зауэр Б.Г., Лонг М.Д. (март 2019 г.). «Клинические рекомендации ACG: язвенный колит у взрослых» . Американский журнал гастроэнтерологии . 114 (3): 384–413. doi : 10.14309/ajg.0000000000000152 . ПМИД 30840605 . S2CID 73473272 .
- ^ Фейерштейн Дж.Д., Чейфец А.С. (июль 2017 г.). «Болезнь Крона: эпидемиология, диагностика и лечение» . Труды клиники Мэйо . 92 (7): 1088–1103. дои : 10.1016/j.mayocp.2017.04.010 . ПМИД 28601423 . S2CID 20223406 .
- ^ Хаскелл Х., Эндрюс К.В., Редди С.И., Дендринос К., Фаррей Ф.А., Стукки А.Ф. и др. (ноябрь 2005 г.). «Патологические особенности и клиническое значение «обратного» илеита при язвенном колите». Американский журнал хирургической патологии . 29 (11): 1472–1481. дои : 10.1097/01.pas.0000176435.19197.88 . ПМИД 16224214 . S2CID 42108108 .
- ^ Jump up to: Перейти обратно: а б Фаучи и др. Внутренняя медицина Харрисона , 17-е изд. Нью-Йорк: McGraw-Hill Medical, 2008. ISBN 978-0-07-159991-7
- ^ Jump up to: Перейти обратно: а б "До настоящего времени" . www.uptodate.com . Проверено 8 ноября 2022 г.
- ^ "До настоящего времени" . www.uptodate.com . Проверено 9 ноября 2022 г.
- ^ Гринштейн А.Дж., Яновиц Х.Д., Сачар Д.Б. (сентябрь 1976 г.). «Внекишечные осложнения болезни Крона и язвенного колита: исследование 700 пациентов». Лекарство . 55 (5): 401–412. дои : 10.1097/00005792-197609000-00004 . ПМИД 957999 .
- ^ Бернштейн К.Н., Бланшар Дж.Ф., Роусторн П., Ю.Н. (апрель 2001 г.). «Распространенность внекишечных заболеваний при воспалительных заболеваниях кишечника: популяционное исследование». Американский журнал гастроэнтерологии . 96 (4): 1116–1122. дои : 10.1111/j.1572-0241.2001.03756.x . ПМИД 11316157 .
- ^ Харборд М., Аннесе В., Ваврика С.Р., Аллес М., Баррейро-де Акоста М., Боберг К.М. и др. (март 2016 г.). «Первый европейский консенсус, основанный на фактических данных, относительно внекишечных проявлений воспалительных заболеваний кишечника». Журнал Крона и колита . 10 (3): 239–254. doi : 10.1093/ecco-jcc/jjv213 . ПМИД 26614685 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м Фейерштейн Дж.Д., Мосс AC, Фаррей Ф.А. (июль 2019 г.). "Язвенный колит" . Труды клиники Мэйо . 94 (7): 1357–1373. дои : 10.1016/j.mayocp.2019.01.018 . ПМИД 31272578 .
- ^ Ланган Р.К., Готч П.Б., Крафчик М.А., Скиллиндж Д.Д. (ноябрь 2007 г.). «Язвенный колит: диагностика и лечение». Американский семейный врач . 76 (9): 1323–1330. ПМИД 18019875 .
- ^ Ваврика С.Р., Шопфер А., Шарл М., Лакатос П.Л., Наварини А., Роглер Г. (август 2015 г.). «Внекишечные проявления воспалительных заболеваний кишечника» . Воспалительные заболевания кишечника . 21 (8): 1982–1992. doi : 10.1097/MIB.0000000000000392 . ПМЦ 4511685 . ПМИД 26154136 .
- ^ Jump up to: Перейти обратно: а б с д Мухвич-Урек М, Томак-Стойменович М, Мияндрушич-Синчич Б (июль 2016 г.). «Патология полости рта при воспалительных заболеваниях кишечника» . Всемирный журнал гастроэнтерологии . 22 (25): 5655–5667. дои : 10.3748/wjg.v22.i25.5655 . ПМЦ 4932203 . ПМИД 27433081 .
- ^ Jump up to: Перейти обратно: а б с Тронкосо Л.Л., Бьянкарди А.Л., де Мораес Х.В., Залтман К. (август 2017 г.). «Офтальмологические проявления у больных воспалительными заболеваниями кишечника: обзор» . Всемирный журнал гастроэнтерологии . 23 (32): 5836–5848. дои : 10.3748/wjg.v23.i32.5836 . ПМЦ 5583569 . ПМИД 28932076 .
- ^ Шенберг С., Стоккерманс Т.Дж. (январь 2020 г.). Эписклерит . СтатПерлз. ПМИД 30521217 .
- ^ Jump up to: Перейти обратно: а б с д и ж г Лангхольц Э. (март 2010 г.). «Современные тенденции воспалительных заболеваний кишечника: естественное течение» . Терапевтические достижения в гастроэнтерологии . 3 (2): 77–86. дои : 10.1177/1756283X10361304 . ПМК 3002570 . ПМИД 21180592 .
- ^ Jump up to: Перейти обратно: а б Фархи Д., Коснес Дж., Зизи Н., Чозидов О., Сексик П., Божери Л. и др. (сентябрь 2008 г.). «Значение узловатой эритемы и гангренозной пиодермии при воспалительных заболеваниях кишечника: когортное исследование 2402 пациентов» . Лекарство . 87 (5): 281–293. дои : 10.1097/MD.0b013e318187cc9c . ISSN 1536-5964 . ПМИД 18794711 . S2CID 6905740 .
- ^ Чен WT, Чи CC (1 сентября 2019 г.). «Связь гнойного гидраденита с воспалительным заболеванием кишечника: систематический обзор и метаанализ» . JAMA Дерматология . 155 (9): 1022–1027. doi : 10.1001/jamadermatol.2019.0891 . ISSN 2168-6084 . ПМК 6625071 . ПМИД 31290938 .
- ^ Jump up to: Перейти обратно: а б с Ченг К., Фэй А.С. (март 2020 г.). «Венозная тромбоэмболия при воспалительных заболеваниях кишечника» . Всемирный журнал гастроэнтерологии . 26 (12): 1231–1241. дои : 10.3748/wjg.v26.i12.1231 . ПМК 7109271 . ПМИД 32256013 . S2CID 214946656 .
- ^ Jump up to: Перейти обратно: а б Нгуен Г.К., Бернштейн К.Н., Биттон А., Чан А.К., Гриффитс А.М., Леонтиадис Г.И. и др. (март 2014 г.). «Консенсусные заявления о риске, профилактике и лечении венозной тромбоэмболии при воспалительных заболеваниях кишечника: Канадская ассоциация гастроэнтерологов». Гастроэнтерология . 146 (3): 835–848.e6. дои : 10.1053/j.gastro.2014.01.042 . ПМИД 24462530 .
- ^ Андраде А.Р., Баррос Л.Л., Азеведо М.Ф., Карлос А.С., Дамиан А.О., Сипахи А.М. и др. (апрель 2018 г.). «Риск тромбоза и смертности при воспалительных заболеваниях кишечника» . Клиническая и трансляционная гастроэнтерология . 9 (4): 142. дои : 10.1038/s41424-018-0013-8 . ПМК 5886983 . ПМИД 29618721 .
- ^ Олссон Р., Даниэльссон А., Ярнерот Г., Линдстрем Э., Лёф Л., Рольни П. и др. (май 1991 г.). «Распространенность первичного склерозирующего холангита у больных язвенным колитом». Гастроэнтерология . 100 (5, ч. 1): 1319–1323. дои : 10.1016/0016-5085(91)90784-I . ПМИД 2013375 .
- ^ Расмуссен Х.Х., Фаллингборг Дж.Ф., Мортенсен П.Б., Выберг М., Таге-Йенсен У., Расмуссен С.Н. (июнь 1997 г.). «Гепатобилиарная дисфункция и первичный склерозирующий холангит у больных болезнью Крона» . Скандинавский журнал гастроэнтерологии . 32 (6): 604–610. дои : 10.3109/00365529709025107 . ISSN 0036-5521 . ПМИД 9200295 .
- ^ Начимуту С. «Болезнь Крона» . Электронная медицинаЗдоровье . Архивировано из оригинала 9 декабря 2019 года . Проверено 8 декабря 2019 г.
- ^ Ко И.К., Ким Б.Г., Авадалла А., Микулан Дж., Лин П., Леттерио Дж.Дж. и др. (июль 2010 г.). «Нацеливание улучшает лечение МСК воспалительных заболеваний кишечника» . Молекулярная терапия . 18 (7): 1365–1372. дои : 10.1038/mt.2010.54 . ПМЦ 2911249 . ПМИД 20389289 .
- ^ Jump up to: Перейти обратно: а б Орхольм М., Биндер В., Соренсен Т.И., Расмуссен Л.П., Кивик КО (октябрь 2000 г.). «Соответствие воспалительных заболеваний кишечника среди датских близнецов. Результаты общенационального исследования». Скандинавский журнал гастроэнтерологии . 35 (10): 1075–1081. дои : 10.1080/003655200451207 . ПМИД 11099061 . S2CID 218907577 .
- ^ Тыск С., Линдберг Э., Ярнерот Г., Флодирус-Мирхед Б. (июль 1988 г.). «Язвенный колит и болезнь Крона в неотобранной популяции монозиготных и дизиготных близнецов. Исследование наследственности и влияния курения» . Гут . 29 (7): 990–996. дои : 10.1136/gut.29.7.990 . ПМЦ 1433769 . ПМИД 3396969 .
- ^ Jump up to: Перейти обратно: а б с Баумгарт, округ Колумбия, Сэндборн, WJ (май 2007 г.). «Воспалительные заболевания кишечника: клинические аспекты, существующие и развивающиеся методы лечения». Ланцет . 369 (9573): 1641–57. дои : 10.1016/S0140-6736(07)60751-X . ПМИД 17499606 . S2CID 35264387 .
- ^ Чо Дж.Х., Николае Д.Л., Рамос Р., Филдс К.Т., Рабенау К., Коррадино С. и др. (май 2000 г.). «Сцепление и неравновесие по сцеплению в хромосомной полосе 1p36 у американских халдеев с воспалительным заболеванием кишечника» . Молекулярная генетика человека . 9 (9): 1425–1432. дои : 10.1093/hmg/9.9.1425 . ПМИД 10814724 .
- ^ Шах А., Уокер М., Бургер Д., Мартин Н., фон Вульфен М., Колоски Н. и др. (август 2019 г.). «Связь между целиакией и воспалительным заболеванием кишечника». Журнал клинической гастроэнтерологии . 53 (7): 514–522. дои : 10.1097/MCG.0000000000001033 . ПМИД 29762265 . S2CID 44102071 .
- ^ Фу Ю, Ли CH, Чи CC (декабрь 2018 г.). «Связь псориаза с воспалительными заболеваниями кишечника: систематический обзор и метаанализ» . JAMA Дерматология . 154 (12): 1417–1423. дои : 10.1001/jamadermatol.2018.3631 . ПМК 6583370 . ПМИД 30422277 .
- ^ Кацанос К.Х., Вулгари П.В., Цианос Е.В. (август 2012 г.). «Воспалительные заболевания кишечника и волчанка: систематический обзор литературы» . Журнал Крона и колита . 6 (7): 735–742. дои : 10.1016/j.crohns.2012.03.005 . ПМИД 22504032 .
- ^ Чен Ю, Чен Л, Син С, Дэн Г, Цзэн Ф, Се Т и др. (июнь 2020 г.). «Риск развития ревматоидного артрита у пациентов с воспалительными заболеваниями кишечника: систематический обзор и метаанализ» . БМК Гастроэнтерология . 20 (1): 192. дои : 10.1186/s12876-020-01339-3 . ПМК 7301504 . ПМИД 32552882 .
- ^ Зиг И., Бек К., Керстен У., Досс М.О. (ноябрь 1991 г.). «Проявление острой интермиттирующей порфирии у больных хроническими воспалительными заболеваниями кишечника». Журнал гастроэнтерологии . 29 (11): 602–605. ПМИД 1771936 .
- ^ Сюй Л, Локхед П., Ко Ю, Клаггетт Б, Леонг Р.В., Анантакришнан А.Н. (ноябрь 2017 г.). «Систематический обзор с метаанализом: грудное вскармливание и риск болезни Крона и язвенного колита» . Алиментарная фармакология и терапия . 46 (9): 780–789. дои : 10.1111/кв.14291 . ПМЦ 5688338 . ПМИД 28892171 .
- ^ Коррао Дж., Траньоне А., Каприлли Р., Траллори Г., Папи С., Андреоли А. и др. (июнь 1998 г.). «Риск воспалительных заболеваний кишечника, связанных с курением, пероральными контрацептивами и грудным вскармливанием в Италии: общенациональное исследование случай-контроль. Совместные исследователи Итальянской группы по изучению толстой и прямой кишки (GISC)» . Международный журнал эпидемиологии . 27 (3): 397–404. дои : 10.1093/ije/27.3.397 . ПМИД 9698126 .
- ^ Вулвертон SE, Харпер Дж. К. (апрель 2013 г.). «Важные разногласия, связанные с терапией изотретиноином прыщей». Американский журнал клинической дерматологии . 14 (2): 71–76. дои : 10.1007/s40257-013-0014-z . ПМИД 23559397 . S2CID 918753 .
- ^ Ярнерот Г., Ярнмарк I, Нильссон К. (ноябрь 1983 г.). «Потребление рафинированного сахара пациентами с болезнью Крона, язвенным колитом или синдромом раздраженного кишечника». Скандинавский журнал гастроэнтерологии . 18 (8): 999–1002. дои : 10.3109/00365528309181832 . ПМИД 6673083 .
- ^ Герлинг Б.Дж., Дагнели ПК, Бадарт-Смук А., Рассел М.Г., Стокбрюггер Р.В., Брюммер Р.Дж. (апрель 2000 г.). «Диета как фактор риска развития язвенного колита». Американский журнал гастроэнтерологии . 95 (4): 1008–1013. дои : 10.1111/j.1572-0241.2000.01942.x . ПМИД 10763951 . S2CID 11295804 .
- ^ Джоветт С.Л., Сил С.Дж., Пирс М.С., Филлипс Э., Грегори В., Бартон Дж.Р. и др. (октябрь 2004 г.). «Влияние диетических факторов на клиническое течение язвенного колита: проспективное когортное исследование» . Гут . 53 (10): 1479–1484. дои : 10.1136/gut.2003.024828 . ПМЦ 1774231 . ПМИД 15361498 .
- ^ Андерсен В., Олсен А., Карбоннел Ф., Тьённеланд А., Фогель У. (март 2012 г.). «Диета и риск воспалительных заболеваний кишечника». Болезни пищеварения и печени . 44 (3): 185–194. дои : 10.1016/j.dld.2011.10.001 . ПМИД 22055893 .
- ^ Тилг Х., Касер А. (октябрь 2004 г.). «Диета и рецидивирующий язвенный колит: отказаться от мяса?» . Гут . 53 (10): 1399–1401. дои : 10.1136/gut.2003.035287 . ПМЦ 1774255 . ПМИД 15361484 .
- ^ Мур Дж., Бэбидж В., Миллард С., Родигер В. (январь 1998 г.). «Сероводород в просвете толстой кишки не повышается при язвенном колите». Пищеварительные заболевания и науки . 43 (1): 162–165. дои : 10.1023/А:1018848709769 . ПМИД 9508519 . S2CID 20919357 .
- ^ Йоргенсен Дж., Мортенсен П.Б. (август 2001 г.). «Сероводород и метаболизм эпителия толстой кишки: последствия язвенного колита». Пищеварительные заболевания и науки . 46 (8): 1722–1732. дои : 10.1023/A:1010661706385 . ПМИД 11508674 . S2CID 30373968 .
- ^ Пиктон Р., Эгго М.К., Лангман М.Дж., Сингх С. (февраль 2007 г.). «Нарушение детоксикации сероводорода при язвенном колите?». Пищеварительные заболевания и науки . 52 (2): 373–378. дои : 10.1007/s10620-006-9529-y . ПМИД 17216575 . S2CID 22547709 .
- ^ Николь В. (2013). «ПФОК и рак в сообществе с высокой степенью воздействия: новые результаты научной группы C8» . Перспективы гигиены окружающей среды . 121 (11–12): А340. дои : 10.1289/ehp.121-A340 . ПМЦ 3855507 . ПМИД 24284021 .
- ^ Jump up to: Перейти обратно: а б Рёдигер В.Е., Мур Дж., Бэбидж В. (август 1997 г.). «Сульфид толстой кишки в патогенезе и лечении язвенного колита». Пищеварительные заболевания и науки . 42 (8): 1571–1579. дои : 10.1023/А:1018851723920 . ПМИД 9286219 . S2CID 25496705 .
- ^ Пирс ES (2018). «Может ли Mycobacterium avium subspecies paratuberculosis вызывать болезнь Крона, язвенный колит… и колоректальный рак?» . Инфекционные агенты и рак . 13 :1. дои : 10.1186/s13027-017-0172-3 . ПМЦ 5753485 . ПМИД 29308085 .
- ^ Элсон К.О., Конг Ю., Уивер К.Т., Шоб Т.Р., МакКланахан Т.К., Фик Р.Б. и др. (2007). «Моноклональный анти-интерлейкин 23 обращает вспять активный колит на модели, опосредованной Т-клетками, на мышах». Гастроэнтерология . 132 (7): 2359–70. дои : 10.1053/j.gastro.2007.03.104 . ПМИД 17570211 .
- ^ Левин Дж., Эллис С.Дж., Ферн Дж.К., Спрингфилд Дж., Левитт, доктор медицинских наук (январь 1998 г.). «Продукция фекального сероводорода при язвенном колите». Американский журнал гастроэнтерологии . 93 (1): 83–87. дои : 10.1111/j.1572-0241.1998.083_c.x . ПМИД 9448181 . S2CID 3141574 .
- ^ Jump up to: Перейти обратно: а б Дассопулос Т., Коэн Р.Д., Шерл Э.Дж., Шварц Р.М., Косински Л., Регейру, доктор медицинских наук (июль 2015 г.). «Путь лечения язвенного колита». Гастроэнтерология . 149 (1): 238–245. дои : 10.1053/j.gastro.2015.05.036 . ПМИД 26025078 .
- ^ Jump up to: Перейти обратно: а б с д и Николаус С., Шрайбер С. (ноябрь 2007 г.). «Диагностика воспалительных заболеваний кишечника» . Гастроэнтерология . 133 (5): 1670–1689. дои : 10.1053/j.gastro.2007.09.001 . ISSN 1528-0012 . ПМИД 17983810 .
- ^ Язвенный колит в электронной медицине.
- ^ Уолмсли Р.С., Эйрс Р.К., Паундер Р.Э., Аллан Р.Н. (июль 1998 г.). «Простой клинический индекс активности колита» . Гут . 43 (1): 29–32. дои : 10.1136/gut.43.1.29 . ПМЦ 1727189 . ПМИД 9771402 .
- ^ Jump up to: Перейти обратно: а б Лэмб К.А., Кеннеди Н.А., Рейн Т., Хенди П.А., Смит П.Дж., Лимди Дж.К. и др. (декабрь 2019 г.). «Консенсусные рекомендации Британского общества гастроэнтерологов по лечению воспалительных заболеваний кишечника у взрослых» . Гут . 68 (Приложение 3): с1–с106. дои : 10.1136/gutjnl-2019-318484 . ПМК 6872448 . ПМИД 31562236 .
- ^ Политис Д.С., Папамихаэль К., Кацанос К.Х., Кулуридис И., Мавромати Д., Цианос Е.В. и др. (март 2019 г.). «Наличие псевдополипов при язвенном колите связано с более высоким риском эскалации лечения» . Анналы гастроэнтерологии . 32 (2): 168–173. дои : 10.20524/aog.2019.0357 . ПМК 6394261 . ПМИД 30837789 .
- ^ «Информация о продукте азатиоприна» (PDF) . Доступ к FDA . Управление по контролю за продуктами и лекарствами.
- ^ Дигнасс А.У., Гаше С., Беттенворт Д., Биргегорд Г., Данезе С., Гисберт Дж.П. и др. (март 2015 г.). «Европейский консенсус по диагностике и лечению дефицита железа и анемии при воспалительных заболеваниях кишечника» . Журнал Крона и колита . 9 (3): 211–222. дои : 10.1093/ecco-jcc/jju009 . ПМИД 25518052 .
- ^ Дель Пинто Р., Пьетропаоли Д., Чандар А.К., Ферри С., Коминелли Ф. (ноябрь 2015 г.). «Связь между воспалительным заболеванием кишечника и дефицитом витамина D: систематический обзор и метаанализ» . Воспалительные заболевания кишечника . 21 (11): 2708–2717. doi : 10.1097/MIB.0000000000000546 . ПМЦ 4615394 . ПМИД 26348447 .
- ^ Мосли М.Х., Зоу Г., Гарг С.К., Фиган С.Г., Макдональд Дж.К., Чанде Н. и др. (июнь 2015 г.). «С-реактивный белок, фекальный кальпротектин и лактоферрин кала для обнаружения эндоскопической активности у пациентов с симптоматическим воспалительным заболеванием кишечника: систематический обзор и метаанализ». Американский журнал гастроэнтерологии . 110 (6): 802–19, викторина 820. doi : 10.1038/ajg.2015.120 . ПМИД 25964225 . S2CID 26111716 .
- ^ Брайант Р.В., Фридман А.Б., Райт Е.К., Тейлор К.М., Бегун Дж., Макони Г. и др. (май 2018 г.). «УЗИ желудочно-кишечного тракта при воспалительных заболеваниях кишечника: недостаточно используемый ресурс с потенциальным изменением парадигмы». Гут . 67 (5): 973–985. дои : 10.1136/gutjnl-2017-315655 . ПМИД 29437914 . S2CID 3344377 .
- ^ Аллокка М., Филиппи Е., Константино А., Боновас С., Фиорино Г., Фурфаро Ф. и др. (май 2021 г.). «Миланские ультразвуковые критерии точны при оценке активности заболевания при язвенном колите: внешняя проверка» . Объединенный европейский гастроэнтерологический журнал . 9 (4): 438–442. дои : 10.1177/2050640620980203 . ПМЦ 8259285 . ПМИД 33349199 .
- ^ Аллокка М., Фиорино Г., Боновас С., Фурфаро Ф., Джиларди Д., Арголло М. и др. (28 ноября 2018 г.). «Точность ультразвуковых критериев Humanitas в оценке активности и тяжести заболевания при язвенном колите: проспективное исследование» . Журнал Крона и колита . 12 (12): 1385–1391. doi : 10.1093/ecco-jcc/jjy107 . ПМК 6260119 . ПМИД 30085066 .
- ^ Ширли Д.А., Муна С. (июль 2016 г.). «Фульминантный амебный колит после терапии кортикостероидами: систематический обзор» . PLOS Забытые тропические болезни . 10 (7): e0004879. дои : 10.1371/journal.pntd.0004879 . ПМЦ 4965027 . ПМИД 27467600 .
- ^ Тремейн WJ (апрель 2012 г.). «Можно ли определить неопределенный колит?». Текущие отчеты гастроэнтерологии . 14 (2): 162–165. дои : 10.1007/s11894-012-0244-x . ПМИД 22314810 . S2CID 40346031 .
- ^ Ким Б., Барнетт Дж.Л., Клир К.Г., Аппельман Х.Д. (ноябрь 1999 г.). «Эндоскопическая и гистологическая пятнистость при лечении язвенного колита» . Американский журнал гастроэнтерологии . 94 (11): 3258–3262. дои : 10.1111/j.1572-0241.1999.01533.x . hdl : 2027.42/74642 . ISSN 0002-9270 . PMID 10566726 . S2CID 11446833 .
- ^ Вудрафф Дж. М., Хансен Дж. А., Гуд Р. А., Сантос Г. В., Славин Р. Е. (декабрь 1976 г.). «Патология реакции трансплантат против хозяина (РТВХ) у взрослых, получающих трансплантацию костного мозга» . Процедура трансплантации . 8 (4): 675–684. ISSN 0041-1345 . ПМИД 11596 .
- ^ Jump up to: Перейти обратно: а б с Ханауэр С.Б., Сэндборн В. (март 2001 г.). «Лечение болезни Крона у взрослых» . Американский журнал гастроэнтерологии . 96 (3): 635–43. doi : 10.1111/j.1572-0241.2001.3671_c.x (неактивен 31 января 2024 г.). ПМИД 11280528 . S2CID 31219115 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка ) - ^ Бруме Ю, Бергквист А (февраль 2006 г.). «Первичный склерозирующий холангит, воспалительные заболевания кишечника и рак толстой кишки». Семинары по заболеваниям печени . 26 (1): 31–41. дои : 10.1055/s-2006-933561 . ПМИД 16496231 . S2CID 260320940 .
- ^ Шепард Н.А. (август 2002 г.). «Гранулемы в диагностике кишечной болезни Крона: развенчание мифа?». Гистопатология . 41 (2): 166–8. дои : 10.1046/j.1365-2559.2002.01441.x . ПМИД 12147095 . S2CID 36907992 .
- ^ Махадева У., Мартин Дж.П., Патель Н.К., Прайс А.Б. (июль 2002 г.). «Гранулематозный язвенный колит: переоценка гранулемы слизистой оболочки в отличии болезни Крона от язвенного колита». Гистопатология . 41 (1): 50–5. дои : 10.1046/j.1365-2559.2002.01416.x . ПМИД 12121237 . S2CID 29476514 .
- ^ ДеРош Т.К., Сяо С.Ю., Лю Икс (август 2014 г.). «Гистологическая оценка язвенного колита» . Отчет гастроэнтеролога . 2 (3): 178–92. дои : 10.1093/гастро/gou031 . ПМК 4124271 . ПМИД 24942757 .
- ^ Чен Дж.Х., Эндрюс Дж.М., Кариявасам В., Моран Н., Гундер П., Коллинз Г. и др. (июль 2016 г.). «Обзорная статья: острый тяжелый язвенный колит – консенсусные утверждения, основанные на фактических данных» . Алиментарная фармакология и терапия . 44 (2): 127–144. дои : 10.1111/кв.13670 . ПМИД 27226344 .
- ^ «Следует ли вам попробовать диету с низким содержанием остатков?» . ВебМД . 25 октября 2016 г. Проверено 29 апреля 2017 г.
- ^ Руководство по управлению клиническим питанием (PDF) . Группа компаний «Компас». 2013.
- ^ Ронкорони Л., Гори Р., Элли Л. и др. Питание у пациентов с воспалительными заболеваниями кишечника: обзор повествования. Питательные вещества. 2022;14(4):751. Опубликовано 10 февраля 2022 г. doi:10.3390/nu14040751
- ^ Jump up to: Перейти обратно: а б Хэм М., Мосс AC (2012). «Месаламин в лечении и поддержании ремиссии язвенного колита» . Экспертное обозрение клинической фармакологии . 5 (2): 113–123. дои : 10.1586/ecp.12.2 . ISSN 1751-2433 . ПМЦ 3314328 . ПМИД 22390554 .
- ^ Jump up to: Перейти обратно: а б Рейн Т., Боновас С., Буриш Дж., Кучарзик Т., Адамина М., Аннесе В. и др. (28 января 2022 г.). «Руководство ECCO по терапии язвенного колита: медикаментозное лечение». Журнал Крона и колита . 16 (1): 2–17. doi : 10.1093/ecco-jcc/jjab178 . ISSN 1873-9946 . ПМИД 34635919 .
- ^ Jump up to: Перейти обратно: а б с Фейерштейн Дж.Д., Исаакс К.Л., Шнайдер Ю., Сиддик С.М., Фальк-Иттер Ю., Сингх С. (апрель 2020 г.). «Клинические практические рекомендации AGA по ведению умеренного и тяжелого язвенного колита» . Гастроэнтерология . 158 (5): 1450–1461. doi : 10.1053/j.gastro.2020.01.006 . ПМЦ 7175923 . ПМИД 31945371 .
- ^ Сэндборн В (2002). «Рациональный выбор пероральных форм 5-аминосалицилата и пролекарств для лечения язвенного колита». Американский журнал гастроэнтерологии . 97 (12): 2939–2941. дои : 10.1016/S0002-9270(02)05509-0 . ПМИД 12492172 .
- ^ Ко К.В., Сингх С., Фейерштейн Дж.Д., Фальк-Иттер С., Фальк-Иттер Ю., Кросс Р.К. и др. (2019). «Клинические практические рекомендации AGA по ведению язвенного колита легкой и средней степени тяжести» . Гастроэнтерология . 156 (3): 748–764. дои : 10.1053/j.gastro.2018.12.009 . ПМК 6858922 . ПМИД 30576644 .
- ^ «FDA одобрило Uceris в качестве средства для лечения язвенного колита» . Хелио Гастроэнтерология . 15 января 2013 г.
- ^ «Этикетка таблеток пролонгированного действия UCERIS (будесонид)» (PDF) . FDA.
- ^ «FDA одобряет новое лечение язвенного колита средней и тяжелой степени активности» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 30 мая 2018 года . Проверено 31 мая 2018 г.
- ^ Чанде Н., Ван Й., Макдональд Дж.К., Макдональд Дж.В. (август 2014 г.). «Метотрексат для индукции ремиссии при язвенном колите» . Кокрановская база данных систематических обзоров . 8 (8): CD006618. дои : 10.1002/14651858.CD006618.pub3 . ПМК 6486224 . ПМИД 25162749 .
- ^ Кришнамурти Р., Абрамс К.Р., Гатри Н., Сэмюэл С., Томас Т. (28 мая 2012 г.). «Циклоспорин PWE-237 при остром тяжелом язвенном колите: метаанализ» . Гут . 61 (Приложение 2): А394.2–А394. дои : 10.1136/gutjnl-2012-302514d.237 . S2CID 74798482 .
- ^ Огата Х., Като Дж., Хираи Ф., Хида Н., Мацуи Т., Мацумото Т. и др. (май 2012 г.). «Двойное слепое плацебо-контролируемое исследование перорального такролимуса (FK506) при лечении госпитализированных пациентов с стероидорефрактерным язвенным колитом» . Воспалительные заболевания кишечника . 18 (5): 803–808. дои : 10.1002/ibd.21853 . ПМИД 21887732 . S2CID 1294555 .
- ^ Лихтигер С., Настоящий Д.Х., Корнблут А., Гелернт И., Бауэр Дж., Галлер Г. и др. (июнь 1994 г.). «Циклоспорин при тяжелом язвенном колите, рефрактерном к стероидной терапии» . Медицинский журнал Новой Англии . 330 (26): 1841–1845. дои : 10.1056/NEJM199406303302601 . ПМИД 8196726 .
- ^ Вайсхоф Р., Оллех Дж.Э., Эль Джурди К., Ивеллес О.В., Коэн Р.Д., Сакураба А. и др. (сентябрь 2019 г.). «Терапия циклоспорином после неэффективности инфликсимаба у госпитализированных пациентов с острым тяжелым колитом эффективна и безопасна» . Журнал Крона и колита . 13 (9): 1105–1110. doi : 10.1093/ecco-jcc/jjz032 . ПМЦ 7327272 . PMID 30726894 .
- ^ «FDA США одобрило препарат Velsipity от Pfizer для взрослых с умеренным и тяжелым активным язвенным колитом (ЯК)» (пресс-релиз). Пфайзер. 13 октября 2023 г. Проверено 13 октября 2023 г. - через Business Wire.
- ^ Азад Хан А.К., Пирис Дж., Трулав СК (октябрь 1977 г.). «Эксперимент по определению активной терапевтической части сульфасалазина». Ланцет . 2 (8044): 892–895. дои : 10.1016/s0140-6736(77)90831-5 . ПМИД 72239 . S2CID 44785199 .
- ^ Мюррей А., Нгуен Т.М., Паркер С.Э., Фиган Б.Г., Макдональд Дж.К. (август 2020 г.). «Пероральная 5-аминосалициловая кислота для индукции ремиссии при язвенном колите» . Кокрановская база данных систематических обзоров . 2020 (8): CD000543. дои : 10.1002/14651858.CD000543.pub5 . ПМЦ 8189994 . ПМИД 32786164 .
- ^ Мюррей А., Нгуен Т.М., Паркер С.Э., Фиган Б.Г., Макдональд Дж.К. (август 2020 г.). «Пероральная 5-аминосалициловая кислота для поддержания ремиссии при язвенном колите» . Кокрановская база данных систематических обзоров . 2020 (8): CD000544. дои : 10.1002/14651858.CD000544.pub5 . ПМЦ 8094989 . ПМИД 32856298 .
- ^ Маршалл Дж.К., Табане М., Стейнхарт А.Х., Ньюман-младший, Ананд А., Ирвин Э.Дж. (ноябрь 2012 г.). «Ректальная 5-аминосалициловая кислота для поддержания ремиссии при язвенном колите». Кокрановская база данных систематических обзоров . 11 : CD004118. дои : 10.1002/14651858.CD004118.pub2 . ПМИД 23152224 .
- ^ Салахудин М.С. (июнь 2019 г.). «Обзор текущих данных, связанных с ступенчатой и нисходящей медикаментозной терапией воспалительных заболеваний кишечника». Наркотики сегодня . 55 (6): 385–405. дои : 10.1358/точка.2019.55.6.2969816 . ПМИД 31250843 . S2CID 195763151 .
- ^ Аксельрад Дж. Э., Лихтигер С., Яйник В. (май 2016 г.). «Воспалительные заболевания кишечника и рак: роль воспаления, иммуносупрессии и лечения рака» . Всемирный журнал гастроэнтерологии (обзор). 22 (20): 4794–4801. дои : 10.3748/wjg.v22.i20.4794 . ПМЦ 4873872 . ПМИД 27239106 .
- ^ Стивенс Дж.П., Балленджи С.Р., Чандрадеван Р., Томпсон А.Б., Шон Б.Т., Кугатасан С. и др. (октябрь 2019 г.). «Эффективность анализа высвобождения гамма-интерферона для скрининга туберкулеза при воспалительных заболеваниях кишечника у детей» . Журнал детской гастроэнтерологии и питания . 69 (4): e111–e116. дои : 10.1097/MPG.0000000000002428 . ПМИД 31261245 . S2CID 195771593 .
- ^ Ли С.К., Вонг С.Х., Луи Дж., Тан В., Там Л.С., Ип М. и др. (июль 2018 г.). «Проспективное исследование по мониторингу туберкулеза во время терапии противоопухолевым фактором некроза у пациентов с воспалительными заболеваниями кишечника и иммуноопосредованными воспалительными заболеваниями» . Журнал Крона и колита . 12 (8): 954–962. doi : 10.1093/ecco-jcc/jjy057 . ПМИД 29757355 . S2CID 21673794 .
- ^ Сэндборн В.Дж., Вермейр С., Пейрен-Бируле Л., Дубинский М.К., Панес Дж., Ярур А. и др. (8 апреля 2023 г.). «Этразимод в качестве индукционной и поддерживающей терапии язвенного колита (ELEVATE): два рандомизированных двойных слепых плацебо-контролируемых исследования фазы 3» . Ланцет . 401 (10383): 1159–1171. дои : 10.1016/S0140-6736(23)00061-2 . ISSN 0140-6736 . ПМИД 36871574 . S2CID 257286271 .
- ^ Калкинс Б.М. (декабрь 1989 г.). «Метаанализ роли курения при воспалительных заболеваниях кишечника». Пищеварительные заболевания и науки . 34 (12): 1841–1854. дои : 10.1007/BF01536701 . ПМИД 2598752 . S2CID 5775169 .
- ^ Лакатош П.Л., Самоши Т., Лакатош Л. (декабрь 2007 г.). «Курение при воспалительных заболеваниях кишечника: хорошо, плохо или некрасиво?» . Всемирный журнал гастроэнтерологии . 13 (46): 6134–6139. дои : 10.3748/wjg.13.6134 . ПМЦ 4171221 . ПМИД 18069751 .
- ^ Калабрезе Э., Янаи Х., Шустер Д., Рубин Д.Т., Ханауэр С.Б. (август 2012 г.). «Возобновление курения в низких дозах у бывших курильщиков с рефрактерным язвенным колитом» . Журнал Крона и колита . 6 (7): 756–762. дои : 10.1016/j.crohns.2011.12.010 . ПМИД 22398093 .
- ^ Коснес Дж. (июнь 2004 г.). «Табак и ВЗК: актуальность для понимания механизмов заболевания и клинической практики». Лучшие практики и исследования. Клиническая гастроэнтерология . 18 (3): 481–496. дои : 10.1016/j.bpg.2003.12.003 . ПМИД 15157822 .
- ^ Гусланди М. (октябрь 1999 г.). «Лечение никотином язвенного колита» . Британский журнал клинической фармакологии . 48 (4): 481–484. дои : 10.1046/j.1365-2125.1999.00039.x . ПМК 2014383 . ПМИД 10583016 .
- ^ Сэндборн У.Дж., Тремейн У.Дж., Оффорд К.П., Лоусон Г.М., Петерсен Б.Т., Баттс К.П. и др. (март 1997 г.). «Трансдермальный никотин при язвенном колите легкой и умеренной активности. Рандомизированное двойное слепое плацебо-контролируемое исследование». Анналы внутренней медицины . 126 (5): 364–371. дои : 10.7326/0003-4819-126-5-199703010-00004 . ПМИД 9054280 . S2CID 25745900 .
- ^ Бонапейс CR, Мэйс Д.А. (1997). «Эффект месаламина и никотина при лечении воспалительных заболеваний кишечника». Анналы фармакотерапии . 31 (7–8): 907–913. дои : 10.1177/106002809703100719 . ПМИД 9220055 . S2CID 24122049 .
- ^ Кеннеди LD (сентябрь 1996 г.). «Никотиновая терапия язвенного колита». Анналы фармакотерапии . 30 (9): 1022–1023. ПМИД 8876866 .
- ^ Рубин Д.Т., Ханауэр С.Б. (август 2000 г.). «Курение и воспалительные заболевания кишечника». Европейский журнал гастроэнтерологии и гепатологии . 12 (8): 855–862. дои : 10.1097/00042737-200012080-00004 . ПМИД 10958212 .
- ^ Jump up to: Перейти обратно: а б Годдард А.Ф., Джеймс М.В., Макинтайр А.С., Скотт Б.Б. и др. (Британское общество гастроэнтерологов) (октябрь 2011 г.). «Руководство по ведению железодефицитной анемии» . Гут . 60 (10): 1309–1316. дои : 10.1136/gut.2010.228874 . ПМИД 21561874 .
- ^ Гаше С., Берстад А., Бефриц Р., Беглингер С., Дигнасс А., Эриксен К. и др. (декабрь 2007 г.). «Методические рекомендации по диагностике и лечению железодефицита и анемии при воспалительных заболеваниях кишечника» . Воспалительные заболевания кишечника . 13 (12): 1545–1553. дои : 10.1002/ibd.20285 . ПМИД 17985376 .
- ^ Моват С., Коул А., Виндзор А., Ахмад Т., Арнотт И., Дрисколл Р. и др. (май 2011 г.). «Руководство по лечению воспалительных заболеваний кишечника у взрослых». Гут . 60 (5): 571–607. дои : 10.1136/gut.2010.224154 . ПМИД 21464096 . S2CID 8269837 .
- ^ О'САЛЛИВАН ПМ (1964). «Лекарственные средства от язвенного колита» . Журнал Канадской медицинской ассоциации . 91 (21). Can Med Assoc J: 1123–1124. ISSN 0008-4409 . ЧВК 1928363 . ПМИД 14229762 .
- ^ Камиллери М., Шарка Л. (14 ноября 2008 г.). «Нарушение моторики тонкой и толстой кишки». Учебник гастроэнтерологии . Уайли. стр. 1108–1156. дои : 10.1002/9781444303254.ch47 . ISBN 978-1-4051-6911-0 . S2CID 83791469 .
- ^ Аманда Фернандес, OMS IV, Рональд Януховски, DO, FACOFP (30 апреля 2020 г.). «Варианты первичной остеопатической помощи при язвенном колите». Семейный врач-остеопат . 12 (3): 10–16. дои : 10.33181/12031 . ISSN 1877-573X . S2CID 219029672 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Седано Р., Кера Р., Симиан Д., Ярур А.Дж. (3 октября 2019 г.). «Подход к острому тяжелому язвенному колиту». Экспертный обзор гастроэнтерологии и гепатологии . 13 (10). Информа UK Limited: 943–955. дои : 10.1080/17474124.2019.1681974 . ISSN 1747-4124 . PMID 31648574 . S2CID 204891274 .
- ^ Десаи Дж., Эльнаггар М., Ханфи А.А., Доши Р. (19 мая 2020 г.). «Токсический мегаколон: предыстория, патофизиология, проблемы управления и решения» . Клиническая и экспериментальная гастроэнтерология . 13 : 203–210. дои : 10.2147/CEG.S200760 . ПМЦ 7245441 . ПМИД 32547151 .
- ^ Торунер, М.; Лофтус, Э.В.; Хармсен, WS; Цинсмайстер, Арканзас; Оренштейн, Р.; Сэндборн, штат Вашингтон; Коломбель, Дж.; Иган, Л.Дж. Факторы риска развития оппортунистических инфекций у пациентов с воспалительными заболеваниями кишечника. Гастроэнтерология 2008, 134, 929–936.
- ^ Фаррей, ФА; Мелмед, Дж.Ю.; Лихтенштейн, Греция; Кейн, С.В. Клинические рекомендации ACG: Профилактика воспалительных заболеваний кишечника. Являюсь. Дж. Гастроэнтерол. 2017, 112, 241–258.
- ^ Кучарзик, Т.; Эллул, П.; Гройтер, Т.; Рахье, Дж. Ф.; Верстокт, Б.; Абреу, К.; Альбукерке, А.; Аллокка, М.; Эстев, М.; Фаррей, ФА; и др. Рекомендации ECCO по профилактике, диагностике и лечению инфекций при воспалительных заболеваниях кишечника. Колит Дж. Крона 2021, 15, 879–913.
- ^ Анантакришнан, АН; МакГинли, Э.Л. Госпитализации, связанные с инфекциями, связаны с повышенной смертностью у пациентов с воспалительными заболеваниями кишечника. Колит Дж. Крона 2013, 7, 107–112.
- ^ Уинтроп, КЛ; Мелмед, Дж.Ю.; Вермейр, С.; Лонг, доктор медицины; Чан, Г.; Педерсен, РД; Лавенди, Н.; Торп, Эй Джей; Ндуака, CI; Су, C. Инфекция опоясывающего герпеса у пациентов с язвенным колитом, получающих тофацитиниб. Воспаление. Дис. кишечника. 2018, 24, 2258–2265 гг.
- ^ Малхи, Г.; Румман, А.; Танабалан, Р.; Кроитору, К.; Сильверберг, М.С.; Стейнхарт, АХ; Нгуен, Г.К. Вакцинация пациентов с воспалительными заболеваниями кишечника: отношение, знания и понимание. Колит Дж. Крона 2015, 9, 439–444.
- ^ Константино, А.; Мишелон, М.; Новиелло, Д.; Макалузо, ФС; Леоне, С.; Бонаккорсо, Н.; Константино, К.; Векки, М.; Каприоли Ф., от имени Научного совета AMICI. Отношение к вакцинации в национальной итальянской когорте пациентов с воспалительными заболеваниями кишечника. Вакцины 2023, 11, 1591.
- ^ Jump up to: Перейти обратно: а б Агабеги ЭД, Агабеги С.С. (2008). «Воспалительное заболевание кишечника (ВЗК)». Шаг вперед к медицине (серия «Шаг вперед») . Хагерствон, доктор медицины: Липпинкотт Уильямс и Уилкинс. стр. 152–156. ISBN 0-7817-7153-6 .
- ^ Феллер М., Хувилер К., Шопфер А., Шан А., Фуррер Х., Эггер М. (февраль 2010 г.). «Долгосрочное лечение антибиотиками болезни Крона: систематический обзор и метаанализ плацебо-контролируемых исследований». Клинические инфекционные болезни . 50 (4): 473–80. дои : 10.1086/649923 . ПМИД 20067425 .
- ^ Прантера С., Скрибано М.Л. (июль 2009 г.). «Антибиотики и пробиотики при воспалительных заболеваниях кишечника: почему, когда и как» . Современное мнение в гастроэнтерологии . 25 (4): 329–33. дои : 10.1097/MOG.0b013e32832b20bf . ПМИД 19444096 .
- ^ «Жизнь со стомой» . Облегчение ВЗК.
- ^ «Колэктомия не является окончательным средством лечения язвенного колита, как показывают данные» . www.mdedge.com . Проверено 15 декабря 2019 г.
- ^ Паппоу Е.П., Киран Р.П. (июнь 2016 г.). «Неудачная сумка J» . Клиники хирургии толстой и прямой кишки . 29 (2): 123–129. дои : 10.1055/s-0036-1580724 . ПМЦ 4882179 . ПМИД 27247537 .
- ^ Jump up to: Перейти обратно: а б Кларк В.Т., Фейерштейн Дж.Д. (август 2019 г.). «Наблюдение за колоректальным раком при воспалительных заболеваниях кишечника: практические рекомендации и последние разработки» . Всемирный журнал гастроэнтерологии . 25 (30): 4148–4157. дои : 10.3748/wjg.v25.i30.4148 . ПМК 6700690 . ПМИД 31435169 . S2CID 201114672 .
- ^ Федорак Р.Н. (ноябрь 2010 г.). «Пробиотики в лечении язвенного колита» . Гастроэнтерология и гепатология . 6 (11): 688–690. ПМЦ 3033537 . ПМИД 21437015 .
- ^ Jump up to: Перейти обратно: а б с Каур Л., Гордон М., Бейнс П.А., Ихеозор-Эджиофор З., Синопулу В., Акобенг А.К. (4 марта 2020 г.). Кокрейновская группа IBD (ред.). «Пробиотики для индукции ремиссии при язвенном колите» . Кокрейновская база данных систематических обзоров . 3 (3): CD005573. дои : 10.1002/14651858.CD005573.pub3 . ПМК 7059959 . ПМИД 32128795 .
- ^ Ихеозор-Эджиофор З., Каур Л., Гордон М., Бейнс П.А., Синопулу В., Акобенг А.К. (4 марта 2020 г.). Кокрейновская группа IBD (ред.). «Пробиотики для поддержания ремиссии при язвенном колите» . Кокрейновская база данных систематических обзоров . 3 (3): CD007443. дои : 10.1002/14651858.CD007443.pub3 . ПМК 7059960 . ПМИД 32128794 .
- ^ Бороди Т.Дж., Брандт Л.Дж., Парамсоти С. (январь 2014 г.). «Терапевтическая трансплантация фекальной микробиоты: современное состояние и будущие разработки» . Современное мнение в гастроэнтерологии . 30 (1): 97–105. дои : 10.1097/MOG.0000000000000027 . ПМЦ 3868025 . ПМИД 24257037 .
- ^ Нарула Н., Кассам З., Юань Ю., Коломбель Дж.Ф., Понсиен С., Рейниш В. и др. (октябрь 2017 г.). «Систематический обзор и метаанализ: трансплантация фекальной микробиоты для лечения активного язвенного колита» . Воспалительные заболевания кишечника . 23 (10): 1702–1709. дои : 10.1097/MIB.0000000000001228 . ПМИД 28906291 .
- ^ Ши Ю, Донг Ю, Хуан В, Чжу Д, Мао Х, Су П (2016). «Трансплантация фекальной микробиоты при язвенном колите: систематический обзор и метаанализ» . ПЛОС ОДИН . 11 (6): e0157259. Бибкод : 2016PLoSO..1157259S . дои : 10.1371/journal.pone.0157259 . ПМЦ 4905678 . ПМИД 27295210 .
- ^ Костелло С.П., Хьюз П.А., Уотерс О., Брайант Р.В., Винсент А.Д., Блатчфорд П. и др. (январь 2019 г.). «Влияние трансплантации фекальной микробиоты на 8-недельную ремиссию у пациентов с язвенным колитом: рандомизированное клиническое исследование» . ДЖАМА . 321 (2): 156–164. дои : 10.1001/jama.2018.20046 . ПМК 6439766 . ПМИД 30644982 .
- ^ Ханаи Х., Иида Т., Такеучи К., Ватанабэ Ф., Маруяма Ю., Андо А. и др. (декабрь 2006 г.). «Поддерживающая терапия куркумином при язвенном колите: рандомизированное, многоцентровое, двойное слепое, плацебо-контролируемое исследование» . Клиническая гастроэнтерология и гепатология . 4 (12): 1502–1506. дои : 10.1016/j.cgh.2006.08.008 . ПМИД 17101300 .
- ^ Jump up to: Перейти обратно: а б Кумар С., Ахуджа В., Санкар М.Дж., Кумар А., Мосс AC (октябрь 2012 г.). «Куркумин для поддержания ремиссии при язвенном колите» . Кокрановская база данных систематических обзоров . 10 : CD008424. дои : 10.1002/14651858.CD008424.pub2 . ПМК 4001731 . ПМИД 23076948 .
- ^ Кафил Т.С., Нгуен Т.М., Макдональд Дж.К., Чанде Н. (ноябрь 2018 г.). «Каннабис для лечения язвенного колита» . Кокрановская база данных систематических обзоров . 11 (11): CD012954. дои : 10.1002/14651858.CD012954.pub2 . ПМК 6516819 . ПМИД 30406638 .
- ^ Синопулу В., Гордон М., Дови Т.М., Акобенг А.К. и др. (Кокрейновская группа Gut) (июль 2021 г.). «Вмешательства по лечению болей в животе при язвенном колите» . Кокрановская база данных систематических обзоров . 2021 (7): CD013589. дои : 10.1002/14651858.CD013589.pub2 . ПМЦ 8407332 . ПМИД 34291816 .
- ^ Де Соуза, Х.; Фиокки, К.; Илиопулос, Д. Интерактом ВЗК: комплексный взгляд на этиологию, патогенез и терапию. Нат. Преподобный Гастроэнтерол. Гепатол. 2017, 14, 739–749.
- ^ Ронкорони Л., Гори Р., Элли Л., Тонтини Дж.Е., Донеда Л., Норса Л. и др. (10 февраля 2022 г.). «Питание у пациентов с воспалительными заболеваниями кишечника: обзор повествования» . Питательные вещества . 14 (4): 751. дои : 10.3390/nu14040751 . ISSN 2072-6643 . ПМЦ 8879392 . ПМИД 35215401 .
 В эту статью включен текст из этого источника, доступного по лицензии CC BY 4.0 .
В эту статью включен текст из этого источника, доступного по лицензии CC BY 4.0 . - ^ Фракас Э., Константино А., Векки М., Буоли М. Депрессивные и тревожные расстройства у пациентов с воспалительными заболеваниями кишечника: есть ли гендерные различия? Международный журнал экологических исследований и общественного здравоохранения. 2023 год; 20(13):6255. https://doi.org/10.3390/ijerph20136255
- ^ Барберио Б, Замани М, Блэк СиДжей, Саварино Э.В., Форд AC. Распространенность симптомов тревоги и депрессии у пациентов с воспалительными заболеваниями кишечника: систематический обзор и метаанализ. Ланцет Гастроэнтерол Гепатол. Май 2021 г.;6(5):359–370. дои: 10.1016/S2468-1253(21)00014-5
- ^ Кеванс Д., Мурти С., Молд Д.Р., Сильверберг М.С. (май 2018 г.). «Ускоренный клиренс инфликсимаба связан с неудачей лечения у пациентов с острым язвенным колитом, резистентным к кортикостероидам» . Журнал Крона и колита . 12 (6): 662–669. doi : 10.1093/ecco-jcc/jjy028 . ПМИД 29659758 .
- ^ Хорио Ю., Учино М., Бандо Т., Чоно Т., Сасаки Х., Хирата А. и др. (май 2017 г.). «Ректально-сохраняющий тип язвенного колита предсказывает отсутствие ответа на фармакотерапию» . БМК Хирургия . 17 (1): 59. дои : 10.1186/s12893-017-0255-5 . ПМЦ 5437574 . ПМИД 28526076 .
- ^ Остерман М.Т., Лихтенштейн Г.Р. (2010). "Язвенный колит". Желудочно-кишечная болезнь и болезнь печени Слейзенгера и Фордтрана . стр. 1975–2013.e9. дои : 10.1016/B978-1-4160-6189-2.00112-8 . ISBN 9781416061892 .
- ^ Патил Д.Т., Одзе Р.Д. (август 2017 г.). «Обратная промывка - это чушь: клиническое значение илеита при язвенном колите». Американский журнал гастроэнтерологии . 112 (8): 1211–1214. дои : 10.1038/ajg.2017.182 . ПМИД 28631729 . S2CID 10801391 .
- ^ Лейтон Дж.А., Шен Б., Барон Т.Х., Адлер Д.Г., Давила Р., Иган Дж.В. и др. (апрель 2006 г.). «Руководство ASGE: эндоскопия в диагностике и лечении воспалительных заболеваний кишечника». Желудочно-кишечная эндоскопия . 63 (4): 558–565. дои : 10.1016/j.gie.2006.02.005 . ПМИД 16564852 .
- ^ Jump up to: Перейти обратно: а б Джесс Т., Гамборг М., Мункхольм П., Соренсен Т.И. (март 2007 г.). «Общая смертность и смертность от конкретных причин при язвенном колите: метаанализ популяционных когортных исследований». Американский журнал гастроэнтерологии . 102 (3): 609–617. дои : 10.1111/j.1572-0241.2006.01000.x . ПМИД 17156150 . S2CID 2086542 .
- ^ да Силва БК, Лира AC, Роша Р, Сантана ГО (июль 2014 г.). «Эпидемиология, демографические характеристики и прогностические предикторы язвенного колита» . Всемирный журнал гастроэнтерологии . 20 (28): 9458–9467. дои : 10.3748/wjg.v20.i28.9458 . ПМК 4110577 . ПМИД 25071340 .
- ^ Нгуен М., Брэдфорд К., Чжан X, Ши Д.К. (январь 2011 г.). «Реактивация цитомегаловируса у больных язвенным колитом» . Язвы . 2011 : 1–7. дои : 10.1155/2011/282507 . ПМК 3124815 . ПМИД 21731826 .
- ^ Вос Т., Аллен С., Арора М., Барбер Р.М., Бхутта З.А., Браун А. и др. (Сотрудники ГББ 2015 г. по заболеваемости и распространенности заболеваний и травм) (октябрь 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и количество лет жизни с инвалидностью по 310 заболеваниям и травмам, 1990–2015 гг.: систематический анализ для исследования глобального бремени болезней 2015 г.» . Ланцет . 388 (10053): 1545–1602. дои : 10.1016/S0140-6736(16)31678-6 . ПМК 5055577 . ПМИД 27733282 .
- ^ Jump up to: Перейти обратно: а б Адамс Дж.Г. (2012). Электронная книга по неотложной медицинской помощи: Основы клинической практики (консультация эксперта – онлайн) . Elsevier Науки о здоровье. п. 304. ИСБН 978-1455733941 .
- ^ Карлингер К., Дьерке Т., Макё Э., Местер А., Тарьян З. (сентябрь 2000 г.). «Эпидемиология и патогенез воспалительных заболеваний кишечника». Европейский журнал радиологии . 35 (3): 154–167. дои : 10.1016/s0720-048x(00)00238-2 . ПМИД 11000558 .
- ^ Подольский Д.К. (август 2002 г.). «Воспалительное заболевание кишечника». Медицинский журнал Новой Англии . 347 (6): 417–429. дои : 10.1056/NEJMra020831 . ПМИД 12167685 .
- ^ Шмидт Дж. А., Маршалл Дж., Хейман М. Дж. (декабрь 1985 г.). «Идентификация и характеристика рецептора куриного трансферрина» . Биохимический журнал . 232 (3): 735–741. дои : 10.1042/bj2320735 . ПМЦ 1152945 . ПМИД 3004417 .
- ^ Шивананда С., Леннард-Джонс Дж., Логан Р., Страх Н., Прайс А., Карпентер Л. и др. (ноябрь 1996 г.). «Заболеваемость воспалительными заболеваниями кишечника в Европе: есть ли разница между севером и югом? Результаты Европейского совместного исследования воспалительных заболеваний кишечника (EC-IBD)» . Гут . 39 (5): 690–697. дои : 10.1136/gut.39.5.690 . ПМЦ 1383393 . ПМИД 9014768 .
- ^ Зонненберг А., Маккарти DJ, Якобсен С.Дж. (январь 1991 г.). «Географические вариации воспалительных заболеваний кишечника в Соединенных Штатах». Гастроэнтерология . 100 (1): 143–149. дои : 10.1016/0016-5085(91)90594-Б . ПМИД 1983816 .
- ^ Буриш Дж., Педерсен Н., Чукович-Чавка С., Бринар М., Каймаклиотис И., Дурикова Д. и др. (апрель 2014 г.). «Градиент заболеваемости воспалительными заболеваниями кишечника с востока на запад в Европе: начальная когорта ECCO-EpiCom». Гут . 63 (4): 588–597. дои : 10.1136/gutjnl-2013-304636 . hdl : 2336/325171 . ПМИД 23604131 . S2CID 25069828 .
- ^ Андерссон Р.Э., Олейсон Г., Тыск С., Экбом А. (март 2001 г.). «Аппендэктомия и защита от язвенного колита» . Медицинский журнал Новой Англии . 344 (11): 808–814. дои : 10.1056/NEJM200103153441104 . ПМИД 11248156 .
- ^ Jump up to: Перейти обратно: а б Бойко Э.Дж., Копселл Т.Д., Перера Д.Р., Инуи Т.С. (март 1987 г.). «Риск язвенного колита среди бывших и нынешних курильщиков сигарет». Медицинский журнал Новой Англии . 316 (12): 707–710. дои : 10.1056/NEJM198703193161202 . ПМИД 3821808 .
- ^ Jump up to: Перейти обратно: а б «Эпидемиология ВЗК» . Центры по контролю и профилактике заболеваний (CDC) . Архивировано из оригинала 23 февраля 2017 года . Проверено 23 февраля 2017 г.
- ^ Махлуф Г.М., Цфасс А.М., Саид С.И., Щебалин М. (апрель 1978 г.). «Влияние синтетического вазоактивного кишечного пептида (VIP), секретина и их частичных последовательностей на желудочную секрецию». Труды Общества экспериментальной биологии и медицины . 157 (4): 565–568. дои : 10.3181/00379727-157-40097 . ПМИД 349569 . S2CID 40543366 .
- ^ «Язвенный колит: лечение» . Национальный институт здравоохранения и передового опыта . 3 мая 2019 г.
- ^ Jump up to: Перейти обратно: а б Малдер Д., Ноубл А., Юстинич С., Даффин Дж. (1 мая 2014 г.). «Повесть о двух болезнях: История воспалительных заболеваний кишечника» . Журнал Крона и колита . 8 (5): 341–348. дои : 10.1016/j.crohns.2013.09.009 . ПМИД 24094598 .
- ^ Jump up to: Перейти обратно: а б Саммерс Р.В., Эллиотт Д.Э., Урбан Дж.Ф., Томпсон Р.А., Вайнсток СП (апрель 2005 г.). «Терапия Trichuris suis при активном язвенном колите: рандомизированное контролируемое исследование» . Гастроэнтерология . 128 (4): 825–832. дои : 10.1053/j.gastro.2005.01.005 . ПМИД 15825065 .
- ^ Jump up to: Перейти обратно: а б Беннетт К.Ф., Кондон Т.С., Гримм С., Чан Х., Чан М.Ю. (1994). «Ингибирование экспрессии молекул адгезии эндотелиальных клеток и лейкоцитов с помощью антисмысловых олигонуклеотидов». Журнал иммунологии . 152 (1): 3530–40. дои : 10.4049/jimmunol.152.7.3530 . S2CID 34563008 .
- ^ Джонс С.К., Бэнкс Р.Э., Хайдар А., Гиринг А.Дж., Хемингуэй И.К., Ибботсон С.Х. и др. (май 1995 г.). «Молекулы адгезии при воспалительных заболеваниях кишечника» . Гут . 36 (5): 724–730. дои : 10.1136/gut.36.5.724 . ПМЦ 1382677 . ПМИД 7541009 .
- ^ ван Девентер С.Дж., Ведель М.К., Бейкер Б.Ф., Ся С., Чуанг Э., Майнер П.Б. (май 2006 г.). «Двойное слепое плацебо-контролируемое исследование фазы II с диапазоном доз аликафорсена у пациентов с острым обострением левостороннего язвенного колита легкой и средней степени тяжести» . Алиментарная фармакология и терапия . 23 (10): 1415–1425. дои : 10.1111/j.1365-2036.2006.02910.x . ПМИД 16669956 . S2CID 31495688 .
- ^ Гури Я.А., Ричардс Д.М., Рахими Э.Ф., Крилл Дж.Т., Елинек К.А., DuPont AW (9 декабря 2014 г.). «Систематический обзор рандомизированных контролируемых исследований пробиотиков, пребиотиков и синбиотиков при воспалительных заболеваниях кишечника» . Клиническая и экспериментальная гастроэнтерология . 7 : 473–487. дои : 10.2147/CEG.S27530 . ПМЦ 4266241 . ПМИД 25525379 .
- ^ Jump up to: Перейти обратно: а б Стрёбек Д., Браун Д.Т., Дженкинс Д.П., Чен Ю.Дж., Коулман Н., Андо Ю. и др. (январь 2013 г.). «NS6180, новый ингибитор каналов K(Ca) 3.1, предотвращает активацию и воспаление Т-клеток на крысиной модели воспалительного заболевания кишечника» . Британский журнал фармакологии . 168 (2): 432–444. дои : 10.1111/j.1476-5381.2012.02143.x . ПМЦ 3572569 . ПМИД 22891655 .
- ^ Jump up to: Перейти обратно: а б Беннике Т.Б., Карлсен Т.Г., Эллингсен Т., Бондеруп ОК, Глеруп Х., Богстед М. и др. (сентябрь 2015 г.). «Внеклеточные ловушки нейтрофилов при язвенном колите: протеомный анализ биопсий кишечника» . Воспалительные заболевания кишечника . 21 (9): 2052–2067. doi : 10.1097/MIB.0000000000000460 . ПМК 4603666 . ПМИД 25993694 .
- ^ Киров С., Сассон А., Чжан С., Часалов С., Донгре А., Стин Х. и др. (февраль 2019 г.). «Деградация внеклеточного матрикса является частью патологии язвенного колита» . Молекулярная омика . 15 (1): 67–76. дои : 10.1039/C8MO00239H . ПМИД 30702115 .
- ^ Райтель М., Винтеркамп С., Вайденхиллер М., Мюллер С., Хан Э.Г. (июль 2007 г.). «Комбинированная терапия с использованием фексофенадина, динатрия кромогликата и гипоаллергенной формулы на основе аминокислот вызвала ремиссию у пациента со стероидозависимым хронически активным язвенным колитом». Международный журнал колоректальных заболеваний . 22 (7): 833–839. дои : 10.1007/s00384-006-0120-y . ПМИД 16944185 . S2CID 2605447 .
- ^ Jump up to: Перейти обратно: а б Дханешвар С., Гаутам Х. (август 2012 г.). «Изучение нового антигистаминного пролекарства, нацеленного на толстую кишку, от колита» (PDF) . Журнал физиологии и фармакологии . 63 (4): 327–337. ПМИД 23070081 .
- ^ Вермейр С., О'Бирн С., Кейр М., Уильямс М., Лу Т.Т., Мэнсфилд Дж.К. и др. (июль 2014 г.). «Этролизумаб в качестве индукционной терапии язвенного колита: рандомизированное контролируемое исследование 2 фазы» . Ланцет . 384 (9940): 309–318. дои : 10.1016/S0140-6736(14)60661-9 . ПМИД 24814090 . S2CID 7369482 .
- ^ Jump up to: Перейти обратно: а б Розенфельд Г., Паркер С.Э., Макдональд Дж.К., Бресслер Б. (декабрь 2015 г.). «Этролизумаб для индукции ремиссии при язвенном колите» . Кокрановская база данных систематических обзоров . 2015 (12): CD011661. дои : 10.1002/14651858.CD011661.pub2 . ПМЦ 8612697 . ПМИД 26630451 .
- ^ Маккер Дж., Хоммес Д.В. (2016). «Этролизумаб при язвенном колите: новенький в блоке?». Экспертное мнение о биологической терапии . 16 (4): 567–572. дои : 10.1517/14712598.2016.1158807 . ПМИД 26914639 . S2CID 24706213 .
- ^ Тейлор Н. (3 февраля 2022 г.). «Roche отказывается от этро, отказываясь от препарата Крона третьей фазы спустя 18 месяцев после публикации слабых данных о колите» . Жестокие биотехнологии . Проверено 12 декабря 2023 г.
- ^ Абреу М.Т., Плеви С., Сэндс Б.Е., Вайнштейн Р. (2007). «Селективный лейкоцитарный аферез для лечения воспалительных заболеваний кишечника». Журнал клинической гастроэнтерологии . 41 (10): 874–888. дои : 10.1097/MCG.0b013e3180479435 . ПМИД 18090155 . S2CID 36724094 .
- ^ Верния П., Д'Овидио В., Мео Д. (октябрь 2010 г.). «Лейкоцитаферез в лечении воспалительных заболеваний кишечника: современное положение и перспективы». Наука о переливании крови и аферезе . 43 (2): 227–229. дои : 10.1016/j.transci.2010.07.023 . ПМИД 20817610 .
Дальнейшее чтение [ править ]
- Рубин Д.Т., Анантакришнан А.Н., Сигел К.А., Зауэр Б.Г., Лонг М.Д. (март 2019 г.). «Клинические рекомендации ACG: язвенный колит у взрослых» . Американский журнал гастроэнтерологии . 114 (3): 384–413. doi : 10.14309/ajg.0000000000000152 . ПМИД 30840605 . S2CID 73473272 .

- Торпи Дж. М., Линм С., Голуб Р. М. (январь 2012 г.). «Страница пациента JAMA. Язвенный колит» . ДЖАМА . 307 (1): 104. дои : 10.1001/jama.2011.1889 . ПМИД 22215172 .
Внешние ссылки [ править ]
- Страница MedlinePlus о язвенном колите
 СМИ, связанные с язвенным колитом, на Викискладе?
СМИ, связанные с язвенным колитом, на Викискладе?