Карцинома
| Карцинома | |
|---|---|
 | |
| Микрофотография первичной легкого мелкоклеточной карциномы , разновидности рака. Сгруппированные раковые клетки состоят в основном из ядра (фиолетового цвета); они имеют лишь скудный обод цитоплазмы . Окружающие бледно окрашенные дискоидные клетки представляют собой эритроциты . Образец цитопатологии . Полевое пятно . | |
| Специальность | онкология |
Карцинома – злокачественное новообразование, развивающееся из эпителиальных клеток . [1] В частности, карцинома — это рак , который начинается в ткани, выстилающей внутреннюю или внешнюю поверхность тела, и возникает из клеток, происходящих из энтодермального , мезодермального слоя. [2] или эктодермальный зародышевый листок во время эмбриогенеза . [3]
Карциномы возникают, когда ДНК клетки повреждается или изменяется , и клетка начинает бесконтрольно расти и становится злокачественной . Оно от греческого : καρκίνωμα , латинизированного : karkinoma , букв. «боля, язва, рак» (само слово происходит от karkinos , что означает краб ). [4]
Классификация [ править ]
По состоянию на 2004 год в научном сообществе не было разработано и принято ни одной простой и всеобъемлющей системы классификации. [5] Однако традиционно злокачественные новообразования обычно классифицируют на различные типы с использованием комбинации критериев, в том числе: [6]
Тип ячейки, с которой они начинаются; конкретно:
- Эпителиальные клетки ⇨ карцинома
- Некроветворные мезенхимальные клетки ⇨ саркома
- Гематопоэтические клетки
- Клетки костного мозга , которые обычно созревают в кровотоке ⇨ лейкемия
- Клетки костномозгового происхождения, которые обычно созревают в лимфатической системе ⇨ лимфома
- Половые клетки ⇨ герминома
Другие критерии, которые играют роль, включают в себя:
- Степень, в которой злокачественные клетки напоминают свои нормальные, нетрансформированные аналоги.
- Внешний вид местной ткани и стромальной архитектуры
- Анатомическое расположение, из которого возникают опухоли
- Генетические, эпигенетические и молекулярные особенности
Гистологические типы [ править ]



- Аденокарцинома ( адено = железа )
- Относится к карциноме, характеризующейся микроскопической цитологией ткани, связанной с железами, архитектурой ткани и/или молекулярными продуктами, связанными с железами, например, муцином .
- Плоскоклеточная карцинома
- Относится к раку с наблюдаемыми признаками и характеристиками, указывающими на плоскоклеточную дифференцировку (межклеточные мостики, ороговение, плоскоклеточные жемчужины).
- Аденосквамозная карцинома
- Относится к смешанной опухоли, содержащей как аденокарциному, так и плоскоклеточный рак, где каждый из этих типов клеток составляет по меньшей мере 10% объема опухоли.
- Анапластическая карцинома
- Относится к гетерогенной группе карцином высокой степени злокачественности, в клетках которой отсутствуют четкие гистологические или цитологические признаки какого-либо из более специфически дифференцированных новообразований . Эти опухоли называются анапластическими или недифференцированными карциномами.
- Крупноклеточная карцинома
- Состоит из крупных однообразных клеток округлой или явно полигональной формы с обильной цитоплазмой .
- Мелкоклеточная карцинома
- Клетки обычно имеют круглую форму, примерно в три раза больше диаметра покоящегося лимфоцита и имеют мало выраженной цитоплазмы. Иногда мелкоклеточные злокачественные новообразования сами по себе могут содержать значительные компоненты слегка полигональных и/или веретенообразных клеток. [8]
Существует большое количество редких подтипов анапластической недифференцированной карциномы. Некоторые из наиболее известных включают поражения, содержащие псевдосаркоматозные компоненты : веретеноклеточную карциному (содержащую удлиненные клетки, напоминающие рак соединительной ткани), гигантоклеточную карциному (содержащую огромные, причудливые, многоядерные клетки) и саркоматоидную карциному (смесь веретенообразных и гигантских клеток). клеточный рак). Плеоморфная карцинома содержит веретеноклеточные и/или гигантоклеточные компоненты плюс по меньшей мере 10% компонентов клеток, характерных для более высокодифференцированных типов (т.е. аденокарциномы и/или плоскоклеточного рака). Очень редко опухоли могут содержать отдельные компоненты, напоминающие как карциному, так и истинную саркому , включая карциносаркому и бластому легких . [8] Курение сигарет в анамнезе является наиболее распространенной причиной крупноклеточного рака.
- Аденосквамозная карцинома с железистыми признаками слева и плоскоклеточными признаками справа.
- Анапластические опухолевые клетки.
- Крупноклеточная карцинома.
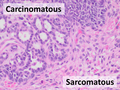
- Карциносаркома со смешанными карциноматозными и саркоматозными элементами.
Карцинома неизвестного участка первичного
Термин «карцинома» также стал охватывать злокачественные опухоли, состоящие из трансформированных клеток , происхождение или линия развития которых неизвестны (см. рак неизвестного первичного происхождения ; CUP), но которые обладают определенными специфическими молекулярными, клеточными и гистологическими характеристиками, типичными для эпителиальных клеток. Это может включать продукцию одной или нескольких форм цитокератина или других промежуточных филаментов , межклеточных мостиков, кератиновых жемчужин и/или мотивов тканевой архитектуры, таких как стратификация или псевдостратификация. [5] [6]
Код МКБ-10 [ править ]
- (8010-8045) Эпителиальные новообразования , БДУ
- (8050-8080) Плоскоклеточные новообразования
- ( M8070/3 ) Плоскоклеточный рак , БДУ
- (8090-8110) Базальноклеточные новообразования
- ( M8090/3 ) Базальноклеточный рак , БДУ
- (8120-8130) Переходноклеточный рак
- (8140-8380) Аденокарциномы
- ( M8140/3 ) Аденокарцинома , БДУ
- ( M8142/3 ) Пластиковый линит
- ( M8155/3 ) Випома
- ( M8160/3 ) Холангиокарцинома
- ( M8170/3 ) Гепатоцеллюлярная карцинома , БДУ
- ( M8200/3 ) Аденоидно-кистозная карцинома
- ( M8312/3 ) Почечно-клеточный рак
- ( M8312/3 ) Опухоль Гравица
- (8390-8420) придатков и придатков кожи Новообразования
- (8430-8439) Мукоэпидермоидные новообразования
- (8440-8490) Кистозные , муцинозные и серозные новообразования
- (8500-8540) Протоковые, дольковые и медуллярные новообразования
- (8550-8559) Ацинарно-клеточные новообразования
- (8560-8580) Сложные эпителиальные новообразования
Карцинома in situ [ править ]
Термин «карцинома in situ» (или CIS) — это термин, обозначающий клетки, которые являются значительно аномальными , но не раковыми. [9] Таким образом, они не являются типичными карциномами. [10]
Патогенез [ править ]
Рак возникает, когда одна клетка-предшественник накапливает мутации и другие изменения в ДНК , гистонах клетки и других биохимических соединениях, составляющих геном . Геном клетки контролирует структуру биохимических компонентов клетки, биохимические реакции, происходящие внутри клетки, и биологические взаимодействия этой клетки с другими клетками. Определенные комбинации мутаций в данной клетке-предшественнике в конечном итоге приводят к тому, что эта клетка (также называемая раковой стволовой клеткой) проявляет ряд аномальных, злокачественных клеточных свойств, которые в совокупности считаются характерными для рака, в том числе:
- способность продолжать непрерывно делиться, производя экспоненциально (или почти экспоненциально) увеличивающееся количество новых злокачественных раковых «дочерних клеток» (неконтролируемый митоз );
- способность проникать через нормальные поверхности и барьеры тела, а также проникать в близлежащие структуры и ткани тела или сквозь них (локальная инвазивность);
- способность распространяться на другие участки тела ( метастазировать ) путем проникновения или попадания в лимфатические сосуды (регионарные метастазы) и/или кровеносные сосуды (отдаленные метастазы). [11]
Если этот процесс непрерывного роста, локальной инвазии, а также регионального и отдаленного метастазирования не остановить с помощью комбинации стимуляции иммунной защиты и медицинского лечения, в результате у хозяина будет постоянно возрастать нагрузка опухолевых клеток по всему телу. хозяина В конце концов, опухолевая масса все больше мешает нормальным биохимическим функциям органов , и в конечном итоге наступает смерть .
Карцинома — это всего лишь одна из форм рака, состоящая из клеток, которые приобрели цитологический вид, гистологическую архитектуру или молекулярные характеристики эпителиальных клеток. [5] [6] Стволовые клетки-предшественники карциномы могут образовываться из любого ряда онкогенных комбинаций мутаций в тотипотентной клетке. [12] клетка мультипотентная , [12] или зрелая дифференцированная клетка. [13]
Метастатический рак [ править ]
Метастатическая карцинома — это рак , способный расти на участках, удаленных от первичного места возникновения; таким образом, диссеминация в кожу может произойти при любом злокачественном новообразовании , и эти инфильтраты могут возникнуть в результате прямой инвазии в кожу из подлежащих опухолей, могут распространяться лимфатическим или гематогенным путем или могут быть занесены в результате терапевтических процедур. [14] : 628–9
Мутация [ править ]
Полногеномное секвенирование установило частоту мутаций во всех геномах человека. Частота мутаций во всем геноме между поколениями человека (от родителя к ребенку) составляет около 70 новых мутаций на поколение. [15]
Карциномы, однако, имеют гораздо более высокую частоту мутаций. Конкретная частота зависит от типа ткани, наличия дефекта репарации ДНК, а также воздействия агентов, повреждающих ДНК, таких как компоненты табачного дыма. Туна и Амос суммировали частоту мутаций на мегабазу (Мб) в некоторых карциномах. [16] как показано в таблице (вместе с указанными частотами мутаций на геном).
| Тип ячейки | Частота мутаций | |
|---|---|---|
| За мегабазу | На диплоидный геном | |
| Зародышевая линия | 0.023 | 70 |
| Рак простаты | 0.9 | 5,400 |
| Колоректальный рак | ~5 | ~30,000 |
| Микросателлитно-стабильный (MSS) рак толстой кишки | 2.8 | 16,800 |
| Микросателлитно-нестабильный рак толстой кишки (MSI) (дефицит репарации несоответствия) | 47 | 282,000 |
| Гепатоцеллюлярная карцинома | 4.2 | 25,200 |
| Рак молочной железы | 1.18–1.66 | 7,080–9,960 |
| Рак легких | 17.7 | 106,200 |
| Мелкоклеточный рак легких | 7.4 | 44,400 |
| Немелкоклеточный рак легких (курящие) | 10.5 | 63,000 |
| Немелкоклеточный рак легких (у никогда не куривших) | 0.6 | 3,600 |
| Аденокарцинома легких (курильщики) | 9.8 | 58,500 |
| Аденокарцинома легких (никогда не курившие) | 1.7 | 10,200 |
Причина мутаций [ править ]
Вероятной основной причиной мутаций при карциномах является повреждение ДНК. [ нужна ссылка ] Например, в случае рака легких повреждение ДНК вызвано агентами экзогенного генотоксичного табачного дыма (например , акролеином , формальдегидом , акрилонитрилом , 1,3-бутадиеном , ацетальдегидом , оксидом этилена и изопреном ). [17] Эндогенные (метаболически вызванные) повреждения ДНК также встречаются очень часто: в геномах клеток человека они происходят в среднем более 60 000 раз в день. [ нужна ссылка ] Внешние и эндогенно вызванные повреждения могут быть преобразованы в мутации из-за неточного синтеза транслейкоза или неточной репарации ДНК (например, за счет негомологичного соединения концов ).
Высокая частота [ править ]
Высокая частота мутаций всего генома в карциномах позволяет предположить, что ранние канцерогенные изменения часто могут быть следствием недостаточности репарации ДНК. Например, частота мутаций существенно увеличивается (иногда в 100 раз) в клетках, дефектных в репарации несоответствий ДНК . [18]
Дефицит репарации ДНК сам по себе может привести к накоплению повреждений ДНК, а склонный к ошибкам синтез транслезий мимо некоторых из этих повреждений может привести к мутациям. Кроме того, неправильное восстановление этих накопленных повреждений ДНК может привести к эпигенетическим изменениям или эпимутациям . Хотя мутация или эпимутация в гене репарации ДНК сама по себе не дает селективного преимущества, такой дефект репарации может быть «пассажиром» в клетке, когда клетка приобретает дополнительную мутацию/эпимутацию, которая действительно обеспечивает пролиферативное преимущество. Такие клетки, обладающие как пролиферативными преимуществами, так и одним или несколькими дефектами репарации ДНК (вызывающими очень высокую частоту мутаций), вероятно, приводят к высокой частоте тотальных мутаций генома, наблюдаемых в карциномах.
восстановление ДНК [ править ]
В соматических клетках нарушения репарации ДНК иногда возникают вследствие мутаций генов репарации ДНК, но гораздо чаще они обусловлены эпигенетическим снижением экспрессии генов репарации ДНК. Таким образом, в последовательности из 113 колоректальных карцином только четыре имели соматические миссенс-мутации в гене репарации ДНК MGMT , в то время как в большинстве этих раков наблюдалось снижение экспрессии белка MGMT из-за метилирования области промотора MGMT . [19]
Диагностика [ править ]
Карциномы могут быть окончательно диагностированы с помощью биопсии , включая тонкоигольную аспирацию (ТНА), толстой биопсии или субтотального удаления единичного узла. [20] микроскопическое исследование патологоанатома для Затем необходимо выявления молекулярных, клеточных или тканевых архитектурных характеристик эпителиальных клеток.
Типы [ править ]
- Оральная часть: большинство видов рака полости рта представляют собой плоскоклеточную карциному.
- Легкие: Карцинома составляет >98% всех случаев рака легких .
- Грудь: Почти все виды рака молочной железы представляют собой протоковую карциному .
- Простата. Наиболее распространенной формой рака простаты является аденокарцинома.
- Толстая и прямая кишка. Почти все злокачественные новообразования толстой и прямой кишки представляют собой либо аденокарциному, либо плоскоклеточный рак.
- Поджелудочная железа: Рак поджелудочной железы почти всегда относится к типу аденокарциномы и очень летален.
- Яичники: одна из самых смертоносных форм из-за позднего выявления. [21]
Некоторые карциномы названы в честь их предполагаемого происхождения (например, гепатоцеллюлярная карцинома , почечно-клеточная карцинома ).
Постановка [ править ]
Стадирование карциномы представляет собой процесс сочетания физикального/клинического обследования, патологического анализа клеток и тканей, хирургических методов, лабораторных тестов и визуализирующих исследований логическим образом для получения информации о размере новообразования и степени его инвазии и метастаз . Стадия карциномы — это переменная, которая наиболее последовательно и тесно связана с прогнозом злокачественного новообразования.
Карциномы обычно обозначаются римскими цифрами. В большинстве классификаций карциномы стадий I и II подтверждаются, когда обнаружено, что опухоль небольшая и/или распространилась только на местные структуры. Обычно обнаружено, что карциномы III стадии распространились на регионарные лимфатические узлы, ткани и/или структуры органов, тогда как опухоли IV стадии уже метастазировали через кровь в отдаленные участки, ткани или органы.
В некоторых типах карцином карцинома стадии 0 использовалась для описания карциномы in situ , а скрытые карциномы можно обнаружить только при исследовании мокроты на наличие злокачественных клеток (при карциномах легких ).
В более современных системах стадирования все чаще используются подстадии (a, b, c) для лучшего определения групп пациентов со схожим прогнозом или вариантами лечения.
Критерии стадирования могут существенно различаться в зависимости от системы органов, в которой возникает опухоль. Например, двоеточие [22] и рак мочевого пузыря [23] Система определения стадии зависит от глубины инвазии, стадия рака молочной железы в большей степени зависит от размера опухоли, а при раке почки стадия зависит как от размера опухоли, так и от глубины инвазии опухоли в почечный синус. Рак легкого имеет более сложную систему стадирования, учитывающую ряд размеров и анатомических переменных. [24]
UICC/AJCC TNM . Чаще всего используются системы [ нужны разъяснения ] [25] Однако для некоторых распространенных опухолей классические методы определения стадии (такие как классификация Дьюкса для рака толстой кишки все еще используются ).
Оценка [ править ]
Классификация карцином подразумевает использование критериев, предназначенных для полуколичественной оценки степени зрелости клеток и тканей, наблюдаемой в трансформированных клетках, по сравнению с внешним видом нормальной исходной эпителиальной ткани, из которой происходит карцинома.
Классификация карциномы чаще всего проводится после того, как лечащий врач и/или хирург получает образец предполагаемой опухолевой ткани с помощью хирургической резекции , игольной или хирургической биопсии , прямого промывания или чистки опухолевой ткани, мокроты цитопатологии и т. д. Затем патологоанатом осматривает опухоль. и его строму , возможно, с использованием окрашивания , иммуногистохимии , проточной цитометрии или других методов. Наконец, патологоанатом полуколичественно классифицирует опухоль на одну из трех или четырех степеней, включая:
- Степень 1, или хорошо дифференцированная: имеется близкое или очень близкое сходство с нормальной родительской тканью, опухолевые клетки легко идентифицируются и классифицируются как определенное злокачественное гистологическое образование;
- Степень 2 или умеренно дифференцированная: имеется значительное сходство с родительскими клетками и тканями, но обычно можно увидеть аномалии, а более сложные особенности не особенно хорошо сформированы;
- Степень 3 или плохо дифференцированная: сходство между злокачественной тканью и нормальной родительской тканью очень мало, аномалии очевидны, а более сложные архитектурные особенности обычно рудиментарны или примитивны;
- Степень 4, или недифференцированная карцинома: эти карциномы не имеют существенного сходства с соответствующими исходными клетками и тканями, без видимых образований желез, протоков, мостов, многослойных слоев, кератиновых жемчужин или других заметных характеристик, соответствующих более высокодифференцированному новообразованию.
Хотя существует определенная и убедительная статистическая корреляция между степенью рака и прогнозом опухоли для некоторых типов опухолей и мест происхождения, сила этой связи может сильно варьировать. Однако в целом можно сказать, что чем выше степень поражения, тем хуже прогноз. [26] [27]
Эпидемиология [ править ]
Хотя рак обычно считается болезнью старости, у детей он также может развиться. [28] В отличие от взрослых, у детей карциномы встречаются исключительно редко. Менее 1% диагнозов карциномы приходится на детей. [29]
Двумя крупнейшими факторами риска рака яичников являются возраст и семейный анамнез. [30]
Ссылки [ править ]
- ^ Киркхэм Н., Лемуан Н.Р. (2001). Прогресс в патологии . Лондон: Гринвичские медицинские СМИ. п. 52. ИСБН 9781841100500 .
- ^ Вайнберг Р.А. (24 мая 2013 г.). Биология рака (Второе изд.). Нью-Йорк. ISBN 9780815345282 . OCLC 841051175 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ «Определение рака» . Архивировано из оригинала 10 октября 2012 года . Проверено 27 января 2014 г.
- ^ Оксфордский словарь английского языка , 3-е издание, св.
- ↑ Перейти обратно: Перейти обратно: а б с Берман Джей Джей (март 2004 г.). «Классификация опухолей: молекулярный анализ соответствует Аристотелю» . БМК Рак . 4 (1): 10. дои : 10.1186/1471-2407-4-10 . ПМК 415552 . ПМИД 15113444 .
- ↑ Перейти обратно: Перейти обратно: а б с Берман Джей Джей (ноябрь 2004 г.). «Таксономия опухолей для классификации новообразований по линиям развития» . БМК Рак . 4 (1): 88. дои : 10.1186/1471-2407-4-88 . ПМЦ 535937 . ПМИД 15571625 .
- ^ Изображение Микаэля Хэггстрема, доктора медицинских наук. Источник выводов: Кэролайн И.М. Андервуд, доктор медицинских наук, Кэролайн Гласс, доктор медицинских наук, доктор философии. «Легкие – Мелкоклеточный рак» . Очертания патологии .
{{cite web}}: CS1 maint: несколько имен: список авторов ( ссылка ) Последнее обновление автора: 20 сентября 2022 г. - ↑ Перейти обратно: Перейти обратно: а б Трэвис В.Д., Брамбилла Э., Мюллер-Гермелинк Х.К., Харрис CC, ред. (2004). Патология и генетика опухолей легких, плевры, тимуса и сердца (PDF) . Классификация опухолей Всемирной организации здравоохранения. Лион: МАИР Пресс. ISBN 978-92-832-2418-1 . Архивировано из оригинала (PDF) 23 августа 2009 года . Проверено 27 января 2014 г.
- ^ Чанг А (2007). Онкология: научно обоснованный подход . Спрингер. п. 162. ИСБН 9780387310565 .
- ^ Лоойженга Л.Х., Херсмус Р., де Леув Б.Х., Ступ Х., Кулс М., Остерхейс Дж.В. и др. (апрель 2010 г.). «Опухоли гонад и DSD». Лучшие практики и исследования. Клиническая эндокринология и обмен веществ . 24 (2): 291–310. дои : 10.1016/j.beem.2009.10.002 . ПМИД 20541153 .
- ^ «Карцинома». Академический словарь прессы по науке и технологиям.
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ↑ Перейти обратно: Перейти обратно: а б Васильев А., ДеПамфилис М.Л. (январь 2017 г.). «Связь между репликацией ДНК, стволовыми клетками и раком» . Гены . 8 (2): 45. doi : 10.3390/genes8020045 . ПМЦ 5333035 . ПМИД 28125050 .
- ^ Анандакришнан Р., Варгезе Р.Т., Кинни Н.А., Гарнер Х.Р. (март 2019 г.). «Оценка количества генетических мутаций (хитов), необходимых для канцерогенеза, на основе распределения соматических мутаций» . PLOS Вычислительная биология . 15 (3): e1006881. Бибкод : 2019PLSCB..15E6881A . дои : 10.1371/journal.pcbi.1006881 . ПМК 6424461 . ПМИД 30845172 .
- ^ Джеймс, Уильям; Бергер, Тимоти; Элстон, Дирк (2005). Болезни кожи Эндрюса: клиническая дерматология . (10-е изд.). Сондерс. ISBN 0-7216-2921-0 .
- ^ Роуч Дж.К., Глусман Дж., Смит А.Ф., Хафф К.Д., Хабли Р., Шеннон П.Т. и др. (апрель 2010 г.). «Анализ генетического наследования в семейном квартете методом полногеномного секвенирования» . Наука . 328 (5978): 636–639. Бибкод : 2010Sci...328..636R . дои : 10.1126/science.1186802 . ПМК 3037280 . ПМИД 20220176 .
- ^ Туна М., Амос С.И. (ноябрь 2013 г.). «Геномное секвенирование при раке» . Письма о раке . 340 (2): 161–170. дои : 10.1016/j.canlet.2012.11.004 . ПМЦ 3622788 . ПМИД 23178448 .
- ^ Каннингем Ф.Х., Фибелкорн С., Джонсон М., Мередит С. (ноябрь 2011 г.). «Новое применение подхода предела воздействия: разделение токсикантов табачного дыма». Пищевая и химическая токсикология . 49 (11): 2921–2933. дои : 10.1016/j.fct.2011.07.019 . ПМИД 21802474 .
- ^ Хеган Д.С., Нараянан Л., Жирик Ф.Р., Эдельманн В., Лискай Р.М., Глейзер П.М. (декабрь 2006 г.). «Различные модели генетической нестабильности у мышей с дефицитом генов репарации ошибочного спаривания Pms2, Mlh1, Msh2, Msh3 и Msh6» . Канцерогенез . 27 (12): 2402–2408. doi : 10.1093/carcin/bgl079 . ПМЦ 2612936 . ПМИД 16728433 .
- ^ Хэлфорд С., Роуэн А., Сойер Э., Талбот I, Томлинсон I (июнь 2005 г.). «О (6)-метилгуанин метилтрансфераза при колоректальном раке: обнаружение мутаций, потеря экспрессии и слабая связь с переходами G: C> A: T» . Гут . 54 (6): 797–802. дои : 10.1136/gut.2004.059535 . ПМК 1774551 . ПМИД 15888787 .
- ^ Вагман Л.Д. (2008). «Принципы хирургической онкологии» . В Паздуре Р., Вагмане Л.Д., Кампхаузене К.А., Хоскинсе В.Дж. (ред.). Лечение рака: междисциплинарный подход (11-е изд.). Архивировано из оригинала 4 октября 2013 года . Проверено 8 июня 2009 г.
- ^ Бойраз Г., Сельчук И., Языджиоглу А., Тунджер З.С. (сентябрь 2013 г.). «Рак яичников, связанный с эндометриозом». Европейский журнал акушерства, гинекологии и репродуктивной биологии . 170 (1): 211–213. дои : 10.1016/j.ejogrb.2013.06.001 . ПМИД 23849309 .
- ^ Пуппа Г, Сонцогни А, Коломбари Р, Пелоси Г (июнь 2010 г.). «Система стадирования колоректального рака TNM: критическая оценка сложных проблем». Архивы патологии и лабораторной медицины . 134 (6): 837–852. дои : 10.5858/134.6.837 . ПМИД 20524862 .
- ^ Шарир С. (февраль 2006 г.). «Обновленная информация о клинической и радиологической стадии и наблюдении за раком мочевого пузыря». Канадский журнал урологии . 13 (Приложение 1): 71–76. ПМИД 16526987 .
- ^ Пепек Дж.М., Чино Дж.П., Маркс Л.Б., Д'амико Т.А., Ю Д.С., Онайтис М.В. и др. (апрель 2011 г.). «Насколько хорошо новая система стадирования рака легких предсказывает местный/региональный рецидив после операции?: Сравнение систем TNM 6 и 7» . Журнал торакальной онкологии . 6 (4): 757–761. дои : 10.1097/JTO.0b013e31821038c0 . ПМИД 21325975 . S2CID 24598745 .
- ^ «Что такое стадия рака?» . Архивировано из оригинала 25 октября 2007 года . Проверено 27 января 2014 г.
- ^ Сан З., Обри М.К., Дешам К., Маркс Р.С., Окуно Ш., Уильямс Б.А. и др. (май 2006 г.). «Гистологическая степень является независимым прогностическим фактором выживаемости при немелкоклеточном раке легкого: анализ 5018 госпитальных и 712 популяционных случаев» . Журнал торакальной и сердечно-сосудистой хирургии . 131 (5): 1014–1020. дои : 10.1016/j.jtcvs.2005.12.057 . ПМИД 16678584 .
- ^ «Плохо дифференцированный рак неизвестной первичной локализации» . Проверено 6 июня 2022 г.
- ^ Куриакосе М.А., Хикс В.Л., Лори Т.Р., Йи Х. (август 2001 г.). «Лечение дифференцированного рака щитовидной железы на основе групп риска» . Журнал Королевского колледжа хирургов Эдинбурга . 46 (4): 216–223. ПМИД 11523714 . Архивировано из оригинала 5 мая 2010 года.
- ^ «Основная статистика детского рака» . www.cancer.org . Проверено 6 мая 2019 г.
- ^ Роетт М.А., Эванс П. (сентябрь 2009 г.). «Рак яичников: обзор» . Американский семейный врач . 80 (6): 609–16. ПМИД 19817326 .