Двойная связь
В химии двойная связь — это ковалентная связь между двумя атомами, включающая четыре связывающих электрона, а не два в одинарной связи . Двойные связи чаще всего возникают между двумя атомами углерода, например, в алкенах . Между двумя разными элементами существует множество двойных связей: например, в карбонильной группе между атомом углерода и атомом кислорода. Другие распространенные двойные связи встречаются в азосоединениях (N=N), иминах (C=N) и сульфоксидах (S=O). В скелетной формуле двойная связь изображается в виде двух параллельных линий (=) между двумя соединенными атомами; типографически знак равенства . для этого используется [1] [2] Двойные связи были введены в химическую запись русским химиком Александром Бутлеровым . [ нужна ссылка ]
Двойные связи с участием углерода прочнее и короче одинарных . Порядок облигаций - два. Двойные связи также богаты электронами, что делает их потенциально более реакционноспособными в присутствии сильного акцептора электронов (как и в реакциях присоединения галогенов ).
- Химические соединения с двойными связями
- Этилен углерода-углерода Двойная связь
- Ацетон углерод-кислород Двойная связь
- Диметилсульфоксид сера-кислород Двойная связь
- Диазен азот-азот Двойная связь
Двойные связи в алкенах [ править ]

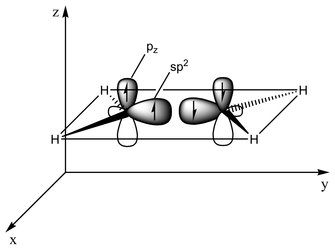
Тип связи можно объяснить с точки зрения орбитальной гибридизации . В этилене каждый атом углерода имеет три sp. 2 орбитали и одна p-орбиталь . Три сп 2 орбитали лежат в плоскости с углами ~120°. P-орбиталь перпендикулярна этой плоскости. Когда атомы углерода приближаются друг к другу, два из sp 2 орбитали перекрываются, образуя сигма-связь . При этом две р-орбитали сближаются (снова в одной плоскости) и вместе образуют пи-связь . Для максимального перекрытия р-орбитали должны оставаться параллельными, и, следовательно, вращение вокруг центральной связи невозможно. Это свойство приводит к цис-транс-изомерии . Двойные связи короче одинарных, поскольку перекрытие p-орбиталей максимально.
- 2 СП 2 орбитали (всего таких орбиталей 3) сближаются, образуя sp 2 -sp 2 сигма-бонд
- Две p-орбитали перекрываются, образуя пи-связь в плоскости, параллельной сигма-плоскости.
этилена C=C При 133 пм длина связи короче, чем длина связи C-C в этане с 154 пм. Двойная связь также прочнее, 636 кДж моль. −1 против 368 кДж моль −1 но не в два раза, поскольку пи-связь слабее сигма-связи из-за менее эффективного пи-перекрытия.
В альтернативном представлении двойная связь возникает в результате двух перекрывающихся sp. 3 орбитали как в изогнутой связи . [3]
Вариации [ править ]
В молекулах с чередующимися двойными и одинарными связями перекрытие р-орбиталей может существовать над несколькими атомами в цепи, что приводит к образованию сопряженной системы . Сопряжение можно обнаружить в таких системах, как диены и еноны . В циклических молекулах сопряжение может привести к ароматичности . В кумуленах две двойные связи соседствуют.
Двойные связи характерны для элементов 2-го периода — углерода , азота и кислорода и реже — для элементов более высоких периодов . Металлы также могут образовывать множественные связи в множественных связях металлического лиганда .
группы Гомологи алкенов 14
Соединения с двойной связью, гомологи алкенов , R 2 E=ER 2, теперь известны для всех более тяжелых элементов 14-й группы . В отличие от алкенов эти соединения не являются плоскими, а имеют скрученную и/или транс-изогнутую структуру. Эти эффекты становятся более выраженными для более тяжелых элементов. Дистаннен (Me 3 Si) 2 CHSn=SnCH(SiMe 3 ) 2 имеет длину связи олово-олово лишь немногим короче одинарной связи, транс-изогнутую структуру с пирамидальной координацией каждого атома олова и легко диссоциирует в растворе на форма (Me 3 Si) 2 CHSn: (станнандиил, аналог карбена). Связь состоит из двух слабых донорно-акцепторных связей, причем неподеленная пара на каждом атоме олова перекрывается с пустой p-орбиталью на другом. [4] [5] Напротив, в дисиленах каждый атом кремния имеет плоскую координацию, но заместители скручены так, что молекула в целом не плоская. В диплюмбенах длина связи Pb=Pb может быть больше, чем у многих соответствующих одинарных связей. [5] Плумбены и станнены обычно диссоциируют в растворе на мономеры с энтальпией связи, которая составляет лишь часть соответствующих одинарных связей. Некоторые двойные связи плюмбены и станнены по прочности аналогичны водородным связям. [4] Модель Картера -Годдарда-Мальрье-Тринкье можно использовать для прогнозирования характера связи. [4]
Типы двойных связей между атомами [ править ]
| С | ТО | Н | С | И | Ге | Сн | Pb | |
|---|---|---|---|---|---|---|---|---|
| С | алкен | карбонильная группа | имин | тиокетон , тиал | алкилиденсиланы | |||
| ТО | дикислород | нитрозосоединение | сульфоксид , сульфон , сульфиновая кислота , сульфоновая кислота | |||||
| Н | азосоединение | |||||||
| С | дисульфид | |||||||
| И | корыта | |||||||
| Ге | зародыши | |||||||
| Сн | станнены | |||||||
| Pb | плюмбены |
Ссылки [ править ]
- ^ Марч, Джерри, 1929–1997 гг. (1985). Передовая органическая химия: реакции, механизмы и структура (3-е изд.). Нью-Йорк: Уайли. ISBN 0-471-88841-9 . OCLC 10998226 . Архивировано из оригинала 10 декабря 2019 г. Проверено 12 декабря 2020 г.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Макмерри, Джон. Органическая химия (Девятое изд.). Бостон, Массачусетс, США. ISBN 978-1-305-08048-5 . OCLC 907259297 . Архивировано из оригинала 4 апреля 2024 г. Проверено 12 декабря 2020 г.
- ^ Кэри, Фрэнсис А., 1937- (2007). Передовая органическая химия . Сундберг, Ричард Дж., 1938- (5-е изд.). Нью-Йорк: Спрингер. ISBN 978-0-387-44897-8 . OCLC 154040953 . Архивировано из оригинала 4 апреля 2024 г. Проверено 12 декабря 2020 г.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: числовые имена: список авторов ( ссылка ) - ↑ Перейти обратно: Перейти обратно: а б с Пауэр, Филип П. (1999). «П-связь и эффект неподеленной пары в множественных связях между более тяжелыми элементами основной группы». Химические обзоры . 99 (12): 3463–3504. дои : 10.1021/cr9408989 . ПМИД 11849028 .
- ↑ Перейти обратно: Перейти обратно: а б Ван, Юйчжун; Робинсон, Грегори Х. (2009). «Уникальная гомоядерная кратная связь в соединениях основной группы». Химические коммуникации (35). Королевское химическое общество : 5201–5213. дои : 10.1039/B908048A . ПМИД 19707626 .
- Пюиккё, Пекка; Ридель, Себастьян; Пацшке, Майкл (2005). «Ковалентные радиусы тройной связи». Химия: Европейский журнал . 11 (12): 3511–20. дои : 10.1002/chem.200401299 . ПМИД 15832398 .