Подсчет электронов
В химии — подсчет электронов это формализм для присвоения количества валентных электронов отдельным атомам в молекуле. Он используется для классификации соединений, а также для объяснения или прогнозирования их электронной структуры и связей . [1] Многие правила химии основаны на подсчете электронов:
- Правило октетов используется со структурами Льюиса для элементов основной группы , особенно более легких, таких как углерод , азот и кислород .
- правило 18 электронов [2] по неорганической химии и металлоорганической химии металлов переходных ,
- Правило Хюккеля для π-электронов ароматических соединений .
- Теория полиэдрических скелетных электронных пар для полиэдрических кластерных соединений , включая переходные металлы и элементы основной группы и их смеси, такие как бораны .
Атомы называются « электронодефицитными », когда у них слишком мало электронов по сравнению с соответствующими правилами, или « гипервалентными », когда у них слишком много электронов. Поскольку эти соединения имеют тенденцию быть более реакционноспособными, чем соединения, подчиняющиеся их правилам, подсчет электронов является важным инструментом для определения реакционной способности молекул. Хотя формализм подсчета рассматривает каждый атом отдельно, эти отдельные атомы (с их гипотетическим присвоенным зарядом) обычно не существуют как свободные виды .
Правила подсчета
[ редактировать ]Двумя методами подсчета электронов являются «нейтральный счет» и «ионный счет». Оба подхода дают один и тот же результат (и поэтому могут быть использованы для проверки расчетов).
- Подход нейтрального подсчета предполагает, что изучаемая молекула или фрагмент состоит из чисто ковалентных связей . Он был популяризирован Малкольмом Грином вместе с лигандов L и X. обозначениями [3] Обычно это считается более простым, особенно для низковалентных переходных металлов. [4]
- Подход «ионного подсчета» предполагает чисто ионные связи между атомами.
Однако важно осознавать, что большинство химических соединений существуют между чисто ковалентными и ионными крайностями.
Нейтральный подсчет
[ редактировать ]- Нейтральный подсчет предполагает, что каждая связь поровну разделена между двумя атомами.
- Этот метод начинается с определения местоположения центрального атома в таблице Менделеева и определения количества его валентных электронов. Валентные электроны для элементов основной группы подсчитываются иначе, чем для переходных металлов, которые используют подсчет d-электронов .
- Например, во втором периоде: B, C, N, O и F имеют 3, 4, 5, 6 и 7 валентных электронов соответственно.
- Например, в периоде 4: K, Ca, Sc, Ti, V, Cr, Fe, Ni имеют 1, 2, 3, 4, 5, 6, 8, 10 валентных электронов соответственно.
- Один добавляется для каждого галогенида или другого анионного лиганда, который связывается с центральным атомом через сигма-связь.
- Два добавляются для каждой неподеленной пары, связывающейся с металлом (например, каждое основание Льюиса связывается с неподеленной парой). Ненасыщенные углеводороды, такие как алкены и алкины, считаются основаниями Льюиса . Точно так же кислоты Льюиса и Бренстеда (протоны) не вносят никакого вклада.
- Один добавляется для каждой гомоэлементной связи.
- Один добавляется для каждого отрицательного заряда и один вычитается для каждого положительного заряда.
Ионный счет
[ редактировать ]- Ионный счет предполагает неравномерное распределение электронов в связи. Более электроотрицательный атом в связи приобретает электрон, потерянный у менее электроотрицательного атома.
- Этот метод начинается с расчета количества электронов элемента, предполагая степень окисления .
- Например, за Fe 2+ имеет 6 электронов
- С 2− имеет 8 электронов
- Два добавляются к каждому галогениду или другому анионному лиганду, который связывается с металлом через сигма-связь .
- Два добавляются для каждой неподеленной пары, связывающейся с металлом (например, каждый фосфиновый лиганд может связываться с неподеленной парой). Точно так же кислоты Льюиса и Бренстеда (протоны) не вносят никакого вклада.
- Для ненасыщенных лигандов, таких как алкены, на каждый атом углерода, связывающийся с металлом, добавляется один электрон.
Электроны, отданные общими фрагментами
[ редактировать ]| Лиганд | Электроны внесли свой вклад (нейтральный подсчет) | Электроны внесли свой вклад (ионный счет) | Ионный эквивалент |
|---|---|---|---|
| Х | 1 | 2 | Х − ; X = F, Cl, Br, I |
| ЧАС | 1 | 2 | ЧАС − |
| ЧАС | 1 | 0 | ЧАС + |
| ТО | 2 | 4 | ТО 2− |
| Н | 3 | 6 | Н 3− |
| СО | 2 | 2 | СО |
| NR№3 | 2 | 2 | № 3 ; R = H, алкил, арил |
| CR 2 | 2 | 4 | КР 2- 2 |
| Этилен | 2 | 2 | С 2 Ч 4 |
| циклопентадиенил | 5 | 6 | С 5 Ч - 5 |
| бензол | 6 | 6 | C6HC6H6 |
«Особые случаи»
[ редактировать ]Число электронов, «пожертвованных» некоторыми лигандами, зависит от геометрии ансамбля металл-лиганд. Примером такого осложнения является сущность M– NO . Когда эта группировка линейна, лиганд NO считается трехэлектронным лигандом. Когда субъединица M–NO сильно изогнута в направлении N, NO рассматривается как псевдогалогенид и, таким образом, представляет собой один электрон (в подходе нейтрального счета). Ситуация мало чем отличается от η 3 против η 1 аллил. Еще одним необычным лигандом с точки зрения счета электронов является диоксид серы.
Примеры
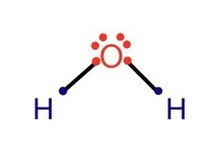
[ редактировать ]Для молекулы воды (H 2 O) использование как нейтрального, так и ионного счета дает в общей сложности 8 электронов.
| Атом | Электроны внесли свой вклад | Количество электронов |
|---|---|---|
| ЧАС . | 1 электрон х 2 | 2 электрона |
| ТО | 6 электронов | 6 электронов |
| Всего = 8 электронов |
Метод нейтрального счета предполагает, что каждая связь ОН разделена поровну (каждый атом получает от связи один электрон). Таким образом, оба атома водорода имеют число электронов, равное единице. Атом кислорода имеет 6 валентных электронов. Общее количество электронов равно 8, что соответствует правилу октетов.

| Атом | Электроны внесли свой вклад | Количество электронов |
|---|---|---|
| ЧАС + | никто | 0 электронов |
| ТО 2- | 8 электронов | 8 электронов |
| Всего = 8 электронов |
При использовании метода ионного счета более электроотрицательный кислород получит электроны, пожертвованные двумя атомами водорода в двух связях OH, и превратится в O. 2- . Теперь у него 8 валентных электронов, что подчиняется правилу октетов.
- CH 4 , для центрального C
- нейтральный подсчет: C вносит 4 электрона, каждый радикал H вносит по одному: 4 + 4 × 1 = 8 валентных электронов
- ионный счет: C 4− вносит 8 электронов, каждый протон вносит по 0: 8 + 4 × 0 = 8 электронов.
- Аналогично для H:
- нейтральный счет: H вносит 1 электрон, C вносит 1 электрон (остальные 3 электрона C предназначены для остальных 3 атомов водорода в молекуле): 1 + 1 × 1 = 2 валентных электрона.
- ионный счет: H вносит 0 электронов (H + ), С 4− вносит 2 электрона (на H), 0 + 1 × 2 = 2 валентных электрона
- вывод: метан подчиняется правилу октетов для углерода и правилу дуэта для водорода, и, следовательно, ожидается, что он будет стабильной молекулой (как мы видим из повседневной жизни).
- H 2 S , для центрального S
- нейтральный счет: S вносит 6 электронов, каждый радикал водорода вносит по одному: 6 + 2 × 1 = 8 валентных электронов
- ионный счет: S 2− вносит 8 электронов, каждый протон вносит 0: 8 + 2 × 0 = 8 валентных электронов
- Вывод: при счете электронов в октетах (на сере) мы можем ожидать, что H 2 S будет псевдотетраэдрическим, если рассматривать две неподеленные пары.
- SCl 2 , для центрального S
- нейтральный счет: S вносит 6 электронов, каждый радикал хлора вносит по одному: 6 + 2 × 1 = 8 валентных электронов
- ионный счет: S 2+ вносит 4 электрона, каждый хлорид-анион вносит 2: 4 + 2 × 2 = 8 валентных электронов
- вывод: см. обсуждение H 2 S выше. Как SCl 2 , так и H 2 S подчиняются правилу октетов, однако поведение этих молекул совершенно различно.
- SF 6 , для центрального S
- нейтральный подсчет: S вносит 6 электронов, каждый радикал фтора вносит по одному: 6 + 6 × 1 = 12 валентных электронов
- ионный счет: S 6+ вносит 0 электронов, каждый фторид-анион вносит 2: 0 + 6 × 2 = 12 валентных электронов.
- вывод: ионный подсчет указывает на то, что в молекуле отсутствуют неподеленные пары электронов, поэтому ее структура будет октаэдрической, как предсказывает VSEPR . Можно было бы заключить, что эта молекула будет высокореактивной, но верно обратное: SF 6 инертен и благодаря этому свойству широко используется в промышленности.

RuCl 2 (bpy) 2 представляет собой октаэдрический металлокомплекс с двумя бидентатными 2,2'-бипиридиновыми (bpy) лигандами и двумя хлоридными лигандами.
| Металл/лиганд | Электроны внесли свой вклад | Количество электронов |
| Ру(0) | д 8 (8 d-электронов) | 8 электронов |
| bpy | 4 электрона х 2 | 8 электронов |
| кл. . | 1 электрон х 2 | 2 электрона |
| Всего = 18 электронов |
В нейтральном методе подсчета рутений комплекса рассматривается как Ru(0). Он имеет 8 d-электронов, которые участвуют в подсчете электронов. Два лиганда bpy представляют собой нейтральные лиганды L-типа , каждый из которых вносит по два электрона. Два хлоридных лиганда являются галлидами и, таким образом, являются донорами 1 электрона, отдавая по 1 электрону каждый на счет электронов. Общее количество электронов RuCl 2 (bpy) 2 равно 18.
| металл/лиганд | электроны внесли свой вклад | количество электронов |
| Ру(II) | д 6 (6 d-электронов) | 6 электронов |
| bpy | 4 электрона х 2 | 8 электронов |
| кл. - | 2 электрона х 2 | 4 электрона |
| Всего = 18 электронов |
В методе ионного счета рутений комплекса рассматривается как Ru(II). Он имеет 6 d-электронов, которые участвуют в подсчете электронов. Два лиганда bpy представляют собой нейтральные лиганды L-типа , каждый из которых вносит по два электрона. Два хлоридных лиганда являются анионными лигандами, поэтому каждый из них отдает по 2 электрона на счет электронов. Общее количество электронов RuCl 2 (bpy) 2 составляет 18, что согласуется с результатом нейронного подсчета.
- TiCl 4 , для центрального Ti
- нейтральный подсчет: Ti вносит 4 электрона, каждый радикал хлора вносит по одному: 4 + 4 × 1 = 8 валентных электронов
- ионный счет: Ti 4+ вносит 0 электронов, каждый хлорид-анион вносит по два: 0 + 4 × 2 = 8 валентных электронов
- Вывод: Имея только 8e (а не 18 возможных), мы можем ожидать, что TiCl 4 будет хорошей кислотой Льюиса. Действительно, он реагирует (в некоторых случаях бурно) с водой, спиртами, эфирами, аминами.
- нейтральный подсчет: Fe вносит 8 электронов, каждый CO вносит по 2: 8 + 2 × 5 = 18 валентных электронов.
- ионный счет: Fe(0) вносит 8 электронов, каждый CO вносит по 2: 8 + 2 × 5 = 18 валентных электронов.
- Выводы: это частный случай, когда подсчет ионов аналогичен подсчету нейтральных частиц, причем все фрагменты нейтральны. Поскольку это 18-электронный комплекс, ожидается, что его можно будет изолировать.
- Ферроцен, (C 5 H 5 ) 2 Fe , для центрального Fe:
- нейтральный счет: Fe вносит 8 электронов, 2 циклопентадиенильных кольца вносят по 5 каждое: 8 + 2 × 5 = 18 электронов.
- ионный счет: Fe 2+ вносит 6 электронов, два ароматических циклопентадиенильных кольца вносят по 6 каждое: 6 + 2 × 6 = 18 валентных электронов на железе.
- Вывод: Ожидается, что ферроцен будет изолируемым соединением.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Паркин, Джерард (2006). «Валентность, степень окисления и формальный заряд: три связанных, но принципиально разных понятия» . Журнал химического образования . 83 (5): 791. Бибкод : 2006ЖЧЭд..83..791П . дои : 10.1021/ed083p791 . ISSN 0021-9584 . Проверено 10 ноября 2009 г.
- ^ Расмуссен, Сет К. (март 2015 г.). «Правило 18-ти электронов и подсчет электронов в соединениях переходных металлов: теория и применение» . Химтексты . 1 (1). дои : 10.1007/s40828-015-0010-4 . ISSN 2199-3793 .
- ^ Грин, MLH (20 сентября 1995 г.). «Новый подход к формальной классификации ковалентных соединений элементов». Журнал металлоорганической химии . 500 (1–2): 127–148. дои : 10.1016/0022-328X(95)00508-N . ISSN 0022-328X .
- ^ Грин, MLH (20 сентября 1995 г.). «Новый подход к формальной классификации ковалентных соединений элементов» . Журнал металлоорганической химии . 500 (1): 127–148. дои : 10.1016/0022-328X(95)00508-N . ISSN 0022-328X .