Галогенная связь
В химии галогенная связь ( XB ) возникает, когда есть свидетельства чистого притягивающего взаимодействия между электрофильной областью, связанной с атомом галогена в молекулярном объекте , и нуклеофильной областью в другом или том же молекулярном объекте. [1] Как и в случае с водородной связью , результатом является не формальная химическая связь , а скорее сильное электростатическое притяжение. [2] [3] Математически взаимодействие можно разложить на два члена: один описывает электростатический с орбитальным смешиванием перенос заряда электронного облака , а другой описывает дисперсию . Галогенные связи находят применение в супрамолекулярной химии ; [2] [3] [4] дизайн лекарств и биохимия ; [5] [6] кристаллическая инженерия [6] и жидкие кристаллы ; [2] и органический катализ . [6]
Определение
[ редактировать ]
Галогенные связи возникают, когда атом галогена электростатически притягивается к частичному отрицательному заряду . Обязательно атом должен быть ковалентно связан антиподальной σ-связью ; концентрация электронов, связанная с этой связью, оставляет положительно заряженную «дырку» на другой стороне. [7] Хотя теоретически все галогены могут участвовать в галогенных связях, σ-дырка сжимается, если рассматриваемое электронное облако плохо поляризуется или галоген настолько электроотрицательен , что поляризует соответствующую σ-связь. [2] [8] Следовательно, склонность к галогенным связям следует тенденции [9] [Примечание 1] F < Cl < Br < I.
Нет четкого различия между галогенными связями и расширенного октета частичными связями ; то, что на первый взгляд является галогенной связью, вполне может оказаться полной связью в неожиданно значимой резонансной структуре . [10] [11] [12] [13]
Характеристики донора
[ редактировать ]Галогенная связь почти коллинеарна другой, обычной связи атома галогена, но геометрия донора электронного заряда может быть гораздо более сложной.
- Многоэлектронные доноры, такие как простые эфиры и амины, предпочитают галогенные связи, коллинеарные неподеленной паре и донорному ядру.
- Производные пиридина имеют тенденцию отдавать галогенные связи примерно копланарно кольцу, и эти два углы около 120°. [14]
- Карбонильные , тиокарбонильные и селенокарбонильные группы с тригональной плоской геометрией вокруг донорного атома Льюиса могут присоединять одну или две галогенные связи. [15]
Анионы обычно являются лучшими акцепторами галогенных связей, чем нейтральные: чем более диссоциирована ионная пара, тем прочнее галогенная связь, образующаяся с анионом. [16]
Сравнение с другими силами, подобными связям
[ редактировать ]Параллельную связь можно легко провести между галогенной связью и водородной связью . Оба взаимодействия вращаются вокруг отношений донора / акцептора электронов между галогеноподобным атомом и электронно-плотным атомом. Но галогенная связь гораздо прочнее и более чувствительна к направлению, чем водородная связь. Типичная водородная связь имеет энергию образования 20 кДж/моль ; галогенов известные энергии связей находятся в диапазоне 10–200 кДж / моль. [15]
Концепция σ-дырок легко распространяется на связи пниктогена, халькогена и аэрогена, соответствующие атомам групп 15 , 16 и 18 (соответственно). [17]
История
[ редактировать ]
В 1814 году Жан-Жак Колен обнаружил (к своему удивлению), что смесь сухого газообразного аммиака и йода образует блестящую жидкость металлического цвета. Фредерик Гатри установил точный состав образовавшегося комплекса I 2 ···NH 3 пятьдесят лет спустя, но физические процессы, лежащие в основе молекулярного взаимодействия, оставались загадочными до тех пор, пока не была разработана Робертом С. Малликеном теория внутренней и внешней сфер. взаимодействия. [18] Согласно классификации Малликена, межмолекулярные взаимодействия, связанные с небольшими парциальными зарядами, влияют только на «внутреннюю сферу» распределения электронов атома; перераспределение электронов, связанное с аддуктами Льюиса, вместо этого влияет на «внешнюю сферу». [19]
Затем, в 1954 году, Одд Хассель плодотворно применил это различие, чтобы рационализировать картины дифракции рентгеновских лучей , связанные со смесью 1,4-диоксана и брома. [20] Результаты показали, что только 2,71 Å разделяют атомы кислорода диоксана и атомы брома, что намного ближе, чем сумма (3,35 Å) ван-дер-ваальсовых радиусов атомов; и что угол между связью O-Br и Br-Br составлял около 180 °. На основании этих фактов Хассель пришел к выводу, что атомы галогенов непосредственно связаны с донорами электронных пар в направлении, направление связи которого совпадает с осями орбиталей неподеленных пар в молекуле-доноре электронных пар. [7] За эту работу Хассель был удостоен Нобелевской премии по химии 1969 года . [21]
Дюма и его коллеги впервые ввели термин «галогенная связь» в 1978 году во время исследования комплексов CCl 4 , CBr 4 , SiCl 4 и SiBr 4 с тетрагидрофураном , тетрагидропираном , пиридином , анизолом и ди-н-бутиловым эфиром в органических соединениях. растворители. [22]
Однако только с середины 1990-х годов природа и применение галогенной связи начали интенсивно изучаться. Посредством систематической и обширной микроволновой спектроскопии аддуктов галогенных связей в газовой фазе Легон и его коллеги привлекли внимание к сходству между галогенными связями и более известными взаимодействиями с водородными связями. [23]
В 2007 году вычислительные расчеты Политцера и Мюррея показали, что анизотропное распределение электронной плотности вокруг ядра галогена — «σ-дыры» [8] — лежат в основе высокой направленности галогенной связи. [24] Затем эту дыру экспериментально наблюдали с помощью зондовой силовой микроскопии Кельвина . [25] [26]
В 2020 году Келлетт и др. показали, что галогенные связи также имеют π-ковалентный характер, аналогичный координационным связям металлов . [27] В августе 2023 года «π-дырка» тоже наблюдалась экспериментально. [28] [29]
Приложения
[ редактировать ]Кристаллическая инженерия
[ редактировать ]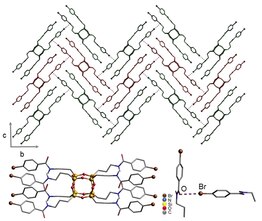
Прочность и направленность галогенных связей являются ключевым инструментом в области инженерии кристаллов , которая пытается формировать кристаллические структуры посредством тщательного контроля межмолекулярных взаимодействий. [31] Галогенные связи могут стабилизировать сополимеры. [32] [33] или вызвать мезоморфизм в изотропных жидкостях . [34] Действительно, жидкокристаллические фазы, индуцированные галогенными связями, известны как в алкоксистильбазолах, так и в алкоксистильбазолах. [34] и силсесквиоксаны (на фото). [30] С другой стороны, стерическая чувствительность галогенных связей может привести к кристаллизации объемных молекул в пористые структуры ; в одном примечательном случае галогенные связи между йодом и ароматическими π-орбиталями заставили молекулы кристаллизоваться в структуру, состоящую почти на 40% из пустот . [35]
Контролируемая полимеризация
[ редактировать ]Сопряженные полимеры открывают заманчивую возможность создания органических молекул с управляемой электронной зонной структурой , но современные методы производства имеют неконтролируемую топологию . Сан, Лаухер и Горофф обнаружили, что некоторые амиды обеспечивают линейную полимеризацию поли(дииоддиацетилена) . В основе механизма лежит самоорганизация амидов через водородные связи, которые затем передаются к дииоддиацетиленовым мономерам через галогенные связи. Хотя чистые кристаллы дийоддиацетилена не полимеризуются самопроизвольно, организация, индуцированная галогенными связями, достаточно прочна, поэтому сокристаллы спонтанно полимеризуются. [36]
- Катализатор-мономер сокристалл. Единицы повторяются каждые 5,25 Å и ориентированы под углом 51,3˚.
- Кристаллическая структура после полимеризации: атом кислорода (фиолетовый) образует водородную связь (синяя пунктирная линия) и слабую галогенную связь с йодными заместителями полимера. Йод также может образовывать галогенную связь с концевыми нитрилами (красная пунктирная линия).
Биологические макромолекулы
[ редактировать ]
Большинство биологических макромолекул содержат мало атомов галогена или вообще не содержат их. Но когда молекулы содержат галогены, галогенные связи часто необходимы для понимания молекулярной конформации . Компьютерные исследования показывают, что известные галогенированные нуклеиновые основания образуют галогенные связи с кислородом , азотом или серой in vitro . Интересно, что атомы кислорода обычно притягивают не галогены с их неподеленными парами , а скорее π- электроны в карбонильной или амидной группе . [5]
Галогенные связи могут иметь важное значение при разработке лекарств также . Например, ингибитор IDD 594 связывается с альдозоредуктазой человека через связь бром-галоген, как показано на рисунке. Молекулы не могут связываться друг с другом, если аналогичная альдегидредуктаза заменяет фермент или хлор заменяет галоген лекарственного средства, поскольку варианты геометрии ингибируют галогенную связь. [37]
Примечания
[ редактировать ]- ^ Хотя водород иногда считают галогеном , условность исключает водородные связи из категории галогенных связей. Полный анализ см. в § Сравнение с другими силами, подобными связям .
Ссылки
[ редактировать ]- ^ Десираджу Г.Р., Хо П.С., Клоо Л., Легон А.С., Марквардт Р., Метранголо П. и др. (2013). «Определение галогенной связи (Рекомендации ИЮПАК 2013 г.)» . Чистое приложение. Хим . 85 (8): 1711–1713. doi : 10.1351/pac-rec-12-05-10 .
- ^ Перейти обратно: а б с д Метранголо П., Нойкирх Х., Пилати Т., Реснати Г. (май 2005 г.). «Процессы распознавания на основе галогенных связей: мир, параллельный водородным связям». Отчеты о химических исследованиях . 38 (5): 386–395. дои : 10.1021/ar0400995 . ПМИД 15895976 .
- ^ Перейти обратно: а б Гилдей Л.К., Робинсон С.В., Барендт Т.А., Лэнгтон М.Дж., Маллани Б.Р., Бир П.Д. (август 2015 г.). «Галогенные связи в супрамолекулярной химии». Химические обзоры . 115 (15): 7118–7195. дои : 10.1021/cr500674c . ПМИД 26165273 .
- ^ Метранголо П., Реснати Дж. (июнь 2001 г.). «Галогенная связь: парадигма супрамолекулярной химии». Химия . 7 (12): 2511–2519. doi : 10.1002/1521-3765(20010618)7:12<2511::AID-CHEM25110>3.0.CO;2-T . ПМИД 11465442 .
- ^ Перейти обратно: а б Ауффингер П., Хейс Ф.А., Вестхоф Э., Хо П.С. (ноябрь 2004 г.). «Галогенные связи в биологических молекулах» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (48): 16789–16794. Бибкод : 2004PNAS..10116789A . дои : 10.1073/pnas.0407607101 . ПМК 529416 . ПМИД 15557000 .
- ^ Перейти обратно: а б с Кавалло Дж., Метранголо П., Милани Р., Пилати Т., Приимаги А., Реснати Дж., Терранео Дж. (февраль 2016 г.). «Галогеновая связь» . Химические обзоры . 116 (4): 2478–2601. doi : 10.1021/acs.chemrev.5b00484 . ПМЦ 4768247 . ПМИД 26812185 .
- ^ Перейти обратно: а б Хассель О. (октябрь 1970 г.). «Структурные аспекты межатомной связи с переносом заряда». Наука . 170 (3957): 497–502. Бибкод : 1970Sci...170..497H . дои : 10.1126/science.170.3957.497 . ПМИД 17799698 .
- ^ Перейти обратно: а б Кларк Т., Хеннеманн М., Мюррей Дж.С., Политцер П. (февраль 2007 г.). «Галогенная связь: сигма-дырка. Труды «Моделирование взаимодействий в биомолекулах II», Прага, 5-9 сентября 2005 г.». Журнал молекулярного моделирования . 13 (2): 291–296. дои : 10.1007/s00894-006-0130-2 . ПМИД 16927107 . S2CID 93970509 .
- ^ Политцер П., Лейн П., Конча М.К., Ма Ю., Мюррей Дж.С. (февраль 2007 г.). «Обзор галогенной связи». Журнал молекулярного моделирования . 13 (2): 305–311. дои : 10.1007/s00894-006-0154-7 . ПМИД 17013631 . S2CID 39255577 .
- ^ Wolters LP, Bickelhaupt FM (апрель 2012 г.). «Галогенная связь против водородной связи: молекулярно-орбитальный взгляд» . ХимияОткрыть . 1 (2): 96–105. дои : 10.1002/open.201100015 . ПМЦ 3922460 . ПМИД 24551497 .
- ^ Арагони М.С., Арка М., Демартин Ф., Девиланова Ф.А., Гарау А., Исайя Ф. и др. (июль 2005 г.). «Расчеты методом DFT, структурные и спектроскопические исследования продуктов, образующихся между IBr и N,N'-диметилбензимидазол-2(3H)-тионом и -2(3H)-селоном». Далтон Транзакции (13): 2252–2258. дои : 10.1039/B503883A . ПМИД 15962045 .
- ^ Эскандари К., Лесани М. (март 2015 г.). «Участвует ли фтор в галогенных связях?». Химия . 21 (12): 4739–4746. дои : 10.1002/chem.201405054 . ПМИД 25652256 .
- ^ Турунен Л., Хансен Дж. Х., Эрдели М. (май 2021 г.). «Галогенная связь: странная химия?» . Химическая запись . 21 (5): 1252–1257. дои : 10.1002/tcr.202100060 . hdl : 10037/22989 . ПМИД 33939244 . S2CID 233483539 .
- ^ Арагони М.К., Арка М., Девиланова Ф.А., Херстхаус М.Б., Хут С.Л., Исайя Ф. и др. (15 апреля 2005 г.). «Реакции доноров пиридила с галогенами и интергалогенами: рентгеновская дифракция и рамановское исследование Фурье» . Журнал металлоорганической химии . III Euchem-конференция по азотным лигандам в металлоорганической химии и гомогенном катализе. 690 (8): 1923–1934. doi : 10.1016/j.jorganchem.2004.11.001 . ISSN 0022-328X .
- ^ Перейти обратно: а б Метранголо П., Мейер Ф., Пилати Т., Реснати Дж., Терранео Дж. (4 августа 2008 г.). «Галогенная связь в супрамолекулярной химии». Ангеванде Хеми . 47 (33): 6114–6127. дои : 10.1002/anie.200800128 . ПМИД 18651626 .
- ^ Лиантонио Р., Метранголо П., Пилати Т., Реснати Дж. (01.05.2003). «Фторсодержащие взаимопроникающие слои в трехкомпонентной кристаллической матрице» . Рост и дизайн кристаллов . 3 (3): 355–361. дои : 10.1021/cg0340244 . ISSN 1528-7483 .
- ^ Бауза А, Фронтера А (июнь 2015 г.). «Взаимодействие аэрогенных связей: новая супрамолекулярная сила?». Ангеванде Хеми . 54 (25): 7340–7343. дои : 10.1002/anie.201502571 . ПМИД 25950423 .
- ^ Гатри Ф (1863). «Xxviii. О йодиде иодаммония» . Дж. Хим. Соц . 16 : 239–244. дои : 10.1039/js8631600239 .
- ^
- Малликен Р.С. (1950). «Структуры комплексов молекул галогенов с ароматическими и кислородсодержащими растворителями I.». Дж. Ам. хим. Соц . 72 (1): 600. doi : 10.1021/ja01157a151 .
- Малликен Р.С. (1952). «Молекулярные соединения и их спектры. II». Дж. Ам. хим. Соц . 74 (3): 811–824. дои : 10.1021/ja01123a067 .
- Малликен Р.С. (1952). «Молекулярные соединения и их спектры. III. Взаимодействие доноров и акцепторов электронов». Дж. Физ. Хим . 56 (7): 801–822. дои : 10.1021/j150499a001 .
- ^ Хассель О, Хвослеф Дж (1954). «Структура 1,4-диоксаната брома» (PDF) . Акта Хим. Скан . 8 : 873. doi : 10.3891/acta.chem.scand.08-0873 .
- ^ Хассель О (1972). «Структурные аспекты межатомной связи с переносом заряда». В Нобелевских лекциях по химии 1963–1970 : 314–329.
- ^ Дюма Ж.М., Перишар Х., Гомель М. (1978). «CX4... Базовые взаимодействия как модели слабых взаимодействий с переносом заряда: сравнение с сильными взаимодействиями с переносом заряда и водородной связью». Дж. Хим. Рез.(S) . 2 : 54–57.
- ^ Легон AC (сентябрь 1999 г.). «Пререактивные комплексы дигалогенов XY с основаниями Льюиса B в газовой фазе: систематический случай галогенного аналога B···XY водородной связи B···HX». Ангеванде Хеми . 38 (18): 2686–2714. doi : 10.1002/(sici)1521-3773(19990917)38:18<2686::aid-anie2686>3.0.co;2-6 . ПМИД 10508357 .
- ^ Политцер П., Мюррей Дж.С., Кларк Т. (июль 2010 г.). «Галогенная связь: электростатически управляемое узконаправленное нековалентное взаимодействие». Физическая химия Химическая физика . 12 (28): 7748–7757. Бибкод : 2010PCCP...12.7748P . дои : 10.1039/c004189k . ПМИД 20571692 .
- ^ Маллада Б., Галлардо А., Ламанек М., де ла Торре Б., Шпирко В., Хобза П., Елинек П. (ноябрь 2021 г.). «Визуализация анизотропного заряда σ-дырки в реальном пространстве с помощью зондовой силовой микроскопии Кельвина». Наука . 374 (6569): 863–867. Бибкод : 2021Sci...374..863M . дои : 10.1126/science.abk1479 . ПМИД 34762455 . S2CID 244039573 .
- ^ Институт органической химии и биохимии Чешской академии наук (IOCB Прага). «Первое наблюдение неоднородного распределения электронного заряда на атоме» . физ.орг . Проверено 7 сентября 2023 г.
- ^ Келлетт CW, Кеннеполь П., Берлингетт CP (июль 2020 г.). «π-ковалентность в галогенной связи» . Природные коммуникации . 11 (1): 3310. Бибкод : 2020NatCo..11.3310K . дои : 10.1038/s41467-020-17122-7 . ПМЦ 7335087 . ПМИД 32620765 .
- ^ Маллада Б., Ондрачек М., Ламанек М., Галлардо А., Хименес-Мартин А., де ла Торре Б. и др. (август 2023 г.). «Визуализация π-дырки в молекулах методами зондовой силовой микроскопии Кельвина» . Природные коммуникации . 14 (1): 4954. Бибкод : 2023NatCo..14.4954M . дои : 10.1038/s41467-023-40593-3 . ПМЦ 10432393 . ПМИД 37587123 .
- ^ Институт органической химии и биохимии КАН. «Ученые подтверждают существующую десятилетиями теорию о неравномерном распределении электронной плотности в ароматических молекулах» . физ.орг . Проверено 7 сентября 2023 г.
- ^ Перейти обратно: а б Джанета М, Шаферт С (01 октября 2017 г.). «Синтез, характеристика и термические свойства амидо-POSS типа Т8 с концевой п-галогенфенильной группой». Журнал металлоорганической химии . 847 : 173–183. дои : 10.1016/j.jorganchem.2017.05.044 . ISSN 0022-328X .
- ^ Метранголо П., Реснати Г. , Пилати Т., Терранео Г., Биелла С. (2009). «Координация анионов и сборка анионов под контролем галогенных связей». CrystEngComm . 11 (7): 1187–1196. дои : 10.1039/B821300C .
- ^ Корради Э., Мейле С.В., Мессина М.Т., Метранголо П., Реснати Дж. (май 2000 г.). «Галогенная связь по сравнению с водородной связью в управлении процессами самосборки. Самосборка перфторуглерод-углеводород, часть IX. Эта работа была поддержана MURST (Cofinanziamento '99) и ЕС (COST-D12-0012)». Коммуникации. Ангеванде Хеми . 39 (10). Уайли-ВЧ: 1782–1786. doi : 10.1002/(SICI)1521-3773(20000515)39:10<1782::AID-ANIE1782>3.0.CO;2-5 . ПМИД 10934360 .
- ^ Амико В., Мейле С.В., Корради Э., Мессина М.Т., Реснати Дж. (август 1998 г.). «Самосборка перфторуглерод-углеводород. Образование 1D бесконечной цепи, обусловленное взаимодействиями азота ···йода» . Журнал Американского химического общества . 120 (32): 8261–8262. дои : 10.1021/ja9810686 . ISSN 0002-7863 .
- ^ Перейти обратно: а б Нгуен Х.Л., Хортон П.Н., Херстхаус М.Б., Легон AC, Брюс Д.В. (январь 2004 г.). «Галогенная связь: новое взаимодействие для образования жидких кристаллов». Журнал Американского химического общества . 126 (1): 16–17. дои : 10.1021/ja036994l . ПМИД 14709037 .
- ^ Пигге ФК, Вангала ВР, Кападиа П.П., Свенсон, округ Колумбия, Рат Н.П. (октябрь 2008 г.). «Гексагональные кристаллические комплексы включения 4-йодфенокситримезоата». Химические коммуникации . 38 (39): 4726–4728. дои : 10.1039/b809592b . ПМИД 18830473 . S2CID 40424594 .
- ^ Сунь А., Лаухер Дж.В., Горофф Н.С. (май 2006 г.). «Получение поли(дииоддиацетилена), упорядоченного сопряженного полимера углерода и йода». Наука . 312 (5776): 1030–1034. Бибкод : 2006Sci...312.1030S . дои : 10.1126/science.1124621 . ПМИД 16709780 . S2CID 36045120 .
- ^ Перейти обратно: а б Ховард Э.И., Санишвили Р., Кашау Р.Е., Митшлер А., Шеврие Б., Барт П. и др. (июнь 2004 г.). «Разработка препарата I сверхвысокого разрешения: детали взаимодействия в комплексе альдозоредуктазы-ингибитора человека при 0,66 А» . Белки . 55 (4): 792–804. дои : 10.1002/прот.20015 . ПМИД 15146478 . S2CID 38388856 .
Электростатическое взаимодействие между атомом Br ингибитора и ОГ Thr 113 имеет необычно короткое расстояние - 2,973(4) Å. Короткий контакт между Br и Thr 113 OG объясняет селективность IDD 594 по отношению к AR, поскольку в альдегидредуктазе остаток Thr заменен на Tyr.... Взаимодействие IDD 594-Br/Thr 113-OG также способствует эффективности ингибитор. Другие галогены, например хлор, не могут вступать в подобное взаимодействие (из-за меньшей поляризуемости).
Дальнейшее чтение
[ редактировать ]- Ранний обзор: Бент, ХА (1968). «Структурная химия донорно-акцепторных взаимодействий». хим. Преподобный . 68 (5): 587–648. дои : 10.1021/cr60255a003 .





