Альдозоредуктаза
| Альдозоредуктаза | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 1.1.1.21 | ||
| Номер CAS. | 9028-31-3 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
В энзимологии кодируемый альдозоредуктаза (или альдегидредуктаза ) ( EC 1.1.1.21 ) представляет собой фермент человека, геном AKR1B1 . Это цитозольная НАДФН -зависимая оксидоредуктаза , которая катализирует восстановление различных альдегидов и карбонилов, включая моносахариды, и прежде всего известна тем, что катализирует восстановление глюкозы до сорбита , первого этапа полиольного пути метаболизма глюкозы. [ 1 ]
Реакции
[ редактировать ]Альдозоредуктаза катализирует НАДФН-зависимое превращение глюкозы в сорбит , первый этап полиольного пути метаболизма глюкозы. Второй и последний этап пути катализируется сорбитдегидрогеназой , которая катализирует НАД-связанное окисление сорбита до фруктозы. Таким образом, полиоловый путь приводит к превращению глюкозы во фруктозу со стехиометрическим использованием НАДФН и образованием НАДН. [ 1 ]
Галактоза также является субстратом полиольного пути, но соответствующий кетосахар не образуется, поскольку сорбитдегидрогеназа не способна окислять галактит. [ 2 ] Тем не менее, альдозоредуктаза может катализировать восстановление галактозы до галактитола.
- галактоза + НАДФН + Н + галактитол + НАДФ +
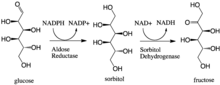
Функция
[ редактировать ]Реакция альдозоредуктазы, в частности вырабатываемый сорбит, важна для функционирования различных органов организма. Например, его обычно используют в качестве первого этапа синтеза фруктозы из глюкозы; второй этап — окисление сорбита во фруктозу, катализируемое сорбитдегидрогеназой . Основной путь от глюкозы до фруктозы ( гликолиз ) включает фосфорилирование глюкозы гексокиназой с образованием глюкозо-6-фосфата с последующей изомеризацией во фруктозо-6-фосфат и гидролизом фосфата, но сорбитоловый путь полезен, поскольку не требует участия энергии в виде АТФ :
- Семенные пузырьки : фруктоза, вырабатываемая из сорбита, используется сперматозоидами .
- Печень : Фруктоза, полученная из сорбита, может использоваться в качестве источника энергии для гликолиза и гликонеогенеза .
Альдозоредуктаза также присутствует в хрусталике , сетчатке , шванновских клетках периферических нервов, плаценте и эритроцитах . [ нужна ссылка ]
У дрозофилы CG6084 кодирует высококонсервативный белок человеческой альдокеторедуктазы 1B. dAKR1B в гемоцитах необходим и достаточен для повышения уровня сахарных спиртов в плазме после кишечной инфекции. Повышенное содержание сорбита впоследствии активирует металлопротеазу 2, которая расщепляет PGRP-LC и активирует системный иммунный ответ в жировых телах. Таким образом, альдозоредуктаза обеспечивает критическую метаболическую контрольную точку в глобальной воспалительной реакции. [ 3 ]
Структура фермента
[ редактировать ]Альдозоредуктазу можно считать прототипом фермента суперсемейства ферментов альдокеторедуктазы. Фермент состоит из 315 аминокислотных остатков и складывается в структурный мотив β/α-цилиндра, состоящий из восьми параллельных β-цепей. [ 4 ] Соседние нити соединены восемью периферийными α-спиральными сегментами, идущими антипараллельно β-листу. [ 5 ] Каталитический активный центр расположен в ядре ствола. [ 5 ] [ 6 ] Кофактор НАДФН расположен в верхней части β/α-цилиндра, при этом никотинамидное кольцо выступает вниз в центре цилиндра, а пирофосфат находится между краями цилиндра. [ 1 ]
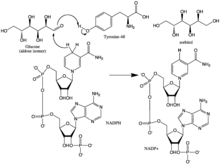



Ферментативный механизм
[ редактировать ]Механизм реакции альдозоредуктазы в направлении восстановления альдегида следует последовательному упорядоченному пути, где связывается НАДФН, а затем субстрат. Связывание НАДФН вызывает конформационное изменение (Фермент•НАДФН → Фермент*•НАДФН), которое включает шарнирное движение поверхностной петли (остатки 213–217) таким образом, чтобы покрыть часть НАДФН способом, аналогичным тому, который происходит у НАДФН. ремень безопасности. Спиртовой продукт образуется путем переноса про-R-гидрида НАДФН на поверхность карбонильного углерода субстрата. После выпуска алкогольного продукта происходит еще одно конформационное изменение (E*•NADP + → E•NADP + ) для высвобождения НАДФ + . [ 8 ] Кинетические исследования показали, что переориентация этой петли для обеспечения высвобождения НАДФ + по-видимому, представляет собой ограничивающий скорость шаг в направлении восстановления альдегидов. [ 9 ] [ 10 ] [ 11 ] Поскольку скорость высвобождения кофермента ограничивает каталитическую скорость, можно видеть, что нарушение взаимодействий, которые стабилизируют связывание кофермента, может иметь драматические эффекты на максимальную скорость (Vmax). [ 11 ]
Гидрид, который передается от НАДФ + глюкоза поступает из С-4 никотинамидного кольца в основании гидрофобной полости. Таким образом, положение этого углерода определяет активный центр фермента. В ферменте на подходящем расстоянии от C-4 существуют три остатка, которые могут быть потенциальными донорами протонов: Tyr-48, His-110 и Cys-298. Данные эволюционного, термодинамического и молекулярного моделирования предсказали, что Tyr-48 является донором протонов. Это предсказание подтвердилось результатами мутагенеза исследований. [ 5 ] [ 12 ] [ 13 ] Таким образом, считается, что взаимодействие [водородных связей] между фенольной гидроксильной группой Tyr-48 и аммониевой боковой цепью Lys-77 помогает облегчить перенос гидрида. [ 5 ]
Роль при диабете
[ редактировать ]Сахарный диабет признан основной причиной новых случаев слепоты и связан с повышенным риском болезненной нейропатии, заболеваний сердца и почечной недостаточности. Было выдвинуто множество теорий, объясняющих механизмы, приводящие к диабетическим осложнениям, включая стимуляцию метаболизма глюкозы полиоловым путем. Кроме того, фермент локализован в глазах ( роговице , сетчатке , хрусталике ), почках и миелиновой оболочке – тканях, которые часто участвуют в осложнениях диабета. [ 14 ] При нормальных гликемических условиях только небольшая часть глюкозы метаболизируется по полиольному пути, так как большая часть глюкозы фосфорилируется гексокиназой, и образующийся продукт, глюкозо-6-фосфат, используется в качестве субстрата для гликолиза или метаболизма пентозофосфата. [ 15 ] [ 16 ] Однако в ответ на хроническую гипергликемию , обнаруженную у диабетиков, поток глюкозы через полиоловый путь значительно увеличивается. До 33% общего использования глюкозы в некоторых тканях может осуществляться полиольным путем. [ 17 ] Концентрация глюкозы часто повышается у диабетиков , и долгое время считалось, что альдозоредуктаза ответственна за диабетические осложнения, затрагивающие ряд органов. Многие ингибиторы альдозоредуктазы были разработаны в качестве потенциальных лекарств, но практически все они оказались безуспешными, хотя некоторые из них, такие как Эпалрестат, коммерчески доступны в нескольких странах. Дополнительные ингибиторы редуктазы, такие как альрестатин , экзисулинд , имирестат , зопольрестат , толрестат , зенарестат , кафикрестат , фидарестат , говорестат , ранирестат , поналрестат , ризарестат , сорбинил и берберин , полиумозид , ганодеровая кислота. [ 18 ] в настоящее время проходят клинические испытания. [ 19 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с Петраш Дж. М. (апрель 2004 г.). «Все в семье: альдозоредуктаза и близкородственные альдокеторедуктазы» . Клетка. Мол. Наука о жизни . 61 (7–8): 737–49. дои : 10.1007/s00018-003-3402-3 . ПМЦ 11138595 . ПМИД 15094999 . S2CID 25983505 .
- ^ Едзиняк Дж. А., Йейтс Э. М., Киношита Дж. Х. (июнь 1973 г.). «Хрусталик-полиолдегидрогеназа». Эксп. Глаз Рез. 16 (2): 95–104. дои : 10.1016/0014-4835(73)90304-7 . ПМИД 4352688 .
- ^ Ян С., Чжао Ю, Ю Дж, Фань З, Гун С.Т., Тан Х, Пан Л. (август 2019 г.). «Сахарные спирты полиольного пути служат аларминами, опосредующими локально-системную коммуникацию врожденного иммунитета у дрозофилы» . Клетка-хозяин и микроб . 26 (2): 240–251. дои : 10.1016/j.chom.2019.07.001 . ПМИД 31350199 .
- ^ Барский О.А., Габбай К.Х., Борен К.М. (сентябрь 1999 г.). «Характеристика гена и промотора альдегидредуктазы человека». Геномика . 60 (2): 188–98. дои : 10.1006/geno.1999.5915 . ПМИД 10486210 .
- ^ Jump up to: а б с д Уилсон Д.К., Борен К.М., Габбай К.Х., Киочо Ф.А. (июль 1992 г.). «Маловероятный участок сахарного субстрата в структуре 1,65 А голофермента альдозоредуктазы человека, вовлеченный в осложнения диабета». Наука . 257 (5066): 81–4. дои : 10.1126/science.1621098 . ПМИД 1621098 .
- ^ Рондо Ж.М., Тет-Фавье Ф., Поджарный А. и др. (январь 1992 г.). «Новый НАДФН-связывающий домен, обнаруженный в кристаллической структуре альдозоредуктазы». Природа . 355 (6359): 469–72. Бибкод : 1992Natur.355..469R . дои : 10.1038/355469a0 . ПМИД 1734286 . S2CID 4260654 .
- ^ Jump up to: а б Рисунок 11-4 в: Род Цветок; Хамфри П. Ранг; Морин М. Дейл; Риттер, Джеймс М. (2007). Фармакология Ранг и Дейл . Эдинбург: Черчилль Ливингстон. ISBN 978-0-443-06911-6 .
- ^ Накано Т., Петраш Дж. М. (август 1996 г.). «Кинетические и спектроскопические доказательства ингибирования активного центра альдозоредуктазы человека». Биохимия . 35 (34): 11196–202. дои : 10.1021/bi9608121 . ПМИД 8780524 .
- ^ Гримшоу С.Э., Шахбаз М., Путни К.Г. (октябрь 1990 г.). «Механистические основы нелинейной кинетики восстановления альдегидов, катализируемого альдозоредуктазой». Биохимия . 29 (42): 9947–55. дои : 10.1021/bi00494a027 . ПМИД 2125486 .
- ^ Кубишески Т.Дж., Гайндман DJ, Морьяна Н.А., Флинн Т.Г. (апрель 1992 г.). «Исследования альдозоредуктазы мышц свиньи. Кинетический механизм и доказательства медленных конформационных изменений при связывании кофермента» . Ж. Биол. хим. 267 (10): 6510–7. дои : 10.1016/S0021-9258(19)50457-4 . ПМИД 1551865 . Проверено 18 мая 2010 г.
- ^ Jump up to: а б Гримшоу С.Э., Борен К.М., Лай С.Дж., Габбай К.Х. (ноябрь 1995 г.). «Альдозоредуктаза человека: константы скорости механизма, включая взаимное преобразование тройных комплексов рекомбинантным ферментом дикого типа». Биохимия . 34 (44): 14356–65. дои : 10.1021/bi00044a012 . ПМИД 7578039 .
- ^ Тарле И., Борхани Д.В., Уилсон Д.К., Киочо Ф.А., Петраш Дж.М. (декабрь 1993 г.). «Зондирование активного сайта альдозоредуктазы человека. Сайт-направленный мутагенез Asp-43, Tyr-48, Lys-77 и His-110» . Ж. Биол. хим. 268 (34): 25687–93. дои : 10.1016/S0021-9258(19)74444-5 . ПМИД 8245005 . Проверено 18 мая 2010 г.
- ^ Борен К.М., Гримшоу С.Э., Лай С.Дж. и др. (март 1994 г.). «Тирозин-48 является донором протонов, а гистидин-110 управляет стереохимической селективностью субстрата в реакции восстановления альдозоредуктазы человека: кинетика фермента и кристаллическая структура мутантного фермента Y48H». Биохимия . 33 (8): 2021–32. дои : 10.1021/bi00174a007 . ПМИД 8117659 .
- ^ Шрийверс Б.Ф., Де Вризе А.С., Фливбьерг А. (декабрь 2004 г.). «От гипергликемии к диабетической болезни почек: роль метаболических, гемодинамических, внутриклеточных факторов и факторов роста/цитокинов» . Эндокр. Откр. 25 (6): 971–1010. дои : 10.1210/er.2003-0018 . ПМИД 15583025 . Проверено 18 мая 2010 г.
- ^ Габбай К.Х., Мерола Л.О., Филд Р.А. (январь 1966 г.). «Путь сорбита: присутствие в нервах и канатиках с накоплением субстрата при диабете». Наука . 151 (3707): 209–10. Бибкод : 1966Sci...151..209G . дои : 10.1126/science.151.3707.209 . ПМИД 5907911 . S2CID 31291584 .
- ^ Линдстад Р.И., МакКинли-Макки Дж.С. (сентябрь 1993 г.). «Метилглиоксаль и полиоловый путь. Трехуглеродные соединения являются субстратами сорбитдегидрогеназы печени овцы» . ФЭБС Летт. 330 (1): 31–5. дои : 10.1016/0014-5793(93)80913-F . ПМИД 8370454 . S2CID 39393722 .
- ^ Ченг Х.М., Гонсалес Р.Г. (апрель 1986 г.). «Влияние высокого уровня глюкозы и окислительного стресса на метаболизм хрусталика, альдозоредуктазу и старческий катарактогенез». Метаб. Клин. Эксп. 35 (4 Приложение 1): 10–4. дои : 10.1016/0026-0495(86)90180-0 . ПМИД 3083198 .
- ^ У Л.И., Ма З.М., Фань XL, Чжао Т., Лю Ч.Х., Хуан Х., Ли М.М., Сюн Л., Чжан К., Чжу Л.Л., Фань М. (ноябрь 2009 г.). «Антинекрозная роль гипоксического прекондиционирования после острой аноксии опосредована путем альдозоредуктазы и сорбита в клетках PC12» . Клеточные стрессы и шапероны . 15 (4): 387–94. дои : 10.1007/s12192-009-0153-6 . ПМК 3082650 . ПМИД 19902381 .
- ^ Шеммель К.Е., Падияра Р.С., Д'Суза Дж.Дж. (сентябрь 2009 г.). «Ингибиторы альдозоредуктазы в лечении диабетической периферической нейропатии: обзор». J. Осложнение диабета . 24 (5): 354–60. дои : 10.1016/j.jdiacomp.2009.07.005 . ПМИД 19748287 .
Дальнейшее чтение
[ редактировать ]- Дениз Р., доктор философии. Ферье (2005). Иллюстрированные обзоры Липпинкотта: биохимия (Иллюстрированные обзоры Липпинкотта) . Хагерстаун, Мэриленд: Липпинкотт Уильямс и Уилкинс. п. 319. ИСБН 0-7817-2265-9 .
- Эттвуд, Массачусетс, Даути CC (декабрь 1974 г.). «Очистка и свойства альдозоредуктазы печени теленка». Биохим. Биофиз. Акта . 370 (2): 358–68. дои : 10.1016/0005-2744(74)90097-7 . ПМИД 4216364 .
- Богосян Р.А., МакГиннесс Е.Т. (апрель 1979 г.). «Аффинная очистка и свойства альдозоредуктазы мозга свиньи». Биохим. Биофиз. Акта . 567 (2): 278–86. дои : 10.1016/0005-2744(79)90113-x . ПМИД 36151 .
- ^ Биби, Джейн А.; Фрей, Перри А. (1 октября 1998 г.). «Галактозомутаротаза: очистка, характеристика и исследование двух важных остатков гистидина» . Биохимия . 37 (42): 14989–14997. дои : 10.1021/bi9816047 . ISSN 0006-2960 .
