3-гидроксиацил-КоА дегидрогеназа
| 3-гидроксиацил-КоА дегидрогеназа | |||
|---|---|---|---|
 Гомодимер (S)-3-гидроксибутирил-КоА дегидрогеназы, Cupriavidus necator | |||
| Идентификаторы | |||
| Номер ЕС. | 1.1.1.35 | ||
| Номер CAS. | 9028-40-4 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| Гидроксиацил-Кофермент А дегидрогеназа | |||
|---|---|---|---|
 Рендеринг PDB на основе 3had. | |||
| Идентификаторы | |||
| Символ | ТЕНЬ | ||
| Альт. символы | ХАДХСК | ||
| ген NCBI | 3033 | ||
| HGNC | 4799 | ||
| МОЙ БОГ | 601609 | ||
| RefSeq | НМ_005327 | ||
| ЮниПрот | Q16836 | ||
| Другие данные | |||
| Номер ЕС | 1.1.1.35 | ||
| Локус | Хр. 4 q22-q26 | ||
| |||
В энзимологии 3 -гидроксиацил-КоА дегидрогеназа ( EC 1.1.1.35 ) — фермент химическую , катализирующий реакцию .
- (S)-3-гидроксиацил-КоА + НАД + 3-оксоацил-КоА + НАДН + Н +
Таким образом, двумя субстратами этого фермента являются (S)-3-гидроксиацил-КоА и НАД. + , тогда как его тремя продуктами являются 3-оксоацил-КоА , НАДН и H. + .
Этот фермент принадлежит к семейству оксидоредуктаз , а именно тех, которые действуют на группу CH-OH донора с НАД. + или НАДФ + как акцептор.
изоферменты
[ редактировать ]У человека следующие гены кодируют белки с активностью 3-гидроксиацил-КоА-дегидрогеназы:
- HADH – гидроксиацил-кофермент А дегидрогеназа
- HSD17B10 - 3-гидроксиацил-КоА дегидрогеназа типа 2
- EHHADH – пероксисомальный бифункциональный фермент.
- HSD17B4 - Пероксисомальный многофункциональный фермент типа 2.
Функция
[ редактировать ]3-Гидроксиацил-КоА-дегидрогеназа классифицируется как оксидоредуктаза . Он участвует в процессах обмена жирных кислот. В частности, он катализирует третью стадию бета-окисления ; окисление L- 3 -гидроксиацил-КоА НАД + . Реакция превращает гидроксильную группу в кетогруппу .
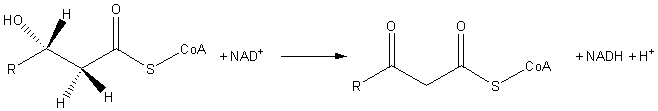
Конечным продуктом является 3-кетоацил-КоА .
Метаболические пути
[ редактировать ]Этот фермент участвует в 8 метаболических путях :
Номенклатура
[ редактировать ]Систематическое название этого класса ферментов: (S)-3-гидроксиацил-КоА:НАД. + оксидоредуктаза. Другие широко используемые имена включают:
- 1-специфическая DPN-связанная бета-гидроксимасляная дегидрогеназа
- 3-гидроксиацетил-кофермент А дегидрогеназа
- 3-гидроксиацил-кофермент А дегидрогеназа
- 3-гидроксибутирил-КоА дегидрогеназа
- 3-гидроксиизобутирил-КоА дегидрогеназа
- 3-кеторедуктаза
- 3-L-гидроксиацил-КоА дегидрогеназа
- 3бета-гидроксиацил-кофермент А дегидрогеназа
- дегидрогеназа бета-гидроксикислот
- бета-гидроксиацил-КоА-дегидрогеназа
- бета-гидроксиацилдегидрогеназа
- бета-гидроксиацил-коэнзим А-синтетаза
- бета-гидроксиацилкофермент А дегидрогеназа
- бета-гидроксибутирилкофермент А дегидрогеназа
- бета-кеторедуктаза
- бета-кетоацил-КоА-редуктаза
- L-3-гидроксиацил-КоА-дегидрогеназа
- L-3-гидроксиацил-кофермент А дегидрогеназа
Структурные исследования
[ редактировать ]По состоянию на 20 января 2010 г. 22 структуры для этого класса ферментов решено PDB с кодами доступа 1F0Y , 1F12 , 1F14 , 1F17 , 1F67 , 1GZ6 , 1IKT , 1IL0 , 1LSJ , 1LSO , 1M75 , 1M76 , 1S9C , 1WDK , , 1WDL , 1WDM , 1ZBQ , 1ZCJ , 2D3T , 2HDH , 3HAD и 3HDH .
Ссылки
[ редактировать ]- Хиллмер П., Готшалк Г. (1974). «Солюбилизация и частичная характеристика дегидрогеназ частиц Clostridium kluyveri ». Биохим. Биофиз. Акта . 334 : 12–23. дои : 10.1016/0005-2744(74)90146-6 .
- Ленингер А.Л., Гревилл Г.Д. (1953). «Ферментативное окисление альфа- и 2-бета-гидроксибутирата». Биохимика и биофизика Acta . 12 (1–2): 188–202. дои : 10.1016/0006-3002(53)90138-3 . ПМИД 13115428 .
- Стерн-младший (ноябрь 1957 г.). «Кристаллическая бета-гидроксибутирилдегидрогеназа из сердца свиньи». Биохимика и биофизика Acta . 26 (2): 448–9. дои : 10.1016/0006-3002(57)90040-9 . ПМИД 13499396 .
- Вакил С.Дж., Грин Д.Э., Мии С., Малер Х.Р. (апрель 1954 г.). «Исследование системы окисления жирных кислот в тканях животных. VI. Бета-гидроксиацил-кофермент А дегидрогеназа» . Журнал биологической химии . 207 (2): 631–8. дои : 10.1016/S0021-9258(18)65679-0 . ПМИД 13163047 .
