Эноил-КоА гидратаза
| эноил-коэнзим А, гидратаза/3-гидроксиацил-кофермент А дегидрогеназа | |||
|---|---|---|---|
 Гексамер еноил-КоА-гидратазы крысы с активным центром оранжевого цвета и субстратом красным. | |||
| Идентификаторы | |||
| Символ | ЭХХАД | ||
| Альт. символы | ECHD | ||
| ген NCBI | 1962 | ||
| HGNC | 3247 | ||
| МОЙ БОГ | 607037 | ||
| RefSeq | НМ_001966 | ||
| ЮниПрот | Q08426 | ||
| Другие данные | |||
| Номер ЕС | 4.2.1.17 | ||
| Локус | Хр. 3 q26.3-q28 | ||
| |||
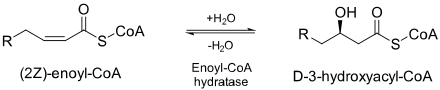
Эноил-КоА-гидратаза (ECH) или кротоназа [1] представляет собой фермент EC 4.2.1.17 , который гидратирует двойную связь между вторым и третьим атомами углерода на 2-транс/цис-еноил-КоА: [2]
ЭХГ необходим для метаболизма жирных кислот при бета-окислении с образованием как ацетил-КоА, так и энергии в форме АТФ . [2]
ЭХГ крыс представляет собой гексамерный белок (этот признак не является универсальным, но фермент человека также является гексамерным), что обуславливает эффективность этого фермента, поскольку он имеет 6 активных центров. Было обнаружено, что этот фермент очень эффективен и позволяет людям очень быстро метаболизировать жирные кислоты в энергию. Фактически этот фермент настолько эффективен, что скорость реакции короткоцепочечных жирных кислот эквивалентна скорости реакции, контролируемой диффузией . [3]
Метаболизм
[ редактировать ]Метаболизм жирных кислот
[ редактировать ]ЭХГ катализирует второй этап (гидратацию) распада жирных кислот ( β-окисление ). [4] Метаболизм жирных кислот – это то, как человеческий организм превращает жиры в энергию. Жиры в пищевых продуктах обычно находятся в форме триглицеринов . Их необходимо расщепить, чтобы жиры могли попасть в организм человека. Когда это происходит, высвобождаются три жирные кислоты.
Метаболизм лейцина
[ редактировать ]Механизм
[ редактировать ]ЭХГ используется при β-окислении для добавления гидроксильной группы и протона к ненасыщенному β-углероду жирноацил-КоА. ECH функционирует, предоставляя два глутамата остатка в качестве каталитической кислоты и основания . Две аминокислоты удерживают молекулу воды на месте, позволяя ей атаковать син-добавку к α-β-ненасыщенному ацил-КоА у β-углерода. Затем α-углерод захватывает другой протон, что завершает образование бета-гидроксиацил-КоА.

Из экспериментальных данных известно также, что в активном центре нет других источников протонов . Это означает, что протон, который захватывает α-углерод, принадлежит воде, которая только что атаковала β-углерод. Это означает, что гидроксильная группа и протон воды присоединяются с одной и той же стороны двойной связи – син-присоединение. Это позволяет ЭХГ образовывать стереоизомер S из 2-транс-еноил-КоА и стереоизомер R из 2-цис-еноил-КоА. Это становится возможным благодаря двум остаткам глутамата , которые удерживают воду в положении, непосредственно прилегающем к ненасыщенной двойной связи α-β. Эта конфигурация требует, чтобы активный центр ЭХГ был чрезвычайно жестким, чтобы удерживать воду в очень специфической конфигурации по отношению к ацил-КоА. Данные о механизме этой реакции не являются окончательными относительно того, является ли эта реакция согласованной (показана на рисунке) или происходит в последовательные стадии. Если это происходит последовательными шагами, промежуточный продукт идентичен тому, который был бы получен из Реакция элиминирования E1cB . [8]
ЭХГ механически подобен фумаразе .
Ссылки
[ редактировать ]- ^ «ЕС 4.2.1.17» . www.sbcs.qmul.ac.uk. Проверено 5 сентября 2018 г.
- ^ Jump up to: а б Алленбах, Л; Пуарье, Ю (2000). «Анализ альтернативных путей β-окисления ненасыщенных жирных кислот с использованием трансгенных растений, синтезирующих полигидроксиалканоаты в пероксисомах» . Физиология растений . 124 (3): 1159–1168. дои : 10.1104/стр.124.3.1159 . ISSN 0032-0889 . ПМК 59215 . ПМИД 11080293 .
- ^ Энгель К.К., Киема Т.Р., Хилтунен Ю.К., Виеренга Р.К. (февраль 1998 г.). «Кристаллическая структура еноил-КоА-гидратазы в комплексе с октаноил-КоА демонстрирует структурные адаптации, необходимые для связывания молекулы длинноцепочечной жирной кислоты-КоА». Журнал молекулярной биологии . 275 (5): 847–59. дои : 10.1006/jmbi.1997.1491 . ПМИД 9480773 .
- ^ Кокс Д.Л., Нельсон М.М. (2005). Ленингерские принципы биохимии (4-е изд.). Нью-Йорк: WH Freeman. п. 647-43 . ISBN 978-0-7167-4339-2 .
- ^ Jump up to: а б Уилсон Дж.М., Фитшен П.Дж., Кэмпбелл Б., Уилсон Дж.Дж., Занчи Н., Тейлор Л., Уилборн С., Калман Д.С., Стаут Дж.Р., Хоффман Дж.Р., Зигенфусс Т.Н., Лопес Х.Л., Крайдер Р.Б., Смит-Райан А.Е., Антонио Дж. (февраль 2013 г.) . «Позиция Международного общества спортивного питания: бета-гидрокси-бета-метилбутират (HMB)» . Журнал Международного общества спортивного питания . 10 (1): 6. дои : 10.1186/1550-2783-10-6 . ПМК 3568064 . ПМИД 23374455 .
- ^ Jump up to: а б Кольмайер М. (май 2015 г.). «Лейцин» . Метаболизм питательных веществ: структуры, функции и гены (2-е изд.). Академическая пресса. стр. 385–388. ISBN 978-0-12-387784-0 . Проверено 6 июня 2016 г.
Энергетическое топливо: со временем большая часть лея расщепляется, образуя около 6,0 ккал/г. Около 60% поступившего в организм Leu окисляется в течение нескольких часов... Кетогенез: значительная часть (40% поступившей в организм дозы) превращается в ацетил-КоА и тем самым способствует синтезу кетонов, стероидов, жирных кислот и других соединения
Рисунок 8.57: Метаболизм L -лейцина - ^ Бансон Б.Дж., Андерсон В.Е., Пецко Г.А. (февраль 2002 г.). «Структурный механизм еноил-КоА-гидратазы: три атома из одной воды добавляются либо ступенчато, либо согласованно по E1cb». Биохимия . 41 (8): 2621–9. дои : 10.1021/bi015844p . ПМИД 11851409 .
Внешние ссылки
[ редактировать ]- Эноил-КоА + гидратаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)