Карбоангидраза
| Карбоангидраза | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 4.2.1.1 | ||
| Номер CAS. | 9001-03-0 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| Карбоангидраза эукариотического типа | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Карб_ангидраза | ||
| Пфам | PF00194 | ||
| ИнтерПро | IPR001148 | ||
| PROSITE | PDOC00146 | ||
| СКОП2 | 1 банка / СКОПе / СУПФАМ | ||
| Мембраном | 333 | ||
| |||
Карбоангидразы , (или карбонатдегидратазы ) ( EC 4.2.1.1 ) образуют семейство ферментов которые катализируют взаимное превращение между диоксидом углерода и водой и диссоциированными ионами угольной кислоты (т.е. ионами бикарбоната и водорода ). [1] Активный центр большинства карбоангидраз содержит ион цинка . Поэтому их классифицируют как металлоферменты . Фермент поддерживает кислотно-щелочной баланс и помогает транспортировать углекислый газ. [2]
Карбоангидраза помогает поддерживать кислотно-щелочной гомеостаз , регулировать pH и баланс жидкости. В зависимости от его местоположения роль фермента меняется незначительно. Например, карбоангидраза вырабатывает кислоту в слизистой оболочке желудка. В почках контроль ионов бикарбоната влияет на содержание воды в клетках. Контроль ионов бикарбоната также влияет на содержание воды в глазах. Ингибиторы карбоангидразы используются для лечения глаукомы — чрезмерного скопления жидкости в глазах. Блокирование этого фермента меняет баланс жидкости в глазах, уменьшая накопление жидкости и тем самым снижая давление. [2] [3]
Карбоангидраза имеет решающее значение для функции гемоглобина благодаря эффекту Бора , который катализирует гидратацию углекислого газа с образованием угольной кислоты и быстрой диссоциацией с образованием воды. [4] По сути, увеличение содержания углекислого газа приводит к снижению pH крови, что снижает связывание кислорода с гемоглобином . [5] Обратное верно, когда снижение концентрации углекислого газа повышает pH крови, что повышает скорость связывания кислорода с гемоглобином. Связать эффект Бора с карбоангидразой просто: карбоангидраза ускоряет реакцию углекислого газа, реагирующего с водой с образованием ионов водорода (протонов) и ионов бикарбоната.
Для описания равновесия в реакции карбоангидразы принцип Ле Шателье используется . Большая часть тканей более кислая, чем ткань легких, поскольку углекислый газ вырабатывается в результате клеточного дыхания в этих тканях, где он реагирует с водой с образованием протонов и бикарбоната. Поскольку концентрация углекислого газа выше, равновесие смещается вправо, в сторону бикарбонатов. Противоположное наблюдается в легких, где выделяется углекислый газ, снижая его концентрацию, поэтому равновесие смещается влево, благоприятствуя выработке углекислого газа. [6]
Возникновение и функция
[ редактировать ]Карбоангидраза была первоначально выделена и охарактеризована из красных кровяных телец в 1933 году, о чем одновременно сообщили Мелдрам и Роутон (в Кембриджском университете в Соединенном Королевстве), а также Стади и О'Брайен (в Пенсильванском университете в США). [7] [8] оба при поиске «каталитического фактора... необходимого для быстрого транзита HCO 3 - [бикарбонат-анион] из эритроцита в... легочные капилляры». [9]
Регулирование pH
[ редактировать ]Карбоангидраза играет существенную роль в регуляции pH крови, что ускоряет процесс CO 2 + H 2 O. HCO HCO3 - + Ч + реакция, обеспечивающая быстрое поддержание равновесного баланса. На равновесную реакцию влияет соотношение бикарбоната и H + до углекислого газа. [10] ОХС 3 - представляет собой сопряженное основание, нейтрализующее кислоты, а H + представляет собой сопряженную кислоту, которая нейтрализует основания посредством кислотно-основного гомеостаза . ОХС 3 - и Х + идеальны для буферизации pH в крови и тканях, поскольку pKa близок к физиологическому pH = 7,2 – 7,6. Начиная с ОХС 3 - и Х + регулируются в почках, а углекислый газ в плазме регулируется в легких; оба действия в почках и легких важны для поддержания стабильности pH крови. Таким образом, карбоангидраза способствует секреции Н+ в просвет почечных канальцев и реабсорбции HCO3 . - в почках. Кроме того, он помогает транспортировать углекислый газ из легочной ткани в альвеолы легочных капилляров, откуда углекислый газ выводится при выдохе. [10]
Карбоангидраза — очень древний фермент, обнаруженный в обоих доменах прокариот, который существует в шести различных классах среди большинства живых организмов. [11] Эти семейства не похожи ни по последовательности, ни по структуре, поскольку они развивались независимо друг от друга, но все они развили один и тот же Zn. 2+ активная структура сайта, демонстрирующая отличный пример конвергентной эволюции. [ нужна ссылка ]
Фон
[ редактировать ]Фермент – это вещество, которое действует в живых организмах как катализатор и помогает ускорить химические реакции. [12] Карбоангидраза — один из важных ферментов, который содержится в эритроцитах, слизистой оболочке желудка, клетках поджелудочной железы и даже почечных канальцах. Он был обнаружен в 1932 году и был разделен на три основных класса. [13] Первый класс — это альфа-карбоангидраза, обнаруженная у млекопитающих, второй класс — бета-карбоангидраза, обнаруженная в бактериях и растениях, и, наконец, третий класс — гамма-карбоангидраза, обнаруженная в метаногенных бактериях в горячих источниках. [14] Все три класса карбоангидразы имеют один и тот же активный центр с металлическим центром Zn; однако структурно они не похожи друг на друга. Основная роль карбоангидразы у человека заключается в катализе превращения углекислого газа в угольную кислоту и обратно. Однако он также может способствовать транспортировке CO 2 в крови, что, в свою очередь, способствует дыханию. Он может даже участвовать в образовании соляной кислоты в желудке. [Необходима ссылка] Таким образом, роль карбоангидразы зависит от того, где она находится в организме.
Структура
[ редактировать ]В CA II млекопитающих активный центр состоит из: жесткой кислоты Льюиса Zn. +2 атом металла, координированный с остатками His -94, -96 и -119 на расстоянии 109˚ друг от друга и гидроксид-ионом (pKa=6,8; 120° в конфигурации T d , гидрофобный карман, прилегающий к связанному с цинком гидроксиду, состоящий из Val -143 у основания и Вал-121, Trp-209 и Leu-198 на шейке, остаток протонного челнока (PSR) His-64 H. + шаттлы H + вход и выход из активного центра посредством конформационного переключения, а также сеть водородных связей, состоящая из гидроксильной группы Thr-199 и карбоксильной группы Glu-106, которая стабилизирует связанный с цинком гидроксид, облегчая ориентацию молекул воды на активной стороне в определенное геометрическая конфигурация. CA II имеет частоту оборота 10 6 с −1 это 10 7 раз быстрее, чем некатализируемая реакция.
Реакция
[ редактировать ]
Реакция, показывающая катализ карбоангидразы в наших тканях:
- СО 2 + Н 2 О ⟶ Н
2 СО
3 ⟶ Ч + + ОЗС −
3
Катализацию карбоангидразы в легких демонстрируют
- ЧАС + + ОЗС −
3 ⟶ Ч
2 СО
3 ⟶ СО 2 + Н 2 О
Причина разнонаправленных реакций в тканях и легких заключается в том, что в них обнаружены разные уровни pH. Без катализатора карбоангидразы реакция протекает очень медленно, однако с катализатором реакция составляет 10 7 раз быстрее.
Реакция, катализируемая карбоангидразой:
- ОЗС −
3 + Ч + ⇌ СО 2 + Н 2 О
Угольная кислота имеет pK a около 6,36 (точное значение зависит от среды), поэтому при pH 7 небольшой процент бикарбоната протонируется.
Карбоангидраза — один из самых быстрых ферментов, и его скорость обычно ограничивается скоростью диффузии его субстратов . Типичные каталитические скорости различных форм этого фермента варьируются от 10 4 и 10 6 реакций в секунду. [15]
Некатализируемая обратная реакция протекает относительно медленно (кинетика в диапазоне 15 секунд). Именно поэтому газированный напиток не дегазируется моментально при открытии тары; однако он быстро дегазируется во рту при контакте с карбоангидразой, содержащейся в слюне. [16]
Ангидраза определяется как фермент, который катализирует удаление молекулы воды из соединения, и именно эта «обратная» реакция дала карбоангидразе свое название, поскольку она удаляет молекулу воды из угольной кислоты.
В легких карбоангидраза превращает бикарбонат в углекислый газ, пригодный для выдоха.
CO 2 транспорт
[ редактировать ]
Углекислый газ транспортируется кровью в трех формах:
- Растворяется в виде газа в плазме – 7-10%.
- Связывается с гемоглобином в виде карбаминогемоглобина в эритроцитах – 20%.
- Присутствует в плазме в виде иона бикарбоната и транспортируется в виде бикарбоната – 70% [17]
Механизм
[ редактировать ]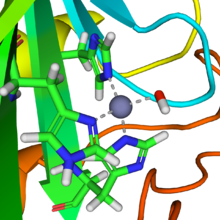

Простетическая цинка группа в ферменте координируется в трех положениях гистидина боковыми цепями . Четвертую координационную позицию занимает вода . Четвертый гистидин расположен близко к водному лиганду, способствуя образованию центра Zn-OH, который связывает CO 2 с образованием бикарбоната цинка. [18] Конструкция является примером общего кислотно-основного катализа (см. статью « Кислотный катализ »). Активный центр также имеет карман, подходящий для углекислого газа, приближая его к гидроксидной группе. Проведенные кинетические исследования определили следующий механизм действия фермента: на этапах 1 и 2 нуклеофил O − на гидроксид-ион, координированный с Zn 2+ осуществляет нуклеофильную атаку частично электрофильного углерода молекулы CO 2 . Здесь Zn 2+ действует как кислота Льюиса, которая снижает pK a координированного лиганда OH 2 с ~7-8 до 6,8 в качестве T d , что приводит к депротонированию воды до гидроксид-иона, а свободный протон нейтрализуется окружающим буфером. На этапе 3) перенос протона (H + ) происходит от OH −1 к некоординированному О − в CO 3 −2 координируется с Zn +2 атом в активном центре. Затем высвобождается ион бикарбоната, и каталитический центр регенерируется за счет связывания другой молекулы воды в обмен на ион бикарбоната. На этапе 4) координированный водный лиганд депротонируется при помощи Zn +2 для генерации еще одного гидроксид-иона, чтобы начать цикл заново. [19] [20]
Семьи
[ редактировать ]
Выявлены как минимум пять различных семейств CA: α, β, γ, δ и ζ. Эти семейства не имеют существенного сходства аминокислотных последовательностей и в большинстве случаев считаются примером конвергентной эволюции . α-CA обнаружены у человека.
α-КА
[ редактировать ]Позвоночные животные , водоросли , растения и некоторые бактерии имеют это семейство КА.
Ферменты СА, обнаруженные у млекопитающих , разделены на четыре широкие подгруппы: [ нужна ссылка ] которые, в свою очередь, состоят из нескольких гомологичных классов генов:
- цитозольные CA7 CA (CA-I, CA-II , CA-III, CA-VII и CA XIII) CA1 , CA2 , CA3 , ( , CA13 )
- митохондриальные КА (CA-VA и CA-VB) ( CA5A , CA5B )
- секретируемые CA (CA-VI) ( CA6 )
- мембранассоциированные СА (CA-IV, CA-IX, CA-XII, CA-XIV и CA-XV) ( CA4 , CA9 , CA12 , CA14 )
Существуют три дополнительные «акаталитические» изоформы карбоангидразы человека ( CA-VIII , CA-X и CA-XI ) ( CA8 , CA10 , CA11 ), функции которых остаются неясными. [21]

| изоформа | Ген | Молекулярный масса [23] (кДа) | Расположение | Специфическая деятельность человека , ферменты [а] [24] (с −1 ) | Чувствительность к сульфаниламиды , [б] К I (нМ) [24] | |
|---|---|---|---|---|---|---|
| Клетка | Салфетка [23] | |||||
| КА-Я | СА1 | 29 | цитозоль | эритроциты и желудочно-кишечный тракт | 2.0 × 10 5 | 250 |
| СА-II | СА2 | 29 | цитозоль | почти вездесущий | 1.4 × 10 6 | 12 |
| СА-III | ок 3 | 29 | цитозоль | 8% растворимого белка в мышцах I типа | 1.3 × 10 4 | 240000 |
| СА-IV | СА4 | 35 | внеклеточный GPI -связанный | ЖКТ , почки , эндотелий | 1.1 × 10 6 | 74 |
| ВОТ И ВСЕ | CA5A | 34,7 (прогноз) | митохондрии | печень | 2.9 × 10 5 | 63 |
| СА-ВБ | CA5B | 36,4 (прогноз) | митохондрии | широко распространенный | 9.5 × 10 5 | 54 |
| КА-VI | СА6 | 39–42 | секретарь | слюна и молоко | 3.4 × 10 5 | 11 |
| КА-VII | СА7 | 29 | цитозоль | широко распространенный | 9.5 × 10 5 | 2.5 |
| CA-IX | СА9 | 54, 58 | клеточной мембраной связанный с | нормальный желудочно-кишечный тракт , некоторые виды рака | 3.8 × 10 5 | 16 |
| СА-XII | СА12 | 44 | внеклеточно расположенный активный сайт | почки , некоторые виды рака | 4.2 × 10 5 | 5.7 |
| СА-XIII [25] | CA13 | 29 | цитозоль | широко распространенный | 1.5 × 10 5 | 16 |
| СА-XIV | CA14 | 54 | внеклеточно расположенный активный сайт | почки , сердце , скелетные мышцы , мозг | 3.1 × 10 5 | 41 |
| СА-XV [26] | CA15 | 34–36 | внеклеточный GPI -связанный | почки , не экспрессируются в тканях человека | 4.7 × 10 5 | 72 |
β-КА
[ редактировать ]Большинство прокариот и растений КА хлоропластов относятся к бета-семейству. два образца подписи Были идентифицированы для этого семейства:
- C-[SA]-DSR-[LIVM]-x-[AP]
- [EQ]-[YF]-A-[LIVM]-x(2)-[LIVM]-x(4)-[LIVMF](3)-xGHx(2)-CG
γ-КА
[ редактировать ]Гамма-класс КА происходит от метаногенов , архей, производящих метан, которые растут в горячих источниках.
дельта-КА
[ редактировать ]Дельта-класс КА описан у диатомовых водорослей . Выделение этого класса КА в последнее время [27] однако подвергаться сомнению.
ζ-КА
[ редактировать ]Дзета-класс КА встречается исключительно у бактерий, у некоторых хемолитотрофов и морских цианобактерий , содержащих цо- карбоксисомы . [28] Недавние трехмерные анализы [27] предполагают, что ζ-CA имеет некоторое структурное сходство с β-CA, особенно вблизи места иона металла. Таким образом, эти две формы могут быть отдаленно родственными, хотя лежащая в их основе аминокислотная последовательность с тех пор значительно разошлась.
η-CA
[ редактировать ]Эта-семейство КА недавно было обнаружено у организмов рода Plasmodium . Ранее считалось, что это группа ферментов, принадлежащих к альфа-семейству КА, однако было продемонстрировано, что η-КА обладают уникальными особенностями, такими как характер координации ионов металлов. [29]
ι-CA
[ редактировать ]Класс iota — это самый последний описанный класс центров сертификации. Он был обнаружен у морской диатомовой водоросли Thalassiosira pseudonana и широко распространен среди морского фитопланктона. [30] У диатомовых водорослей ι-КА необходим для механизмов концентрации CO 2 и, в отличие от других классов КА, может использовать марганец вместо цинка в качестве металлического кофактора. [30] Гомологи ι-CA были также подтверждены у грамотрицательных бактерий, где они могут присутствовать в виде белкового гомодимера. [31]
Структура и функции
[ редактировать ]В природе встречается несколько форм карбоангидразы. В наиболее изученной форме α-карбоангидразы , присутствующей у животных, ион цинка координируется имидазольными кольцами из трех остатков гистидина : His94, His96 и His119. [32]
Основная функция фермента у животных — взаимное преобразование углекислого газа и бикарбоната для поддержания кислотно-щелочного баланса в крови и других тканях, а также помощь в выведении углекислого газа из тканей.
У млекопитающих существует по меньшей мере 14 различных изоформ. Растения содержат другую форму, называемую β-карбоангидразой , которая с эволюционной точки зрения является отдельным ферментом, но участвует в той же реакции, а также использует ион цинка в своем активном центре. У растений карбоангидраза помогает повысить концентрацию CO 2 в хлоропластах , чтобы увеличить скорость карбоксилирования фермента RuBisCO . Это реакция, которая объединяет CO 2 в органические углеродные сахара во время фотосинтеза и может использовать только CO 2 , а не угольную кислоту или бикарбонат. форму углерода [ нужна ссылка ]
Кадмийсодержащая карбоангидраза
[ редактировать ]Было обнаружено, что морские диатомовые водоросли экспрессируют новую форму ζ карбоангидразы. Было обнаружено, что T. weissflogii , вид фитопланктона, распространенный во многих морских экосистемах, содержит карбоангидразу с ионом кадмия вместо цинка. [33] Раньше считалось, что кадмий — токсичный металл, не имеющий никакой биологической функции. Однако этот вид фитопланктона, похоже, адаптировался к низким уровням цинка в океане, используя кадмий, когда цинка недостаточно. [34] Хотя концентрация кадмия в морской воде также невелика (около 1х10 −16 молярный ), возможность использовать любой металл имеет экологические преимущества в зависимости от того, какой из них более доступен в данный момент. Таким образом, этот тип карбоангидразы является камбиалистическим, то есть он может заменять металл в своем активном центре другими металлами (а именно цинком и кадмием). [35]
Сходства с другими карбоангидразами
[ редактировать ]Механизм кадмийкарбоангидразы (CDCA) по существу такой же, как и у других карбоангидраз, в превращении углекислого газа и воды в бикарбонат и протон. [36] Кроме того, как и другие карбоангидразы, CDCA ускоряет реакцию, почти такую же, как скорость диффузии ее субстратов, и ее можно ингибировать производными сульфонамида и сульфамата . [36]
Отличия от других карбоангидраз
[ редактировать ]В отличие от большинства других карбоангидраз, ион металла активного центра не связан тремя остатками гистидина и гидроксид-ионом. Вместо этого он связан двумя остатками цистеина , одним остатком гистидина и гидроксид-ионом, что характерно для β-КА. [36] [37] Поскольку кадмий является мягкой кислотой , он будет более прочно связан с мягкими основными лигандами. [35] Атомы серы на остатках цистеина являются мягкими основаниями, поэтому связывают кадмий более прочно, чем это сделал бы азот на остатках гистидина. CDCA также имеет трехмерную складчатую структуру, которая не похожа ни на одну другую карбоангидразу, а ее аминокислотная последовательность отличается от других карбоангидраз. [36] Это мономер с тремя доменами, каждый из которых имеет идентичную аминокислотную последовательность и каждый содержит активный центр с ионом металла. [37]
Еще одно ключевое различие между CDCA и другими карбоангидразами заключается в том, что CDCA имеет механизм замены иона кадмия на ион цинка в том случае, если цинк становится более доступным для фитопланктона, чем кадмий. Активный центр CDCA по существу «закрыт» цепочкой из девяти аминокислот с остатками глицина в положениях 1 и 9. В норме эти ворота остаются закрытыми, и ион кадмия задерживается внутри. Однако благодаря гибкости и положению остатков глицина эти ворота можно открыть, чтобы удалить ион кадмия. Тогда на его место можно будет поставить ион цинка, и ворота за ним закроются. [36] Будучи пограничной кислотой , цинк не будет так прочно связываться с цистеиновыми лигандами, как кадмий, но фермент все равно будет активен и достаточно эффективен. Металл в активном центре можно переключать между цинком и кадмием в зависимости от того, какого из них больше в данный момент. Именно способность CDCA использовать кадмий или цинк, вероятно, дает T. weissflogii преимущество в выживании. [34]
Транспорт кадмия
[ редактировать ]Кадмий в больших количествах до сих пор считается смертельным для фитопланктона. Исследования показали, что T. weissflogii вызывает начальную токсическую реакцию на кадмий при воздействии на него. Токсичность металла снижается за счет транскрипции и трансляции фитохелатина — белка, способного связывать и транспортировать кадмий. После связывания с фитохелатином кадмий перестает быть токсичным и может безопасно транспортироваться к ферменту CDCA. [33] Также было показано, что поглощение кадмия через фитохелатин приводит к значительному увеличению экспрессии CDCA. [33]
CDCA-подобные белки
[ редактировать ]Другой фитопланктон из разных источников воды был протестирован на наличие CDCA. Было обнаружено, что многие из них содержат белки, гомологичные CDCA, обнаруженному у T. weissflogii . [33] Сюда входят виды из Грейт-Бей, штат Нью-Джерси , а также из Тихого океана вблизи экватора . У всех протестированных видов CDCA-подобные белки показали высокий уровень экспрессии даже при высоких концентрациях цинка и в отсутствие кадмия. [33] Сходство между этими белками и CDCA, экспрессируемым T. weissflogii, варьировало, но они всегда были сходны как минимум на 67%. [33]
Улавливание и секвестрация углерода
[ редактировать ]Карбоангидраза в принципе может оказаться полезной для улавливания углерода . Некоторые карбоангидразы могут выдерживать температуру до 107 °C и чрезвычайную щелочность (pH> 10). [38] Пилотный запуск с более стабильным CA в потоке дымовых газов, который состоял из 12–13% мольного состава CO₂, имел степень улавливания 63,6% в течение 60-часового периода без каких-либо заметных эффектов на производительность фермента. СА был помещен в раствор N-метилдиэтаноламина (МДЭА), где он служил для увеличения разницы концентраций (движущей силы) CO 2 между потоком дымовых газов электростанции и жидкой фазой в жидкостно-газовом контакторе. [38]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Барсук М.Р., Прайс Г.Д. (1994). «Роль карбоангидразы в фотосинтезе». Анну. Преподобный Физиол растений. Завод Мол. Биол . 45 : 369–392. дои : 10.1146/annurev.pp.45.060194.002101 .
- ^ Jump up to: а б «PDB101: Молекула месяца: карбоангидраза» . RCSB: PDB-101 . Проверено 3 декабря 2018 г.
- ^ Супуран, Коннектикут (27 мая 2004 г.). «Карбоангидразы: каталитические и ингибирующие механизмы, распределение и физиологическая роль» . В Супуране, Коннектикут, Скоззафава А., Конвей Дж. (ред.). Карбоангидразы . Тейлор и Фрэнсис. дои : 10.1201/9780203475300 . ISBN 9780203475300 . Архивировано из оригинала 11 апреля 2023 года . Проверено 19 июля 2022 г.
- ^ Окчипинти Р., Борон В.Ф. (август 2019 г.). «Роль карбоангидраз и ингибиторов в кислотно-щелочной физиологии: результаты математического моделирования» . Международный журнал молекулярных наук . 20 (15): 3841. doi : 10.3390/ijms20153841 . ПМК 6695913 . ПМИД 31390837 .
- ^ «Эффект Бора» . www.pathwaymedicine.org . Проверено 23 ноября 2019 г.
- ^ «Принцип Ле Шателье» . www.chemguide.co.uk . Проверено 23 ноября 2019 г.
- ^ Форстер Р.Э. (2000). «Заметки об открытии карбоангидразы». В Чегвиддене В.Р., Картере Н.Д., Эдвардсе Ю.Х. (ред.). Карбоангидразы: новые горизонты . Дополнительный опыт. Том. 90. Базель: Спрингер/Биркхаузер. стр. 1–11. дои : 10.1007/978-3-0348-8446-4_1 .
- ^ Старр I (1989). «Уильям Кристофер Стэди, 1886–1959». Биографические воспоминания (PDF) . Вашингтон, округ Колумбия: Издательство Национальной академии наук. стр. 513–518.
- ^ Доджсон С.Дж. (1991). «Карбоангидразы». В Доджсоне С.Дж., Ташиане Р.Д., Гросе Дж., Картере Н.Д. (ред.). Карбоангидразы: клеточная физиология и молекулярная генетика . Бостон, Массачусетс: Springer US. стр. 3–14. дои : 10.1007/978-1-4899-0750-9_1 . ISBN 978-1-4899-0750-9 .
- ^ Jump up to: а б Deutsch HF (1 января 1987 г.). «Карбоангидразы». Международный журнал биохимии . 19 (2): 101–113. дои : 10.1016/0020-711X(87)90320-X . ISSN 0020-711X .
- ^ Чегвидден В.Р., Картер Н.Д. (2000). «Введение в карбоангидразы». В Чегвиддене В.Р., Картере Н.Д., Эдвардсе Ю.Х. (ред.). Карбоангидразы . Базель: Биркхойзер. стр. 13–28. дои : 10.1007/978-3-0348-8446-4_2 . ISBN 978-3-0348-8446-4 .
- ^ «Британский словарь» .
- ^ Марен Т.Х. (октябрь 1967 г.). «Карбоангидраза: химия, физиология и ингибирование» . Физиологические обзоры . 47 (4): 595–781. дои : 10.1152/physrev.1967.47.4.595 . ПМИД 4964060 . S2CID 19954840 .
- ^ Бертини И., Грей Х., Стифель Э., Валентайн Дж. (2007). Биологическая неорганическая химия: структура и реакционная способность (1-е изд.). Саусалито, Калифорния: Университетские научные книги. раздел IX.1.3.1. п. 180. ИСБН 978-1-891389-43-6 .
- ^ Jump up to: а б Линдског С (1997). «Строение и механизм карбоангидразы». Фармакология и терапия . 74 (1): 1–20. дои : 10.1016/S0163-7258(96)00198-2 . ПМИД 9336012 .
- ^ Тэтчер Б.Дж., Доэрти А.Е., Орвиски Э., Мартин Б.М., Хенкин Р.И. (сентябрь 1998 г.). «Гастин из околоушной слюны человека представляет собой карбоангидразу VI». Связь с биохимическими и биофизическими исследованиями . 250 (3): 635–41. дои : 10.1006/bbrc.1998.9356 . ПМИД 9784398 .
- ^ Ядав Р.Р., Кришнамурти К., Мудлиар С.Н., Деви С.С., Наогхаре П.К., Бафана А., Чакрабарти Т. (июнь 2014 г.). «Связывание углекислого газа, опосредованное карбоангидразой: обещания, проблемы и перспективы». Журнал фундаментальной микробиологии . 54 (6): 472–481. дои : 10.1002/jobm.201300849 . ПМИД 24740638 . S2CID 29177837 .
- ^ Паркин Дж. (февраль 2004 г.). «Синтетические аналоги, имеющие отношение к структуре и функции ферментов цинка». Химические обзоры . 104 (2): 699–767. дои : 10.1021/cr0206263 . ПМИД 14871139 . S2CID 9857226 .
- ^ Берг Дж. М., Тимочко Дж. Л., Страйер Л. (2013). Страйер Биохимия . дои : 10.1007/978-3-8274-2989-6 . ISBN 978-3-8274-2988-9 .
- ^ Гото М., Такахаши Т., Ямасита Ф., Кореэда А., Мори Х., Ота М., Аракава Ю. (ноябрь 1997 г.). «Ингибирование металло-бета-лактамазы, продуцируемой Serratia marcescens, тиоловыми соединениями». Биологический и фармацевтический вестник . 20 (11): 1136–1140. дои : 10.1021/ar9501232 . ПМИД 9401719 .
- ^ Лавджой Д.А., Хьюитт-Эммет Д., Портер К.А., Чепой Д., Шеффилд А., Вейл В.В., Ташиан Р.Э. (декабрь 1998 г.). «Эволюционно консервативный, «акаталитический» белок XI, родственный карбоангидразе, содержит мотив последовательности, присутствующий в нейропептиде саувагине: ген CA-RP XI человека (CA11) встроен между кластером секреторных генов и геном DBP в положении 19q13.3». Геномика . 54 (3): 484–93. дои : 10.1006/geno.1998.5585 . ПМИД 9878252 .
- ^ Бориак-Сьодин П.А., Зейтлин С., Чен Х.Х., Креншоу Л., Гросс С., Дантанараяна А. и др. (декабрь 1998 г.). «Структурный анализ связывания ингибитора карбоангидразы II человека» . Белковая наука . 7 (12): 2483–9. дои : 10.1002/pro.5560071201 . ПМК 2143894 . ПМИД 9865942 .
- ^ Jump up to: а б Если не указано иное: Бор ВФ (2005). Медицинская физиология: клеточный и молекулярный подход . Эльзевир/Сондерс. ISBN 978-1-4160-2328-9 . Страница 638
- ^ Jump up to: а б Хилво М., Баранаускене Л., Салцано А.М., Скалони А., Матулис Д., Инноченти А. и др. (октябрь 2008 г.). «Биохимическая характеристика CA IX, одного из наиболее активных изоферментов карбоангидразы» . Журнал биологической химии . 283 (41): 27799–809. дои : 10.1074/jbc.M800938200 . ПМИД 18703501 .
- ^ Лехтонен Дж., Шен Б., Вихинен М., Казини А., Скоззафава А., Супуран CT и др. (январь 2004 г.). «Характеристика CA XIII, нового члена семейства изоферментов карбоангидразы» . Журнал биологической химии . 279 (4): 2719–27. дои : 10.1074/jbc.M308984200 . ПМИД 14600151 .
- ^ Хилво М., Толванен М., Кларк А., Шен Б., Шах Г.Н., Вахид А. и др. (ноябрь 2005 г.). «Характеристика CA XV, новой GPI-заякоренной формы карбоангидразы» . Биохимический журнал . 392 (Часть 1): 83–92. дои : 10.1042/BJ20051102 . ПМЦ 1317667 . ПМИД 16083424 .
- ^ Jump up to: а б Савая М.Р., Кэннон Г.К., Хайнхорст С., Танака С., Уильямс Э.Б., Йейтс Т.О., Керфельд, Калифорния (март 2006 г.). «Структура бета-карбоангидразы карбоксисомальной оболочки представляет собой отдельный подкласс с одним активным центром по цене двух» . Журнал биологической химии . 281 (11): 7546–55. дои : 10.1074/jbc.M510464200 . ПМИД 16407248 .
- ^ Итак, АК, Эспи Г.С., Уильямс Э.Б., Шивели Дж.М., Хайнхорст С., Кэннон Г.С. (февраль 2004 г.). «Новая эволюционная линия карбоангидразы (класс эпсилон) является компонентом оболочки карбоксисомы» . Журнал бактериологии . 186 (3): 623–30. дои : 10.1128/JB.186.3.623-630.2004 . ПМК 321498 . ПМИД 14729686 .
- ^ Дель Прете С., Вулло Д., Фишер ГМ, Эндрюс К.Т., Поульсен С.А., Капассо С., Супуран Коннектикут (сентябрь 2014 г.). «Открытие нового семейства карбоангидраз у возбудителя малярии Plasmodium falciparum - η-карбоангидраз». Письма по биоорганической и медицинской химии . 24 (18): 4389–4396. дои : 10.1016/j.bmcl.2014.08.015 . hdl : 10072/63103 . ПМИД 25168745 .
- ^ Jump up to: а б Дженсен Э.Л., Клемент Р., Коста А., Маберли С.К., Гонтеро Б (август 2019 г.). «Новый широко распространенный подкласс карбоангидразы в морском фитопланктоне» . Журнал ISME . 13 (8): 2094–2106. дои : 10.1038/s41396-019-0426-8 . ПМК 6776030 . ПМИД 31024153 .
- ^ Дель Прете С, Ночентини А, Супуран КТ, Капассо С (декабрь 2020 г.). «Буркхолдерия территории» . Журнал ингибирования ферментов и медицинской химии . 35 (1): 1060–1068. дои : 10.1080/14756366.2020.1755852 . ПМК 7191908 . ПМИД 32314608 .
- ^ Кришнамурти В.М., Кауфман Г.К., Урбах А.Р., Гитлин И., Гудиксен К.Л., Вейбель Д.Б., Уайтсайдс Г.М. (март 2008 г.). «Карбоангидраза как модель для биофизических и физико-органических исследований белков и белок-лигандного связывания» . Химические обзоры . 108 (3): 946–1051. дои : 10.1021/cr050262p . ПМК 2740730 . ПМИД 18335973 .
- ^ Jump up to: а б с д и ж Пак Х, Макгинн П.Дж., More FM (19 мая 2008 г.). «Экспрессия кадмийкарбоангидразы диатомовых водорослей в морской воде» . Водная микробная экология . 51 : 183–193. дои : 10.3354/ame01192 .
- ^ Jump up to: а б Лейн Т.В., Сайто М.А., Джордж Г.Н., Пикеринг И.Дж., Принс Р.К., Морель Ф.М. (май 2005 г.). «Биохимия: фермент кадмия из морской диатомовой водоросли» . Природа . 435 (7038): 42. Бибкод : 2005Natur.435...42L . дои : 10.1038/435042а . ПМИД 15875011 . S2CID 52819760 .
- ^ Jump up to: а б Бертини и др. (2007) , с. [ нужна страница ] .
- ^ Jump up to: а б с д и Сигел А, Сигел Х, Сигел Р.К. (2013). Кадмий от токсичности к незаменимости . Дордрехт: Спрингер. ISBN 978-94-007-5179-8 .
- ^ Jump up to: а б Сюй Ю, Фэн Л, Джеффри П.Д., Ши Ю, Морель Ф.М. (март 2008 г.). «Структура и металлообмен в кадмийкарбоангидразе морских диатомей». Природа . 452 (7183): 56–61. Бибкод : 2008Natur.452...56X . дои : 10.1038/nature06636 . ПМИД 18322527 . S2CID 4420280 .
- ^ Jump up to: а б Алвизо О., Нгуен Л.Дж., Сэвил К.К., Брессон Дж.А., Лакхапатри С.Л., Солис Э.О. и др. (ноябрь 2014 г.). «Направленная эволюция ультрастабильной карбоангидразы для высокоэффективного улавливания углерода из дымовых газов» . Труды Национальной академии наук Соединенных Штатов Америки . 111 (46): 16436–41. Бибкод : 2014PNAS..11116436A . дои : 10.1073/pnas.1411461111 . ПМК 4246266 . ПМИД 25368146 .
Дальнейшее чтение
[ редактировать ]- Лайалл В., Алам Р.И., Фан Д.К., Эресо Г.Л., Фан Т.Х., Малик С.А. и др. (сентябрь 2001 г.). «Снижение внутриклеточного рН клеток вкусовых рецепторов крысы является непосредственным стимулом передачи кислого вкуса» . Американский журнал физиологии. Клеточная физиология . 281 (3): C1005-13. дои : 10.1152/ajpcell.2001.281.3.C1005 . ПМИД 11502578 .
