Фенилацетон
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК 1-фенилпропан-2-он | |
| Другие имена бензилметилкетон; Метилбензилкетон; Фенил-2-пропанон | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.002.859 |
| КЕГГ | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 9 Н 10 О | |
| Молярная масса | 134.178 g·mol −1 |
| Появление | Бесцветный, приятный запах |
| Плотность | 1,006 г/мл |
| Температура плавления | −15 ° C (5 ° F; 258 К) |
| Точка кипения | От 214 до 216 ° C (от 417 до 421 ° F; от 487 до 489 К) |
| -83.44·10 −6 см 3 /моль | |
| Юридический статус | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
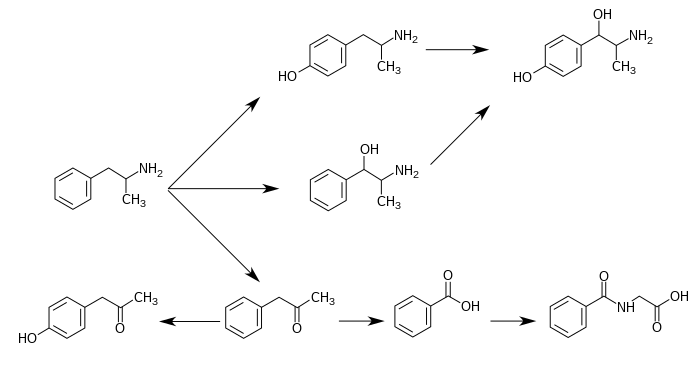
Фенилацетон , также известный как фенил-2-пропанон , представляет собой органическое соединение с химической формулой C 6 H 5 CH 2 COCH 3 . Это бесцветное масло, растворимое в органических растворителях . Это монозамещенное производное бензола, состоящее из ацетона, присоединенного к фенильной группе . Таким образом, его систематическое название по ИЮПАК — 1-фенил-2-пропанон .
Это вещество используется при производстве метамфетамина и амфетамина , где оно широко известно как P2P . [2] [3] Из-за того, что незаконные лаборатории по производству наркотиков использовали фенилацетон для производства амфетаминов, фенилацетон был объявлен контролируемым веществом Списка II в Соединенных Штатах в 1980 году. [4] У людей фенилацетон встречается как метаболит амфетамина и метамфетамина посредством FMO3 - опосредованного окислительного дезаминирования . [5]
Синтез
[ редактировать ]Существует множество способов синтеза фенилацетона. В промышленности используется газофазное кетоновое декарбоксилирование фенилуксусной кислоты с использованием уксусной кислоты на катализаторе из церия и оксида алюминия твердом кислотном . [6] Была описана соответствующая реакция лабораторного масштаба. [7]
Альтернативный путь - катализируемая цеолитом изомеризация оксида фенилпропилена . Другой лабораторный синтез включает традиционные способы, включая Фриделя-Крафтса алкилирования хлорацетона бензолом реакцию в присутствии хлорида алюминия катализатора . [8]
Метаболизм амфетамина
[ редактировать ]Метаболические пути амфетамина у человека [источники 1] |
Фенилацетон является промежуточным продуктом биоразложения амфетамина. В печени человека флавинсодержащая монооксигеназа 3 (FMO3) дезаминирует амфетамины в фенилацетон, который нетоксичен для человека. [20] Фенилацетон окисляется до бензойной кислоты превращается в гиппуровую кислоту под действием ферментов глицин-N-ацилтрансферазы , которая перед выведением (ГЛИАТ).
Фенилацетон может подвергаться парагидроксилированию до 4-гидроксифенилацетона , который встречается в организме человека как метаболит амфетамина.
Регулирование и культура
[ редактировать ]Чтобы предотвратить незаконный синтез амфетаминов из фенилацетона, прекурсор фенилуксусная кислота подлежит регулированию в Соединенных Штатах в соответствии с Законом о химической утечке и незаконном обороте .
В сериале « Во все тяжкие » Уолтер Уайт производит метамфетамин, используя фенилацетон и метиламин посредством реакции восстановительного аминирования . Уайт произвел фенилацетон в трубчатой печи, используя фенилуксусную кислоту и уксусную кислоту. [ нужна ссылка ]

См. также
[ редактировать ]- MDP2P – родственное соединение с метилендиокси-группой и предшественник МДМА .
- Циклогексилацетон - циклогексановое производное фенилацетона.
- Фенилацетоны
- Метамфетамин
- Закон о контролируемых веществах
Примечания
[ редактировать ]- ^ 4-гидроксиамфетамин Было показано, что метаболизируется в 4-гидроксинорэфедрин под действием дофамин-бета-гидроксилазы (DBH) in vitro , и предполагается, что он метаболизируется аналогичным образом in vivo . [10] [15] Данные исследований, в которых измерялось влияние концентраций DBH в сыворотке крови на метаболизм 4-гидроксиамфетамина у людей, позволяют предположить, что другой фермент может опосредовать превращение 4-гидроксиамфетамина в 4-гидроксинорэфедрин ; [15] [17] однако другие данные исследований на животных позволяют предположить, что эта реакция катализируется DBH в синаптических везикулах норадренергических нейронов головного мозга. [18] [19]
Ссылки
[ редактировать ]- ^ Анвиса (31 марта 2023 г.). «РДК № 784 – Списки наркотических средств, психотропных веществ, прекурсоров и других веществ, находящихся под особым контролем» [Постановление Коллегии № 784 – Списки наркотических средств, психотропных веществ, прекурсоров и других веществ, находящихся под особым контролем» (на бразильском португальском языке). Официальный вестник Союза (опубликован 4 апреля 2023 г.). Архивировано из оригинала 3 августа 2023 года . Проверено 15 августа 2023 г.
- ^ Тоске, Стивен Г.; Браун, Жаклин Л.; Миллер, Эрин Э.; Филлипс, Моника З.; Керр, Сьюзен С.; Хейс, Патрик А. (1 мая 2019 г.). «Последние тенденции в составлении профиля метамфетамина: отслеживание метода нитростирола, используемого для производства P2P» . Судебная химия . 13 : 100140. doi : 10.1016/j.forc.2018.12.003 . ISSN 2468-1709 . S2CID 104413528 .
- ^ «Синтез фенил-2-пропанона (P2P) - [www.rhodium.ws]» . erowid.org . Проверено 15 апреля 2023 г.
- ^ «Списки контролируемых веществ; размещение фенилацетона в Списке II; (фенил-2-пропанон, P2P, метилбензилкетон, бензилметилкетон)» (PDF) . Изомерный дизайн . Управление по борьбе с наркотиками . 11 февраля 1980 г. Архивировано (PDF) из оригинала 3 марта 2022 г. . Проверено 16 января 2023 г.
- ^ Кэшман, Джон Р.; Сюн, Йенг Н.; Сюй, Лифэн; Яновский, Аарон (1 марта 1999 г.). «N-Оксигенация амфетамина и метамфетамина человеческой флавинсодержащей монооксигеназой (форма 3): роль в биоактивации и детоксикации» . Журнал фармакологии и экспериментальной терапии . 288 (3): 1251–1260. ISSN 0022-3565 . ПМИД 10027866 .
- ^ Сигел, Хардо; Эггерсдорфер, Манфред (2000). «Кетоны». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a15_077 . ISBN 9783527306732 .
- ^ Херд, Чарльз Д.; Томас, Чарльз Л. (июль 1936 г.). «Получение дибензилкетона и фенилацетона» . Журнал Американского химического общества . 58 (7): 1240. doi : 10.1021/ja01298a043 . ISSN 0002-7863 .
- ^ Дж. Филип Мейсон; Льюис И. Терри (1 июня 1940 г.). «Приготовление фенилацетона». Дж. Ам. хим. Соц . 62 (6): 1622. doi : 10.1021/ja01863a506 . S2CID 101303942 .
- ^ «Информация о назначении Adderall XR» (PDF) . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США . Shire US Inc., декабрь 2013 г., стр. 12–13 . Проверено 30 декабря 2013 г.
- ^ Jump up to: а б Гленнон Р.А. (2013). «Стимуляторы фенилизопропиламина: агенты, связанные с амфетамином» . В Лемке Т.Л., Уильямс Д.А., Рош В.Ф., Зито В. (ред.). Принципы медицинской химии Фоя (7-е изд.). Филадельфия, США: Wolters Kluwer Health/Lippincott Williams & Wilkins. стр. 646–648. ISBN 9781609133450 .
Простейший незамещенный фенилизопропиламин, 1-фенил-2-аминопропан или амфетамин, служит общей структурной матрицей для галлюциногенов и психостимуляторов. Амфетамин оказывает центральное стимулирующее, аноректическое и симпатомиметическое действие и является прототипом этого класса (39). ... Фаза 1 метаболизма аналогов амфетамина катализируется двумя системами: цитохромом P450 и флавинмонооксигеназой. ... Амфетамин также может подвергаться ароматическому гидроксилированию до п -гидроксиамфетамина. ... Последующее окисление в бензильном положении DA-β-гидроксилазой дает п- гидроксинорэфедрин. Альтернативно, прямое окисление амфетамина DA-β-гидроксилазой может дать норэфедрин.
- ^ Тейлор КБ (январь 1974 г.). «Дофамин-бета-гидроксилаза. Стереохимический ход реакции» (PDF) . Журнал биологической химии . 249 (2): 454–458. дои : 10.1016/S0021-9258(19)43051-2 . ПМИД 4809526 . Проверено 6 ноября 2014 г.
Дофамин-β-гидроксилаза катализирует удаление атома водорода про- R и образование 1-норэфедрина, (2S , 1R ) -2-амино-1-гидроксил-1-фенилпропана из d -амфетамина.
- ^ Крюгер С.К., Уильямс Д.Э. (июнь 2005 г.). «Флавинсодержащие монооксигеназы млекопитающих: структура/функция, генетический полиморфизм и роль в метаболизме лекарств» . Фармакология и терапия . 106 (3): 357–387. doi : 10.1016/j.pharmthera.2005.01.001 . ПМК 1828602 . ПМИД 15922018 .
Таблица 5: N-содержащие препараты и ксенобиотики, оксигенированные FMO - ^ Кэшман-младший, Сюн Ю.Н., Сюй Л., Яновский А. (март 1999 г.). «N-оксигенация амфетамина и метамфетамина человеческой флавинсодержащей монооксигеназой (форма 3): роль в биоактивации и детоксикации». Журнал фармакологии и экспериментальной терапии . 288 (3): 1251–1260. ПМИД 10027866 .
- ^ Сантагати Н.А., Феррара Г., Марраццо А., Ронсисвалле Г. (сентябрь 2002 г.). «Одновременное определение амфетамина и одного из его метаболитов методом ВЭЖХ с электрохимическим обнаружением». Журнал фармацевтического и биомедицинского анализа . 30 (2): 247–255. дои : 10.1016/S0731-7085(02)00330-8 . ПМИД 12191709 .
- ^ Jump up to: а б с Сьердсма А., фон Штудниц В. (апрель 1963 г.). «Активность дофамин-бета-оксидазы у человека при использовании гидроксиамфетамина в качестве субстрата» . Британский журнал фармакологии и химиотерапии . 20 (2): 278–284. дои : 10.1111/j.1476-5381.1963.tb01467.x . ПМК 1703637 . ПМИД 13977820 .
Гидроксиамфетамин вводили перорально пяти людям... Поскольку превращение гидроксиамфетамина в гидроксинорэфедрин происходит in vitro под действием дофамин-β-оксидазы, предложен простой метод измерения активности этого фермента и действия его ингибиторов на человека. . ... Отсутствие эффекта от введения неомицина одному пациенту свидетельствует о том, что гидроксилирование происходит в тканях организма. ... основная часть β-гидроксилирования гидроксиамфетамина происходит в тканях, не относящихся к надпочечникам. К сожалению, в настоящее время нельзя быть полностью уверенным в том, что гидроксилирование гидроксиамфетамина in vivo осуществляется тем же ферментом, который превращает дофамин в норадреналин.
- ^ Баденхорст К.П., ван дер Слюс Р., Эразмус Э., ван Дейк А.А. (сентябрь 2013 г.). «Глициновая конъюгация: значение в метаболизме, роль глицин-N-ацилтрансферазы и факторы, влияющие на межиндивидуальные вариации». Экспертное заключение по метаболизму и токсикологии лекарственных средств . 9 (9): 1139–1153. дои : 10.1517/17425255.2013.796929 . ПМИД 23650932 . S2CID 23738007 .
Рисунок 1. Глициновая конъюгация бензойной кислоты. Путь конъюгации глицина состоит из двух этапов. Сначала бензоат лигируется с CoASH с образованием высокоэнергетического тиоэфира бензоил-КоА. Эта реакция катализируется лигазами средней цепи кислоты HXM-A и HXM-B:CoA и требует энергии в виде АТФ. ... Бензоил-КоА затем конъюгируется с глицином с помощью GLYAT с образованием гиппуровой кислоты, высвобождая CoASH. В дополнение к факторам, перечисленным в рамках, уровни АТФ, КоАСГ и глицина могут влиять на общую скорость пути конъюгации глицина.
- ^ Хорвиц Д., Александр Р.В., Ловенберг В., Кейзер Х.Р. (май 1973 г.). «Дофамин-β-гидроксилаза сыворотки человека. Связь с гипертонией и симпатической активностью». Исследование кровообращения . 32 (5): 594–599. дои : 10.1161/01.RES.32.5.594 . ПМИД 4713201 . S2CID 28641000 .
Биологическое значение различных уровней активности DβH в сыворотке изучали двумя способами. Во-первых, способность in vivo β-гидроксилировать синтетический субстрат гидроксиамфетамин сравнивали у двух субъектов с низкой активностью DβH в сыворотке и у двух субъектов со средней активностью. ... В одном исследовании гидроксиамфетамин (паредрин), синтетический субстрат DβH, вводили субъектам с низким или средним уровнем активности DβH в сыворотке. Процент препарата, гидроксилированного до гидроксинорэфедрина, был сопоставим у всех испытуемых (6,5–9,62) (табл. 3).
- ^ Фриман Джей Джей, Сульсер Ф (декабрь 1974 г.). «Образование п-гидроксинорэфедрина в головном мозге после внутрижелудочкового введения п-гидроксиамфетамина». Нейрофармакология . 13 (12): 1187–1190. дои : 10.1016/0028-3908(74)90069-0 . ПМИД 4457764 .
У видов, у которых основным путем метаболизма является ароматическое гидроксилирование амфетамина, п- гидроксиамфетамин (POH) и п- гидроксинорэфедрин (PHN) могут вносить вклад в фармакологический профиль исходного препарата. ... Расположение реакций p- гидроксилирования и β-гидроксилирования важно для видов, у которых ароматическое гидроксилирование амфетамина является преобладающим путем метаболизма. После системного введения амфетамина крысам ПОН был обнаружен в моче и плазме.
Наблюдаемое отсутствие значительного накопления PHN в головном мозге после внутрижелудочкового введения (+)-амфетамина и образование заметных количеств PHN из (+)-POH в ткани головного мозга in vivo подтверждает точку зрения, что ароматическое гидроксилирование амфетамина после его системное введение происходит преимущественно на периферии, и затем POH транспортируется через гематоэнцефалический барьер, поглощаясь норадренергическими нейронами головного мозга, где (+)-POH преобразуется в везикулах-хранилищах под действием дофамин-β-гидроксилазы в PHN. - ^ Мацуда Л.А., Хэнсон Г.Р., Гибб Дж.В. (декабрь 1989 г.). «Нейрохимические эффекты метаболитов амфетамина на центральные дофаминергические и серотонинергические системы». Журнал фармакологии и экспериментальной терапии . 251 (3): 901–908. ПМИД 2600821 .
Метаболизм p -OHA в p -OHNor хорошо известен, и дофамин-β-гидроксилаза, присутствующая в норадренергических нейронах, может легко превращать p -OHA в p -OHNor после внутрижелудочкового введения.
- ^ Крюгер, Шэрон К.; Уильямс, Дэвид Э. (1 июня 2005 г.). «Флавинсодержащие монооксигеназы млекопитающих: структура/функция, генетический полиморфизм и роль в метаболизме лекарств» . Фармакология и терапия . 106 (3): 357–387. doi : 10.1016/j.pharmthera.2005.01.001 . ISSN 0163-7258 . ПМК 1828602 . ПМИД 15922018 .