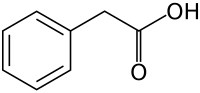
Фенилуксусная кислота
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Фенилуксусная кислота | |
| Систематическое название ИЮПАК 2-фенилэтановая кислота | |
| Другие имена α-толуиловая кислота Бензолуксусная кислота 2-фенилуксусная кислота β-фенилуксусная кислота | |
| Идентификаторы | |
3D model ( JSmol ) | |
| 3DMeet | |
| 1099647 | |
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Лекарственный Банк | |
| Информационная карта ECHA | 100.002.862 |
| Номер ЕС |
|
| 68976 | |
| КЕГГ | |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 8 Н 8 О 2 | |
| Молярная масса | 136.15 g/mol |
| Появление | белое твердое вещество |
| Запах | медоподобный |
| Плотность | 1,0809 г/см 3 |
| Температура плавления | От 76 до 77 ° C (от 169 до 171 ° F; от 349 до 350 К) |
| Точка кипения | 265,5 ° С (509,9 ° F; 538,6 К) |
| 15 г/л | |
| Кислотность ( pKa ) | 4,31 (Н 2 О) [1] |
| -82.72·10 −6 см 3 /моль | |
| Опасности | |
| СГС Маркировка : | |
  | |
| Опасность | |
| Х318 , Х319 | |
| П264 , П280 , П305+П351+П338 , П310 , П337+П313 | |
| NFPA 704 (огненный алмаз) | |
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов |
| Юридический статус | |
| Родственные соединения | |
Родственные соединения | Бензойная кислота , Фенилпропановая кислота , Коричная кислота |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Фенилуксусная кислота ( сопряженное основание фенилацетат ), также известная под различными синонимами , представляет собой органическое соединение , содержащее функциональную фенильную группу и функциональную группу карбоновой кислоты . Это белое твердое вещество с сильным медовым запахом . Эндогенно это катаболит фенилаланина . Поскольку он является коммерческим химическим веществом , поскольку его можно использовать при незаконном производстве фенилацетона (используемого при производстве замещенных амфетаминов ), он подлежит контролю в таких странах, как США и Китай . [3]
возникновение
[ редактировать ]Было обнаружено, что фенилуксусная кислота является активным ауксином (разновидностью растительного гормона ). [4] содержится преимущественно во фруктах . Однако его действие значительно слабее, чем действие основной молекулы ауксина индол-3-уксусной кислоты . Кроме того, эта молекула естественным образом вырабатывается метаплевральной железой большинства видов муравьев и используется в качестве противомикробного средства. Это также продукт окисления фенэтиламина в организме человека после метаболизма моноаминоксидазой и последующего метаболизма промежуточного продукта, фенилацетальдегида , ферментом альдегиддегидрогеназы ; эти ферменты также обнаружены во многих других организмах.
Подготовка
[ редактировать ]соединение можно получить гидролизом бензилцианида : Это [5] [6]

Реакции
[ редактировать ]Фенилуксусная кислота подвергается кетоновому декарбоксилированию с образованием кетонов . [7] Он может конденсироваться сам с собой с образованием дибензилкетона или с большим избытком другой карбоновой кислоты (в форме ангидрида кислоты ), например, с уксусным ангидридом с образованием фенилацетона .
Приложения
[ редактировать ]Фенилуксусная кислота используется в некоторых духах она обладает медовым концентрациях запахом даже в низких , так как . Он также используется при производстве пенициллина G и диклофенака . Он также используется для лечения гипераммониемии типа II, чтобы помочь уменьшить количество аммиака в кровотоке пациента за счет образования фенилацетил-КоА, который затем реагирует с богатым азотом глутамином с образованием фенилацетилглутамина . Это соединение затем выводится из организма пациента. Он также используется при незаконном производстве фенилацетона , который используется при производстве метамфетамина .
Натриевая соль фенилуксусной кислоты – фенилацетат натрия – применяется в качестве фармацевтического препарата для лечения нарушений цикла мочевины , в том числе в виде комбинированного препарата фенилацетат натрия/бензоат натрия (Аммонул). [8]
Фенилуксусная кислота используется при приготовлении и является производным нескольких фармацевтических препаратов, включая камилофин , бендазол , триафунгин , фенацемид , лоркаинид , фениндион , фенелзин и циклопентолат . [ нужна ссылка ]
В популярной культуре
[ редактировать ]В криминальной драме «Во все тяжкие » фенилуксусная кислота дважды фигурирует в качестве прекурсора метамфетамина : сначала в эпизоде под названием « Сделка без грубостей », затем в « Салуд ». [9]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Хейнс, Уильям М., изд. (2016). Справочник CRC по химии и физике (97-е изд.). ЦРК Пресс . стр. 5–89. ISBN 978-1498754286 .
- ^ Анвиса (31 марта 2023 г.). «ПДК № 784 - Перечни наркотических средств, психотропных веществ, прекурсоров и других веществ, находящихся под особым контролем» [Постановление Коллегиального совета № 784]. 784 - Списки наркотических средств, психотропных веществ, прекурсоров и других веществ, находящихся под особым контролем] (на бразильском португальском языке). Официальный вестник Союза (опубликовано 4 апреля 2023 г.). Архивировано из оригинала 03 августа 2023 г. Проверено 15 августа 2023 г.
- ^ «Список регулируемых химических веществ-прекурсоров наркотиков в Китае» . Архивировано из оригинала 17 августа 2015 года . Проверено 27 апреля 2015 г.
- ^ Вайтман, Ф.; Лайти, Д.Л. (1982). «Идентификация фенилуксусной кислоты как природного ауксина в побегах высших растений». Физиология Плантарум . 55 (1): 17–24. дои : 10.1111/j.1399-3054.1982.tb00278.x .
- ^ Адамс Р.; Таль, А. Ф. (1922). «Фенилуксусная кислота» . Органические синтезы . 2:59 ; Сборник томов , т. 1, с. 436 .
- ^ Веннер, В. (1952). «Фенилацетамид» . Органические синтезы . 32:92 ; Сборник томов , т. 4, с. 760 .
- ^ Сигел, Хардо; Эггерсдорфер, Манфред (2000). «Кетоны». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a15_077 . ISBN 9783527306732 .
- ^ «Монография по фенилацетату и бензоату натрия для специалистов» . Наркотики.com . Проверено 16 ноября 2019 г.
- ^ Харниш, Фальк; Салтхаммер, Тунга. «Химия во все тяжкие» . Химические взгляды . Химия Европы . Архивировано из оригинала 8 февраля 2024 года.

