Пропионил-КоА-карбоксилаза
| Пропионил-КоА-карбоксилаза | |||
|---|---|---|---|
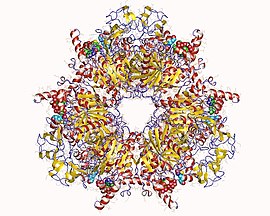 Гетеро12мер пропионил-КоА-карбоксилазы, скручивающий метилкрасный | |||
| Идентификаторы | |||
| Номер ЕС. | 6.4.1.3 | ||
| Номер CAS. | 9023-94-3 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Пропионил-КоА-карбоксилаза ( EC 6.4.1.3 , PCC ) катализирует карбоксилирования реакцию пропионил-КоА в митохондриальном матриксе . PCC классифицируется как лигаза [1] и лиаза . [2] Фермент биотинзависимый . Продуктом реакции является (S) -метилмалонил-КоА .
- АТФ + пропионил-КоА + HCO 3 − <=> АДФ + фосфат + (S)-метилмалонил-КоА
(S)-Метилмалонил-КоА не может напрямую использоваться животными. На него действует рацемаза , образуя (R)-метилмалонил-КоА, который затем превращается в сукцинил-КоА под действием метилмалонил-КоА-мутазы (одного из немногих метаболических ферментов, которого является витамин B12 кофактором ). Сукцинил-КоА, промежуточный продукт цикла Кребса , далее метаболизируется до фумарата , затем малата и затем оксалоацетата . Оксалоацетат может транспортироваться в цитозоль с образованием фосфоенолпирувата и других глюконеогенных промежуточных продуктов. Таким образом, пропионил-КоА является важным предшественником глюкозы .
Пропионил-КоА является конечным продуктом метаболизма жирных кислот с нечетной цепью, включая большинство метилированных жирных кислот . Аминокислоты валин , изолейцин и метионин также являются субстратами метаболизма пропионил-КоА.
Структура
[ редактировать ]Пропионил-КоА-карбоксилаза (PCC) представляет собой альфа(6)-бета(6)-додекамер массой 750 кДа. (Только около 540 кДа приходится на нативный фермент. [3] ) Альфа-субъединицы расположены в виде мономеров, украшающих центральное гексамерное ядро бета-6. Указанное ядро ориентировано в виде короткого цилиндра с отверстием вдоль его оси.
Альфа-субъединица PCC содержит домены биотинкарбоксилазы (BC) и белка-переносчика биотинкарбоксила (BCCP). Домен, известный как домен BT, также расположен на альфа-субъединице и необходим для взаимодействия с бета-субъединицей. Особый интерес представляет 8-нитевая антипараллельная бета-бочкообразная складка этого домена. Бета-субъединица содержит активность карбоксилтрансферазы (CT). [4]

Сайты BC и CT находятся на расстоянии примерно 55 Å друг от друга, что указывает на транслокацию всего домена BCCP во время катализа карбоксилирования пропионил - КоА . [5] Это обеспечивает четкое доказательство решающего димерного взаимодействия между альфа- и бета-субъединицами.
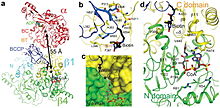
Биотин-связывающий карман PCC гидрофобен и высококонсервативен. Биотин и пропионил-КоА связываются перпендикулярно друг другу в оксианионную дырку активном центре, содержащем . Было установлено, что соотношение нативного фермента и биотина составляет один моль нативного фермента на 4 моля биотина. [3] Считается, что N1 биотина является основой активного центра. [4]
Сайт-направленный мутагенез в D422 показывает изменение субстратной специфичности сайта связывания пропионил-КоА, что указывает на важность этого остатка в каталитической активности PCC. [6] В 1979 году ингибирование фенилглиоксалем показало, что фосфатная группа пропионил-КоА или АТФ реагирует с важным остатком аргинина в активном центре во время катализа. [7] Позже (2004 г.) было высказано предположение, что аргинин-338 служит для ориентации промежуточного карбоксифосфата для оптимального карбоксилирования биотина. [8]
Значения KM для АТФ, пропионил-КоА и бикарбоната составили 0,08 мМ, 0,29 мМ и 3,0 мМ соответственно. Изоэлектрическая точка приходится на pH 5,5. Структурная целостность PCC сохраняется в диапазоне температур от -50 до 37 градусов Цельсия и диапазоне pH от 6,2 до 8,8. Было показано, что оптимальный pH составляет от 7,2 до 8,8 без связанного биотина. [3] Для биотина оптимальный pH составляет 8,0-8,5. [9]
Механизм
[ редактировать ]Обычный механизм каталитической реакции включает промежуточный карбанион и не протекает через согласованный процесс. [10] На рисунке 3 показан вероятный путь.
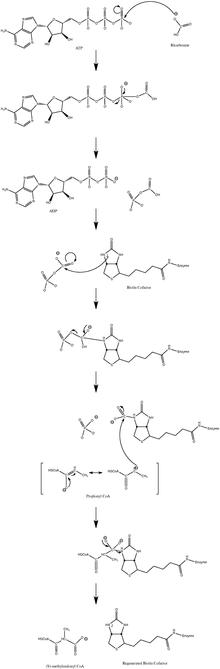
Было показано, что реакция слегка обратима при низком потоке пропионил-КоА. [11]
Гены субъединиц
[ редактировать ]Пропионил-КоА-карбоксилаза человека содержит две субъединицы, каждая из которых кодируется отдельным геном:
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Патология
[ редактировать ]Дефицит связан с пропионовой ацидемией . [12] [13] [14]
Активность PCC является наиболее чувствительным индикатором статуса биотина, протестированным на сегодняшний день. В будущих исследованиях беременности использование данных активности PCC лимфоцитов должно оказаться ценным для оценки статуса биотина. [15]
Внутригенная комплементация
[ редактировать ]Когда несколько копий полипептида, кодируемого геном, образуют агрегат, такая белковая структура называется мультимером. Когда мультимер образуется из полипептидов, продуцируемых двумя разными мутантными аллелями конкретного гена, смешанный мультимер может проявлять большую функциональную активность, чем несмешанные мультимеры, образованные каждым из мутантов по отдельности. В таком случае это явление называется внутригенной комплементацией .
PCC представляет собой гетерополимер, состоящий из субъединиц α и β в структуре α 6 β 6 . Мутации PCC либо в субъединице α (PCCα), либо в субъединице β (PCCβ) могут вызывать пропионовую ацидемию у людей. Когда различные мутантные клеточные линии фибробластов кожи , дефектные по PCCβ, сливали в парные комбинации, образовавшийся в результате гетеромультимерный белок β часто проявлял более высокий уровень активности, чем можно было бы ожидать, исходя из активности родительских ферментов. [16] Это открытие внутригенной комплементации указывает на то, что мультимерная структура PCC обеспечивает кооперативные взаимодействия между составляющими мономерами PCCβ, которые могут генерировать более функциональную форму холофермента.
Регулирование
[ редактировать ]Пропионил-КоА-карбоксилазы
[ редактировать ]а. Карбамазепин (противоэпилептический препарат): значительно снижает уровень ферментов в печени. [17]
б. E. coli Белки -шаперонины groES и groEL: необходимы для сворачивания и сборки гетеромерных субъединиц PCC человека. [18]
в. Бикарбонат: отрицательная кооперативность [8]
д. мг 2+ и МгАТФ 2− : аллостерическая активация [19]
Пропионил-КоА-карбоксилаза
[ редактировать ]а. 6-дезоксиэритронолид B: снижение уровня PCC приводит к увеличению производства [20]
б. Глюкокиназа в бета-клетках поджелудочной железы: предшественник бета-PCC, как показано, снижает KM и увеличивает Vmax; активация [21]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ ЕС 6.4.1.3
- ^ ЕС 4.1.1.41
- ^ Jump up to: а б с Калоусек Ф., Дариго, доктор медицинских наук, Розенберг Л.Е. (январь 1980 г.). «Выделение и характеристика пропионил-КоА-карбоксилазы из нормальной печени человека. Доказательства существования протомерного тетрамера с неидентичными субъединицами» . Журнал биологической химии . 255 (1): 60–65. дои : 10.1016/S0021-9258(19)86263-4 . ПМИД 6765947 .
- ^ Jump up to: а б Дьякович Л., Митчелл Д.Л., Фам Х., Гаго Г., Мельгар М.М., Хосла С. и др. (ноябрь 2004 г.). «Кристаллическая структура бета-субъединицы ацил-КоА-карбоксилазы: структурная инженерия субстратной специфичности». Биохимия . 43 (44): 14027–14036. дои : 10.1021/bi049065v . ПМИД 15518551 .
- ^ Jump up to: а б с Хуан К.С., Садре-Баззаз К., Шен Ю, Дэн Б., Чжоу Чж., Тонг Л. (август 2010 г.). «Кристаллическая структура альфа (6) бета (6) голофермента пропионил-кофермента А карбоксилазы» . Природа . 466 (7309): 1001–1005. дои : 10.1038/nature09302 . ПМЦ 2925307 . ПМИД 20725044 .
- ^ Араболаза А., Шиллито М.Э., Лин Т.В., Дьякович Л., Мельгар М., Фам Х. и др. (август 2010 г.). «Кристаллические структуры и мутационный анализ бета-субъединицы ацил-КоА-карбоксилазы Streptomyces coelicolor» . Биохимия . 49 (34): 7367–7376. дои : 10.1021/bi1005305 . ПМЦ 2927733 . ПМИД 20690600 .
- ^ Вольф Б., Калоусек Ф., Розенберг Л.Е. (1979). «Незаменимые остатки аргинина в активных центрах пропионил-КоА-карбоксилазы и бета-метилкротонил-КоА-карбоксилазы». Фермент . 24 (5): 302–306. дои : 10.1159/000458679 . ПМИД 510274 .
- ^ Jump up to: а б Слоан В., Уолдроп Г.Л. (апрель 2004 г.). «Кинетическая характеристика мутаций, обнаруженных при пропионовой ацидемии и метилкротонилглицинурии: доказательства кооперативности биотинкарбоксилазы» . Журнал биологической химии . 279 (16): 15772–15778. дои : 10.1074/jbc.M311982200 . ПМИД 14960587 .
- ^ Ся Ю.Е., Скалли К.Дж., Розенберг Л.Е. (июнь 1979 г.). «Человеческая пропионил-КоА-карбоксилаза: некоторые свойства частично очищенного фермента в фибробластах контрольной группы и пациентов с пропионовой ацидемией» . Педиатрические исследования . 13 (6): 746–751. дои : 10.1203/00006450-197906000-00005 . ПМИД 481943 .
- ^ Стуббе Дж., Фиш С., Абелес Р.Х. (январь 1980 г.). «Являются ли карбоксилирования с участием биотина согласованными или несогласованными?» . Журнал биологической химии . 255 (1): 236–242. дои : 10.1016/S0021-9258(19)86289-0 . ПМИД 7350155 .
- ^ Решко А.Е., Касумов Т., Пирс Б.А., Дэвид Ф., Хоппель К.Л., Стэнли В.К. и др. (сентябрь 2003 г.). «Оценка обратимости анаплеротических реакций пути пропионил-КоА в сердце и печени» . Журнал биологической химии . 278 (37): 34959–34965. дои : 10.1074/jbc.M302013200 . ПМИД 12824185 .
- ^ Угарте М., Перес-Серда С., Родригес-Помбо П., Девиат Л.Р., Перес Б., Ричард Э. и др. (1999). «Обзор мутаций в генах PCCA и PCCB, вызывающих пропионовую ацидемию». Человеческая мутация . 14 (4): 275–282. doi : 10.1002/(SICI)1098-1004(199910)14:4<275::AID-HUMU1>3.0.CO;2-N . ПМИД 10502773 . S2CID 37710112 .
- ^ Девиат ЛР, Перес Б, Перес-Серда С, Родригес-Помбо П, Клаверо С, Угарте М (2004). «Пропионовая ацидемия: обновление мутаций, функциональные и структурные эффекты вариантов аллелей». Молекулярная генетика и обмен веществ . 83 (1–2): 28–37. дои : 10.1016/j.ymgme.2004.08.001 . ПМИД 15464417 .
- ^ Деодато Ф., Боензи С., Санторелли Ф.М., Диониси-Вичи К. (май 2006 г.). «Метилмалоновая и пропионовая ацидурия». Американский журнал медицинской генетики. Часть C. Семинары по медицинской генетике . 142С (2): 104–112. дои : 10.1002/ajmg.c.30090 . ПМИД 16602092 . S2CID 21114631 .
- ^ Страттон С.Л., Богусевич А., Мок М.М., Мок Н.И., Уэллс А.М., Мок Д.М. (август 2006 г.). «Лимфоцитарная пропионил-КоА-карбоксилаза и ее активация биотином являются чувствительными индикаторами предельного дефицита биотина у людей» . Американский журнал клинического питания . 84 (2): 384–388. дои : 10.1093/ajcn/84.1.384 . ПМК 1539098 . ПМИД 16895887 .
- ^ Родригес-Помбо П., Перес-Серда С., Перес Б., Девиат Л.Р., Санчес-Пулидо Л., Угарте М. К модели для объяснения внутригенной комплементации гетеромультимерной протеинпропионил-КоА-карбоксилазы. Биохим Биофиз Акта. 2005;1740(3):489-498. doi:10.1016/j.bbadis.2004.10.009
- ^ Ратман С.К., Айзеншенк С., МакМахон Р.Дж. (ноябрь 2002 г.). «Обилие и функция биотин-зависимых ферментов снижаются у крыс, хронически получающих карбамазепин» . Журнал питания . 132 (11): 3405–3410. дои : 10.1093/jn/132.11.3405 . ПМИД 12421859 .
- ^ Келсон Т.Л., Оура Т., Краус Дж.П. (март 1996 г.). «Шаперонин-опосредованная сборка дикого типа и мутантных субъединиц пропионил-КоА-карбоксилазы человека, экспрессируемой в Escherichia coli» . Молекулярная генетика человека . 5 (3): 331–337. дои : 10.1093/hmg/5.3.331 . ПМИД 8852656 .
- ^ МакКеон С., Вольф Б. (1982). «Активация аденозинтрифосфатом магния и магния пропионил-КоА-карбоксилазы человека и бета-метилкротонил-КоА-карбоксилазы». Фермент . 28 (1): 76–81. дои : 10.1159/000459088 . ПМИД 6981505 .
- ^ Чжан Х., Богигиан Б.А., Пфайфер Б.А. (февраль 2010 г.). «Исследование роли нативного метаболизма пропионил-КоА и метилмалонил-КоА на продукцию гетерологичных поликетидов в Escherichia coli» . Биотехнология и биоинженерия . 105 (3): 567–573. дои : 10.1002/бит.22560 . ПМК 9896014 . ПМИД 19806677 . S2CID 659042 .
- ^ Сираиси А., Ямада Ю., Цуура Ю., Фиджимото С., Цукияма К., Мукаи Е. и др. (январь 2001 г.). «Новый регулятор глюкокиназы в бета-клетках поджелудочной железы: предшественник бета-субъединицы пропионил-КоА-карбоксилазы взаимодействует с глюкокиназой и увеличивает ее активность» . Журнал биологической химии . 276 (4): 2325–2328. дои : 10.1074/jbc.C000530200 . ПМИД 11085976 .
Внешние ссылки
[ редактировать ]- Пропионил-КоА + карбоксилаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)