Тирозиназа
| ТИР | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | TYR , ATN, CMM8, OCA1, OCA1A, OCAIA, SHEP3, тирозиназа, тирозиназа | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 606933 ; МГИ : 98880 ; Гомологен : 30969 ; GeneCards : TYR ; ОМА : ТИР - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
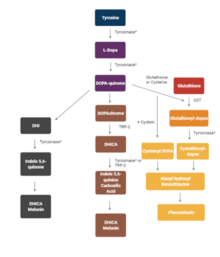
Тирозиназа — это оксидаза , которая является , ограничивающим скорость, ферментом контролирующим выработку меланина . Фермент в основном участвует в двух различных реакциях синтеза меланина, также известных как путь Рэпера-Мейсона. Во-первых, гидроксилирование монофенола и, во-вторых, превращение о-дифенола в соответствующий о-хинон. о-хинон претерпевает несколько реакций, в конечном итоге образуя меланин. [5] Тирозиназа — медьсодержащий фермент, присутствующий в тканях растений и животных, который катализирует выработку меланина и других пигментов из тирозина путем окисления. Он содержится в меланосомах , которые синтезируются в меланоцитах кожи . У человека фермент тирозиназа кодируется TYR геном . [6]
Катализируемая реакция
[ редактировать ]Тирозиназа осуществляет окисление фенолов, таких как тирозин и дофамин, с помощью дикислорода (O 2 ). В присутствии катехола ) . образуется бензохинон (см. реакцию ниже Водороды, удаленные из катехола, соединяются с кислородом , образуя воду .
Специфичность субстрата резко ограничивается у тирозиназы млекопитающих, которая использует только L-форму тирозина или ДОФА в качестве субстрата и имеет ограниченную потребность в L-ДОФА в качестве кофактора. [7]
Активный сайт
[ редактировать ]
| монофенолмонооксигеназа | |||
|---|---|---|---|
 Катехол-хинон | |||
| Идентификаторы | |||
| Номер ЕС. | 1.14.18.1 | ||
| Номер CAS. | 9002-10-2 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| Тирозиназа | |||
|---|---|---|---|
 Трехмерная структура функциональной единицы гемоцианина осьминога | |||
| Идентификаторы | |||
| Символ | Тирозиназа | ||
| Пфам | PF00264 | ||
| Пфам Клан | CL0205 | ||
| ИнтерПро | ИПР002227 | ||
| PROSITE | PDOC00398 | ||
| СКОП2 | 1хк2 / СКОПе / СУПФАМ | ||
| |||
| Общий центральный домен тирозиназы | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Тирозиназа | ||
| Пфам | PF00264 | ||
| ИнтерПро | ИПР002227 | ||
| PROSITE | PDOC00398 | ||
| СКОП2 | 1хк2 / СКОПе / СУПФАМ | ||
| |||
Два атома меди в активном центре ферментов тирозиназы взаимодействуют с дикислородом, образуя высокореактивный химический промежуточный продукт, который затем окисляет субстрат . Активность тирозиназы аналогична активности катехолоксидазы , родственного класса оксидазы меди . Тирозиназы и катехолоксидазы вместе называются полифенолоксидазами .
Структура
[ редактировать ]Тирозиназы были выделены и изучены из самых разных видов растений, животных и грибов. Тирозиназы разных видов различаются по структурным свойствам, тканевому распределению и клеточному расположению. [9] Не обнаружено общей структуры белка тирозиназы, встречающейся у всех видов. [10] Ферменты, обнаруженные в тканях растений, животных и грибов, часто различаются по своей первичной структуре, размеру, характеру гликозилирования и характеристикам активации. Однако все тирозиназы имеют общий двухъядерный медный центр типа 3 внутри своих активных центров . Здесь каждый из двух атомов меди координирован с тремя гистидина остатками .

Растение
[ редактировать ]In vivo растений ППО экспрессируются в виде около 64–68 кДа, белков массой хлоропласта состоящих из трех доменов: транзитного пептида ~4–9 кДа тилакоида (содержащего сигнальный пептид ), каталитически активного домена (~ 37–42 кДа), содержащего биядерный домен (~ 15–19 кДа) , медный центр и С-концевой экранирующий активный центр . [11]
млекопитающее
[ редактировать ]Тирозиназа млекопитающих представляет собой единственный трансмембранный белок , охватывающий всю мембрану . [12] У человека тирозиназа рассортирована по меланосомам. [13] а каталитически активный домен белка находится внутри меланосом. Лишь небольшая, ферментативно несущественная часть белка распространяется в цитоплазму меланоцита .
В отличие от грибковой тирозиназы, человеческая тирозиназа представляет собой мембраносвязанный гликопротеин и содержит 13% углеводов. [14]
Производный аллель TYR (rs2733832) связан с более светлой пигментацией кожи в человеческих популяциях. Он наиболее распространен в Европе , но также встречается с более низкой и умеренной частотой в Центральной Азии , на Ближнем Востоке , в Северной Африке и среди пигмеев сан и мбути . [15]
Бактериальный
[ редактировать ]Предполагается, что в торфяниках бактериальные удаляя фенольные соединения, которые ингибируют разложение органического тирозиназы действуют как ключевые регуляторы хранения углерода , углерода . [16]
Генная регуляция
[ редактировать ]Ген тирозиназы регулируется фактором транскрипции, ассоциированным с микрофтальмией (MITF). [17] [18]

Клиническое значение
[ редактировать ]Мутация в гене тирозиназы, приводящая к нарушению выработки тирозиназы, приводит к глазо-кожному альбинизму I типа — наследственному заболеванию, которое поражает одного из каждых 20 000 человек. [20]
Активность тирозиназы очень важна. Если не контролировать синтез меланина , это приводит к увеличению синтеза меланина. Снижение активности тирозиназы было направлено на улучшение или профилактику состояний, связанных с гиперпигментацией кожи, таких как мелазма и пигментные пятна . [21]
некоторые полифенолы, в том числе флавоноиды или стильбеноиды , аналоги субстратов, поглотители свободных радикалов и хелаторы меди, ингибируют тирозиназу. Известно, что [22] Отныне медицинская и косметическая промышленность сосредоточивают исследования на ингибиторах тирозиназы для лечения кожных заболеваний. [5]
Ингибиторы
[ редактировать ]Известные ингибиторы тирозиназы: [23]
- Азелаиновая кислота
- 4-бутилрезорцинол
- гидрохинон
- L -аскорбиновая кислота - Витамин С
- Транексамовая кислота
Генетика
[ редактировать ]Хотя альбинизм широко распространен, было проведено лишь несколько исследований генетических мутаций в генах тирозиназы животных. Один из них был на Bubalus bubalis (водяной буйвол). дикого типа Последовательность мРНК тирозиназы B. bubalis составляет 1958 пар оснований (п.н.) с открытой рамкой считывания (ORF) длиной 1593 п.н., что соответствует 530 аминокислотам. Между тем, ген тирозиназы альбиноса B. bubalis (GenBank JN_887463) укорочен в положении 477, что вызвано точечной мутацией в нуклеотиде 1431, которая превращает триптофан (TGG) в стоп-кодон (TGA), что приводит к более короткому и неактивному кодону. ген тирозиназы. [24] У других альбиносов есть точковые мутации, которые, по-видимому, инактивируют тирозиназу без усечения (примеры см. в таблице и на рисунке).
| Разновидность | Общее имя | Аминокислотная мутация | ГенБанк | Юнипрот ID |
|---|---|---|---|---|
| Буйвол буйвол | Водяной буйвол | W477 -> Стоп-кодон | JN_887462 | J7FBF2 |
| Pelophylax nigromaculatus | Прудовая лягушка | Удаление K228 | Q04604 | |
| Гландирана морщинистая | Морщинистая лягушка | G376 -> D376 | А0А1И9ФЖ0 | |
| Фейерверк для Кавамуры | Рисовая лягушка | G57 -> R57 | А0А1Е1G7U0 |

Учитывая, что существует несколько исследований геномных данных гена тирозиназы, существует лишь несколько исследований мутаций у амфибий- альбиносов . Миура и др. (2018) исследуют аминокислотные мутации в гене тирозиназы у трех лягушек -альбиносов : Pelophylax nigromaculatus (прудовиковая лягушка), Glandirana Rugosa (морщинистая лягушка) и Fejervarya kawamurai (рисовая лягушка). Всего было изучено пять различных популяций, из которых три представляли P. nigromaculatus и по одной G. Rugosa и F. kawamurai . В двух из трех популяций P. nigromaculatus произошла мутация сдвига рамки считывания из-за вставки тимина в экзоны 1 и 3, а в третьей популяции отсутствовали три нуклеотида, кодирующие лизин популяции G. Rugosa в экзоне 1. В миссенс -мутация , при которой произошла замена аминокислоты с глицина на аспарагиновую кислоту , а мутация F. kawamurai также представляла собой замену аминокислоты с глицина на аргинин . Мутация G. Rugosa и F. kawamurai происходит в экзонах 1 и 3. Мутации третьей популяции P. nigromaculatus , а также мутации G. Rugosa и F. kawamurai произошли в областях, которые высоко консервативны среди позвоночных , что может привести к дисфункции гена тирозиназы. [25]


Эволюция
[ редактировать ]
Тирозиназа — высококонсервативный белок у животных и, по-видимому, возникла уже у бактерий . Родственный тирозиназе белок (Tyrp1) и допахромтаутомераза (Dtc), которые кодируют белок, участвующий в синтезе меланина , которые являются общими регуляторными элементами структуры экзонов/интронов . Развитие сходится трех типов пигментных клеток позвоночных , хотя и различное, таким образом, в определенной точке, обеспечивая экспрессию членов семейства тирозиназ для производства пигментов меланина. [27] связанные с семейством тирозиназ, Гены, играют важную роль в эволюции , генетике и развития биологии пигментных клеток , а также в подходе к человеческим расстройствам, связанным с дефектами три типа пигментных клеток, продуцирующих меланин. их синтеза, регуляции или функции у позвоночных. Хорошо известны начиная с эмбрионального происхождения, т. е. из нервного гребня , нервной трубки и шишковидного тела . Все они обладают способностью вырабатывать пигменты меланин. Их биосинтез регулируется эволюционно консервативными ферментами семейства тирозиназ (tyr, tyr1 и tyr2), также называемыми ДОФАхромтаутомеразой (dct). Среди них Тир играет важную роль в производстве меланина. Однако секвенирование генома различных таксонов для более глубокого эволюционного анализа становится более важным в настоящем исследовании. [28] Аналогичным образом, семейство медных белков типа 3 выполняет различные биологические функции , включая образование пигмента, врожденный иммунитет и транспорт кислорода. Комбинированный генетический, филогенетический и структурный анализ пришел к выводу, что исходный медный белок типа 3 содержал один пептид и был сгруппирован в подкласс α . Ген предкового белка претерпел две дупликации, т.е. первую до дивергенции неизвестной эукариотической линии, а вторую - перед диверсификацией . Предыдущая дупликация давала цитозольную форму ( β ), а последняя дупликация давала мембраносвязанную форму ( Γ ). Структурное сравнение показало, что активный центр α- и γ -форм покрыт алифатическими аминокислотами, а β- форма покрыта ароматическим остатком. Таким образом, эволюция этого семейства генов представляет собой линию многоклеточных эукариот вследствие утраты одного или нескольких из этих трех подклассов и специфического для линии расширения одного или обоих оставшихся подклассов . [29] Геномно - консервативные нуклеотидные выравнивания тирозиназы среди семейства позвоночных, таких как лягушки, змеи и человек, позволяют предположить, что она произошла от одного предкового гена тирозиназы. Дупликация этого гена , и мутация вероятно, ответственны за появление гена , связанного с тирозиназой . [30]
Приложения
[ редактировать ]В пищевой промышленности
[ редактировать ]В пищевой промышленности желательно ингибирование тирозиназы, поскольку тирозиназа катализирует окисление фенольных соединений, содержащихся во фруктах и овощах, в хиноны , что придает нежелательный вкус и цвет, а также снижает доступность некоторых незаменимых аминокислот, а также усвояемость продуктов. . Таким образом, высокоэффективные ингибиторы тирозиназы также необходимы в сельском хозяйстве и пищевой промышленности. [14] Хорошо известные ингибиторы тирозиназы включают койевую кислоту , [31] трополон , [32] кумарины , [33] ванилиновая кислота , ванилин и ванильный спирт . [34]
В косметической промышленности
[ редактировать ]В различных азиатских культурах более светлый цвет кожи ассоциировался с молодостью и красотой. Недавние исследования косметических компаний были сосредоточены на разработке новых отбеливающих агентов, которые избирательно подавляют активность тирозиназы, чтобы уменьшить гиперпигментацию , избегая при этом цитотоксичности здоровых меланоцитов . [35] Традиционные фармакологические агенты, такие как кортикостероиды , гидрохинон и аминонумерованный хлорид, осветляют кожу за счет ингибирования созревания меланоцитов. [36] Однако эти агенты связаны с побочными эффектами. Косметические компании были сосредоточены на разработке новых отбеливающих агентов, которые избирательно подавляют активность тирозиназы, чтобы уменьшить гиперпигментацию, избегая при этом цитотоксичности меланоцитов, поскольку тирозиназа является лимитирующей стадией пути меланогенеза.
У насекомых
[ редактировать ]Тирозиназа выполняет у насекомых широкий спектр функций, включая заживление ран, склеротизацию , синтез меланина и инкапсуляцию паразитов. В результате это важный фермент, поскольку он является защитным механизмом насекомых. Некоторые инсектициды направлены на ингибирование тирозиназы. [14]
Из полимеров, вдохновленных мидийным клеем.
[ редактировать ]Активируемая тирозиназой полимеризация пептидов напоминающих , содержащих цистеина и тирозина остатки мидийный клей , приводит к образованию полимеров, . Остатки тирозина по окисляются ферментативно до допахинонов , с которыми могут связываться тиолы цистеина Михаэлю посредством межмолекулярного присоединения . Полученные полимеры прочно адсорбируются на различных поверхностях с высокой адгезии энергией . [37] [38]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000077498 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000004651 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б Кумар С.М., Сатиша У.В., Дхармеш С., Рао А.Г., Сингх С.А. (март 2011 г.). «Взаимодействие сесамола (3,4-метилендиоксифенола) с тирозиназой и его влияние на синтез меланина». Биохимия . 93 (3): 562–9. дои : 10.1016/j.biochi.2010.11.014 . ПМИД 21144881 .
- ^ Бартон Д.Е., Квон Б.С., Франк У (июль 1988 г.). «Ген тирозиназы человека, картированный на хромосоме 11 (q14----q21), определяет вторую область гомологии с хромосомой 7 мыши». Геномика . 3 (1): 17–24. дои : 10.1016/0888-7543(88)90153-X . ПМИД 3146546 .
- ^ Слушание В.Дж., Экель Т.М., Монтегю П.М., Николсон Дж.М. (февраль 1980 г.). «Тирозиназа млекопитающих. Стехиометрия и измерение продуктов реакции». Biochimica et Biophysical Acta (BBA) - Энзимология . 611 (2): 251–68. дои : 10.1016/0005-2744(80)90061-3 . ПМИД 6766744 .
- ^ PDB : 1WX3 ; Матоба Ю, Кумагай Т, Ямамото А, Ёсицу Х, Сугияма М (2006). «Кристаллографические доказательства того, что двуядерный медный центр тирозиназы является гибким во время катализа» . Ж. Биол. Хим . 281 (13): 8981–8990. дои : 10.1074/jbc.M509785200 . ПМИД 16436386 .
- ^ Майер А.М. (ноябрь 2006 г.). «Полифенолоксидазы в растениях и грибах: куда пойти? Обзор». Фитохимия . 67 (21): 2318–31. Бибкод : 2006PChem..67.2318M . doi : 10.1016/j.phytochem.2006.08.006 . ПМИД 16973188 .
- ^ Йенике Э., Декер Х (апрель 2003 г.). «Тирозиназы ракообразных образуют гексамеры» . Биохимический журнал . 371 (Часть 2): 515–23. дои : 10.1042/BJ20021058 . ПМЦ 1223273 . ПМИД 12466021 .
- ^ Майер А.М. (ноябрь 2006 г.). «Полифенолоксидазы в растениях и грибах: куда пойти? Обзор». Фитохимия . 67 (21): 2318–31. Бибкод : 2006PChem..67.2318M . doi : 10.1016/j.phytochem.2006.08.006 . ПМИД 16973188 .
- ^ Квон Б.С., Хак А.К., Померанц Ш.Х., Халабан Р. (ноябрь 1987 г.). «Выделение и последовательность клона кДНК тирозиназы человека, который картируется в локусе c-альбиноса мыши» . Труды Национальной академии наук Соединенных Штатов Америки . 84 (21): 7473–7. Бибкод : 1987PNAS...84.7473K . дои : 10.1073/pnas.84.21.7473 . ПМК 299318 . ПМИД 2823263 .
- ^ Теос А.С., Тенза Д., Мартина Дж.А., Хурбейн И., Педен А.А., Свидерская Е.В., Стюарт А., Робинсон М.С., Беннетт Д.К., Катлер Д.Ф., Бонифачино Дж.С., Маркс М.С., Рапосо Г (ноябрь 2005 г.). «Функции адаптерного белка (AP)-3 и AP-1 в сортировке тирозиназы от эндосом к меланосомам» . Молекулярная биология клетки . 16 (11): 5356–72. дои : 10.1091/mbc.E05-07-0626 . ПМЦ 1266432 . ПМИД 16162817 .
- ^ Jump up to: а б с Ким Ю.Дж., Уяма Х. (август 2005 г.). «Ингибиторы тирозиназы природного и синтетического происхождения: структура, механизм ингибирования и перспективы на будущее» . Клеточные и молекулярные науки о жизни . 62 (15): 1707–23. дои : 10.1007/s00018-005-5054-y . ПМЦ 11139184 . ПМИД 15968468 . S2CID 8280251 .
- ^ «Частота аллеля для полиморфного сайта: rs2733832» . АЛЬФРЕД. Архивировано из оригинала 20 августа 2016 года . Проверено 23 июня 2016 г.
- ^ Панис Ф., Крахлер Р.Ф., Крахлер Р., Ромпель А. (июнь 2021 г.). «Экспрессия, очистка и характеристика хорошо адаптированной тирозиназы из торфяников, выявленной с помощью частичного анализа сообщества» . Экологические науки и технологии . 55 (16): 11445–11454. Бибкод : 2021EnST...5511445P . doi : 10.1021/acs.est.1c02514 . ПМК 8375020 . ПМИД 34156250 .
- ^ Хоу Л., Пантье Джей Джей, Арнхейтер Х (декабрь 2000 г.). «Передача сигналов и регуляция транскрипции в линии меланоцитов, происходящих из нервного гребня: взаимодействие между KIT и MITF». Разработка . 127 (24): 5379–89. дои : 10.1242/dev.127.24.5379 . ПМИД 11076759 .
- ^ Хук К.С., Шлегель Н.К., Айххофф О.М., Видмер Д.С., Преториус С., Эйнарссон С.О., Валгейрсдоттир С., Бергштейнсдоттир К., Щепски А., Даммер Р., Штайнгримссон Е. (декабрь 2008 г.). «Новые цели MITF идентифицированы с использованием двухэтапной стратегии микрочипов ДНК» . Исследование пигментных клеток и меланомы . 21 (6): 665–76. дои : 10.1111/j.1755-148X.2008.00505.x . ПМИД 19067971 .
- ^ М. С. Эллер, К. Остром и Б. А. Гилкрест, «Повреждение ДНК усиливает меланогенез», Труды Национальной академии наук Соединенных Штатов Америки, том. 93, нет. 3, стр. 1087–1092, 1996 г.
- ^ Виткоп CJ (октябрь 1979 г.). «Альбинизм: гематологическая болезнь накопления, предрасположенность к раку кожи и дефекты зрительных нейронов, общие для всех типов глазо-кожного и глазного альбинизма». Алабамский журнал медицинских наук . 16 (4): 327–30. ПМИД 546241 .
- ^ Андо Х., Кондо Х., Ичихаши М., Hearing VJ (апрель 2007 г.). «Подходы к выявлению ингибиторов биосинтеза меланина посредством контроля качества тирозиназы» . Журнал исследовательской дерматологии . 127 (4): 751–61. дои : 10.1038/sj.jid.5700683 . ПМИД 17218941 .
- ^ Чанг Т.С. (июнь 2009 г.). «Обновленный обзор ингибиторов тирозиназы» . Международный журнал молекулярных наук . 10 (6): 2440–75. дои : 10.3390/ijms10062440 . ПМК 2705500 . ПМИД 19582213 .
- ^ Пиллаяр Т., Маникам М., Намасиваям В. (декабрь 2017 г.). «Средства для отбеливания кожи: перспективы медицинской химии ингибиторов тирозиназы» . Журнал ингибирования ферментов и медицинской химии . 32 (1): 403–425. дои : 10.1080/14756366.2016.1256882 . ПМК 6010116 . ПМИД 28097901 .
- ^ Даме, Мария Сесилия Флорисбаль; Ксавьер, Гилденор Медейрос; Оливейра-Фильо, Хосе Паес; Борхес, Александр Секорун; Оливейра, Энрике Нуньес; Рит-Корреа, Франклин; Шильд, Ана Люсия (20 июля 2012 г.). «Нонсенс-мутация в гене тирозиназы вызывает альбинизм у водяного буйвола» . БМК Генетика . 13:62 . дои : 10.1186/1471-2156-13-62 . ISSN 1471-2156 . ПМЦ 3411452 . ПМИД 22817390 .
- ^ Jump up to: а б Миура, Икуо; Тагами, Масатака; Фуджитани, Такеши; Огата, Мицуаки (10 февраля 2018 г.). «Спонтанные мутации тирозиназы выявлены у альбиносов трех видов диких лягушек» . Гены и генетические системы . 92 (4): 189–196. дои : 10.1266/ggs.16-00061 . ISSN 1880-5779 . ПМИД 28674275 .
- ^ Ким, Ён-Хён; Пак, Сан-Дже; Чхве, Се Хи; Ли, Джа-Ранг; Чо, Хён-Му; Ким, Сан-Великобритания; Ким, Джи-Су; Сим, Бо-Вунг; Сон, Бонг-Сок; Ли, Ёнджон; Джин, Ён Бэ; Хон, Юнг-Джу; Чон, Кан-Джин; Канг, Филионг; Пэк, Сын Хо; Ли, Санг-Рэ; Ха, Джэ Вон; Чанг, Кю Тэ (2017). «Идентификация и характеристика гена тирозиназы (TYR) и вариантов его транскрипта (TYR_1 и TYR_2) у макак-крабоедов (Macaca fascicleis)» . Джин . 630 : 21–27. дои : 10.1016/j.gene.2017.07.047 . ПМИД 28756020 .
- ^ Агнес Камачо-Хюбнер, Кристель Ришар, Фридрих Бирманн (20 февраля 2022 г.). «Геномная структура и эволюционная консервативность семейства генов тирозиназы фугу» . Джин . 285 (1–2): 59–68. дои : 10.1016/s0378-1119(02)00411-0 . ПМИД 12039032 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Розария Эспозито, Сальваторе Д'Аньелло, Паола Скуарцони, Мария Роза Пеццотти, Филомена Ристораторе и Антониетта Спаньоло (2012). «Новый взгляд на эволюцию семейства генов тирозиназы многоклеточных животных» . ПЛОС ОДИН . 7 (4): e35731. Бибкод : 2012PLoSO...735731E . дои : 10.1371/journal.pone.0035731 . ПМЦ 3334994 . ПМИД 22536431 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Агилера, Фелипе; Макдугалл, Кармель; Дегнан, Бернар М. (01 мая 2013 г.). «Происхождение, эволюция и классификация медных белков типа 3: расширение и потеря генов, специфичных для линии, у Metazoa» . Эволюционная биология BMC . 13 (1): 96. Бибкод : 2013BMCEE..13...96A . дои : 10.1186/1471-2148-13-96 . ISSN 1471-2148 . ПМЦ 3658974 . ПМИД 23634722 .
- ^ Ф. Мюризье и Ф. Бирманн (2006). «Генетика пигментных клеток: уроки семейства генов тирозиназы» . Гистология и гистопатология . 21 (5): 567–578. ПМИД 16493586 .
- ^ Мендес Э., Перри Мде Дж., Франциско А.П. (май 2014 г.). «Разработка и открытие ингибиторов грибной тирозиназы и их терапевтическое применение». Мнение экспертов об открытии лекарств . 9 (5): 533–54. дои : 10.1517/17460441.2014.907789 . ПМИД 24708040 . S2CID 12589166 .
- ^ Рескиньо А, Соллаи Ф, Пису Б, Ринальди А, Санжуст Э (август 2002 г.). «Ингибирование тирозиназы: общие и прикладные аспекты» . Журнал ингибирования ферментов и медицинской химии . 17 (4): 207–18. дои : 10.1080/14756360210000010923 . ПМИД 12530473 .
- ^ Соллай Ф., Зукка П., Санжуст Э., Стери Д., Рескиньо А. (декабрь 2008 г.). «Умбеллиферон и эскулетин: ингибиторы или субстраты полифенолоксидаз?» . Биологический и фармацевтический вестник . 31 (12): 2187–93. дои : 10.1248/bpb.31.2187 . hdl : 11584/105440 . ПМИД 19043197 .
- ^ Рескиньо А., Касаньола-Мартин ГМ, Санжуст Э., Зукка П., Марреро-Понсе Ю. (март 2011 г.). «Производные ваниллоидов как ингибиторы тирозиназы, основанные на моделях QSAR на основе виртуального скрининга». Тестирование и анализ наркотиков . 3 (3): 176–81. дои : 10.1002/dta.187 . ПМИД 21125547 .
- ^ Цянь В., Лю В., Чжу Д., Цао Ю., Тан А., Гонг Г., Су Х. «Натуральные отбеливающие кожу соединения для лечения меланогенеза (обзор)» . Экспериментальная и терапевтическая медицина 20.1 (2020): 173-185.
- ^ Ладжис AFB и Арифф AB: Открытие новых депигментирующих соединений и их эффективности в лечении гиперпигментации: данные исследования in vitro. J Космет Дерматол. 18:703–727. 2019.
- ^ Хорш Дж., Уилке П., Прецлер М., Сьюз М., Мельник И., Реммлер Д. и др. (ноябрь 2018 г.). «Полимеризация, как это делают мидии: на пути к синтетическим белкам ножек мидий и устойчивым клеям» . Ангеванде Хеми . 57 (48): 15728–15732. дои : 10.1002/anie.201809587 . ПМК 6282983 . ПМИД 30246912 .
- ^ Ариас С., Амини С., Хорш Дж., Прецлер М., Ромпель А., Мельник И. и др. (октябрь 2020 г.). «На пути к искусственным белкам из мидийного клея: дифференцирующие модули последовательностей для адгезии и переключаемой когезии» . Ангеванде Хеми . 59 (42): 18495–18499. дои : 10.1002/anie.202008515 . ПМК 7590116 . ПМИД 32596967 .
Внешние ссылки
[ редактировать ]- Запись GeneReviews/NCBI/NIH/UW о глазокожном альбинизме типа 1
- Тирозиназа в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)