Триптофан-2,3-диоксигеназа
| ТДО2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | TDO2 , TDO, TO, TPH2, TRPO, триптофан-2,3-диоксигеназа, HYPTRP | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 191070 ; МГИ : 1928486 ; Гомологен : 4132 ; Генные карты : TDO2 ; ОМА : TDO2 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
В энзимологии - триптофан-2,3-диоксигеназа ( EC 1.13.11.11 ) представляет собой гем- фермент, который катализирует окисление L - триптофана ( L Trp) до N -формил- L -кинуренина в качестве первой и лимитирующей стадии процесса. кинурениновый путь .
- L -триптофан + О 2 ⇌ N -формил- L -кинуренин
Триптофан-2,3-диоксигеназа играет центральную роль в физиологической регуляции потока триптофана в организме человека как часть общего биологического процесса метаболизма триптофана. ТДО катализирует первую и лимитирующую скорость деградацию триптофана по кинурениновому пути и тем самым регулирует системные уровни триптофана. [5] У человека триптофан-2,3-диоксигеназа кодируется TDO2 геном . [6]
Функция
[ редактировать ]| Триптофан-2,3-диоксигеназа | |||
|---|---|---|---|
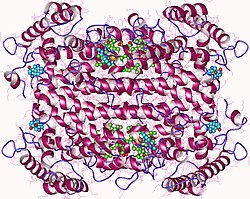
 Кристаллическая структура триптофан-2,3-диоксигеназы из xanthomonas Campestris | |||
| Идентификаторы | |||
| Номер ЕС. | 1.13.11.11 | ||
| Номер CAS. | 9014-51-1 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Этот фермент принадлежит к семейству оксидоредуктаз , в частности действующих на одиночные доноры с О 2 в качестве окислителя и включения двух атомов кислорода в субстрат (оксигеназы). Это семейство включает триптофан-2,3-диоксигеназу (TDO, также иногда называемую триптофаноксигеназой и L -триптофанпирролазой) и близкородственный фермент индоламин-2,3-диоксигеназу (IDO). [7] [8] И TDO, и IDO содержат по одному нековалентно связанному гему на мономер; TDO обычно тетрамерен, тогда как IDO мономерен.
Триптофан-2,3-диоксигеназа была впервые открыта в 1930-х годах. [9] и встречается как у эукариот , так и у прокариот . Экспрессия триптофан-2,3-диоксигеназы у млекопитающих обычно ограничена печенью, но у некоторых видов она была обнаружена в головном мозге и придатках яичек , а в некоторых тканях ее выработка может индуцироваться в ответ на стимулы. [8] ТДО крысы был первым, который был экспрессирован рекомбинантно (в E. coli ). [10] Также был выражен человеческий TDO. [11] [12]
В это же семейство ферментов входит индол-2,3-диоксигеназа Shewanella oneidensis. [13] и PrnB, второй фермент пути биосинтеза пирролнитрина из Pseudomonas fluorescens , [14] хотя ни для того, ни для другого еще не была продемонстрирована диоксигеназная активность. В 2007 году был идентифицирован новый фермент, способный катализировать диоксигенацию L -триптофана, IDO2 . [15]
Структура
[ редактировать ]Триптофан-2,3-диоксигеназа — гемсодержащий фермент , цитозольный кодируемый геном TDO2. [5] Кристаллографические исследования Xanthomonas Campestris TD) [13] и Ralstonia Metallidurans TDO) [16] обнаружили, что их структуры по существу идентичны и представляют собой тесно связанные гомотетрамерные ферменты. [17] Их лучше всего описать как димер из димеров, поскольку N-концевые остатки каждого мономера образуют часть сайта связывания субстрата в соседнем мономере. Белки полностью спиральные, и гибкая петля, участвующая в связывании L -триптофана, наблюдается сразу за карманом активного центра. Эта петля, по-видимому, индуцируется связыванием субстрата, поскольку наблюдается только в кристаллах, выращенных в присутствии L -триптофана. [17]
Доступны две структуры TDO со связанным субстратом (триптофаном). [17] , [18]
Механизм
[ редактировать ]Ранние предположения о механизме окисления триптофана были представлены Соно и Доусоном. [19] Это предполагало механизм абстракции, катализируемый основаниями, с участием только железа ( Fe II ) гем. Предполагается, что TDO и IDO реагируют по одному и тому же механизму, хотя конкретных доказательств этому нет. В IDO феррил гем (Fe IV ) был идентифицирован в ходе оборота. [20] [21] Поэтому механистические предложения были скорректированы, чтобы включить в этот механизм образование феррильного гема. [22] Предполагается, что TDO реагирует таким же образом, но в TDO не наблюдалось феррильного гема. См. также обсуждение механизма индоламин-2,3-диоксигеназы .

Клиническое значение
[ редактировать ]Было показано, что триптофан-2,3-диоксигеназа экспрессируется в значительной части опухолей человека . [5] В том же исследовании экспрессия триптофан-2,3-диоксигеназы опухолями предотвращала их отторжение иммунизированными мышами. Ингибитор триптофан-2,3-диоксигеназы, разработанный группой, восстановил способность этих мышей отторгать опухоли, экспрессирующие триптофан-2,3-диоксигеназу, демонстрируя, что ингибиторы триптофан-2,3-диоксигеназы обладают потенциалом в терапии рака.
Другое исследование показало, что триптофан-2,3-диоксигеназа потенциально участвует в метаболическом пути, ответственном за поведение, связанное с тревогой . [23] Создав мышей с дефицитом триптофан-2,3-диоксигеназы и сравнив их с диким типом , группа обнаружила, что у мышей с дефицитом триптофан-2,3-диоксигеназы наблюдались повышенные уровни в плазме не только триптофана, но также серотонина и 5-HIAA в плазме крови. гиппокамп мозг и средний . Различные тесты, такие как тесты в приподнятом крестообразном лабиринте и тесты в открытом поле, выявили анксиолитическую модуляцию у этих нокаутных мышей, причем результаты демонстрируют прямую связь между триптофан-2,3-диоксигеназой и метаболизмом триптофана, а также поведением, связанным с тревогой, в физиологических условиях.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с ENSG00000151790 GRCh38: выпуск Ensembl 89: ENSG00000262635, ENSG00000151790 — Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000028011 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б с Пилотт Л., Ларрье П., Строобант В., Колау Д., Долусик Е., Фредерик Р., Де План Е., Юттенхове С., Воутерс Дж., Мазерил Б., Ван ден Эйнде Б.Дж. (февраль 2012 г.). «Обращение опухолевой иммунной резистентности путем ингибирования триптофан-2,3-диоксигеназы» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (7): 2497–2502. Бибкод : 2012PNAS..109.2497P . дои : 10.1073/pnas.1113873109 . ПМК 3289319 . ПМИД 22308364 .
- ^ «Ген Энтрез: TDO2 триптофан-2,3-диоксигеназа» .
- ^ Ефимов И., Басран Дж., Текрей С.Дж., Ханда С., Моват К.Г., Рэйвен Э.Л. (апрель 2011 г.). «Строение и механизм реакции гемодиоксигеназ» . Биохимия . 50 (14): 2717–2724. дои : 10.1021/bi101732n . ПМК 3092302 . ПМИД 21361337 .
- ^ Jump up to: а б Текрей С.Дж., Брукманн С., Моват К.Г., Форухар Ф., Чепмен С.К., Тонг Л. (2008). «Индоламин-2,3-диоксигеназа и триптофан-2,3-диоксигеназа». Справочник по металлопротеинам . дои : 10.1002/0470028637.met223 .
- ^ Котаке Ю.; Масаяма И.З. (1936). «О механизме образования кинуренина из триптофана». З. Физиол. Хим . 243 : 237–244. дои : 10.1515/bchm2.1936.243.6.237 .
- ^ Рен С., Лю Х., Ликад Э., Коррейя М.А. (сентябрь 1996 г.). «Экспрессия триптофан-2,3-диоксигеназы печени крысы в Escherichia coli: структурная и функциональная характеристика очищенного фермента». Архив биохимии и биофизики . 333 (1): 96–102. дои : 10.1006/abbi.1996.0368 . ПМИД 8806758 .
- ^ Батабьял Д., Йе С.Р. (декабрь 2007 г.). «Человеческая триптофандиоксигеназа: сравнение с индоламин-2,3-диоксигеназой». Журнал Американского химического общества . 129 (50): 15690–15701. дои : 10.1021/ja076186k . ПМИД 18027945 .
- ^ Басран Дж., Рафиче С.А., Чаухан Н., Ефимов И., Чизман М.Р., Гамсари Л., Рэйвен Э.Л. (апрель 2008 г.). «Кинетическое, спектроскопическое и окислительно-восстановительное исследование триптофан-2,3-диоксигеназы человека». Биохимия . 47 (16): 4752–4760. дои : 10.1021/bi702393b . ПМИД 18370401 .
- ^ Jump up to: а б Форухар Ф, Андерсон Дж.Л., Моват К.Г., Воробьев С.М., Хуссейн А., Абашидзе М., Брукманн С., Текрей С.Дж., Ситхараман Дж., Такер Т., Сяо Р., Ма Л.С., Чжао Л., Актон ТБ, Монтелионе Г.Т., Чепмен С.К., Тонг Л. (январь 2007 г.). «Молекулярные данные о распознавании субстратов и катализе триптофан-2,3-диоксигеназой» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (2): 473–478. Бибкод : 2007PNAS..104..473F . дои : 10.1073/pnas.0610007104 . ПМК 1766409 . ПМИД 17197414 .
- ^ Де Лаурентис В., Хим Л., Андерсон Дж.Л., Адам А., Джонсон К.А., Филлипс Р.С., Чепмен С.К., ван Пи К.Х., Нейсмит Дж.Х. (октябрь 2007 г.). «Второй фермент пути биосинтеза пирролнитрина относится к суперсемейству гем-зависимых диоксигеназ» . Биохимия . 46 (43): 12393–12404. дои : 10.1021/bi7012189 . ПМЦ 3326534 . ПМИД 17924666 .
- ^ Болл Х.Дж., Санчес-Перес А., Вайзер С., Остин С.Дж., Астельбауэр Ф., Миу Дж., Маккуиллан Дж.А., Стокер Р., Джермин Л.С., Хант Н.Х. (июль 2007 г.). «Характеристика индоламин-2,3-диоксигеназоподобного белка, обнаруженного у людей и мышей». Джин . 396 (1): 203–213. дои : 10.1016/j.gene.2007.04.010 . ПМИД 17499941 .
- ^ Чжан Ю, Канг С.А., Мукерджи Т., Бэйл С., Крейн Б.Р., Бегли Т.П., Илик С.Е. (январь 2007 г.). «Кристаллическая структура и механизм триптофан-2,3-диоксигеназы, гемового фермента, участвующего в катаболизме триптофана и биосинтезе хинолината». Биохимия . 46 (1): 145–155. дои : 10.1021/bi0620095 . ПМИД 17198384 .
- ^ Jump up to: а б с Текрей С.Дж., Моват К.Г., Чепмен С.К. (декабрь 2008 г.). «Изучение механизма действия триптофан-2,3-диоксигеназы» . Труды Биохимического общества . 36 (Часть 6): 1120–1123. дои : 10.1042/bst0361120 . ПМЦ 2652831 . ПМИД 19021508 .
- ^ Льюис-Баллестер А., Форухар Ф., Ким С.М., Лью С., Ван Ю., Каркашон С., Ситхараман Дж., Батабьял Д., Чанг Б.И., Хуссейн М., Коррейя М.А., Йе С.Р., Тонг Л. (октябрь 2016 г.). «Молекулярные основы катализа и субстрат-опосредованной клеточной стабилизации триптофан-2,3-диоксигеназы человека» . Научные отчеты . 6 : 35169. Бибкод : 2016NatSR...635169L . дои : 10.1038/srep35169 . ПМК 5071832 . ПМИД 27762317 .
- ^ Соно М., член парламента Роуча, Коултер Э.Д., Доусон Дж.Х. (ноябрь 1996 г.). «Гемсодержащие оксигеназы». Химические обзоры . 96 (7): 2841–2888. дои : 10.1021/cr9500500 . ПМИД 11848843 .
- ^ Льюис-Баллестер А., Батабьял Д., Эгава Т., Лу С., Лин Ю., Марти М.А., Капече Л., Эстрин Д.А., Йе С.Р. (октябрь 2009 г.). «Доказательства наличия феррильного промежуточного соединения в диоксигеназе на основе гема» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (41): 17371–17376. Бибкод : 2009PNAS..10617371L . дои : 10.1073/pnas.0906655106 . ПМК 2765089 . ПМИД 19805032 .
- ^ Янагисава С., Ёцуя К., Хашиваки Ю., Хоритани М., Сугимото Х., Широ Ю., Аппельман Э.Х., Огура Т. (2010). «Идентификация видов гема Fe-O 2 и Fe=O для индоламин-2,3-диоксигеназы во время каталитического оборота» . Чем Летт . 39 : 36–37. дои : 10.1246/кл.2010.36 .
- ^ Басран Дж., Ефимов И., Чаухан Н., Текрей С.Дж., Крупа Дж.Л., Итон Дж., Гриффит Г.А., Моват К.Г., Ханда С., Рэйвен Э.Л. (октябрь 2011 г.). «Механизм образования N -формилкинуренина гемодиоксигеназами» . Журнал Американского химического общества . 133 (40): 16251–16257. дои : 10.1021/ja207066z . ПМК 3210546 . ПМИД 21892828 .
- ^ Канаи М., Фунакоши Х., Такахаси Х., Хаякава Т., Мизуно С., Мацумото К., Накамура Т. (март 2009 г.). «Триптофан-2,3-диоксигеназа является ключевым модулятором физиологического нейрогенеза и тревожного поведения у мышей» . Молекулярный мозг . 2 (8): 8. дои : 10.1186/1756-6606-2-8 . ПМЦ 2673217 . ПМИД 19323847 .
Дальнейшее чтение
[ редактировать ]- Комингс Д.Э., Мулеман Д., Дитц Г.В., Донлон Т. (февраль 1991 г.). «Человеческая триптофаноксигеназа, локализованная в 4q31: возможные последствия для алкоголизма и других поведенческих расстройств». Геномика . 9 (2): 301–308. дои : 10.1016/0888-7543(91)90257-F . ПМИД 2004780 .
- Комингс Д.Э., Мулеман Д., Дитц Г., Шерман М., Форест Г.Л. (сентябрь 1995 г.). «Последовательность человеческой триптофан-2,3-диоксигеназы (TDO2): наличие элемента, подобного глюкокортикоидному ответу, состоящего из повтора GTT и интронного повтора CCCCT». Геномика . 29 (2): 390–396. дои : 10.1006/geno.1995.9990 . PMID 8666386 .
- Дик Р., Мюррей Б.П., Рид М.Дж., Коррейя М.А. (август 2001 г.). «Структурно-функциональные взаимоотношения триптофан-2,3-диоксигеназы печени крысы: идентификация предполагаемых остатков гистидина, лигирующих гем». Архив биохимии и биофизики . 392 (1): 71–78. дои : 10.1006/abbi.2001.2420 . ПМИД 11469796 .
- Кудо Ю., Бойд К.А., Сарджент И.Л., Редман К.В. (март 2003 г.). «Снижение катаболизма триптофана плацентарной индоламин-2,3-диоксигеназой при преэклампсии». Американский журнал акушерства и гинекологии . 188 (3): 719–726. дои : 10.1067/моб.2003.156 . ПМИД 12634647 .
- Наби Р., Сераджи Ф.Дж., Чугани, округ Колумбия, Чжун Х., Хук А.Х. (февраль 2004 г.). «Связь полиморфизма гена триптофан-2,3-диоксигеназы с аутизмом». Американский журнал медицинской генетики. Часть B. Нейропсихиатрическая генетика . 125Б (1): 63–68. дои : 10.1002/ajmg.b.20147 . ПМИД 14755447 . S2CID 26302464 .
- Гиймен Г.Дж., Смайт Дж., Такикава О., Брю Б.Дж. (январь 2005 г.). «Экспрессия индоламин-2,3-диоксигеназы и производство хинолиновой кислоты микроглией, астроцитами и нейронами человека». Глия . 49 (1): 15–23. дои : 10.1002/glia.20090 . ПМИД 15390107 . S2CID 31823904 .
- Бахарванд Х., Хашеми С.М., Каземи Аштиани С., Фаррохи А. (2006). «Дифференциация эмбриональных стволовых клеток человека в гепатоциты в 2D и 3D культуральных системах in vitro» . Международный журнал биологии развития . 50 (7): 645–652. дои : 10.1387/ijdb.052072hb . ПМИД 16892178 .
- Батабьял Д., Йе С.Р. (декабрь 2007 г.). «Человеческая триптофандиоксигеназа: сравнение с индоламин-2,3-диоксигеназой». Журнал Американского химического общества . 129 (50): 15690–15701. дои : 10.1021/ja076186k . ПМИД 18027945 .
- Гупта Р., Фу Р., Лю А, Хендрих М.П. (2007). «ЭПР и мессбауэровская спектроскопия показывают неэквивалентные гемы в триптофандиоксигеназе» . Журнал Американского химического общества . 132 (3): 1098–1109. дои : 10.1021/ja908851e . ПМК 4251817 . ПМИД 20047315 .
- Аллегри Дж., Рагацци Э., Бертаццо А., Коста К.В., Рокки Р. (2003). «Метаболизм триптофана по кинурениновому пути у крыс». Развитие метаболизма триптофана и серотонина . Достижения экспериментальной медицины и биологии. Том. 527. стр. 481–496. дои : 10.1007/978-1-4615-0135-0_56 . ISBN 978-1-4613-4939-6 . ПМИД 15206766 .
- Чунг Л.В., Ли Х, Сугимото Х., Широ Ю., Морокума К. (сентябрь 2008 г.). «Исследование теории функциональной плотности недостающей части в понимании химии гема: механизм реакции индоламин-2,3-диоксигеназы и триптофан-2,3-диоксигеназы». Журнал Американского химического общества . 130 (37): 12299–12309. дои : 10.1021/ja803107w . ПМИД 18712870 .
- Аллегри Дж., Рагацци Э., Бертаццо А., Бьясиоло М., Коста К.В. (2003). «Метаболизм триптофана у кроликов». Развитие метаболизма триптофана и серотонина . Достижения экспериментальной медицины и биологии. Том. 527. стр. 473–479. дои : 10.1007/978-1-4615-0135-0_55 . ISBN 978-1-4613-4939-6 . ПМИД 15206765 .




