Цистеиндиоксигеназа
| Цистеиндиоксигеназа | |||
|---|---|---|---|
 CDO человека (взято из PDB 2IC1) | |||
| Идентификаторы | |||
| Номер ЕС. | 1.13.11.20 | ||
| Номер CAS. | 37256-59-0 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
| цистеиндиоксигеназа I типа | |||
|---|---|---|---|
 Цистеиндиоксигеназа 1, мономер, человек | |||
| Идентификаторы | |||
| Символ | CDO1 | ||
| ген NCBI | 1036 | ||
| HGNC | 1795 | ||
| МОЙ БОГ | 603943 | ||
| RefSeq | НМ_001801 | ||
| ЮниПрот | Q16878 | ||
| Другие данные | |||
| Номер ЕС | 1.13.11.20 | ||
| Локус | 5 q23.2 | ||
| |||
Цистеиндиоксигеназа ( CDO ) представляет собой негемовый фермент , железа который катализирует превращение L- цистеина в цистеинсульфиновую кислоту (цистеинсульфинат). CDO играет важную роль в катаболизме цистеина, регулируя внутриклеточные уровни цистеина и реагируя на изменения доступности цистеина. [ 1 ] Таким образом, CDO строго регулируется и претерпевает большие изменения в концентрации и эффективности. Он окисляет цистеин до соответствующей сульфиновой кислоты путем активации дикислорода , хотя точный механизм реакции до сих пор неясен. Помимо того, что CDO обнаружен у млекопитающих, он также существует в некоторых дрожжах и бактериях, хотя точная функция до сих пор неизвестна. [ 2 ] [ 3 ] CDO участвует в различных нейродегенеративных заболеваниях и раке , что, вероятно, связано с токсичностью цистеина. [ 1 ] [ 2 ]
Функция
[ редактировать ]CDO отвечает за первый важный этап метаболизма цистеина. [ 4 ] CDO окисляется до цистеинсульфиновой кислоты (которая существует преимущественно в форме анионного сульфината in vivo ). В целом CDO катализирует присоединение дикислорода (O 2 ). [ 5 ] к тиолу с образованием сульфиновой кислоты . Более конкретно, CDO является частью группы негемовых железооксигеназ, которые используют кислород в качестве акцептора электронов. цистеинсульфиновая кислота метаболизируется двумя различными путями: декарбоксилируется до сульфиноаланиндекарбоксилазой и Затем окисляется до таурина гипотауриндегидрогеназой гипотаурина ; или трансаминируется до предполагаемого промежуточного продукта 3-сульфинилпирувата, который самопроизвольно разлагается на пируват и сульфит . [ 1 ] [ 6 ] может быть окислен до сульфата сульфитоксидазой Сульфит затем . [ 1 ] Таким образом, CDO необходим для производства гипотаурина/таурина и сульфитов/сульфатов. Роль CDO может варьироваться в зависимости от типа клеток, поскольку он может использоваться в первую очередь для производства таурина или сульфата или для деградации цистеина. [ 1 ]

Схема реакции CDO, показывающая образование цистеинсульфиновой кислоты из цистеина путем включения дикислорода.
Структура
[ редактировать ]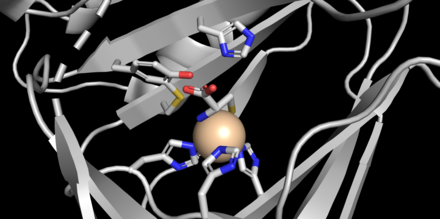
CDO представляет собой белок массой 22,5 кДа. [ 2 ] содержащий 200 аминокислотных остатков [ 3 ] и имеет изоэлектрическую точку (pI) 5,5. [ 2 ] Первичная структура высоко консервативна у разных видов млекопитающих: CDO мыши и человека различаются только по 16 остаткам. [ 3 ] CDO является частью суперсемейства купиновых . [ 2 ] члены которого обладают 6-нитевым β-цилиндром [ 8 ] в топологии «желе-ролл». [ 3 ] Кристаллические структуры белка были получены с разрешением 1,5 Å (мышь). [ 1 ] Активный центр имеет уникальную геометрию: вместо типичной лицевой триады из двух гистидинов и одной карбоксилатной боковой цепи, координирующейся с частицами железа (II), [ 9 ] три гистидиновых лиганда связаны с железом. [ 2 ] [ 3 ] [ 8 ] Кроме того, кристаллические структуры показывают аминный азот и тиолат серы цистеина, координированные с железом, в дополнение к одной молекуле воды (см. Рисунок). [ 2 ]
CDO содержит уникальный внутренний кофактор, созданный в результате внутримолекулярного образования тиоэфира между Cys93 и Tyr157, который, как предполагается, участвует в катализе. [ 1 ] Когда белок был впервые выделен, на агарозном геле наблюдались две полосы: [ 3 ] соответствующий белку, содержащему кофактор, и несвязанному «незрелому» белку соответственно. Сшивание увеличивает эффективность CDO в десять раз и регулируется уровнями цистеина, необычного примера образования белкового кофактора, опосредованного субстратом (активация прямой связи). [ 1 ]
Механизм
[ редактировать ]Механизм CDO до сих пор недостаточно изучен, несмотря на активные исследования по выяснению деталей реакции. [ 2 ] В целом реакция включает присоединение О 2 к цистеину, которое происходит самопроизвольно, без ферментативного катализа. [ 3 ] Исследования показали, что цистеинилтирозиновый мостик снижает окислительный потенциал тирозина (обычно донора электронов, как в фотосистеме II ) на ~0,5 В относительно фенола и повышает его кислотность. [ 2 ] Тиоэфирный фрагмент, вероятно, играет структурную, окислительно-восстановительную или кислотно-основную роль. Другие исследования показали, что Tyr157 необходим для функционирования фермента (возможно, в виде тирозинильного радикала) и является высококонсервативным в вариантах CDO. [ 2 ] Кроме того, исследования показали, что цистеамин , структурно схожая с цистеином молекула, усиливает окисление цистеина, но не является его субстратом. [ 2 ] [ 6 ]

Один предложенный механизм, подтвержденный компьютерными и спектроскопическими исследованиями, включает O 2 связывание цис -тиолата с образованием реактивного железа (III) -супероксо - разновидностей ( A ), которое затем атакует связанную серу цистеина с образованием четырехчленной кольцевой структуры ((A) Б ). [ 10 ] [ 11 ] [ 12 ] Гетеролитический разрыв связи OO затем приводит к образованию оксо -промежуточного соединения высоковалентного железа (IV) ( C ), которое передает второй кислород сере. [ 10 ] [ 11 ]
Регулирование
[ редактировать ]CDO жестко регулируется в клетке для поддержания гомеостаза цистеина. В частности, CDO реагирует на изменения доступности цистеина с пищей и потребления белка, поддерживая пониженную активность при низких уровнях цистеина и повышенную активность при высоких уровнях для предотвращения цитотоксичности. [ 1 ] Исследования показали, что CDO может резко повысить активность печени в течение нескольких часов. В отличие от многих ферментов, он преимущественно регулируется на уровне оборота белка, а не на уровне транскрипции (уровни мРНК). Высокие уровни цистеина ингибируют убиквитинилирование , что снижает скорость протеасомной деградации. [ 1 ] CDO также регулируется в жировой ткани, где высокие уровни цистеина вызывают повышенное производство гипотаурина/таурина. [ 1 ] Также считается, что в регуляции CDO участвуют как сшитые, так и незрелые формы белка.
Актуальность заболевания
[ редактировать ]Из-за своей значимости для метаболизма цистеина изменения активности CDO могут вызывать заболевания у людей. Исследования показали, что повышенный уровень цистеина может быть цитотоксическим , нейротоксическим , [ 1 ] и эксайтотоксический . [ 2 ] Аномальная или недостаточная активность CDO связана с болезнью Альцгеймера , болезнью Паркинсона , ревматоидным артритом , [ 13 ] и заболевания двигательных нейронов. [ 1 ] [ 2 ] [ 14 ] При этих заболеваниях у пациентов наблюдаются пониженные уровни сульфатов, повышенные концентрации цистеина в плазме натощак и другие симптомы, соответствующие нарушению окисления цистеина. [ 1 ] Дефицит CDO и последующее накопление цистеина в бледном шаре связаны с нейродегенерацией, связанной с пантотенаткиназой . [ 15 ]
Экспрессия CDO изменяется в раковых клетках [ 2 ] Было показано, что метилирование гена промотора CDO1 (цистеиндиоксигеназы человека типа I) происходит при раке толстой кишки, молочной железы, пищевода, легких, мочевого пузыря и желудка. [ 16 ] Замалчивание CDO1 является критическим эпигенетическим событием при раке молочной железы, приводящим к снижению активности CDO1. [ 16 ] [ 17 ] В частности, снижение активности CDO1 приводит к увеличению содержания сероводорода (H 2 S), что связано с различными заболеваниями. [ 16 ] Эти результаты позволяют предположить, что CDO1 (цистеиндиоксигеназа человека типа I) действует как ген-супрессор опухоли и потенциально может служить биомаркером рака. [ 16 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час я дж к л м н Стипанук М.Х., Уэки И., Домини Дж.Э., Симмонс Ч.Р., Хиршбергер Л.Л. (май 2009 г.). «Цистеиндиоксигеназа: надежная система регуляции уровня цистеина в клетках» . Аминокислоты . 37 (1): 55–63. дои : 10.1007/s00726-008-0202-y . ПМЦ 2736881 . ПМИД 19011731 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н Джозеф Калифорния, Марони MJ (август 2007 г.). «Цистеиндиоксигеназа: структура и механизм». Химические коммуникации (32): 3338–49. дои : 10.1039/B702158E . ПМИД 18019494 .
- ^ Перейти обратно: а б с д и ж г Стипанук М.Х., Симмонс Ч.Р., Карплюс П.А., Домини Дж.Е. (июнь 2011 г.). «Тиолдиоксигеназы: уникальные семейства купиновых белков» . Аминокислоты . 41 (1): 91–102. дои : 10.1007/s00726-010-0518-2 . ПМК 3136866 . ПМИД 20195658 .
- ^ Чай С.К., Джеркинс А.А., Баник Дж.Дж., Шалев И., Пинкхэм Дж.Л., Уден ПК и др. (март 2005 г.). «Гетерологичная экспрессия, очистка и характеристика рекомбинантной цистеиндиоксигеназы крысы» . Журнал биологической химии . 280 (11): 9865–9. дои : 10.1074/jbc.M413733200 . ПМИД 15623508 .
- ^ Ломбардини Дж. Б., Сингер Т. П., Бойер П. Д. (март 1969 г.). «Цистеиноксигеназа. II. Исследования механизма реакции с кислородом-18» . Журнал биологической химии . 244 (5): 1172–5. дои : 10.1016/S0021-9258(18)91825-9 . ПМИД 5767301 .
- ^ Перейти обратно: а б Сакакибара С., Ямагути К., Хосокава Ю., Кохаши Н., Уэда И. (февраль 1976 г.). «Очистка и некоторые свойства цистеиноксидазы (цистеиндиоксигеназы) печени крыс». Acta биохимии и биофизики (BBA) - энзимология 422 (2): 273–9. дои : 10.1016/0005-2744(76) 90138-8 ПМИД 2307 .
- ^ Йе С., Ву Х, Вэй Л., Тан Д., Сунь П., Бартлам М. и др. (февраль 2007 г.). «Понимание механизма цистеиндиоксигеназы человека. Ключевые роли тиоэфирного кофактора тирозин-цистеина» . Журнал биологической химии . 282 (5): 3391–402. дои : 10.1074/jbc.M609337200 . ПМИД 17135237 .
- ^ Перейти обратно: а б Маккой Дж.Г., Бэйли Л.Дж., Битто Э., Бингман К.А., Асети Дж., Фокс Б.Г. и др. (февраль 2006 г.). «Структура и механизм цистеиндиоксигеназы мыши» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (9): 3084–9. Бибкод : 2006PNAS..103.3084M . дои : 10.1073/pnas.0509262103 . ПМЦ 1413891 . ПМИД 16492780 .
- ^ Гарднер Дж.Д., Пирс Б.С., Фокс Б.Г., Брунольд Т.С. (июль 2010 г.). «Спектроскопическая и вычислительная характеристика связанной с субстратом цистеиндиоксигеназы мыши: природа аддуктов цистеина железа и железа и механистические последствия» . Биохимия . 49 (29): 6033–41. дои : 10.1021/bi100189h . ПМК 2914100 . ПМИД 20397631 .
- ^ Перейти обратно: а б с Чесноков Е.П., Фапонле А.С., Дэвис К.Г., Кен М.Г., Тернер Р., Феллнер М. и др. (июль 2016 г.). «Промежуточное соединение железа и кислорода, образующееся во время каталитического цикла цистеиндиоксигеназы» . Химические коммуникации . 52 (57): 8814–7. дои : 10.1039/C6CC03904A . ПМК 5043143 . ПМИД 27297454 .
- ^ Перейти обратно: а б с Вильяр-Асеведо Дж., Луго-Мас П., Блейкли М.Н., Рис Дж.А., Ганас А.С., Ханада Э.М. и др. (январь 2017 г.). «Присоединение оксоатома металла к тиолату Fe (III)» . Журнал Американского химического общества . 139 (1): 119–129. дои : 10.1021/jacs.6b03512 . ПМК 5262503 . ПМИД 28033001 .
- ^ Кумар Д., Тиль В., де Виссер С.П. (март 2011 г.). «Теоретическое исследование механизма процесса активации кислорода в ферментах цистеиндиоксигеназы». Журнал Американского химического общества . 133 (11): 3869–82. дои : 10.1021/ja107514f . ПМИД 21344861 .
- ^ Эмери П., Брэдли Х., Артур В., Танн Э., Уоринг Р. (июль 1992 г.). «Генетические факторы, влияющие на исход раннего артрита - роль статуса сульфоксидации». Британский журнал ревматологии . 31 (7): 449–51. дои : 10.1093/ревматология/31.7.449 . ПМИД 1628166 .
- ^ Хифилд М.Т., Ферн С., Стивентон ГБ, Уоринг Р.Х., Уильямс А.С., Стурман С.Г. (март 1990 г.). «Уровни цистеина и сульфата в плазме у пациентов с двигательными нейронами, болезнью Паркинсона и Альцгеймера». Письма по неврологии . 110 (1–2): 216–20. дои : 10.1016/0304-3940(90)90814-п . ПМИД 2325885 . S2CID 26672064 .
- ^ Стипанук М.Х., Домини Дж.Э., Ли Дж.И., Колозо Р.М. (июнь 2006 г.). «Метаболизм цистеина у млекопитающих: новый взгляд на регуляцию метаболизма цистеина» . Журнал питания . 136 (дополнение 6): 1652S–1659S. дои : 10.1093/jn/136.6.1652S . ПМИД 16702335 .
- ^ Перейти обратно: а б с д Брэйт М., Линг С., Нагпал Дж.К., Чанг Х., Пак Х.Л., Ли Дж. и др. (сентябрь 2012 г.). «Цистеиндиоксигеназа 1 представляет собой ген-супрессор опухолей, подавляемый метилированием промотора при множественных раковых заболеваниях человека» . ПЛОС ОДИН . 7 (9): е44951. Бибкод : 2012PLoSO...744951B . дои : 10.1371/journal.pone.0044951 . ПМЦ 3459978 . ПМИД 23028699 .
- ^ Йешке Дж., О'Хаган Х.М., Чжан В., Ватапалли Р., Калмон М.Ф., Данилова Л. и др. (июнь 2013 г.). «Частая инактивация цистеиндиоксигеназы 1 типа способствует выживанию клеток рака молочной железы и устойчивости к антрациклинам» . Клинические исследования рака . 19 (12): 3201–11. дои : 10.1158/1078-0432.CCR-12-3751 . ПМЦ 3985391 . ПМИД 23630167 .
Внешние ссылки
[ редактировать ]- CDO1 Расположение человеческого гена в браузере генома UCSC .
- Подробности о гене человека CDO1 в браузере генома UCSC .
