Высоковалентное железо

Высоковалентное железо обычно обозначает соединения и промежуточные соединения, в которых железо находится в формальной степени окисления > 3 и имеет количество связей > 6 с координационным числом ≤ 6. Этот термин довольно необычен для гептакоординированных соединений железа. [1] Его следует отличать от терминов «гипервалентный» и «гиперкоординатный» , поскольку соединения высоковалентного железа не обязательно нарушают правило 18 электронов и не обязательно имеют координационные числа > 6. Ион феррата(VI) [FeO 4 ] 2− была первой синтезированной структурой этого класса. Синтетические соединения, обсуждаемые ниже, в целом содержат сильно окисленное железо, поскольку эти концепции тесно связаны.
Соединения оксо железа
[ редактировать ]Разновидности оксоферрилов обычно предлагаются в качестве промежуточных продуктов в каталитических циклах , особенно в биологических системах, в которых O 2 требуется активация . Двухатомный кислород имеет высокий восстановительный потенциал (E 0 = 1,23 В), но первым шагом, необходимым для использования этого потенциала, является термодинамически неблагоприятное одноэлектронное восстановление E 0 = -0,16 В. Это восстановление происходит в природе путем образования супероксидного комплекса, в котором восстановленный металл окисляется О 2 . Продуктом этой реакции является пероксидный радикал, который более активен в реакции. Широко применимым методом получения высоковалентных форм оксоферрилов является окисление йодзобензолом : [2]
- символическое окисление соединения железа с использованием иодзобензола ; L обозначает поддерживающий лиганд
Fe(IV)O
[ редактировать ]
Сообщалось о нескольких синтезах разновидностей оксо железа (IV). [3] Эти соединения моделируют биологические комплексы, такие как цитохром P450 , NO-синтаза и изопенициллин-N-синтаза. Двумя такими зарегистрированными соединениями являются тиолат-лигированное оксоирон (IV) и циклам-ацетат оксоирон (IV). Тиолат-лигированное оксоирон (IV) образуется в результате окисления предшественника [Fe II (TMCS)](PF 6 ) (TMCS = 1-меркаптоэтил-4,8,11-триметил-1,4,8,11-тетраза циклотетрадекан), и 3-5 эквивалентов H 2 O 2 при -60 ˚C в метаноле . Соединение железа (IV) имеет темно-синий цвет и демонстрирует интенсивные особенности поглощения при 460, 570, 850 и 1050 нм. Этот вид Fe IV (=O)(TMCS)+ стабилен при -60 ˚C, но сообщается о разложении при повышении температуры. Соединение 2 было идентифицировано методами мессбауэровской спектроскопии высокого разрешения , масс-спектрометрии с ионизацией электрораспылением (ESI-MS), рентгеновской абсорбционной спектроскопии , расширенной тонкой структуры рентгеновского поглощения (EXAFS), ультрафиолетово-видимой спектроскопии (УФ-Вид), преобразования Фурье. инфракрасная спектроскопия (FT-IR), и результаты сравнивались с расчетами теории функционала плотности (DFT). [4]
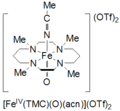
Тетраметилциклам оксоирон(IV) образуется по реакции Fe II (TMC)(OTf) 2 , TMC = 1,4,8,11-тетраметил-1,4,8,11-тетраазациклотетрадекан; OTf = CF 3 SO 3 , с йодозилбензолом (PhIO) в CH 3 CN при -40 ˚C. Сообщается о втором методе образования оксо железа (IV) циклама как реакции Fe II (TMC)(OTf) 2 с 3 эквивалентами H 2 O 2 в течение 3 часов. Этот вид имеет бледно-зеленый цвет и имеет максимум поглощения при 820 нм. Сообщается, что он стабилен в течение как минимум 1 месяца при температуре -40 ˚C. Он был охарактеризован методами мессбауэровской спектроскопии, ESI-MS, EXAFS, UV-vis, рамановской спектроскопии и FT-IR. [5]
высоковалентного железа Комплексы биспидина способны окислять циклогексан до циклогексанола и циклогексанона с выходом 35% при соотношении спирта к кетону до 4. [6]
Fe(V)O
[ редактировать ]Фе V TAML(=O), TAML = тетраамидо макроциклический лиганд , образуется в результате реакции [Fe III (TAML)(H 2 O)](PPh 4 ) с 2-5 эквивалентами метахлорпербензойной кислоты при -60°С в н-бутиронитриле. Это темно-зеленое соединение (два λ max при 445 и 630 нм соответственно) стабильно при 77 К. Стабилизация Fe(V) объясняется сильной π-донорной способностью депротонированных амидных азотов. [7]
Fe(VI)O
[ редактировать ]VI) представляет собой анион химической Феррат ( формулы [ FeO неорганический 2− . Он светочувствителен и придает своим соединениям и растворам бледно-фиолетовый цвет. Это один из самых сильных известных водоустойчивых окислителей . Хотя феррат (VI) классифицируется как слабое основание , концентрированные растворы феррата (VI) стабильны только при высоком pH .
Электронная структура
[ редактировать ]Дан обзор электронной структуры порфириновых оксожелезосодержащих соединений. [8]
Соединения нитридожелеза и имидожелеза
[ редактировать ]
Нитридожелезо [9] и имидожелезо [10] соединения тесно связаны с химией железа и азота . [11] биологическое значение порфиринов нитридо железа(V). Рассмотрено [12] [13] Широко применимым методом получения высоковалентных форм нитридо железа является термическое или фотохимическое окислительное удаление молекулярного азота из азидного комплекса.
- символическое окислительное отщепление азота дает комплекс нитридо железа; L обозначает поддерживающий лиганд.
Fe(IV)N
[ редактировать ]Существует несколько структурно охарактеризованных соединений нитридо железа (IV). [14] [15] [16]
Fe(V)N
[ редактировать ]Первое соединение нитридо железа(V) было синтезировано и охарактеризовано Вагнером и Накамото (1988, 1989) с использованием фотолиза и рамановской спектроскопии при низких температурах. [17] [18]
Fe(VI)N
[ редактировать ]Второе Фе МЫ других видах, кроме иона феррата(VI) , [(Me 3 cy-ac)FeN](PF 6 ) 2 Сообщалось о . Эта разновидность образуется в результате окисления с последующим фотолизом с образованием разновидности Fe(VI). Характеристика комплекса Fe(VI) выполнена методами мессбауэровского, EXAFS, ИК-расчета и DFT-расчетов. В отличие от иона феррата(VI), соединение 5 диамагнитно . [19]
μ-Нитридосоединения и катализ окисления
[ редактировать ]дижелеза с мостиковой Соединения фталоцианина связью, такие как фталоцианин железа (II), катализируют окисление метана в метанол , формальдегид и муравьиную кислоту с использованием перекиси водорода в качестве жертвенного окислителя. [20] [21]
Электронная структура
[ редактировать ]Виды нитридо железа (IV) и нитридо железа (V) были впервые теоретически исследованы в 2002 году. [22]
См. также
[ редактировать ]- Катализатор Якобсена (высоковалентный марганец)
Ссылки
[ редактировать ]- ^ Крейг и др. Далтон Транс., 2010, 39, 4874-4881. дои : 10.1039/B927032A
- ^ Que и др.; Журнал неорганической биохимии, том 100, выпуск 4, апрель 2006 г., страницы 421–433; дои : 10.1016/j.jinorgbio.2006.01.014
- ^ Да, Гереон М.; Толман, Уильям Б. (2015). «Глава 5, раздел 2.2.4 Промежуточные соединения Fe(IV)-оксо ». Питер М. Х. Кронек и Марта Э. Соса Торрес (ред.). Поддержание жизни на планете Земля: металлоферменты, усваивающие дикислород и другие жевательные газы . Ионы металлов в науках о жизни. Том. 15. Спрингер. стр. 145–146. дои : 10.1007/978-3-319-12415-5_5 . ISBN 978-3-319-12414-8 . ПМИД 25707468 .
- ^ Буковски М.Р., Кентоп К.Д., Стубна А., Боминаар Э.Л., Халфен Дж.А., Мунк Э., Нам В., Кью Л., Science, 310, 1000-1002, 2005; дои : 10.1126/science.111909
- ^ Роде, Дж.-У., Ин, Дж.-Х., Лим, М.Х., Бреннессел, В.В., Биковски, М.Р., Стубна, А., Мунк, Э., Имя, В., Ке, Л., Наука , 299, 1037-1039, 2003; дои : 10.1126/science.299.5609.1037
- ^ Комба, П. и др.; Неорг. Chem., 2009, 48 (21), стр. 10389–10396; два : 10.1021/ic901702s
- ^ Оливейра, Ф.Т., Чанда, А., Банерджи, Д., Шан, Х., Мондал, С., Ке, Л., Боминаар, Э.Л., Мунк, Э., Коллинз, Т.Дж., Science, 315, 835-838 , 2007; дои : 10.1126/science.1133417
- ^ Фуджи, Х.; Обзоры координационной химии, том 226, выпуски 1–2, март 2002 г., страницы 51–60; два : 10.1016/S0010-8545(01)00441-6
- ^ Берри, Дж. Ф.; Комментарии по неорганической химии, 30: 28–66, 2009; дои : 10.1080/02603590902768875
- ^ Петерс, Дж. К., Мен, член парламента; Журнал неорганической биохимии, том 100, выпуск 4, апрель 2006 г., страницы 634–643; дои : 10.1016/j.jinorgbio.2006.01.023
- ^ Тайлер, Д.Р., Кроссленд, Дж.Э.; Обзоры координационной химии 254 (2010) 1883–1894; два : 10.1016/j.ccr.2010.01.005
- ^ Накамото, К.; Обзоры координационной химии, том 226, выпуски 1–2, март 2002 г., страницы 153–165; два : 10.1016/S0010-8545(01)00425-8
- ^ Накамото, К.; Журнал молекулярной структуры, тома 408–409, 1 июня 1997 г., страницы 11–16; два : 10.1016/S0022-2860(96)09670-6
- ^ Питерс, Джонас Дж.; Кью, Лоуренс-младший и др.; Неорг. Chem., 2007, 46 (14), стр. 5720–5726; дои : 10.1021/ic700818q
- ^ Смит и др.; Angewandte Chemie International Edition, том 48, выпуск 17, страницы 3158–3160, 14 апреля 2009 г.; два : 10.1002/anie.200900381
- ^ Мейер и др.; Angewandte Chemie International Edition, том 47, выпуск 14, страницы 2681–2684, 25 марта 2008 г., 14 апреля 2009 г.; два : 10.1002/anie.200800600
- ^ Вагнер, WD; Накамото, К.; Дж.Ам. хим. Сок., 1988, 110 (12), стр. 4044–4045; два : 10.1021/ja00220a057
- ^ Вагнер, WD; Накамото, К.; Дж.Ам. хим. Сок., 1989, 111 (5), стр. 1590–1598; два : 10.1021/ja00187a010
- ^ Берри Дж. Ф., Билл Э., Боте Э., Джордж С.Д., Минер Б., Низ Ф., Вигхардт К., Science, 312, 1937–1941, 2006; дои : 10.1126/science.1128506
- ^ Сорокин, А.Б.; Кудрик Е.В.; Бушу, Д.; хим. Коммун., 2008, 2562-2564; два : 10.1039/B804405H
- ^ Обзор: Ке, Л., Толман, В.Б.; Nature 455, 333–340 (18 сентября 2008 г.); дои : 10.1038/nature07371
- ^ Дей, А.; Гош, А.; Дж.Ам. хим. Сок., 2002, 124 (13), стр. 3206–3207; два : 10.1021/ja012402s
Дальнейшее чтение
[ редактировать ]- Соломон и др.; Angewandte Chemie International Edition, том 47, выпуск 47, страницы 9071–9074, 10 ноября 2008 г.; два : 10.1002/anie.200803740

