Метионинсинтаза
| ССО | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | MTR , HMAG, MS, cblG, 5-метилтетрагидрофолат-гомоцистеин метилтрансфераза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 156570 ; МГИ : 894292 ; Гомологен : 37280 ; GeneCards : MTR ; ОМА : MTR – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер ЕС | 2.1.1.13 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Метионинсинтаза ( MS , MeSe , MTR ) в первую очередь отвечает за регенерацию метионина из гомоцистеина у большинства людей. У человека он кодируется MTR геном (5-метилтетрагидрофолат-гомоцистеин-метилтрансфераза). [5] [6] Метионинсинтаза является частью S-аденозилметионина (SAMe) цикла биосинтеза и регенерации . [7] и является ферментом, ответственным за связь цикла с одноуглеродным метаболизмом через фолатный цикл. Существует две основные формы этого фермента: витамин B12 ( кобаламин)-зависимая (MetH) и независимая (MetE) формы. [8] хотя минимальные основные метионинсинтазы, которые не вписываются ни в одну из категорий, также были описаны у некоторых анаэробных бактерий . [9] Две доминирующие формы ферментов, по-видимому, эволюционно независимы и основаны на совершенно разных химических механизмах. [10] Млекопитающие и другие высшие эукариоты экспрессируют только кобаламин-зависимую форму. Напротив, распределение двух форм у Archaeplastida ( растений и водорослей ) более сложное. Растения обладают исключительно кобаламин-независимой формой, [11] в то время как у водорослей есть один из двух, в зависимости от вида. [12] Многие различные микроорганизмы экспрессируют как кобаламин-зависимые, так и кобаламин-независимые формы. [13]
Механизм
[ редактировать ]
Метионинсинтаза катализирует заключительный этап регенерации метионина (Met) из гомоцистеина (Hcy). Как кобаламин-зависимая, так и кобаламин-независимая формы фермента осуществляют одну и ту же общую химическую реакцию: перенос метильной группы от 5-метилтетрагидрофолата (N 5 -MeTHF) в гомоцистеин с образованием тетрагидрофолата (THF) и метионина. [8] Метионинсинтаза — единственный фермент млекопитающих, метаболизирующий N. 5 -MeTHF для регенерации активного кофактора THF. В кобаламин -зависимой (MetH) форме фермента реакция протекает в две стадии по предпочтительному упорядоченному последовательному механизму. [14] Считается, что физиологическое состояние покоя фермента содержит связанный с ферментом кофактор (Cob) в форме метилкобаламина с атомом кобальта в формальном состоянии валентности +3 (Cob(III)-Me). Затем кобаламин деметилируется активированным цинком тиолатом гомоцистеина, образуя метионин и восстанавливая кофактор до состояния Cob(I). В форме Cob(I) связанный с ферментом кофактор теперь способен отрывать метильную группу от активированного 5-метилтетрагидрофолата (N 5 -MeTHF), образуя тетрагидрофолат (THF) и регенерируя метилкоаламиновую форму фермента. [15]

В физиологических условиях примерно один раз в 2000 каталитических оборотов Co(I) может окисляться до неактивного Co(II) в Cob-зависимом MetH. Чтобы объяснить этот эффект, белок содержит механизм самореактивации, процесс восстановительного метилирования, в котором S-аденозилметионин используется в качестве отдельного донора метила. У людей активность фермента снижается в этом процессе с помощью метионинсинтазоредуктазы (MTRR), которая состоит из флаводоксиноподобного и ферродоксин-НАДФ+ оксидоредуктазы (FNR)-подобных доменов. [16] У многих бактерий восстановление осуществляется однодоменным белком флаводоксином. [17] Белок редуктаза отвечает за перенос электрона от восстановленного кофактора FMN к неактивному Cob(II), что обеспечивает регенерацию активного фермента метилкобаламина посредством переноса метила от S-аденозилметионина к восстановленному промежуточному продукту Cob(I). [18] Этот процесс известен как цикл реактивации, и считается, что он отделен от нормального каталитического цикла крупномасштабными конформационными перестройками внутри фермента. [19] Поскольку окисление Cob(I) неизбежно приводит к отключению cob-зависимой активности метионинсинтазы, дефекты или дефицит метионинсинтазоредуктазы могут быть вовлечены в некоторые заболевания, связанные с дефицитом метионинсинтазы. [20]
Механизм кобаламин-независимой (MetE) формы, напротив, протекает через прямой перенос метила от активированного N 5 -MeTHF в гомоцистеин тиолат цинка. Хотя механизм значительно проще, реакция прямого переноса гораздо менее благоприятна, чем реакции, опосредованные кобаламином, и в результате скорость обмена MetE примерно в 100 раз медленнее, чем у MetH. Поскольку кобаламин-независимый фермент не содержит кофактора кобаламина, он не склонен к окислительной инактивации. [21] [8] [22] [23]
Структура
[ редактировать ]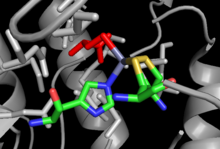
Структуры высокого разрешения были решены методом рентгеновской кристаллографии для интактного MetE как в отсутствие, так и в присутствии субстратов. [23] [22] а для фрагментов MetH [24] [25] [26] [27] хотя не существует структурного описания полностью интактного фермента MetH. Доступные структуры и сопутствующий биоинформатический анализ указывают на минимальное сходство в общей структуре, хотя сходство имеется внутри самих сайтов связывания субстрата. [28] Cob-зависимый MetH разделен на 4 отдельных домена. Домены от N-до C-конца обозначаются как связывающие гомоцистеин (домен Hcy), N 5 -метилТГФ-связывающий (домен MTHF) кобаламин-связывающий (домен Cob) и S-аденозиметионин-связывающий или реактивационный домен. Домен реактивации связывает SAM и является местом взаимодействия с флаводоксином или метионинсинтазоредуктазой во время цикла реактивации фермента. [17] [16] [20] Домен, связывающий кобаламин, содержит два субдомена, причем кофактор связан с субдоменом, связывающим Россман-фолд B 12 , который, в свою очередь, увенчан другим субдоменом, субдоменом кепки пучка четырех спиралей. [25] Пучок из четырех спиралей служит для защиты кофактора кобаламина от нежелательной реактивности, но может значительно изменить конформацию, чтобы открыть кофактору доступ к другим субстратам во время оборота. [26] И Hcy, и N 5 -Домены MeTHF используют архитектуру TIM ; Домен Hcy содержит сайт связывания цинка, который в MetH состоит из трех остатков цистеина, координированных с ионом цинка, который, в свою очередь, связывает и активирует Hcy. Затем 5 -MeTHF-связывающий домен связывает и активирует N 5 -MeTHF через сеть водородных связей с несколькими остатками аспарагина , аргинина и аспарагиновой кислоты . Во время оборота фермент претерпевает значительные конформационные изменения, которые включают перемещение Cob-домена вперед и назад от домена Hcy к N. 5 -MeTHF-домен для того, чтобы протекали две реакции переноса метила. [24]
Независимый от початков MetE состоит из двух TIM-бочковых доменов, которые связывают гомоцистеин и N. 5 -MeTHF индивидуально. Два домена имеют архитектуру с двойным бочонком, расположенным лицом к лицу, что требует «закрытия» структуры при связывании обоих субстратов, чтобы обеспечить прямой перенос метила. [22] Стратегии связывания субстрата аналогичны MetH, хотя в случае MetE атом цинка вместо этого координируется с двумя цистеинами, гистидином и глутаматом . [23] пример для которого показан справа.
Биохимическая функция
[ редактировать ]
У людей основная цель фермента — регенерация Met в цикле S-аденозилметионина (SAM). Цикл SAM за один оборот потребляет Met и АТФ и генерирует Hcy и может включать любую из ряда критических ферментативных реакций, в которых S-аденозилметионин используется в качестве источника активной метильной группы для метилирования нуклеиновых кислот , гистонов , фосфолипидов и различных белки . [29] [30] Таким образом, метионинсинтаза выполняет важную функцию, позволяя циклу SAM продолжаться без постоянного притока Met. В качестве вторичного эффекта метионинсинтаза также служит для поддержания низкого уровня Hcy и, поскольку метионинсинтаза является одним из немногих ферментов, которые используют N 5 -MeTHF в качестве субстрата для косвенного поддержания уровня THF. [31] [32]
У бактерий и растений метионинсинтаза служит двойной цели: как поддерживать цикл SAM, так и катализировать заключительную синтетическую стадию синтеза de novo Met, который является одной из 20 канонических аминокислот . [33] [11] Хотя химическая реакция для обоих процессов совершенно одинакова, общая функция отличается от метионинсинтазы у людей, поскольку Met является незаменимой аминокислотой , которая не синтезируется de novo в организме. [34]
Клиническое значение
[ редактировать ]Мутации в гене MTR были идентифицированы как основная причина дефицита метилкобаламина группы комплементации G или дефицита метилкобаламина cblG-типа. [5] Дефицит или нарушение регуляции фермента из-за недостаточности метионинсинтазоредуктазы может напрямую привести к повышению уровня гомоцистеина ( гипергомоцистеинемия ), что связано со слепотой, неврологическими симптомами и врожденными дефектами. [35] [36] Дефицит метионинсинтазоредуктазы (MTRR) или метилентетрагидрофолатредуктазы (MTHFR) также может привести к этому состоянию. В большинстве случаев дефицит метионинсинтазы проявляется в течение 2 лет после рождения, при этом у многих пациентов быстро развивается тяжелая энцефалопатия . [37] Одним из последствий снижения активности метионинсинтазы, которое можно измерить с помощью обычных клинических анализов крови, является мегалобластная анемия .
Генетика
[ редактировать ]Идентифицировано несколько полиморфизмов, связанных с cblG, в гене MTR. [38]
- 2756D→G (Асп 919 Гли)
- 3804C→T (Про 1137 Лея)
- Δ2926A-2928T (ΔIle 881 )
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000116984 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000021311 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Перейти обратно: а б «MTR 5-метилтетрагидрофолат-гомоцистеин метилтрансфераза ( Homo sapiens )» . Энтрез. 19 мая 2009 года . Проверено 24 мая 2009 г.
- ^ Ли Ю.Н., Гулати С., Бейкер П.Дж., Броуди Л.К., Банерджи Р., Крюгер В.Д. (декабрь 1996 г.). «Клонирование, картирование и анализ РНК гена метионинсинтазы человека» . Молекулярная генетика человека . 5 (12): 1851–1858. дои : 10.1093/hmg/5.12.1851 . ПМИД 8968735 .
- ^ Банерджи Р.В., Мэтьюз Р.Г. (март 1990 г.). «Кобаламинзависимая метионинсинтаза» . Журнал ФАСЭБ . 4 (5): 1450–1459. дои : 10.1096/fasebj.4.5.2407589 . hdl : 2027.42/154369 . ПМИД 2407589 . S2CID 8210250 .
- ^ Перейти обратно: а б с Мэтьюз Р.Г., Смит А.Е., Чжоу З.С., Таурог Р.Э., Бандарян В., Эванс Дж.К., Людвиг М. (2003). «Кобаламин-зависимая и кобаламин-зависимая метионинсинтазы: есть ли два решения одной и той же химической проблемы?». Helvetica Chimica Acta . 86 (12): 3939–3954. дои : 10.1002/hlca.200390329 .
- ^ Деобальд Д., Ханна Р., Шахрияри С., Слой G, Адриан Л. (февраль 2020 г.). «Идентификация и характеристика бактериальной ядерной метионинсинтазы» . Научные отчеты . 10 (1): 2100. Бибкод : 2020NatSR..10.2100D . дои : 10.1038/s41598-020-58873-z . ПМК 7005905 . ПМИД 32034217 .
- ^ Пейчал Р., Людвиг М.Л. (февраль 2005 г.). Страуд Р.М. (ред.). «Кобаламин-независимая метионинсинтаза (MetE): двойная бочка лицом к лицу, возникшая в результате дупликации генов» . ПЛОС Биология . 3 (2): е31. дои : 10.1371/journal.pbio.0030031 . ПМК 539065 . ПМИД 15630480 .
- ^ Перейти обратно: а б Раванель С., Гакьер Б., Джоб Д., Дус Р. (июнь 1998 г.). «Особенности биосинтеза и обмена метионина у растений» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (13): 7805–7812. Бибкод : 1998PNAS...95.7805R . дои : 10.1073/pnas.95.13.7805 . ПМК 22764 . ПМИД 9636232 .
- ^ Хелливелл К.Е., Уилер Г.Л., Лептос К.К., Гольдштейн Р.Э., Смит АГ (октябрь 2011 г.). «Понимание эволюции ауксотрофии витамина B12 на основе секвенированных геномов водорослей» . Молекулярная биология и эволюция . 28 (10): 2921–2933. дои : 10.1093/molbev/msr124 . ПМИД 21551270 .
- ^ Жидовский Т.М. (1986). «Стереохимический анализ переноса метила, катализируемого кобаламин-зависимой метионинсинтазой из Escherichia coli B». Журнал Американского химического общества . 108 (11): 3152–3153. дои : 10.1021/ja00271a081 .
- ^ Банерджи Р.В., Фраска В., Баллоу Д.П., Мэтьюз Р.Г. (декабрь 1990 г.). «Участие аламина cob (I) в реакции, катализируемой метионинсинтазой из Escherichia coli: кинетический анализ стационарной и быстрой реакции». Биохимия . 29 (50): 11101–11109. дои : 10.1021/bi00502a013 . ПМИД 2271698 .
- ^ Рума Банерджи, изд. (1999). Химия и биохимия В12 . Нью-Йорк: Уайли. ISBN 0-471-25390-1 . OCLC 40397055 .
- ^ Перейти обратно: а б Ямада К., Гравий Р.А., Торая Т., Мэтьюз Р.Г. (июнь 2006 г.). «Человеческая метионинсинтазоредуктаза является молекулярным шапероном для метионинсинтазы человека» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (25): 9476–9481. Бибкод : 2006PNAS..103.9476Y . дои : 10.1073/pnas.0603694103 . ПМЦ 1480432 . ПМИД 16769880 .
- ^ Перейти обратно: а б Холл Д.А., Джордан-Старк Т.К., Лу Р.О., Людвиг М.Л., Мэтьюз Р.Г. (сентябрь 2000 г.). «Взаимодействие флаводоксина с кобаламин-зависимой метионинсинтазой». Биохимия . 39 (35): 10711–10719. дои : 10.1021/bi001096c . ПМИД 10978155 .
- ^ Джарретт Дж.Т., Гувер Д.М., Людвиг М.Л., Мэтьюз Р.Г. (сентябрь 1998 г.). «Механизм аденозилметионин-зависимой активации метионинсинтазы: быстрый кинетический анализ промежуточных продуктов восстановительного метилирования фермента Cob (II) аламин». Биохимия . 37 (36): 12649–12658. дои : 10.1021/bi9808565 . ПМИД 9730838 .
- ^ Джарретт Дж.Т., Хуанг С., Мэтьюз Р.Г. (апрель 1998 г.). «Метионинсинтаза существует в двух различных конформациях, которые различаются по реакционной способности по отношению к метилтетрагидрофолату, аденозилметионину и флаводоксину». Биохимия . 37 (16): 5372–5382. дои : 10.1021/bi9730893 . ПМИД 9548919 .
- ^ Перейти обратно: а б Уолтерс КР, Скраттон Н.С. (июнь 2007 г.). «Взаимодействия белков в комплексе метионинсинтаза-метионинсинтазаредуктаза человека и значение механизма реактивации фермента». Биохимия . 46 (23): 6696–6709. дои : 10.1021/bi700339v . ПМИД 17477549 .
- ^ Чжан З, Тянь С, Чжоу С, Ван В, Го Ю, Ся Дж и др. (декабрь 2012 г.). «Механизм проектирования, синтеза и биологических исследований N5-замещенных аналогов тетрагидрофолата как ингибиторов кобаламин-зависимой метионинсинтазы и потенциальных противораковых средств». Европейский журнал медицинской химии . 58 : 228–236. дои : 10.1016/j.ejmech.2012.09.027 . ПМИД 23124219 .
- ^ Перейти обратно: а б с Убхи Д.К., Робертус Дж.Д. (февраль 2015 г.). «Кобаламин-независимый фермент метионинсинтаза, захваченный в закрытой конформации, индуцированной субстратом» . Журнал молекулярной биологии . 427 (4): 901–909. дои : 10.1016/j.jmb.2014.12.014 . ПМИД 25545590 .
- ^ Перейти обратно: а б с Коутмос М., Пейчал Р., Бомер Т.М., Мэтьюз Р.Г., Смит Дж.Л., Людвиг М.Л. (март 2008 г.). «Эластичность активного центра металла связана с активацией гомоцистеина в метионинсинтазах» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (9): 3286–3291. Бибкод : 2008PNAS..105.3286K . дои : 10.1073/pnas.0709960105 . ПМК 2265165 . ПМИД 18296644 .
- ^ Перейти обратно: а б Эванс Дж.К., Хаддлер Д.П., Хилгерс М.Т., Романчук Г., Мэтьюз Р.Г., Людвиг М.Л. (март 2004 г.). «Структура N-концевых модулей предполагает перемещение больших доменов во время катализа метионинсинтазой» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (11): 3729–3736. Бибкод : 2004PNAS..101.3729E . дои : 10.1073/pnas.0308082100 . ПМЦ 374312 . ПМИД 14752199 .
- ^ Перейти обратно: а б Дреннан К.Л., Хуанг С., Драммонд Дж.Т., Мэтьюз Р.Г., Людвиг М.Л. (декабрь 1994 г.). «Как белок связывает B12: рентгеновская структура B12-связывающих доменов метионинсинтазы 3,0 А». Наука . 266 (5191): 1669–1674. дои : 10.1126/science.7992050 . ПМИД 7992050 .
- ^ Перейти обратно: а б Бандарян В., Паттридж К.А., Леннон Б.В., Хаддлер Д.П., Мэтьюз Р.Г., Людвиг М.Л. (январь 2002 г.). «Альтернация домена переключает B (12)-зависимую метионинсинтазу в конформацию активации». Структурная биология природы . 9 (1): 53–56. дои : 10.1038/nsb738 . ПМИД 11731805 . S2CID 10529695 .
- ^ Датта С., Кутмос М., Паттридж К.А., Людвиг М.Л., Мэтьюз Р.Г. (март 2008 г.). «Дисульфид-стабилизированный конформер метионинсинтазы раскрывает неожиданную роль гистидинового лиганда кофактора кобаламина» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (11): 4115–4120. Бибкод : 2008PNAS..105.4115D . дои : 10.1073/pnas.0800329105 . ПМЦ 2393809 . ПМИД 18332423 .
- ^ Пейчал Р., Людвиг М.Л. (февраль 2005 г.). «Кобаламин-независимая метионинсинтаза (MetE): двойная бочка лицом к лицу, возникшая в результате дупликации генов» . ПЛОС Биология . 3 (2): е31. дои : 10.1371/journal.pbio.0030031 . ПМК 539065 . ПМИД 15630480 .
- ^ Бродерик Дж. Б., Даффус Б. Р., Душен К. С., Шепард Э. М. (апрель 2014 г.). «Радикальные ферменты S-аденозилметионина» . Химические обзоры . 114 (8): 4229–4317. дои : 10.1021/cr4004709 . ПМК 4002137 . ПМИД 24476342 .
- ^ Шейн Б. (июнь 2008 г.). «Метаболизм фолата и витамина B12: обзор и взаимодействие с рибофлавином, витамином B6 и полиморфизмами». Бюллетень по еде и питанию . 29 (2 доп.): S5–S16. дои : 10.1177/15648265080292S103 . ПМИД 18709878 . S2CID 21493797 .
- ^ Уоткинс Д., Ру М., Хван ХИ, Ким С.Д., Мюррей А., Филип Н.С. и др. (июль 2002 г.). «Гипергомоцистеинемия из-за дефицита метионинсинтазы, cblG: структура гена MTR, разнообразие генотипов и распознавание общей мутации P1173L» . Американский журнал генетики человека . 71 (1): 143–153. дои : 10.1086/341354 . ПМЦ 384971 . ПМИД 12068375 .
- ^ Гергурович Дж. М., Сюй X, Ван Дж. З., Ян Л., Райсек Р. П., Ван Л., Рабиновиц Дж. Д. (ноябрь 2021 г.). «Метионинсинтаза поддерживает пулы тетрагидрофолата опухоли» . Природный метаболизм . 3 (11): 1512–1520. дои : 10.1038/s42255-021-00465-w . ПМЦ 9284419 . ПМИД 34799699 . S2CID 244450216 .
- ^ Член парламента Ферла, Патрик В.М. (август 2014 г.). «Бактериальный биосинтез метионина» . Микробиология . 160 (Часть 8): 1571–1584. дои : 10.1099/mic.0.077826-0 . ПМИД 24939187 .
- ^ Гессен Х., Хёфген Р. (июнь 2003 г.). «Молекулярные аспекты биосинтеза метионина». Тенденции в науке о растениях . 8 (6): 259–262. дои : 10.1016/S1360-1385(03)00107-9 . ПМИД 12818659 .
- ^ Банерджи Р.В., Мэтьюз Р.Г. (март 1990 г.). «Кобаламинзависимая метионинсинтаза» . Журнал ФАСЭБ . 4 (5): 1450–1459. дои : 10.1096/fasebj.4.5.2407589 . hdl : 2027.42/154369 . ПМИД 2407589 . S2CID 8210250 .
- ^ Ким Дж, Ким Х, Ро Х, Квон Ю (апрель 2018 г.). «Причины гипергомоцистеинемии и ее патологическое значение». Архивы фармацевтических исследований . 41 (4): 372–383. дои : 10.1007/s12272-018-1016-4 . ПМИД 29552692 . S2CID 3986295 .
- ^ Аутерик О, де Сез Ж, Стойкович Т, Кюиссе ЖМ, Доббелэр Д, Делаланд С и др. (июль 2012 г.). «Дефицит метионинсинтазы: редкая причина лейкоэнцефалопатии у взрослых». Неврология . 79 (4): 386–388. дои : 10.1212/WNL.0b013e318260451b . ПМИД 22786600 . S2CID 207121496 .
- ^ Гулати С., Бейкер П., Ли Ю.Н., Фаулер Б., Крюгер В., Броуди Л.К., Банерджи Р. (декабрь 1996 г.). «Дефекты метионинсинтазы человека у пациентов cblG» . Молекулярная генетика человека . 5 (12): 1859–1865. дои : 10.1093/hmg/5.12.1859 . PMID 8968736 .
Дальнейшее чтение
[ редактировать ]- Людвиг М.Л., Мэтьюз Р.Г. (1997). «Структурные взгляды на B12-зависимые ферменты». Ежегодный обзор биохимии . 66 : 269–313. doi : 10.1146/annurev.biochem.66.1.269 . ПМИД 9242908 .
- Мэтьюз Р.Г., Шеппард С., Гулдинг С. (апрель 1998 г.). «Метилентетрагидрофолатредуктаза и метионинсинтаза: биохимия и молекулярная биология» . Европейский журнал педиатрии . 157 (Приложение 2): S54–S59. дои : 10.1007/PL00014305 . hdl : 2027.42/42254 . ПМИД 9587027 . S2CID 8709190 .
- Гарович-Кочич В., Розенблатт Д.С. (август 1992 г.). «Метиониновая ауксотрофия при врожденных нарушениях метаболизма кобаламина». Клиническая и исследовательская медицина . 15 (4): 395–400. ПМИД 1516297 .
- О'Коннор Д.Л., Мориарти П., Пиччано М.Ф. (1992). «Влияние дефицита железа на поток фолатов в молочной железе». Международный журнал исследований витаминов и питания . 62 (2): 173–180. ПМИД 1517041 .
- Эверман Б.В., Коблин Д.Д. (март 1992 г.). «Старение, хроническое введение этанола и острое воздействие закиси азота: влияние на статус витамина B12 и фолиевой кислоты у крыс» . Механизмы старения и развития . 62 (3): 229–243. дои : 10.1016/0047-6374(92)90109-Q . ПМИД 1583909 . S2CID 11766691 .
- Василиадис А., Розенблатт Д.С., Купер Б.А., Бержерон Дж.Дж. (август 1991 г.). «Лизосомальное накопление кобаламина в фибробластах пациента с врожденным нарушением метаболизма кобаламина (группа комплементации cblF): визуализация с помощью радиоавтографии электронного микроскопа». Экспериментальные исследования клеток . 195 (2): 295–302. дои : 10.1016/0014-4827(91)90376-6 . ПМИД 2070814 .
- Ли Ю.Н., Гулати С., Бейкер П.Дж., Броуди Л.К., Банерджи Р., Крюгер В.Д. (декабрь 1996 г.). «Клонирование, картирование и анализ РНК гена метионинсинтазы человека» . Молекулярная генетика человека . 5 (12): 1851–1858. дои : 10.1093/hmg/5.12.1851 . ПМИД 8968735 .
- Гулати С., Бейкер П., Ли Ю.Н., Фаулер Б., Крюгер В., Броуди Л.К., Банерджи Р. (декабрь 1996 г.). «Дефекты метионинсинтазы человека у пациентов cblG» . Молекулярная генетика человека . 5 (12): 1859–1865. дои : 10.1093/hmg/5.12.1859 . PMID 8968736 .
- Леклерк Д., Кампо Э., Гойетт П., Аджалла С.Э., Кристенсен Б., Росс М. и др. (декабрь 1996 г.). «Метионинсинтаза человека: клонирование кДНК и идентификация мутаций у пациентов группы комплементации cblG с нарушениями фолата/кобаламина» . Молекулярная генетика человека . 5 (12): 1867–1874. дои : 10.1093/hmg/5.12.1867 . ПМИД 8968737 .
- Чен Л.Х., Лю М.Л., Хван ХИ, Чен Л.С., Коренберг Дж., Шейн Б. (февраль 1997 г.). «Метионинсинтаза человека. Клонирование кДНК, локализация и экспрессия генов» . Журнал биологической химии . 272 (6): 3628–3634. дои : 10.1074/jbc.272.6.3628 . ПМИД 9013615 .
- Уилсон А., Леклерк Д., Сабери Ф., Кампо Э., Хван Х.И., Шейн Б. и др. (август 1998 г.). «Функционально нулевые мутации у пациентов с cblG-вариантной формой дефицита метионинсинтазы» . Американский журнал генетики человека . 63 (2): 409–414. дои : 10.1086/301976 . ПМЦ 1377317 . ПМИД 9683607 .
- Саломон О., Розенберг Н., Живелин А., Стейнберг Д.М., Корнброт Н., Дардик Р. и др. (2002). «Полиморфизмы метионинсинтазы A2756G и метилентетрагидрофолатредуктазы A1298C не являются факторами риска идиопатической венозной тромбоэмболии». Гематологический журнал . 2 (1): 38–41. дои : 10.1038/sj.thj.6200078 . ПМИД 11920232 .
- Уоткинс Д., Ру М., Хван ХИ, Ким С.Д., Мюррей А., Филип Н.С. и др. (июль 2002 г.). «Гипергомоцистеинемия из-за дефицита метионинсинтазы, cblG: структура гена MTR, разнообразие генотипов и распознавание общей мутации P1173L» . Американский журнал генетики человека . 71 (1): 143–153. дои : 10.1086/341354 . ПМЦ 384971 . ПМИД 12068375 .
- Де Марко П., Калево М.Г., Морони А., Арата Л., Мерелло Э., Финнелл Р.Х. и др. (2002). «Исследование полиморфизмов MTHFR и MS как факторов риска развития NTD у итальянской популяции» . Журнал генетики человека . 47 (6): 319–324. дои : 10.1007/s100380200043 . ПМИД 12111380 .
- Дулин М.Т., Барбо С., Макдоннелл М., Хесс К., Уайтхед А.С., Митчелл Л.Е. (ноябрь 2002 г.). «Материнские генетические эффекты, оказываемые генами, участвующими в реметилировании гомоцистеина, влияют на риск расщелины позвоночника» . Американский журнал генетики человека . 71 (5): 1222–1226. дои : 10.1086/344209 . ПМЦ 385102 . ПМИД 12375236 .
- Чжу Х., Уикер Нью-Джерси, Шоу Г.М., Ламмер Э.Дж., Хендрикс К., Суарес Л. и др. (март 2003 г.). «Полиморфизм фермента реметилирования гомоцистеина и повышенный риск дефектов нервной трубки». Молекулярная генетика и обмен веществ . 78 (3): 216–221. дои : 10.1016/S1096-7192(03)00008-8 . ПМИД 12649067 .
Внешние ссылки
[ редактировать ]- Запись GeneReviews/NCBI/NIH/UW о нарушениях внутриклеточного метаболизма кобаламина
- ЭНЗИМ: EC 2.1.1.13. Архивировано 22 июня 2011 г. на Wayback Machine.
- 5-Метилтетрагидрофолат-гомоцистеин + S-метилтрансфераза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)





