Тимидилатсинтаза
| ТИМС | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | TYMS , HST422, TMS, TS, тимидилатсинтетаза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 188350 ; МГИ : 98878 ; Гомологен : 834 ; Генные карты : TYMS ; ОМА : TYMS - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| тимидилатсинтаза | |||
|---|---|---|---|
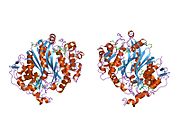
 Гомодимер тимидилатсинтазы, человека | |||
| Идентификаторы | |||
| Номер ЕС. | 2.1.1.45 | ||
| Номер CAS. | 9031-61-2 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| Тимидилатсинтаза | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Тимидилат_синт | ||
| Пфам | PF00303 | ||
| ИнтерПро | IPR000398 | ||
| PROSITE | PDOC00086 | ||
| СКОП2 | 1тыс / ОБЛАСТЬ / СУПФАМ | ||
| |||
Тимидилатсинтаза (TS) ( EC 2.1.1.45 ) [5] представляет собой фермент , который катализирует превращение дезоксиуридинмонофосфата (dUMP) в дезокситимидинмонофосфат (dTMP). Тимидин — один из нуклеотидов ДНК. При ингибировании ТС возникает дисбаланс дезоксинуклеотидов и повышение уровня dUMP . Оба вызывают повреждение ДНК. [6] [7]
Функция
[ редактировать ]Следующая реакция катализируется тимидилатсинтазой:
- 5,10-метилентетрагидрофолат + dUMP дигидрофолат + дТМФ
Посредством восстановительного дезоксиуридинмонофосфат метилирования ( dUMP) и N5,N10-метилентетрагидрофолат вместе используются для образования dTMP, образуя дигидрофолат в качестве вторичного продукта.
Это обеспечивает единственный путь образования dTMP de novo и является единственным ферментом метаболизма фолата, в котором 5,10-метилентетрагидрофолат окисляется во время одноуглеродного переноса. [8] Фермент необходим для регулирования сбалансированного снабжения 4-х предшественников ДНК при нормальной репликации ДНК: дефекты активности фермента, влияющие на процесс регуляции, вызывают различные биологические и генетические аномалии, такие как смерть без тимина. [9] Фермент является важной мишенью для некоторых химиотерапевтических препаратов. Тимидилатсинтаза представляет собой фермент массой около 30–35 кДа у большинства видов, за исключением простейших и растений, где она существует в виде бифункционального фермента, включающего домен дигидрофолатредуктазы. [8] В каталитическом механизме участвует остаток цистеина (ковалентно связывающий интермедиат 5,6-дигидро-dUMP). Последовательность вокруг активного центра этого фермента консервативна от фагов до позвоночных.
Тимидилатсинтаза индуцируется транскрипционным фактором LSF/ TFCP2 , а LSF является онкогеном при гепатоцеллюлярной карциноме . LSF и тимидилатсинтаза играют важную роль в пролиферации и прогрессировании рака печени, а также в устойчивости к лекарствам. [10]
Клиническое значение
[ редактировать ]Тимидилатсинтаза (ТС) играет решающую роль на ранних стадиях биосинтеза ДНК . [11] Повреждение или делеция ДНК происходят ежедневно в результате воздействия как эндогенных факторов, так и факторов окружающей среды. К таким факторам окружающей среды относятся вредное воздействие ультрафиолета и сигаретный дым, который содержит различные канцерогены. [12] Следовательно, синтез и вставка здоровой ДНК жизненно важны для нормального функционирования организма и предотвращения раковой активности. ингибирование синтеза важных нуклеотидов, Кроме того, важно необходимых для роста клеток. По этой причине TS стал важной мишенью для лечения рака с помощью химиотерапии . Чувствительность TS к действию ингибиторов TS является ключевой частью его успеха в лечении колоректального рака, рака поджелудочной железы, яичников, желудка и молочной железы. [11]
Использование TS в качестве мишени для наркотиков
[ редактировать ]Использование ингибиторов TS стало основным направлением использования TS в качестве мишени для лекарств. Наиболее широко используемым ингибитором является 5-фторурацил (5-ФУ) и его метаболизированная форма 5-фтордезоксиуридинмонофосфат (5-FdUMP), который действует как антиметаболит , необратимо ингибирующий TS путем конкурентного связывания. [13] Однако из-за низкого уровня 5-ФУ, обнаруженного у многих пациентов, было обнаружено, что в сочетании с лейковорином (ЛВ) 5-ФУ имеет больший успех в подавлении механизмов прогрессирования опухоли и повышении активности иммунной системы. [14]
Экспериментально было показано, что низкие уровни экспрессии TS приводят к лучшему ответу на 5-ФУ и более высоким показателям успеха и выживаемости пациентов с раком толстой кишки и печени. [11] Однако дополнительные эксперименты просто показали, что уровни TS могут быть связаны со стадией заболевания, пролиферацией клеток и дифференцировкой опухоли у пациентов с аденокарциномой легких , но низкие уровни не обязательно являются показателем высокого успеха. Уровни экспрессии мРНК TS могут быть полезны для прогнозирования злокачественного потенциала некоторых раковых клеток, тем самым улучшая цели лечения рака и обеспечивая более высокие показатели выживаемости среди онкологических больных [Хашимото].
Связь TS с клеточным циклом также способствует его использованию в лечении рака. Несколько зависимых от клеточного цикла киназ и факторов транскрипции влияют на уровни TS в клеточном цикле, которые повышают его активность во время S-фазы , но снижают его активность, когда клетки больше не пролиферируют. [11] С помощью ауторегуляции TS контролирует не только свою собственную трансляцию, но и трансляцию других белков, таких как p53, мутация которого является причиной роста значительной части опухолей. Благодаря трансляции TS имеет различную экспрессию в раковых клетках и опухолях, что приводит к ранней гибели клеток. [13]
Интерактивная карта маршрутов
[ редактировать ]Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [§ 1]
- ^ Интерактивную карту маршрутов можно редактировать на WikiPathways: «Фторпиримидинактивность_WP1601» .
Описание механизма
[ редактировать ]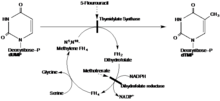
В предлагаемом механизме TS образует ковалентную связь с субстратом dUMP посредством 1,4-присоединения с участием цистеинового нуклеофила. Субстрат тетрагидрофолат отдает метильную группу альфа-углероду, восстанавливая при этом новый метил на dUMP с образованием dTMP. [15]

Доказано, что имин, образующийся в результате реакции с ТГФ и dUMP, является интермедиатом в реакции с dUMP за счет мутаций в структуре TS, препятствующих завершению механизма. V316Am TS, мутант с делецией С-концевых валинов из обеих субъединиц, позволяет катализировать дегалогенирование BrdUMP, предшествующее описанному выше механизму, и ковалентную связь с ТГФ и dUMP. Мутантный TS не способен осуществить конформационное изменение С-конца, необходимое для разрыва ковалентных связей с образованием dTMP, что показывает, что предложенный механизм верен. Структура была установлена с помощью рентгеновской кристаллографии V316Am TS, чтобы проиллюстрировать структуру полного гомодимера TS (рис. 1). Кроме того, было показано возможное взаимодействие 175Arg и 174Arg между димерами. Считается, что эти аргинины стабилизируют структуры UMP внутри активных центров, создавая водородные связи с фосфатной группой (рис. 2). [Страуд и Файнер-Мур] [ нужна ссылка ] 5-ФУ является ингибитором ТС. При попадании в клетку 5-фторурацил (5-ФУ) внутриклеточно превращается в различные активные метаболиты. Одним из таких метаболитов является FdUMP, который отличается от dUMP наличием фтора вместо водорода на альфа-углероде. FdUMP способен ингибировать TS путем связывания с сайтом связывания нуклеотидов dUMP. Это конкурентное связывание ингибирует нормальную функцию синтеза dTMP из dUMP [Longley]. [ нужна ссылка ] Таким образом, dUMP не может провести реакцию элиминирования и завершить отдачу метила из ТГФ.

Рисунок 1. На этом рисунке изображен гомодимер TS. Как вы можете видеть, оранжевая и бирюзовая основные цепи никогда не соединяются и не переплетаются, но между димерами существует взаимодействие боковых цепей. На оранжевом белке вы можете визуально обнаружить две длинные боковые цепи, которые входят в бирюзовый белок (они расположены внутри желтого круга). Другие бежевые части — это боковые цепи, которые взаимодействуют внутри активного сайта. Чуть ниже желтого круга вы можете увидеть тот же рисунок боковых цепей и конфигурацию.

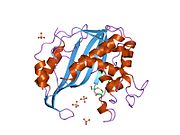
Рисунок 2. На этом рисунке показаны возможные взаимодействия H-связей между аргининами и UMP в активном центре тимидилатсинтазы. Это можно увидеть по слабым линиям между синими и красными кончиками. Эти аргинины используются для удержания положения молекулы UMP, чтобы взаимодействие могло происходить правильно. Два аргинина в правом верхнем углу, расположенные рядом друг с другом на позвоночнике, на самом деле происходят из другого белка этого димерного фермента. Это взаимодействие является одной из многих межмолекулярных сил, которые удерживают вместе эти две третичные структуры. Желтая подставка в верхней средней части показывает серную связь, которая образуется между боковой цепью цистеина и UMP. Это ковалентно удерживает UMP внутри активного сайта до тех пор, пока он не вступит в реакцию с образованием TMP.
См. также
[ редактировать ]- Аналоги пиримидина
- Ингибитор тимидилатсинтазы
- Тимидинкиназа
- Тимидинкиназа в клинической химии
- Тимидилаткиназа
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000176890 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000025747 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ген Энтрез: тимидилатсинтетаза TYMS» .
- ^ «ДНК: форма и функция» (PDF) . Архивировано из оригинала (PDF) 25 мая 2013 г. Проверено 2 мая 2014 г.
- ^ «Синтез ДНК» .
- ^ Jump up to: а б Страуд Р.М., Санти Д.В., Харди Л.В., Монфор В.Р., Джонс М.О., Файнер-Мур Дж.С. (1987). «Атомная структура тимидилатсинтазы: цель рационального дизайна лекарств». Наука . 235 (4787): 448–455. Бибкод : 1987Sci...235..448H . дои : 10.1126/science.3099389 . ПМИД 3099389 .
- ^ Гото О, Симидзу К, Канеда С, Налбантоглу Дж, Такеиси К, Сено Т, Аюсава Д (1990). «Структурный и функциональный анализ гена тимидилатсинтазы человека» . Ж. Биол. Хим . 265 (33): 20277–20284. дои : 10.1016/S0021-9258(17)30501-X . ПМИД 2243092 .
- ^ Сантекадур П.К., Раджасекаран Д., Сиддик А., Гредлер Р., Чен Д., Шаус С.Е., Хансен У., Фишер П.Б., Саркар Д. (2012). «Фактор транскрипции LSF: новый онкоген гепатоцеллюлярной карциномы» (PDF) . Am J Cancer Res . 2 (3): 269–85. ПМК 3365805 . ПМИД 22679558 .
- ^ Jump up to: а б с д Петерс Г.Дж., Бэкус Х.Х., Фримантл С., ван Трист Б., Кодаччи-Писанелли Г., ван дер Вилт К.Л., Смид К., Люнек Дж., Калверт А.Х., Марш С., МакЛеод Х.Л., Блумена Е., Мейер С., Янсен Г., ван Гроенинген С.Дж. , Пинедо Х.М. (2002). «Индукция тимидилатсинтазы как механизм устойчивости к 5-фторурацилу». Биохим. Биофиз. Акта . 1587 (2–3): 194–205. дои : 10.1016/S0925-4439(02)00082-0 . ПМИД 12084461 .
- ^ «Лейковорин» . Информация о лекарствах MedlinePlus . Национальная медицинская библиотека США.
- ^ Jump up to: а б Папамихаэль Д. (1999). «Использование ингибиторов тимидилатсинтазы в лечении распространенного колоректального рака: современное состояние» . Онколог . 4 (6): 478–487. doi : 10.1634/теонколог.4-6-478 . ПМИД 10631692 .
- ^ Николини А, Конте М, Росси Дж, Феррари П, Даффи М, Барак В, Карпи А, Микколи П (2011). «Дополнительный 5-ФУ-ЛВ значительно увеличивает выживаемость при раке желудочно-кишечного тракта» . Фронт Биосци . 3 (4): 1475–82. дои : 10.2741/348 . ПМИД 21622151 .
- ^ Каррерас CW, Санти Д.В. (1995). «Каталитический механизм и структура тимидилатсинтазы». Анну. Преподобный Биохим . 64 : 721–62. дои : 10.1146/annurev.bi.64.070195.003445 . ПМИД 7574499 .
Дальнейшее чтение
[ редактировать ]- Каррерас CW, Санти Д.В. (1995). «Каталитический механизм и структура тимидилатсинтазы». Ежегодный обзор биохимии . 64 (1): 721–762. дои : 10.1146/annurev.bi.64.070195.003445 . ПМИД 7574499 .
- Банерджи Д., Майер-Кукук П., Капио Г. и др. (2002). «Новые аспекты устойчивости к препаратам, направленным на дигидрофолатредуктазу и тимидилатсинтазу». Биохим. Биофиз. Акта . 1587 (2–3): 164–73. дои : 10.1016/S0925-4439(02)00079-0 . ПМИД 12084458 .
- Лю Дж., Шмитц Дж.К., Лин X и др. (2002). «Тимидилатсинтаза как трансляционный регулятор экспрессии клеточных генов». Биохим. Биофиз. Акта . 1587 (2–3): 174–82. дои : 10.1016/s0925-4439(02)00080-7 . ПМИД 12084459 .
- Чу Дж., Дольник Б.Дж. (2002). «Природная антисмысловая (rTSalpha) РНК индуцирует сайт-специфическое расщепление мРНК тимидилатсинтазы». Биохим. Биофиз. Акта . 1587 (2–3): 183–93. дои : 10.1016/s0925-4439(02)00081-9 . ПМИД 12084460 .
- Питерс Г.Дж., Бэкус Х.Х., Фримантл С. и др. (2002). «Индукция тимидилатсинтазы как механизм устойчивости к 5-фторурацилу». Биохим. Биофиз. Акта . 1587 (2–3): 194–205. дои : 10.1016/S0925-4439(02)00082-0 . ПМИД 12084461 .
- Кости М.П., Тонди Д., Ринальди М. и др. (2002). «Структурные исследования видоспецифического ингибирования тимидилатсинтазы». Биохим. Биофиз. Акта . 1587 (2–3): 206–14. дои : 10.1016/s0925-4439(02)00083-2 . ПМИД 12084462 . S2CID 19676651 .
- Лин Д., Ли Х., Тан В. и др. (2007). Генетический полиморфизм ферментов, метаболизирующих фолаты, и риск рака желудочно-кишечного тракта: потенциальное взаимодействие генов и питательных веществ в развитии рака . Форум питания. Том. 60. С. 140–5. дои : 10.1159/000107090 . ISBN 978-3-8055-8216-2 . ПМИД 17684410 .
Внешние ссылки
[ редактировать ]- Тимидилат + синтетаза Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для тимидилатсинтазы человека.