Метилирование
Метилирование в химических науках — это добавление метильной группы к субстрату или замещение атома (или группы) метильной группой. Метилирование — это форма алкилирования , при которой метильная группа заменяет атом водорода . Эти термины широко используются в химии , биохимии , почвоведении и биологии .
В биологических метилирование катализируется ферментами ; системах такое метилирование может участвовать в модификации тяжелых металлов , регуляции экспрессии генов , регуляции функций белков и процессинге РНК . Метилирование образцов тканей in vitro также является способом уменьшения некоторых артефактов гистологического окрашивания . Обратной стороной метилирования является деметилирование .
В биологии
[ редактировать ]В биологических системах метилирование осуществляется ферментами. Метилирование может модифицировать тяжелые металлы и регулировать экспрессию генов, процессинг РНК и функцию белков. Это ключевой процесс, лежащий в основе эпигенетики . Источниками метильных групп являются S-метилметионин, метилфолат, метил В12. [1]
Метаногенез
[ редактировать ]Метаногенез , процесс образования метана из CO 2 , включает в себя серию реакций метилирования. Эти реакции вызываются набором ферментов, принадлежащих семейству анаэробных микробов. [2]

При обратном метаногенезе метилирующим агентом является метан. [3]
О-метилтрансферазы
[ редактировать ]Широкий спектр фенолов подвергается O-метилированию с образованием производных анизола . Этот процесс, катализируемый такими ферментами, как -КоА-О-метилтрансфераза , является ключевой реакцией в биосинтезе лигнолов , предшественников лигнина кофеоил , основного структурного компонента растений.
Растения производят флавоноиды и изофлавоны с метилированием гидроксильных групп, то есть метокси-связей . Это 5-О-метилирование влияет на растворимость флавоноида в воде. Примерами являются 5-О-метилгенистеин , 5-О-метилмирицетин и 5-О-метилкверцетин (азалеатин).
Белки
[ редактировать ]Наряду с убиквитинированием и фосфорилированием метилирование является основным биохимическим процессом модификации функции белка. Наиболее распространенные метилирования белков затрагивают аргинин и лизиновый остаток специфических гистонов. В противном случае метилированию подвержены гистидин, глутамат, аспарагин, цистеин. Некоторые из этих продуктов включают S -метилцистеин , два изомера N -метилгистидина и два изомера N -метиларгинина. [4]
Метионинсинтаза
[ редактировать ]
Метионинсинтаза регенерирует метионин (Met) из гомоцистеина (Hcy). Общая реакция превращает 5-метилтетрагидрофолат (N 5 -MeTHF) в тетрагидрофолат (THF) с переносом метильной группы на Hcy с образованием Met. Синтез метионина может быть кобаламин-зависимым и кобаламин-независимым: у растений есть и то, и другое, животные зависят от метилкобаламинозависимой формы.
В метилкобаламин-зависимых формах фермента реакция протекает в две стадии по типу реакции пинг-понга. Фермент первоначально переводится в реактивное состояние за счет переноса метильной группы от N 5 -MeTHF на Co(I) в фермент-связанном кобаламине ((Cob), также известном как витамин B12)),, образуя метилкобаламин (Me-Cob), который теперь содержит Me-Co(III), и активируя фермент. Затем Hcy, который координировался со связанным с ферментом цинком с образованием реактивного тиолата, вступает в реакцию с Me-Cob. Активированная метильная группа переносится от Me-Cob к тиолату Hcy, который регенерирует Co(I) в Cob, и Met высвобождается из фермента. [5]
Тяжелые металлы: мышьяк, ртуть, кадмий.
[ редактировать ]Биометилирование — это путь превращения некоторых тяжелых элементов в более мобильные или более смертоносные производные, которые могут попасть в пищевую цепь . Биометилирование мышьяка соединений начинается с образования метанарсонатов . Таким образом, трехвалентные неорганические соединения мышьяка метилируются с образованием метанарсоната. S-аденозилметионин является донором метила. Метанарсонаты являются предшественниками диметиларсонатов, опять же в результате цикла восстановления (до метиларсоновой кислоты) с последующим вторым метилированием. [6] Сходные пути обнаруживаются при микробном метилировании ртути в метилртуть .
Эпигенетическое метилирование
[ редактировать ]Метилирование ДНК
[ редактировать ]Метилирование ДНК — это превращение цитозина в 5-метилцитозин . Образование Me-CpG катализируется ферментом ДНК-метилтрансферазой . У позвоночных метилирование ДНК обычно происходит в сайтах CpG (сайты цитозин-фосфат-гуанин, то есть сайты, где за цитозином непосредственно следует гуанин в последовательности ДНК). У млекопитающих метилирование ДНК часто встречается в клетках организма. [7] и метилирование сайтов CpG, по-видимому, происходит по умолчанию. [8] [9] В ДНК человека около 80–90% сайтов CpG метилированы, но есть определенные области, известные как CpG-островки , богатые CG (высокое содержание цитозина и гуанина, состоящие примерно на 65% остатков CG ), в которых ни один из них не метилирован. . Они связаны с промоторами 56% генов млекопитающих, включая все повсеместно экспрессируемые гены . От одного до двух процентов генома человека составляют кластеры CpG, и существует обратная зависимость между метилированием CpG и транскрипционной активностью. Метилирование, способствующее эпигенетическому наследованию, может происходить либо посредством метилирования ДНК, либо метилирования белка. Неправильное метилирование генов человека может привести к развитию заболеваний. [10] [11] включая рак. [12] [13]
У медоносных пчел метилирование ДНК связано с альтернативным сплайсингом и регуляцией генов, согласно данным функциональных геномных исследований, опубликованных в 2013 году. [14] Кроме того, метилирование ДНК связано с изменениями экспрессии иммунных генов, когда медоносные пчелы находились под летальной вирусной инфекцией. [15] Было опубликовано несколько обзорных статей по темам метилирования ДНК у социальных насекомых. [16] [17]
Метилирование РНК
[ редактировать ]Метилирование РНК происходит у разных видов РНК, а именно. тРНК , рРНК , мРНК , тмРНК , мяРНК , мяРНК , микроРНК и вирусная РНК. Различные каталитические стратегии используются для метилирования РНК различными РНК-метилтрансферазами. Считается, что метилирование РНК существовало до метилирования ДНК на ранних формах жизни, развивающейся на Земле. [18]
N6-метиладенозин (m6A) является наиболее распространенной и распространенной модификацией метилирования молекул РНК (мРНК), присутствующей у эукариот. 5-метилцитозин (5-mC) также часто встречается в различных молекулах РНК. Недавние данные убедительно свидетельствуют о том, что метилирование РНК m6A и 5-mC влияет на регуляцию различных биологических процессов, таких как стабильность РНК и трансляция мРНК. [19] и что аномальное метилирование РНК способствует этиологии заболеваний человека. [20]
У социальных насекомых, таких как медоносные пчелы, метилирование РНК изучается как возможный эпигенетический механизм, лежащий в основе агрессии посредством реципрокных скрещиваний. [21]
Метилирование белка
[ редактировать ]Метилирование белка обычно происходит по остаткам аргинина или лизина аминокислотным в последовательности белка. [22] Аргинин может быть метилирован один раз (монометилированный аргинин) или дважды, либо обеими метильными группами на одном концевом азоте ( асимметричный диметиларгинин ), либо одной на обоих атомах азота (симметричный диметиларгинин), с помощью протеинаргининметилтрансфераз (PRMT). Лизин может быть метилирован один, два или три раза лизинметилтрансферазами . Метилирование белков наиболее изучено в гистонах . Перенос метильных групп от S-аденозилметионина к гистонам катализируется ферментами, известными как гистонметилтрансферазы . Гистоны, метилированные по определенным остаткам, могут действовать эпигенетически, подавляя или активируя экспрессию генов. [23] [24] Метилирование белка является одним из типов посттрансляционной модификации .
Эволюция
[ редактировать ]Метильный метаболизм очень древний и может быть обнаружен у всех организмов на Земле, от бактерий до человека, что указывает на важность метаболизма метила для физиологии. [25] Действительно, фармакологическое ингибирование глобального метилирования у человека, мыши, рыбы, мухи, круглых червей, растений, водорослей и цианобактерий вызывает одинаковые эффекты на их биологические ритмы, демонстрируя консервативную физиологическую роль метилирования в ходе эволюции. [26]
По химии
[ редактировать ]Термин метилирование в органической химии относится к процессу алкилирования, используемому для описания доставки Группа СН 3 . [27]
Электрофильное метилирование
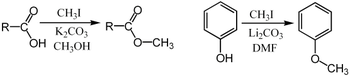
[ редактировать ]Метилирование обычно выполняется с использованием электрофильных источников метила, таких как йодметан . [28] диметилсульфат , [29] [30] диметилкарбонат , [31] или хлорид тетраметиламмония . [32] Менее распространенные, но более мощные (и более опасные) метилирующие реагенты включают метилтрифлат , [33] диазометан , [34] и метилфторсульфонат ( «магический метил» ). Все эти реагенты реагируют посредством S N 2 нуклеофильных замещений . Например, карбоксилат может быть метилирован кислородом с получением метилового эфира ; алкоксидная соль РО − также может быть метилирован с образованием эфира , РОЧ 3 ; кетона или енолят может быть метилирован по углероду с образованием нового кетона .
Метилирование по Пурди является специфическим для метилирования углеводов по кислороду с использованием йодметана и оксида серебра . [35]
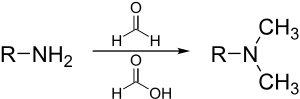
Метилирование Эшвейлера-Кларка
[ редактировать ]Реакция Эшвейлера -Кларка — метод метилирования аминов . [36] Этот метод позволяет избежать риска кватернизации , который возникает при метилировании аминов галогенидами метила.
Диазометан и триметилсилилдиазометан
[ редактировать ]Диазометан и более безопасный аналог триметилсилилдиазометан метилируют карбоновые кислоты, фенолы и даже спирты:
Преимущество метода состоит в том, что побочные продукты легко удаляются из смеси продуктов. [37]
Нуклеофильное метилирование
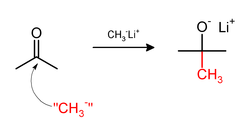
[ редактировать ]Метилирование иногда включает использование нуклеофильных метильных реагентов. Сильно нуклеофильные метилирующие агенты включают метиллитий ( CH3Li Li) [38] или реактивы Гриньяра, такие как бромид метилмагния ( СН 3 MgX ). [39] Например, CH 3 Li присоединяет метильные группы к карбонилу (C=O) кетонов и альдегидов.:
Более мягкие метилирующие агенты включают тетраметилолово , диметилцинк и триметилалюминий . [40]
См. также
[ редактировать ]Темы по биологии
[ редактировать ]- Бисульфитное секвенирование - биохимический метод, используемый для определения наличия или отсутствия метильных групп в последовательности ДНК.
- MethDB База данных метилирования ДНК
- Микромасштабный термофорез - биофизический метод определения состояния метилизации ДНК. [41]
- Реметилирование , обратимое удаление метильной группы в метионине и 5-метилцитозине.
Темы органической химии
[ редактировать ]- Алкилирование
- Метокси
- Метиленирование титана-цинка
- Реагент Петасис
- Реагент Нистеда
- Реакция Виттига
- реактив Теббе
Ссылки
[ редактировать ]- ^ Рэгсдейл, Стивен В. (2008). «Катализ переноса метильных групп с участием тетрагидрофолата и B12». Фолиевая кислота и фолаты . Витамины и гормоны. Том. 79. стр. 293–324. дои : 10.1016/S0083-6729(08)00410-X . ISBN 978-0-12-374232-2 . ПМК 3037834 . ПМИД 18804699 .
- ^ Тауэр, Р.К., «Биохимия метаногенеза: дань уважения Марджори Стивенсон», Microbiology, 1998, том 144, страницы 2377-2406.
- ^ Тиммерс, Пер ХА; Вельте, Корнелия У.; Кохорст, Джаспер Дж.; Плагг, Кэролайн М.; Джеттен, Майк С.М.; Стамс, Альфонс Дж. М. (2017). «Обратный метаногенез и дыхание метанотрофных архей» . Архея . 2017 : 1–22. дои : 10.1155/2017/1654237 . hdl : 1822/47121 .
- ^ Кларк, Стивен Г. (2018). «Рибосома: горячая точка для идентификации новых типов протеин-метилтрансфераз» . Журнал биологической химии . 293 (27): 10438–10446. дои : 10.1074/jbc.AW118.003235 . ПМК 6036201 . ПМИД 29743234 .
- ^ Мэтьюз, Р.Г.; Смит, А.Е.; Чжоу, З.С.; Таурог, РЭ; Бандарян, В.; Эванс, Дж. К.; Людвиг, М. (2003). «Кобаламин-зависимая и кобаламин-зависимая метионинсинтазы: есть ли два решения одной и той же химической проблемы?». Helvetica Chimica Acta . 86 (12): 3939–3954. дои : 10.1002/hlca.200390329 .
- ^ Стибло, М.; Дель Разо, LM; Вега, Л.; Гермолец, ДР; ЛеКлюиз, Эль; Гамильтон, Джорджия; Рид, В.; Ван, К.; Каллен, WR; Томас, диджей (2000). «Сравнительная токсичность трехвалентных и пятивалентных неорганических и метилированных мышьяков в клетках крысы и человека». Архив токсикологии . 74 (6): 289–299. дои : 10.1007/s002040000134 . ПМИД 11005674 . S2CID 1025140 .
- ^ Тост Дж (2010). «Метилирование ДНК: введение в биологию и связанные с болезнями изменения многообещающего биомаркера». Мол Биотехнолог . 44 (1): 71–81. дои : 10.1007/s12033-009-9216-2 . ПМИД 19842073 . S2CID 20307488 .
- ^ Листер Р., Пелиццола М., Дауэн Р.Х., Хокинс Р.Д., Хон Дж., Тонти-Филиппини Дж., Нери Дж.Р., Ли Л., Йе З., Нго К.М., Эдсолл Л., Антосевич-Бурже Дж., Стюарт Р., Руотти В., Миллар А.Х., Томсон JA, Рен Б., Экер-младший (ноябрь 2009 г.). «Метиломы ДНК человека при разрешении оснований демонстрируют широко распространенные эпигеномные различия» . Природа . 462 (7271): 315–22. Бибкод : 2009Natur.462..315L . дои : 10.1038/nature08514 . ПМК 2857523 . ПМИД 19829295 .
- ^ Стадлер М.Б., Мурр Р., Бургер Л., Иванек Р., Линерт Ф., Шелер А., ван Нимвеген Э., Вирбелауэр Дж., Окли Э.Дж., Гайдацис Д., Тивари В.К., Шюбелер Д. (декабрь 2011 г.). «ДНК-связывающие факторы формируют метилом мыши в дистальных регуляторных областях» . Природа . 480 (7378): 490–5. дои : 10.1038/nature11086 . ПМИД 22170606 .
- ^ Ротондо Х.К., Селватичи Р., Ди Доменико М., Марси Р., Веске Ф., Тоньон М., Мартини Ф. (сентябрь 2013 г.). «Потеря метилирования импринтированного гена H19 коррелирует с гиперметилированием промотора гена метилентетрагидрофолатредуктазы в образцах спермы бесплодных мужчин» . Эпигенетика . 8 (9): 990–7. дои : 10.4161/epi.25798 . ПМЦ 3883776 . ПМИД 23975186 .
- ^ Ротондо Х.К., Боси С., Баззан Э., Ди Доменико М., Де Маттеи М., Селватичи Р., Пателла А., Марси Р., Тоньон М., Мартини Ф (декабрь 2012 г.). «Гиперметилирование промотора гена метилентетрагидрофолатредуктазы в образцах спермы бесплодных пар коррелирует с рецидивирующими спонтанными абортами» . Репродукция человека . 27 (12): 3632–8. дои : 10.1093/humrep/des319 . hdl : 11392/1689715 . ПМИД 23010533 .
- ^ Ротондо Х.К., Борги А., Селватичи Р., Магри Е., Бьянкини Е., Монтинари Е., Корацца М., Виргили А., Тоньон М., Мартини Ф. (2016). «Вызванная гиперметилированием инактивация гена IRF6 как возможное раннее событие прогрессирования плоскоклеточного рака вульвы, связанного со склероатрофическим лишаем». JAMA Дерматология . 152 (8): 928–33. дои : 10.1001/jamadermatol.2016.1336 . ПМИД 27223861 .
- ^ Ротондо Х.К., Борги А., Селватичи Р., Маццони Э., Бонони И., Корацца М., Кусини Х., Монтинари Э., Гафа Р., Тоньон М., Мартини Ф. (2018). «Связь гена β-рецептора ретиноевой кислоты с возникновением и прогрессированием плоскоклеточного рака вульвы, связанного со склероатрофическим лишаем» . JAMA Дерматология . 154 (7): 819–823. дои : 10.1001/jamadermatol.2018.1373 . ПМК 6128494 . ПМИД 29898214 .
- ^ Ли-Бьярлай, Хунмей; Ли, Ян; Страуд, Хьюм; Фэн, Сухуа; Ньюман, Томас К.; Канеда, Меган; Хоу, Кирк К.; Уорли, Ким С.; Элсик, Кристина Г.; Виклайн, Сэмюэл А.; Якобсен, Стивен Э.; Ма, Цзянь; Робинсон, Джин Э. (30 июля 2013 г.). «Нокаут ДНК-метилтрансферазы 3 РНК-интерференцией влияет на альтернативный сплайсинг генов у медоносной пчелы» . Труды Национальной академии наук . 110 (31): 12750–12755. Бибкод : 2013PNAS..11012750L . дои : 10.1073/pnas.1310735110 . ПМЦ 3732956 . ПМИД 23852726 .
- ^ Ли-Бьярлай, Хунмей; Бонкристиани, Умберто; Хауэлл, Гэри; Герман, Джейк; Кларк, Линдси; Стрэнд, Мишлин К.; Тарпи, Дэвид; Рюппелл, Олав (24 сентября 2020 г.). «Транскриптомная и эпигеномная динамика медоносных пчел в ответ на летальную вирусную инфекцию» . Границы генетики . 11 . дои : 10.3389/fgene.2020.566320 . ПМЦ 7546774 . ПМИД 33101388 .
- ^ Ли-Бьярлай, Хунмэй (19 мая 2016 г.). «Функция меток метилирования ДНК у социальных насекомых» . Границы экологии и эволюции . 4 . дои : 10.3389/fevo.2016.00057 .
- ^ Ван, Ин; Ли-Бьярлай, Хунмэй (2015). Физиологические и молекулярные механизмы питания медоносных пчел . Достижения в физиологии насекомых. Том. 49. стр. 25–58. дои : 10.1016/bs.aiip.2015.06.002 . ISBN 978-0-12-802586-4 .
- ^ Рана, Аджай К.; Анкри, Серж (6 июня 2016 г.). «Возрождение мира РНК: взгляд на появление РНК-метилтрансфераз» . Границы генетики . 7:99 . дои : 10.3389/fgene.2016.00099 . ПМЦ 4893491 . ПМИД 27375676 .
- ^ Чой, Джунхонг; Йонг, Ка-Венг; Демирджи, Хасан; Чен, Джин; Петров, Алексей; Прабхакар, Арджун; О'Лири, Шон Э; Доминисини, Дэн; Рехави, Гидеон; Солтис, С. Майкл; Эренберг, Монс; Пуглиси, Джозеф Д. (февраль 2016 г.). «N6-метиладенозин в мРНК нарушает селекцию тРНК и динамику трансляции-элонгации» . Структурная и молекулярная биология природы . 23 (2): 110–115. дои : 10.1038/nsmb.3148 . ПМЦ 4826618 . ПМИД 26751643 .
- ^ Стюарт, Кендал (15 сентября 2017 г.). «Тестирование метилирования (MTHFR) и дефицит фолиевой кислоты» . Архивировано из оригинала 12 октября 2017 года . Проверено 11 октября 2017 г.
- ^ Бреснахан, Шон Т.; Ли, Эллен; Кларк, Линдси; Ма, Ронг; Ранхель, Джулиана; Грозингер, Кристина М.; Ли-Бьярлай, Хунмэй (12 июня 2023 г.). «Изучение влияния родительского происхождения на транскрипцию и метилирование РНК при опосредовании агрессивного поведения медоносных пчел (Apis mellifera)» . БМК Геномика . 24 (1): 315. doi : 10.1186/s12864-023-09411-4 . ПМЦ 10258952 . ПМИД 37308882 .
- ^ Уолш, Кристофер (2006). «Метилирование белка» . Посттрансляционная модификация белков: расширение запасов природы . Издатели Робертс и компания. стр. 121–149. ISBN 978-0-9747077-3-0 .
- ^ Гревал, Шив И.С.; Райс, Джадд С. (июнь 2004 г.). «Регуляция гетерохроматина посредством метилирования гистонов и малых РНК» . Современное мнение в области клеточной биологии . 16 (3): 230–238. дои : 10.1016/j.ceb.2004.04.002 . ПМИД 15145346 .
- ^ Накаяма, Дзюнъити; Райс, Джадд К.; Страл, Брайан Д.; Эллис, К. Дэвид; Гревал, Шив И.С. (6 апреля 2001 г.). «Роль метилирования гистона H3 лизина 9 в эпигенетическом контроле сборки гетерохроматина». Наука . 292 (5514): 110–113. Бибкод : 2001Sci...292..110N . дои : 10.1126/science.1060118 . ПМИД 11283354 .
- ^ Козбиал, Петр З; Мушегян, Аркадий Р. (декабрь 2005 г.). «Естественная история S-аденозилметионин-связывающих белков» . BMC Структурная биология . 5 (1): 19. дои : 10.1186/1472-6807-5-19 . ПМЦ 1282579 . ПМИД 16225687 .
- ^ Фустин, Жан-Мишель; Йе, Шики; Рейкерс, Кристин; Канеко, Кенсуке; Фукумото, Кадзуки; Ямано, Маю; Верстевен, Марийке; Грюневальд, Эллен; Каргилл, Саманта Дж.; Тамай, Т. Кэтрин; Сюй, Яо; Джаббур, Мария Луиза; Кодзима, Рика; Ламберти, Мелиса Л.; Ёсиока-Кобаяши, Кумико; Уитмор, Дэвид; Таммам, Стефани; Хауэлл, П. Линн; Кагеяма, Рёитиро; Мацуо, Такуя; Станевски, Ральф; Голомбек, Диего А.; Джонсон, Карл Хирши; Какея, Хидеаки; ван Оойен, Гербен; Окамура, Хитоши (6 мая 2020 г.). «Дефицит метилирования нарушает биологические ритмы, передаваемые от бактерий к человеку» . Коммуникационная биология . 3 (1): 211. дои : 10.1038/s42003-020-0942-0 . ПМК 7203018 . ПМИД 32376902 .
- ^ «Ароматическое замещение, нуклеофильное и металлоорганическое». Продвинутая органическая химия марта . 2006. стр. 853–933. дои : 10.1002/9780470084960.ch13 . ISBN 978-0-471-72091-1 .
- ^ Вяс, Г.Н.; Шах, Нью-Мексико (1951). «Монометиловый эфир хунинацетофенона». Органические синтезы . 31 : 90. дои : 10.15227/orgsyn.031.0090 .
- ^ Хиерс, Г.С. (1929). «Анизол». Органические синтезы . 9:12 . дои : 10.15227/orgsyn.009.0012 .
- ^ Айк, Роланд Н.; Редеманн, Эрнст; Уайзгарвер, Бернетт Б.; Аллес, Гордон А. (1949). «м-Метоксибензальдегид». Органические синтезы . 29:63 . дои : 10.15227/orgsyn.029.0063 .
- ^ Тундо, Пьетро; Сельва, Маурицио; Бомбен, Андреа (1999). «Моно-C-метилатион арилацетонитрилов и метиларилацетатов диметилкарбонатом: общий метод синтеза чистых 2-арилпропионовых кислот. 2-фенилпропионовая кислота». Органические синтезы . 76 : 169. дои : 10.15227/orgsyn.076.0169 .
- ^ Ненад, Мараш; Поланц, Словенко; Кочевар, Мариян (2008). «Микроволновое метилирование фенолов хлоридом тетраметиламмония в присутствии K 2 CO 3 или Cs 2 CO 3 ». Тетраэдр . 64 (51): 11618–11624. дои : 10.1016/j.tet.2008.10.024 .
- ^ Пун, Кевин У.К.; Альбиниак, Филип А.; Дадли, Грегори Б. (2007). «Защита спиртов с использованием трифторметансульфоната 2-бензилокси-1-метилпиридиния: метил (R)-(-)-3-бензилокси-2-метилпропаноат». Органические синтезы . 84 : 295. дои : 10.15227/orgsyn.084.0295 .
- ^ Ниман, М.; Джонсон, Уильям С. (1961). «Холестанилметиловый эфир». Органические синтезы . 41 :9. дои : 10.15227/orgsyn.041.0009 .
- ^ Перди, Т.; Ирвин, Дж. К. (1903). «С.? Алкилирование сахаров» . Журнал Химического общества, Сделки . 83 : 1021–1037. дои : 10.1039/CT9038301021 .
- ^ Айк, Роланд Н.; Уайзгарвер, Бернетт Б.; Аллес, Гордон А. (1945). «β-Фенилэтилдиметиламин». Органические синтезы . 25 : 89. дои : 10.15227/orgsyn.025.0089 .
- ^ Сиойри Т., Аояма Т., Сноуден Т. (2001). «Триметилсилилдиазометан». Энциклопедия реагентов для органического синтеза . Электронная энциклопедия реагентов для органического синтеза EROS . дои : 10.1002/047084289X.rt298.pub2 . ISBN 978-0-471-93623-7 .
- ^ Липски, Шэрон Д.; Холл, Стэн С. (1976). «Ароматические углеводороды из ароматических кетонов и альдегидов: 1,1-Дифенилэтан». Органические синтезы . 55 :7. дои : 10.15227/orgsyn.055.0007 .
- ^ Граммитт, Оливер; Беккер, Эрнест И. (1950). «Транс-1-фенил-1,3-бутадиен». Органические синтезы . 30:75 . дои : 10.15227/orgsyn.030.0075 .
- ^ Негиси, Эй-ичи; Мацусита, Хадзиме (1984). «Катализируемый палладием синтез 1,4-диенов путем аллилирования алкенилана: α-фарнезена». Органические синтезы . 62 : 31. дои : 10.15227/orgsyn.062.0031 .
- ^ Винкен С.Дж., Бааске П., Дур С., Браун Д. (2011). «Кривые термофоретического плавления количественно определяют конформацию и стабильность РНК и ДНК» . Исследования нуклеиновых кислот . 39 (8): е52. дои : 10.1093/nar/gkr035 . ПМК 3082908 . ПМИД 21297115 .
Внешние ссылки
[ редактировать ]- deltaMasses Обнаружение метилирования после масс-спектрометрии