Рацемизация
В химии соединения под воздействием рацемизация — это превращение оптически активного тепла или химической реакции в рацемическую (оптически неактивную) форму. Это создает молярное соотношение энантиомеров 1:1 и называется рацемической смесью (т.е. содержит равное количество форм (+) и (-). Плюсовая и минусовая формы называются праворотацией и леворотацией . [1] Энантиомеры D и L присутствуют в равных количествах, полученный образец описывается как рацемическая смесь или рацемат. Рацемизация может происходить по разным механизмам и имеет особое значение в фармакологии, поскольку разные энантиомеры могут оказывать разное фармацевтическое действие.
Стереохимия
[ редактировать ]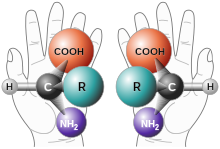
Хиральные молекулы имеют две формы (в каждой точке асимметрии), которые различаются своими оптическими характеристиками: левовращающая форма ( (-)-форма ) будет вращаться против часовой стрелки в плоскости поляризации луча света, тогда как правовращающая форма форма ( (+)-форма ) будет вращаться по часовой стрелке в плоскости поляризации луча света. [1] Две формы, которые не совмещаются при вращении в трехмерном пространстве, называются энантиомерами . Эти обозначения не следует путать с обозначениями молекул D и L , которые указывают на сходство структуры с D -глицеральдегидом и L -глицеральдегидом. Кроме того, ( R )- и ( S )- относятся к химической структуре молекулы, основанной на Кана-Ингольда-Прелога, приоритетных правилах именования а не на вращении света. Обозначение R/S сейчас является основным обозначением +/-, поскольку обозначения D и L используются в основном для сахаров и аминокислот. [2]
Рацемизация происходит, когда одна чистая форма энантиомера превращается в равную долю обоих энантиомеров, образуя рацемат . Когда имеется одинаковое количество правовращающих и левовращающих молекул, чистое оптическое вращение рацемата равно нулю. Энантиомеры также следует отличать от диастереомеров , которые представляют собой тип стереоизомеров, которые имеют разные молекулярные структуры вокруг стереоцентра и не являются зеркальными отражениями.
Частичная или полная рацемизация стереохимии в растворах является результатом механизмов SN1 . происходит полная инверсия стереохимической конфигурации Однако, когда в реакции замещения , реакция SN2 . ответственность за это несет [3]
Физические свойства
[ редактировать ]В твердом состоянии рацемические смеси могут иметь физические свойства, отличные от любого из чистых энантиомеров, из-за дифференциальных межмолекулярных взаимодействий (см. раздел «Биологическое значение»). Переход от чистого энантиомера к рацемату может изменить его плотность, температуру плавления, растворимость, теплоту плавления, показатель преломления и его различные спектры. Кристаллизация рацемата может привести к образованию отдельных (+) и (-) форм или к одному рацемическому соединению. Однако в жидком и газообразном состояниях рацемические смеси будут вести себя с физическими свойствами, идентичными или почти идентичными их чистым энантиомерам . [4]
Биологическое значение
[ редактировать ]В общем, большинство биохимических реакций стереоселективны, поэтому только один стереоизомер будет давать желаемый продукт, а другой просто не участвует или может вызывать побочные эффекты. Следует отметить, что форма L аминокислот и форма D сахаров (в первую очередь глюкозы) обычно являются биологически реактивной формой. Это связано с тем, что многие биологические молекулы хиральны и, таким образом, реакции между конкретными энантиомерами приводят к образованию чистых стереоизомеров. [5] Также примечателен тот факт, что все аминокислотные остатки существуют в L- форме. Однако бактерии производят остатки D -аминокислот, которые полимеризуются в короткие полипептиды, которые можно обнаружить в клеточных стенках бактерий. Эти полипептиды менее усваиваются пептидазами и синтезируются бактериальными ферментами вместо трансляции мРНК, которая обычно производит L -аминокислоты. [5]
Стереоселективный характер большинства биохимических реакций означал, что разные энантиомеры химического вещества могут иметь разные свойства и воздействие на человека. Многие психотропные препараты проявляют различную активность или эффективность в зависимости от изомера, например, амфетамин часто отпускают в виде рацемических солей, в то время как более активный декстроамфетамин резервируется для рефрактерных случаев или более тяжелых показаний; Другим примером является метадон , один изомер которого действует как опиоидный агонист, а другой – как антагонист NMDA . [6]
Рацемизация фармацевтических препаратов может происходить in vivo . Талидомид в виде ( R )-энантиомера эффективен против утренней тошноты , тогда как ( S )-энантиомер является тератогенным , вызывая врожденные дефекты при приеме в первом триместре беременности. Если человеку вводят только один энантиомер, обе формы позже могут быть обнаружены в сыворотке крови. [7] Таким образом, препарат не считается безопасным для использования женщинами детородного возраста, и, хотя он имеет и другие применения, его использование строго контролируется. [8] [9] Талидомид можно использовать для лечения множественной миеломы . [10]
Другим широко используемым препаратом является ибупрофен , который оказывает противовоспалительное действие только благодаря одному энантиомеру, тогда как другой биологически инертен. Аналогичным образом, стереоизомер ( S ) гораздо более реактивен, чем энантиомер ( R ) в циталопраме (Celexa), антидепрессанте, который ингибирует обратный захват серотонина. [11] [5] [12] Поэтому конфигурационная стабильность лекарственного средства представляет собой область интересов фармацевтических исследований. [13] Производство и анализ энантиомеров в фармацевтической промышленности изучается в области хирального органического синтеза.
Образование рацемических смесей
[ редактировать ]Рацемизации можно добиться, просто смешивая равные количества двух чистых энантиомеров. Рацемизация также может происходить при химическом взаимопревращении. Например, когда ( R )-3-фенил-2-бутанон растворяется в водном этаноле, содержащем NaOH или HCl , образуется рацемат. Рацемизация происходит посредством промежуточной енольной формы, в которой бывший стереоцентр становится плоским и, следовательно, ахиральным. [14] : 373 Входящая группа может приближаться с любой стороны плоскости, поэтому существует равная вероятность того, что протонирование обратно к хиральному кетону приведет к образованию либо R- , либо S -формы, что приведет к образованию рацемата.
Рацемизация может происходить посредством некоторых из следующих процессов:
- Реакции замещения, которые протекают через свободный промежуточный карбокатион , такие как реакции мономолекулярного замещения , приводят к нестереоспецифическому добавлению заместителей, что приводит к рацемизации.
- Хотя мономолекулярные реакции элиминирования также протекают через карбокатион, они не приводят к образованию хирального центра. Вместо этого они приводят к образованию набора геометрических изомеров , в которых транс / цис ( E / Z ) формы, а не рацематы. образуются
- В мономолекулярной реакции алифатического электрофильного замещения , если карбанион плоский или не может сохранять пирамидальную структуру, то должна произойти рацемизация, хотя и не всегда. [15] : 517–518
- В реакции свободнорадикального замещения , если образование свободного радикала происходит при хиральном углероде, то почти всегда наблюдается рацемизация. [15] : 610
Скорость рацемизации (от L -форм до смеси L -форм и D -форм) использовалась как способ датирования биологических образцов в тканях с медленной скоростью оборота, судебно-медицинских образцов и окаменелостей в геологических отложениях. Этот метод известен как аминокислотное датирование .
Открытие оптической активности
[ редактировать ]В 1843 году Луи Пастер обнаружил оптическую активность паравинной, или рацемической, кислоты, содержащейся в виноградном вине. Ему удалось разделить два кристалла энантиомера, которые вращали поляризованный свет в противоположных направлениях. [11]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Кеннеполь Д., Фармер С. (13 февраля 2019 г.). «6.7: Оптическая активность и рацемические смеси» . Химия LibreTexts . Проверено 16 ноября 2022 г.
- ^ Брукс В.Х., Гуида В.К., Дэниел К.Г. (2011). «Значение хиральности в дизайне и разработке лекарств» . Актуальные темы медицинской химии . 11 (7): 760–770. дои : 10.2174/156802611795165098 . ПМЦ 5765859 . ПМИД 21291399 .
- ^ Браун WH, Айверсон Б.Л., Анслин Э., Фут CS (2017). Органическая химия (Восьмое изд.). Бостон, Массачусетс: Cengage Learning. ISBN 978-1-337-51640-2 .
- ^ Митчелл АГ (1998). «Рацемические препараты: рацемическая смесь, рацемическое соединение или псевдорацемат?» (PDF) . Журнал фармации и фармацевтических наук . 1 (1): 8–12. ПМИД 10942967 .
- ^ Jump up to: а б с Voet D , Voet JG , Пратт CW (2013). Основы биохимии: жизнь на молекулярном уровне (4-е изд.). Хобокен, Нью-Джерси: John Wiley & Sons . ISBN 978-0-470-54784-7 .
- ^ Арнольд Л.Е., Вендер П.Х., Макклоски К., Снайдер Ш. (декабрь 1972 г.). «Левоамфетамин и декстроамфетамин: сравнительная эффективность при гиперкинетическом синдроме. Оценка по целевым симптомам». Архив общей психиатрии . 27 (6): 816–822. дои : 10.1001/archpsyc.1972.01750300078015 . ПМИД 4564954 .
- ^ Тео С.К., Колберн В.А., Трейсуэлл В.Г., Кук К.А., Стирлинг Д.И., Яворски М.С. и др. (2004). «Клиническая фармакокинетика талидомида». Клиническая фармакокинетика . 43 (5): 311–327. дои : 10.2165/00003088-200443050-00004 . ПМИД 15080764 . S2CID 37728304 .
- ^ Столберг С.Г. (17 июля 1998 г.). «Талидомид одобрен для лечения проказы, возможны и другие применения» . Нью-Йорк Таймс . Проверено 8 января 2012 г.
- ^ «Использование талидомида при проказе» . ВОЗ: Ликвидация проказы . Всемирная организация здравоохранения . Архивировано из оригинала 10 ноября 2006 года . Проверено 22 апреля 2010 г.
- ^ Мёлер Т.М., Хилленгасс Дж., Гласмахер А., Гольдшмидт Х. (декабрь 2006 г.). «Талидомид при множественной миеломе». Современная фармацевтическая биотехнология . 7 (6): 431–440. дои : 10.2174/138920106779116919 . ПМИД 17168659 .
- ^ Jump up to: а б Нельсон Д.Л., Кокс М.М. (2013). Ленингерские принципы биохимии (6-е изд.). Нью-Йорк: WH Freeman . ISBN 978-1-4292-3414-6 .
- ^ Жако С., Дэвид DJ, Гардье А.М., Санчес С. (2007). «[Эсциталопрам и циталопрам: неожиданная роль R-энантиомера]». Л'Энцефале . 33 (2): 179–187. дои : 10.1016/s0013-7006(07)91548-1 . ПМИД 17675913 .
- ^ Рейст М., Теста Б., Каррупт П.А. (2003). «Рацемизация лекарств и ее значение в фармацевтических исследованиях» . В: Эйхельбаум М.Ф., Теста Б., Сомоги А. (ред.). Стереохимические аспекты действия и распределения лекарственных средств . Справочник по экспериментальной фармакологии. Том. 153. С. 91–112. дои : 10.1007/978-3-642-55842-9_4 . ISBN 978-3-642-62575-6 .
- ^ Стрейтвизер А. , Хиткок CH (1985). Введение в органическую химию (3-е изд.). Максвелл Макмиллан . ISBN 978-0-02-946720-6 .
- ^ Jump up to: а б Марш Дж (1985). Передовая органическая химия: реакции, механизмы и структура (3-е изд.). Джон Уайли и сыновья . ISBN 978-0-471-85472-2 .