Хиральный дериватизирующий агент

В аналитической химии ( хиральный дериватизирующий агент CDA ) , также известный как хиральный разделяющий реагент , представляет собой реагент дериватизации , который представляет собой хиральное вспомогательное средство, используемое для преобразования смеси энантиомеров в диастереомеры с целью анализа количества каждого присутствующего энантиомера и определения оптическая чистота образца. Анализ можно проводить с помощью спектроскопии или хроматографии. Некоторые аналитические методы, такие как ВЭЖХ и ЯМР , в их наиболее распространенных формах не могут различать энантиомеры в образце, но могут различать диастереомеры. Следовательно, преобразование смеси энантиомеров в соответствующую смесь диастереомеров может позволить провести анализ. Использование хиральных производных агентов сократилось с популяризацией хиральной ВЭЖХ . Помимо анализа, хиральная дериватизация также используется для хирального разделения , фактического физического разделения энантиомеров.
История
[ редактировать ]С тех пор как химикам стала доступна ЯМР-спектроскопия, было проведено множество исследований по применению этого метода. Один из них отметил разницу в химическом сдвиге (т.е. расстоянии между пиками) двух диастереомеров. [1] И наоборот, два соединения, которые являются энантиомерами, имеют одинаковые спектральные свойства ЯМР. Было высказано предположение, что если бы смесь энантиомеров можно было превратить в смесь диастереомеров путем присоединения их к другому химическому веществу, которое само по себе было хиральным, можно было бы различить эту новую смесь с помощью ЯМР и, следовательно, узнать об исходной энантиомерной смеси. Первый популярный пример этой техники был опубликован в 1969 году Гарри С. Мошером . В качестве хирального агента использовался одиночный энантиомер МТПА (α-метокси-α-(трифторметил)фенилуксусной кислоты), также известный как кислота Мошера . [2] Соответствующий хлорангидрид также известен как хлорангидрид Мошера , а полученные диастереомерные эфиры известны как сложные эфиры Мошера. Другая система — Pirkle's Alcohol, разработанная в 1977 году.
Требования
[ редактировать ]Общее использование и конструкция CDA подчиняются следующим правилам, чтобы CDA мог эффективно определять стереохимию аналита: [3]
- CDA должен быть энантиомерно чистым или (что менее удовлетворительно) его энантиомерная чистота должна быть точно известна.
- Реакция ЦДА с обоими энантиомерами должна идти до конца в условиях реакции. Это позволяет избежать обогащения или истощения одного энантиомера аналита за счет кинетического разрешения.
- CDA не должен рацемизироваться в условиях дериватизации или анализа. Его прикрепление должно быть достаточно мягким, чтобы субстрат также не рацемизировался. Если анализ завершается методом ВЭЖХ, CDA должен содержать хромофор для улучшения обнаруживаемости.
- Если анализ завершается методом ЯМР, CDA должен иметь функциональную группу, которая дает синглет в результирующем спектре ЯМР, причем синглет должен быть удален от других пиков.
метод Мошера
[ редактировать ]Кислота Мошера через свое производное хлорангидрида легко реагирует со спиртами и аминами с образованием сложных эфиров и амидов соответственно. Отсутствие альфа-протона в кислоте предотвращает потерю стереохимической точности в условиях реакции. Таким образом, использование энантиомерно чистой кислоты Мошера позволяет определить конфигурацию простых хиральных аминов и спиртов . [4] Например, ( R )- и ( S )-энантиомеры 1-фенилэтанола реагируют с ( S )-хлоридом кислоты Мошера с образованием ( R , S )- и ( S , S )-диастереомеров соответственно, которые различаются по ЯМР. [5]
CFNA (альтернатива кислоте Мошера)
[ редактировать ]Новый хиральный дериватизирующий агент (CDA), α-циано-α-фтор(2-нафтил)уксусная кислота (2-CFNA), был получен в оптически чистой форме методом хиральной ВЭЖХ-разделения рацемического метилового эфира 2-CFNA. Этот эфир был получен фторированием метил-α-циано(2-нафтил)ацетата FClO3. Было показано, что 2-CFNA является более эффективным CDA, чем агент Мошера, для определения энантиомерного избытка первичного спирта. [6]
Хроматография с использованием CDA
[ редактировать ]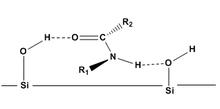
При реакции CDA с целевым аналитом хроматографию для разделения полученных продуктов можно использовать . В общем, хроматографию можно использовать для разделения хиральных соединений, чтобы обойти трудную кристаллизацию и/или собрать все пары диастереомеров в растворе. Хроматография также имеет множество разновидностей (например, ВЭЖХ , газовая хроматография , флэш-хроматография ) с широким спектром применимости к различным категориям молекул. Способность CDA разделять хиральные молекулы зависит от двух основных механизмов хроматографии: [7]
- Дифференциальная сольватация в подвижной фазе
- Дифференциальная адсорбция на неподвижной фазе
Постулаты Гельмхена
[ редактировать ]Постулаты Гельмхена [8] [9] — теоретические модели, используемые для прогнозирования порядка элюирования и степени разделения диастереомеров (в том числе образованных из CDA), адсорбированных на поверхности. Хотя постулаты Хельмхена специфичны для амидов на силикагеле с использованием жидкостной хроматографии, постулаты дают фундаментальные рекомендации для других молекул. Постулаты Гельмхена таковы:
- Конформации одинаковы в растворе и при адсорбции.
- Диастереомеры связываются с поверхностями (силикагель в нормально-фазовой хроматографии) главным образом с помощью водородных связей.
- Значительное разделение диастереомеров ожидается только в том случае, если молекулы смогут адсорбироваться на кремнеземе через две точки контакта (две водородные связи). Это взаимодействие может быть нарушено заместителями .
- Диастереомеры с объемистыми заместителями на альфа-углероде (R2) и азоте (R1) могут экранировать водородную связь с поверхностью, поэтому молекула будет элюироваться раньше, чем аналогичные молекулы с меньшими заместителями.
Доказано, что постулаты Гельмхена применимы и к другим функциональным группам, таким как: карбаматы , [7] сложные эфиры , [10] и эпоксиды . [11]
Хиральные стационарные фазы
[ редактировать ]Стационарные фазы могут реагировать с CDA с образованием хиральных стационарных фаз, которые могут расщеплять хиральные молекулы. [12] Реагируя со спиртами на силикатной неподвижной фазе, CDA добавляют хиральный центр к неподвижной фазе, что позволяет разделить хиральные молекулы.
CDA в ЯМР-спектроскопии
[ редактировать ]CDA используются вместе с ЯМР-спектроскопическим анализом для определения энантиомерного избытка и абсолютной конфигурации субстрата. Хиральные дискриминирующие агенты иногда трудно отличить от хиральных сольватирующих агентов (CSA), и некоторые агенты можно использовать в качестве обоих. Скорость обмена между подложкой и металлическим центром является наиболее важным определяющим фактором, позволяющим различать использование соединения в качестве CDA или CSA. Как правило, CDA имеет медленный обмен, тогда как CSA имеет быстрый обмен. [13] CDA более широко используются, чем CSA, для определения абсолютных конфигураций, поскольку ковалентная связь с субстратом и вспомогательным реагентом приводит к образованию частиц с большей конформационной жесткостью, что создает большие различия в спектрах ЯМР. [14] CDA и CSA можно использовать вместе для улучшения хирального распознавания, хотя это не является распространенным явлением.
Реагенты сдвига ЯМР, такие как EuFOD , спирт Пиркла и TRISPHAT, используют преимущество образования диастереомерных комплексов между реагентом сдвига и аналитическим образцом. [15]
Основные проблемы при использовании CDA
[ редактировать ]Основными проблемами, которые следует учитывать при использовании CDA в ЯМР-спектроскопии, являются кинетическое разрешение , рацемизация во время реакции дериватизации и то, что реагент должен иметь 100% оптическую чистоту. Кинетическое разрешение особенно важно при определении оптической чистоты, но оно несколько незначительно, когда CDA используется для определения абсолютной конфигурации оптически чистого субстрата. [13] Кинетическое разрешение можно преодолеть, используя избыток CDA. [16] Рацемизация может произойти как с CDA, так и с субстратом, и в обоих случаях она может существенно повлиять на результаты.
Стратегии ЯМР-анализа
[ редактировать ]Двумя основными методами ЯМР-анализа являются одинарная и двойная дериватизация. Двойная дериватизация обычно считается более точной, но однократная дериватизация обычно требует меньше реагентов и, следовательно, является более экономически эффективной.
Методы одиночной дериватизации
[ редактировать ]Спектр ЯМР продукта, образовавшегося в результате реакции субстрата с CDA при комнатной температуре, сравнивают с одним из следующих: [14]
- спектр той же производной при регистрации при более низкой температуре
- спектр того же производного после образования комплекса с солью металла
- спектр субстрата без дериватизации
Методы двойной дериватизации
[ редактировать ]Либо энантиомер субстрата дериватизируется двумя энантиомерами CDA, либо оба энантиомера субстрата дериватизируются одним энантиомером CDA. В обоих случаях образуются два диастереомера, и химические сдвиги их ядер оцениваются для определения конфигурации субстрата. [16]
методы ЯМР
[ редактировать ]Наиболее распространенными методами ЯМР, используемыми при распознавании хиральных соединений, являются 1 H-ЯМР, 19 F-ЯМР и 13 С-ЯМР. 1 H-ЯМР является основным методом, используемым для определения абсолютной конфигурации. 19 F-ЯМР применяется практически исключительно для исследования оптической чистоты. 13 С-ЯМР в основном используется для характеристики субстратов, не имеющих протонов, непосредственно связанных с асимметричным атомом углерода. [14]
Ссылки
[ редактировать ]- ^ Дж. Л. Матеос и ди-джей Крам (1959). «Исследования по стереохимии. XXXI. Конформация, конфигурация и физические свойства диастереомеров с открытой цепью». Дж. Ам. хим. Соц. 81 (11): 2756–2762. дои : 10.1021/ja01520a037 .
- ^ Дж. А. Дейл, Д. Л. Далл и Х. С. Мошер (1969). «α-Метокси-α-трифторметилфенилуксусная кислота — универсальный реагент для определения энантиомерного состава спиртов и аминов». Дж. Орг. хим. 34 (9): 2543–2549. дои : 10.1021/jo01261a013 .
- ^ Гоули, Роберт Э .; Обе, Джеффри (2012). Принципы асимметричного синтеза .
- ^ Д. Паркер (1991). «ЯМР-определение энантиомерной чистоты». хим. Откр. 91 (7): 1441–1457. дои : 10.1021/cr00007a009 .
- ^ Стереохимия и хиральные дериватизирующие агенты (PDF)
- ^ Новый эффективный дериватизирующий агент — альфа-циано-альфа-фтор(2-нафтил)уксусная кислота (2-CFNA). применение к ЭЭ-определению (-)-3-ацетокси-2-фтор-2-(гексадецилоксиметил)пропан-1-ола. , Тояма, Япония: Медицинский и фармацевтический университет Тоямы, 2000 г., архивировано с оригинала 5 июля 2013 г.
- ^ Перейти обратно: а б Пиркл, штат Вашингтон; Дж. Р. Хауске (1977). «Методы широкого спектра разделения оптических изомеров. Обсуждение причин хроматографического разделения некоторых диастереомерных карбаматов». Дж. Орг. Хим . 42 (11): 1839. doi : 10.1021/jo00431a004 .
- ^ Хельмхен, Г.; К. Чистый; Р. Отт (1972). «Целевое разделение и абсолютная конфигурация энантиомерных карбоновых кислот и аминов (1-е сообщение) Гюнтер Хельмхен». Буквы тетраэдра . 13 (37): 3873. doi : 10.1016/s0040-4039(01)94184-x .
- ^ Хельмхен, Г.; Г. Нилл; Д. Флокерзи; В. Шуле; МСК Юсеф (1979). «Препаративное направленное разрешение энантиомерных аминов с помощью жидкостной хроматографии диастереомерных 4-гидроксибутирамидов». Энджью. хим. Межд. Эд. англ . 18 (1): 62. дои : 10.1002/anie.197900651 .
- ^ Пиркл, штат Вашингтон; Дж. Р. Хауске (1977). «Разработка хиральных дериватизирующих агентов для хроматографического разделения оптических изомеров. Асимметричный синтез некоторых хиральных фторалкилированных аминов». Дж. Орг. Хим . 42 (14): 2436. doi : 10.1021/jo00434a019 .
- ^ Пиркл, штат Вашингтон; П. Л. Ринальди (1979). «Синтез и определение энантиомерной чистоты оптически активного эпоксидного диспарлюра, полового феромона непарного шелкопряда». Дж. Орг. Хим . 44 (7): 1025. doi : 10.1021/jo01321a001 .
- ^ Блашке, Г. (1980). «Хроматографическое разрешение рацематов. Новые аналитические методы (17)». Энджью. хим. Межд. Эд. англ . 19 (1): 13. дои : 10.1002/anie.198000131 .
- ^ Перейти обратно: а б Венцель, Томас Дж. Дискриминация хиральных соединений с помощью ЯМР-спектроскопии . John Wiley & Sons, Inc., стр. 1–7.
- ^ Перейти обратно: а б с Дж. М. Секо; Э. Киньоа; Р. Ригера* (июнь 2012 г.). «Задание абсолютной конфигурации полифункциональных соединений методом ЯМР с использованием хиральных дериватизирующих агентов». Химические обзоры . 112 (8): 4603–4641. дои : 10.1021/cr2003344 . ПМИД 22658125 .
- ^ Шастри, В.С.; Бюнцли, Жан-Клод; Рао, В. Рамачандра; Райуду, ГВС; Перумаредди, младший (2003). «Реагенты для ЯМР-сдвига лантаноидов». Современные аспекты редких земель и их комплексов . стр. 779–843. дои : 10.1016/B978-044451010-5/50024-9 . ISBN 9780444510105 .
- ^ Перейти обратно: а б Катажина М. Блажевская; Тадеуш Гайда (июль 2009 г.). «Определение абсолютной конфигурации гидрокси- и аминофосфонатов методом ЯМР-спектроскопии». Тетраэдр: Асимметрия . 20 (12): 1337–1361. дои : 10.1016/j.tetasy.2009.05.021 .