Энантиомер
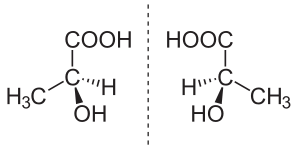
В химии ( — энантиомер /ɪˈnænti.əmər , ɛ-, -oʊ-/ [1] ih-NAN-tee-ə-mar ; от древнегреческого ἐναντίος (энантиос) «противоположность» и μέρος (мерос) «часть») – также называемый оптическим изомером , [2] антипод , [3] или оптический антипод [4] – один из двух стереоизомеров , которые не накладываются на свое зеркальное отражение . Энантиомеры друг друга очень похожи на правую и левую руки; без зеркального отображения одной из них руки невозможно наложить друг на друга. [5] Это исключительно соотношение хиральности и постоянных трехмерных отношений между молекулами или другими химическими структурами: никакая переориентация молекулы в целом или конформационные изменения не превращают одно химическое вещество в его энантиомер. Химические структуры с хиральностью вращают плоскополяризованный свет. [6] Смесь равных количеств каждого энантиомера, рацемическая смесь или рацемат , не вращает свет. [7] [8] [9]
Стереоизомеры включают как энантиомеры, так и диастереомеры . Диастереомеры, как и энантиомеры, имеют одну и ту же молекулярную формулу и не могут накладываться друг на друга; однако они не являются зеркальным отражением друг друга. [10]
Соглашения об именах [ править ]
Существует три общих соглашения об именах для указания одного из двух энантиомеров ( абсолютная конфигурация ) данной хиральной молекулы: система R/S основана на геометрии молекулы; система (+)- и (-)- (также записанная с использованием устаревших эквивалентов d- и l- ) основана на ее свойствах оптического вращения ; а система D / L основана на взаимосвязи молекулы с энантиомерами глицеральдегида .
Система R/S основана на геометрии молекулы относительно хирального центра. [11] Система R/S назначается молекуле на основе правил приоритета, установленных правилами приоритета Кана-Ингольда-Прелога , в которых группе или атому с наибольшим атомным номером присваивается наивысший приоритет, а группе или атому с наименьшим атомным номером. номеру присваивается самый низкий приоритет.
молекулы Символы (+) или (-) используются для обозначения оптического вращения — направления, в котором вращается поляризация света при прохождении через раствор, содержащий молекулу. [12] Когда молекулу называют правовращающей, она вращает плоскость поляризованного света по часовой стрелке и также может быть обозначена как (+). [11] Когда он обозначается как левовращающий, он вращает плоскость поляризованного света против часовой стрелки и также может быть обозначен как (-). [11]
Латинские слова, обозначающие «левый», — это laevus и sinister , а слово, обозначающее «правый», — «dexter» (или «rectus» в смысле «правильный» или «добродетельный»). Английское слово right является родственником слова «прямая мышца» . Отсюда и произошли обозначения D/L и R/S, а также использование префиксов лево- и декстро- в общих названиях .
Приставка ar- от латинского Recto (правый) применяется к правосторонней версии; es- , от латинского зловещего (слева) до левосторонней молекулы. [ нужна ссылка ] Пример: кетамин , аркетамин , эскетамин .
Центры хиральности [ править ]

Асимметричный атом называется центром киральности . [13] [14] разновидность стереоцентра . Центр хиральности также называют хиральным центром. [15] [16] [17] или асимметричный центр . [18] В некоторых источниках термины «стереоцентр» , «стереогенный центр» , «стереогенный атом» или «стереоген» используются исключительно для обозначения центра хиральности. [15] [17] [19] в то время как другие используют эти термины в более широком смысле для обозначения центров, которые приводят к образованию диастереомеров (стереоизомеров, которые не являются энантиомерами). [14] [20] [21]
Соединения, содержащие ровно один (или любое нечетное число) асимметричных атомов, всегда являются хиральными. Однако соединениям, которые содержат четное количество асимметричных атомов, иногда не хватает хиральности, поскольку они расположены зеркально-симметричными парами, и они известны мезосоединения как . Например, мезовинная кислота (показана справа) имеет два асимметрических атома углерода, но не проявляет энантиомерии, поскольку существует зеркальная плоскость симметрии. И наоборот, существуют формы киральности, которые не требуют асимметричных атомов, такие как аксиальная , плоская и спиральная хиральность. [15] : стр. 3
Несмотря на то, что хиральная молекула лишена отражательной (C s ) и роторно-отражательной симметрии (S 2 n ), она может иметь и другие молекулярные симметрии , и ее симметрия описывается одной из киральных точечных групп : C n , D n , T, O, или I. Например, перекись водорода является хиральной и имеет C 2 (двойную вращательную) симметрию. Обычным хиральным случаем является точечная группа C 1 , что означает отсутствие симметрии, как в случае молочной кислоты.
Примеры [ править ]

Примером такого энантиомера является седативный препарат талидомид , который продавался в ряде стран мира с 1957 по 1961 год. Он был снят с продажи, когда было обнаружено, что он вызывает врожденные дефекты. Один энантиомер вызывал желаемый седативный эффект, тогда как другой неизбежно вызывал [22] присутствующие в равных количествах, вызывают врожденные дефекты. [23]
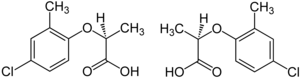
Гербицид ) мекопроп представляет собой рацемическую смесь, . гербицидной активностью которой обладает (R)-(+)-энантиомер («Мекопоп-П», «Дуплозан КВ» [24]
Другим примером являются антидепрессанты эсциталопрам и циталопрам . Циталопрам представляет собой рацемат [смесь ( S )-циталопрама и ( R )-циталопрама 1:1]; Эсциталопрам [( S )-циталопрам] представляет собой чистый энантиомер. Дозировки эсциталопрама обычно составляют половину доз циталопрама. Здесь (S)-циталопрам называется хиральным переключателем циталопрама.
Хиральные препараты [ править ]
Энантиочистые соединения состоят только из одного из двух энантиомеров. Энантиочистота имеет практическое значение, поскольку такие композиции обладают улучшенной терапевтической эффективностью. [25] Переход от рацемического препарата к энантиочистому препарату называется хиральным переключением . Во многих случаях энантиомеры оказывают различное действие. Одним из случаев является случай пропоксифена. Энантиомерная пара пропоксифена продается отдельно компанией Eli Lilly and Company. Одним из партнеров является декстропропоксифен , анальгетик (Дарвон), а другой называется левопропоксифен , эффективное противокашлевое средство (Новрад). [26] [27] Интересно отметить, что торговые названия препаратов ДАРВОН и НОВРАД также отражают зеркальное химическое соотношение. В других случаях клиническая польза для пациента может отсутствовать. В некоторых юрисдикциях одноэнантиомерные препараты патентуются отдельно от рацемической смеси. [28] Возможно, активен только один из энантиомеров. Или может быть, что оба активны, и в этом случае разделение смеси не имеет объективных преимуществ, но продлевает патентоспособность препарата. [29]
Энантиоселективные препараты [ править ]
При отсутствии эффективной энантиомерной среды ( прекурсора , хирального катализатора или кинетического разделения ) разделение рацемической смеси на энантиомерные компоненты невозможно, хотя некоторые рацемические смеси самопроизвольно кристаллизуются в виде рацемического конгломерата , в котором кристаллы энантиомеры физически разделены и могут быть разделены механически. Однако большинство рацематов образуют кристаллы, содержащие оба энантиомера в соотношении 1:1.
В своей новаторской работе Луи Пастер смог выделить изомеры тартрата натрия-аммония, поскольку отдельные энантиомеры кристаллизуются отдельно от раствора. Конечно, образуется равное количество энантиоморфных кристаллов, но два типа кристаллов можно разделить пинцетом. Такое поведение необычно. Менее распространенный метод — самодиспропорционирование энантиомеров .
Вторая стратегия — асимметричный синтез: использование различных методов для получения желаемого соединения с высоким энантиомерным избытком . Охваченные методы включают использование хиральных исходных материалов ( синтез хирального пула ), использование хиральных вспомогательных веществ и хиральных катализаторов , а также применение асимметричной индукции . Использование ферментов ( биокатализа ) также может привести к получению желаемого соединения.
Третья стратегия — энантиоконвергентный синтез , синтез одного энантиомера из рацемического предшественника с использованием обоих энантиомеров. При использовании хирального катализатора оба энантиомера реагента приводят к образованию одного энантиомера продукта. [30]
Энантиомеры не могут быть выделены, если существует доступный путь рацемизации (взаимное превращение энантиоморфов с образованием рацемической смеси) при заданной температуре и времени. Например, амины с тремя различными заместителями являются хиральными, но, за немногими исключениями (например, замещенными N -хлоразиридинами), они быстро подвергаются « зонтичной инверсии » при комнатной температуре, что приводит к рацемизации. Если рацемизация происходит достаточно быстро, молекулу часто можно рассматривать как ахиральную усредненную структуру.
Нарушение четности [ править ]
Фактически каждый энантиомер в паре имеет одинаковую энергию. Однако теоретическая физика предсказывает, что из-за нарушения четности слабого ядерного взаимодействия (единственной силы в природе, которая может «отличать лево от права») на самом деле существует небольшая разница в энергии между энантиомерами (порядка 10 −12 эВ или 10 −10 кДж/моль или менее) из-за механизма слабого нейтрального тока . Эта разница в энергии намного меньше, чем изменения энергии, вызванные даже небольшими изменениями в молекулярной конформации, и слишком мала, чтобы ее можно было измерить с помощью современной технологии, и поэтому химически несущественна. [16] [31] [32] В том смысле, который используют физики элементарных частиц, «истинный» энантиомер молекулы, который имеет точно такое же содержание массы-энергии, что и исходная молекула, представляет собой зеркальное отражение, которое также построено из антиматерии (антипротонов, антинейтронов и позитронов). . [16] В этой статье термин «энантиомер» используется только в химическом смысле соединений обычного вещества, которые не накладываются на свое зеркальное отражение.
Квази -энантиомеры [ править ]
Квазиэнантиомеры — это молекулярные виды, которые не являются строго энантиомерами, но ведут себя так, как если бы они были таковыми. В квази -энантиомерах отражается большая часть молекулы; однако атом или группа внутри молекулы заменяются аналогичным атомом или группой. [33] Квази -энантиомеры также можно определить как молекулы, которые могут стать энантиомерами, если в молекуле заменяется атом или группа. [34] Примером квази -энантиомеров могут быть ( S )-бромбутан и ( R )-йодбутан. В нормальных условиях энантиомеры ( S )-бромбутана и ( R )-йодбутана будут ( R) -бромбутаном и ( S )-йодбутаном соответственно. Квази -энантиомеры также могут образовывать квази-рацематы, которые подобны нормальным рацематам (см. Рацемическая смесь ) тем, что они образуют равную смесь квази -энантиомеров. [33]
Хотя квазиэнантиомеры не считаются реальными энантиомерами, соглашение об именах квазиэнантиомеров также следует той же тенденции, что и энантиомеры, если рассматривать конфигурации ( R ) и ( S ), которые рассматриваются на геометрической основе (см. Правила приоритета Кана-Ингольда-Прелога ).
Квазиэнантиомеры находят применение в параллельном кинетическом разрешении . [35]
См. также [ править ]
Ссылки [ править ]
- ^ «Энантиомер: определение и значение» . Словарь.com . Проверено 26 апреля 2024 г.
- ^ Химия (ИЮПАК), Международный союз теоретической и прикладной химии. «ИЮПАК – оптические изомеры (О04308)» . goldbook.iupac.org . дои : 10.1351/goldbook.O04308 . Проверено 17 ноября 2022 г.
- ^ Химия (ИЮПАК), Международный союз теоретической и прикладной химии. «ИЮПАК – антиподы (А00403)» . goldbook.iupac.org . дои : 10.1351/goldbook.A00403 . Проверено 17 ноября 2022 г.
- ^ Химия (ИЮПАК), Международный союз теоретической и прикладной химии. «ИЮПАК – оптические антиподы (О04304)» . goldbook.iupac.org . дои : 10.1351/goldbook.O04304 . Проверено 17 ноября 2022 г.
- ^ МакКонати, Джонатан; Оуэнс, Майкл Дж. (2003). «Стереохимия в действии наркотиков» . Сопутствующий журнал первичной медико-санитарной помощи журнала клинической психиатрии . 5 (2): 70–73. дои : 10.4088/pcc.v05n0202 . ISSN 1523-5998 . ПМК 353039 . ПМИД 15156233 .
- ^ «Хиральность и оптическая активность» . chemed.chem.purdue.edu . Проверено 17 ноября 2022 г.
- ^ Химия (ИЮПАК), Международный союз теоретической и прикладной химии. «ИЮПАК - рацемический (R05026)» . goldbook.iupac.org . дои : 10.1351/goldbook.R05026 . Проверено 17 ноября 2022 г.
- ^ Химия (ИЮПАК), Международный союз теоретической и прикладной химии. «ИЮПАК - рацемат (R05025)» . goldbook.iupac.org . дои : 10.1351/goldbook.R05025 . Проверено 17 ноября 2022 г.
- ^ Вебер, Эрин. «Библиотечные справочники: CHEM 221: Стереохимия / Изомерия» . Libraryguides.salisbury.edu . Проверено 17 ноября 2022 г.
- ^ Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Jump up to: Перейти обратно: а б с Брюстер, Джеймс Х. (декабрь 1986 г.). «Различие диастереомеров в обозначениях Кана-Ингольда-Прелога (RS)» . Журнал органической химии . 51 (25): 4751–4753. дои : 10.1021/jo00375a001 . ISSN 0022-3263 .
- ^ Колдуэлл, Джон; Вайнер, Ирвинг В. (декабрь 2001 г.). «Стереохимия: определения и примечания к номенклатуре» . Психофармакология человека: клиническая и экспериментальная . 16 (С2): С105–С107. дои : 10.1002/hup.334 . ISSN 0885-6222 . ПМИД 12404716 . S2CID 12367578 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Центр хиральности ». doi : 10.1351/goldbook.C01060
- ^ Jump up to: Перейти обратно: а б Уэйд, Лерой Г. (2006). «Точность в стереохимической терминологии». Дж. Хим. Образование . 83 (12): 1793. Бибкод : 2006JChEd..83.1793W . дои : 10.1021/ed083p1793 . ISSN 0021-9584 .
- ^ Jump up to: Перейти обратно: а б с Каррас, Манфред (2018). «Синтез энантиомерно чистых спиральных ароматических соединений, таких как NHC-лиганды, и их использование в асимметричном катализе (доктор философии). Карлов университет . Получено 6 августа 2021 г.
- ^ Jump up to: Перейти обратно: а б с Элиэль, Эрнест Л.; Вилен, Сэмюэл Х.; Мандер, Льюис Н. (1994). Стереохимия органических соединений . Нью-Йорк: Уайли. ISBN 0471016705 . ОСЛК 27642721 .
- ^ Jump up to: Перейти обратно: а б Клейден, Джонатан; Гривз, Ник; Уоррен, Стюарт Г. (2012). Органическая химия . Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-927029-3 . OCLC 761379371 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Онлайн исправленная версия: (2006–) « Асимметричный центр ». doi : 10.1351/goldbook.A00480
- ^ Кларк, Эндрю; Китсон, Рассел Р.А.; Мистри, Нимеш; Тейлор, Пол; Тейлор, Мэтью; Ллойд, Майкл; Акамунэ, Кэролайн (2021). Введение в стереохимию . Кембридж, Великобритания. ISBN 978-1-78801-315-4 . OCLC 1180250839 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Онлайн-исправленная версия: (2006–) « Стереогенная единица (стереоген/стереоэлемент) ». doi : 10.1351/goldbook.S05980
- ^ Мислоу, Курт; Сигел, Джей (1984). «Стереоизомерия и локальная хиральность». Дж. Ам. хим. Соц . 106 (11): 3319–3328. дои : 10.1021/ja00323a043 . ISSN 0002-7863 .
- ^ Кноче, Б; Блашке, Г. (1994). «Исследования по рацемизации талидомида in vitro методом высокоэффективной жидкостной хроматографии». Журнал хроматографии А. 666 (1–2): 235–240. дои : 10.1016/0021-9673(94)80385-4 .
- ^ Воэт, Дональд; Воэт, Джудит Г.; Пратт, Шарлотта В. (2006). Основы биохимии . п. 89 . ISBN 0-471-21495-7 .
- ^ Г. Смит; КХЛ Кеннард; А.Х. Белый; П.Г. Ходжсон (апрель 1980 г.). «(±)-2-(4-Хлор-2-метилфенокси)пропионовая кислота (мекопроп)». Акта Кристаллогр. Б. 36 (4): 992–994. дои : 10.1107/S0567740880005134 .
- ^ Ариенс, Эверардус Дж. (1986). «Стереохимия: источник проблем медицинской химии» . Обзоры медицинских исследований . 6 (4): 451–466. дои : 10.1002/med.2610060404 . ISSN 0198-6325 . ПМИД 3534485 . S2CID 36115871 .
- ^ Дрейер, Деннис Э (1986). «Фармакодинамические и фармакокинетические различия между энантиомерами лекарств у человека: обзор» . Клиническая фармакология и терапия . 40 (2): 125–133. дои : 10.1038/clpt.1986.150 . ISSN 0009-9236 . ПМИД 3731675 . S2CID 33537650 .
- ^ Ариенс, Э.Дж. (1989). Хиральное разделение методом ВЭЖХ . Чичестер: Эллис Хорввод. стр. 31–68.
- ^ «Европейское агентство по лекарственным средствам – Sepracor Pharmaceuticals Ltd отзывает заявку на получение регистрационного удостоверения на препарат Лунивия (эсзопиклон)» . www.ema.europa.eu . 17 сентября 2018 г. Архивировано из оригинала 1 декабря 2017 г. Проверено 14 февраля 2011 г.
- ^ Меррилл Гузнер (2004). Таблетка стоимостью 800 миллионов долларов: правда о стоимости новых лекарств (отрывок) . Издательство Калифорнийского университета. ISBN 0-520-23945-8 .
- ^ Мор, Дж. Т.; Мур, Дж. Т.; Штольц, Б.М. (2016). «Энантиоконвергентный катализ» . Байльштейн Дж. Орг. Хим . 12 : 2038–2045. дои : 10.3762/bjoc.12.192 . ПМК 5082454 . ПМИД 27829909 . Проверено 4 августа 2021 г.
- ^ Альберт, Гихарро (2008). Происхождение хиральности в молекулах жизни: пересмотр от осознания текущих теорий и перспектив этой нерешенной проблемы . Да, Мигель. Кембридж, Великобритания: Королевское химическое общество. ISBN 9781847558756 . OCLC 319518566 .
- ^ Стиклер, Бенджамин А.; Дикманн, Мира; Бергер, Роберт; Ван, Дацин (14 сентября 2021 г.). «Энантиомерные суперпозиции в результате интерференции материи и волн хиральных молекул» . Физический обзор X . 11 (3): 031056. arXiv : 2102.06124 . Бибкод : 2021PhRvX..11c1056S . дои : 10.1103/PhysRevX.11.031056 . ISSN 2160-3308 . S2CID 231879820 .
- ^ Jump up to: Перейти обратно: а б Чжан, Цишэн; Ривкин, Алексей; Карран, Деннис П. (1 мая 2002 г.). «Квазирацемический синтез: концепции и реализация с использованием стратегии фтористой метки для получения энантиомеров пиридоверицина и маппицина» . Журнал Американского химического общества . 124 (20): 5774–5781. дои : 10.1021/ja025606x . ISSN 0002-7863 . ПМИД 12010052 .
- ^ Чжан, Цишэн; Карран, Деннис П. (19 августа 2005 г.). «Квазиэнантиомеры и квазирацематы: новые инструменты для идентификации, анализа, разделения и синтеза энантиомеров» . Химия - Европейский журнал . 11 (17): 4866–4880. дои : 10.1002/chem.200500076 . ISSN 0947-6539 . ПМИД 15915521 .
- ^ Г.С. Кумбаридес, М. Дингжан, Дж. Имс, А. Флинн, Дж. Нортен и Ю. Йоханнес, Tetrahedron Lett. 46 (2005), с. 2897 год
Внешние ссылки [ править ]
 СМИ, связанные с энантиомерами, на Викискладе?
СМИ, связанные с энантиомерами, на Викискладе? - химвики:стереоизомерия