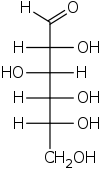
Проекция Фишера
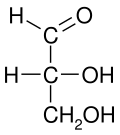

В химии проекция Фишера , разработанная Эмилем Фишером в 1891 году, представляет собой двумерное представление трехмерной органической молекулы посредством проекции . Проекции Фишера первоначально были предложены для изображения углеводов и использовались химиками, особенно в области органической химии и биохимии . Использование проекций Фишера для неуглеводных продуктов не рекомендуется, поскольку такие рисунки неоднозначны и их легко спутать с другими типами рисунков. Основная цель проекций Фишера — показать хиральность молекулы и различить пару энантиомеров. Некоторые известные применения включают рисование сахаров и изображение изомеров. [1]
Конвенции
[ редактировать ]Все связи изображаются горизонтальными или вертикальными линиями. Углеродная цепь изображается вертикально, атомы углерода иногда не показаны и представлены центром пересекающихся линий (см. рисунок ниже). Ориентация углеродной цепи такова, что первый углерод (C1) находится вверху. [2] В альдозе C1 — углерод альдегидной группы; в кетозе C1 — это углерод, ближайший к кетоновой группе, которая обычно находится у C2. [3]
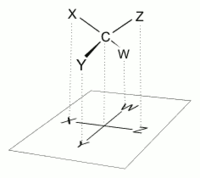
Правильный способ просмотра проекции Фишера — это вертикально ориентировать молекулу относительно углеродной цепи, чтобы все горизонтальные связи были направлены к зрителю, а все вертикальные связи были направлены от наблюдателя. [4] Молекулы с простой тетраэдрической геометрией можно легко вращать в пространстве, так что это условие выполняется (см. рисунки). Проекции Фишера обычно строятся, начиная с представления козла. Для этого все соединения с атомами углерода основной цепи необходимо повернуть так, чтобы полученные проекции Ньюмана показали затменную конфигурацию. [2] Затем углеродная цепь располагается вертикально вверх, причем все горизонтальные крепления направлены к зрителю. [2] Наконец, присоединения к атомам углерода основной цепи, обращенные от наблюдателя, размещаются в вертикальном положении проекции Фишера, а те, которые обращены к наблюдателю, размещаются в горизонтальном положении проекции Фишера. [4] Каждое пересечение горизонтальной и вертикальной линий в проекции Фишера представляет собой углерод в основной углеродной цепи. [2]
В некоторых случаях проекции Фишера являются эффективным представлением трехмерной молекулярной конфигурации. Например, моносахарид с тремя атомами углерода ( триоза ), такой как D- глицериновый альдегид , изображенный выше, имеет тетраэдрическую геометрию с C2 в его центре и может вращаться в пространстве так, что углеродная цепь расположена вертикально с C1 в центре. вверху, а горизонтальные связи, соединяющие C2 с водородом и гидроксидом, наклонены к зрителю.
Однако при создании проекции Фишера для моносахарида с числом атомов углерода более трех невозможно сориентировать молекулу в пространстве так, чтобы все горизонтальные связи были наклонены к зрителю. После поворота молекулы так, чтобы обе горизонтальные связи с C2 были наклонены к зрителю, горизонтальные связи с C3 обычно будут наклонены в сторону. Итак, после образования связей с С2, прежде чем провести связи с С3, молекулу необходимо повернуть в пространстве на 180° вокруг своей вертикальной оси. Для завершения рисунка могут потребоваться дальнейшие подобные вращения.
Это означает, что в большинстве случаев проекция Фишера не является точным представлением фактической трехмерной конфигурации молекулы. Его можно рассматривать как проекцию модифицированной версии молекулы, идеально перекрученной на нескольких уровнях вдоль ее основной цепи. Например, с открытой цепью молекула D- глюкозы повернулась так, что горизонтальные связи с C2 были наклонены к зрителю, а связи с C3 и C5 были бы наклонены в сторону от зрителя, и, следовательно, ее точная проекция не совпадала бы с Проекция Фишера. Для более точного представления с открытой цепью молекулы проекцию Натта можно использовать .
Согласно правилам ИЮПАК, все атомы водорода желательно изображать явно; в частности, должны присутствовать атомы водорода концевой группы углеводов. [5] В этом отношении проекция Фишера отличается от скелетных формул .
Хиральность
[ редактировать ]Хиральные молекулы можно охарактеризовать как молекулы с набором стереоизомеров или левых и правых энантиомеров . По определению лорда Кельвина , молекула обладает хиральностью, «если ее изображение в плоском зеркале, идеально реализованное, не может быть совмещено с самим собой». Другими словами, хиральная молекула асимметрична в том смысле, что ее зеркальное отражение не будет точной копией самой себя. [6] Хиральность является ключом к пониманию во многих областях, таких как разработка лекарств, поскольку один энантиомер лекарства может вызывать серьезные побочные эффекты, в то время как другой обеспечивает облегчение недуга. [7] Это важно с точки зрения проекций Фишера, поскольку хиральность является важным фактором, который следует учитывать как при их рисовании, так и при чтении. Большим преимуществом модели является возможность легко интерпретировать хиральность на основе ориентации заместителей. Небольшие изменения в форматировании этих моделей могут привести к другой интерпретации стереохимии , что означает, что молекула изображена неправильно. Проекции Фишера помогают визуализировать хиральность, а также расположение заместителей в пространстве, поэтому их применение может быть полезно для многих.
Хиральность из проекции
[ редактировать ]Определение киральности на основе проекций Фишера фактически такое же, как и стандартный метод. Основное отличие заключается в том, что проекции Фишера позволяют отображать ориентацию заместителей вертикальными и горизонтальными линиями. Учитывая, что ориентация этих молекул уже известна, при необходимости ее можно корректно изобразить клиньями и черточками. После этого ранжируется приоритет каждой из групп, связанных с углеродом, и стандартным образом определяется хиральность. [8] Хотя в реальном процессе определения хиральности нет существенной разницы, проекции Фишера позволяют лучше визуализировать расположение заместителей в пространстве, что делает удобным определение S- или R-хиральности на основе этой модели. [ сомнительно – обсудить ] . В некоторых случаях может быть полезно нарисовать проекцию Фишера для более крупной молекулы, чтобы визуализировать и определить хиральность конкретного углерода.
Другие модели
[ редактировать ]Проекции Хаворта — это родственные химические обозначения, используемые для представления сахаров в форме кольца. Группы в правой части проекции Фишера эквивалентны группам под плоскостью кольца в проекциях Хаворта. [9] Проекции Фишера не следует путать со структурами Льюиса , которые не содержат никакой информации о трехмерной геометрии . Проекции Ньюмана — еще одна система, которую можно использовать, поскольку они демонстрируют структуру молекулы в шахматном или затменном конформационном состоянии. [10] Обозначения клином и тире помогут продемонстрировать стереохимию внутри конкретной молекулы.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Грегерсен Э. «Проекция Фишера | Определение и факты» . Британская энциклопедия . Проверено 17 ноября 2022 г.
- ^ Jump up to: а б с д Морено Л.Ф. (январь 2012 г.). «Понимание проекции Фишера и преобразования представления угловых линий». Журнал химического образования . 89 (1): 175–176. Бибкод : 2012ЮЧЭд..89..175М . дои : 10.1021/ed101011c . ISSN 0021-9584 .
- ^ Вольфрам М.Л. и др. (Номенклатурный комитет Отделения химии углеводов Американского химического общества и Британский комитет по номенклатуре углеводов [подкомитет Публикационного комитета Химического общества (Лондон)]) (февраль 1963 г.). «Правила номенклатуры углеводов». Журнал органической химии . 28 (2): 281–291. дои : 10.1021/jo01037a001 . ISSN 0022-3263 .
- ^ Jump up to: а б Охота I (2022). «Глава 3: Конформации алканов и циклоалканов» . Проверено 16 ноября 2022 г.
- ^ Бречер Дж. (январь 2006 г.). «Графическое представление стереохимической конфигурации (Рекомендации ИЮПАК 2006 г.)» (PDF) . Чистая и прикладная химия . 78 (10): 1897–1970 (1933–1934). дои : 10.1351/pac200678101897 . S2CID 97528124 .
- ^ Деринг А., Ушакова Е., Рогач А.Л. (март 2022 г.). «Хиральные углеродные точки: синтез, оптические свойства и новые применения» . Свет: наука и приложения . 11 (1): 75. Бибкод : 2022LSA....11...75D . дои : 10.1038/s41377-022-00764-1 . ПМЦ 8964749 . ПМИД 35351850 .
- ^ Хатт А.Дж., О'Грейди Дж. (январь 1996 г.). «Хиральность лекарств: рассмотрение значения стереохимии противомикробных препаратов» . Журнал антимикробной химиотерапии . 37 (1): 7–32. дои : 10.1093/jac/37.1.7 . ПМИД 8647776 .
- ^ Эплинг Г.А. (август 1982 г.). «Определение конфигурации хиральной молекулы в проекциях Фишера». Журнал химического образования . 59 (8): 650. Бибкод : 1982JChEd..59..650E . дои : 10.1021/ed059p650 . ISSN 0021-9584 .
- ^ Мэтьюз К.К., Ван Холде К.Э., Ахерн К.Г. (2000). Биохимия (3-е изд.). Сан-Франциско, Калифорния: Бенджамин Каммингс. ISBN 978-0-8053-3066-3 .
- ^ Элиэль Э.Л., Вилен Ш., Мандер Л.Н. (1994). Стереохимия органических соединений . Нью-Йорк: Уайли. ISBN 978-0-471-01670-0 . ОСЛК 27642721 .