Альдоза
Альдоза связанными со — это моносахарид (простой сахар) с углеродной основной цепью с карбонильной группой на крайнем атоме углерода, что делает его альдегидом , и гидроксильными группами, всеми остальными атомами углерода. Альдозы можно отличить от кетоз , у которых карбонильная группа находится далеко от конца молекулы и, следовательно, являются кетонами .
Структура
[ редактировать ]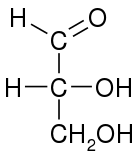
Как и большинство углеводов, простые альдозы имеют общую химическую формулу C n (H 2 O) n . Поскольку формальдегид (n=1) и гликольальдегид (n=2) обычно не считаются углеводами, [1] Простейшей возможной альдозой является триоза- глицеральдегид , который содержит только три углерода атома . [2]
Поскольку у них есть по крайней мере один асимметричный углеродный центр, все альдозы проявляют стереоизомерию . Альдозы могут существовать как в D -форме, так и в L -форме. Определение делается на основе киральности асимметричного углерода, наиболее удаленного от альдегидного конца, а именно второго с конца углерода в цепи. Альдозы со спиртовыми группами справа от проекции Фишера представляют собой D -альдозы, а со спиртами слева — L -альдозы. D -альдозы в природе более распространены, чем L -альдозы. [1]
Примеры альдоз включают глицеральдегид , эритрозу , рибозу , глюкозу и галактозу . Кетозы и альдозы можно химически дифференцировать с помощью теста Селиванова , при котором образец нагревается с кислотой и резорцином . [3] Тест основан на реакции дегидратации , которая происходит быстрее в кетозах, так что, хотя альдозы реагируют медленно, образуя светло-розовый цвет, кетозы реагируют быстрее и сильнее, образуя темно-красный цвет.
Альдозы могут изомеризоваться в кетозы посредством превращения Лобри-де Брюйна-ван Экенштейна .
Номенклатура и распространенные альдозы
[ редактировать ]
Альдозы различают по числу атомов углерода в основной цепи. Минимальное количество атомов углерода в основной цепи, необходимое для образования молекулы, которая по-прежнему считается углеводом, составляет 3, а углеводы с тремя атомами углерода называются триозами. Единственной альдотриозой является глицеральдегид , имеющий один хиральный стереоцентр с двумя возможными энантиомерами, D- и L -глицеральдегидом.
Некоторые распространенные альдозы:
- Триоза : глицеральдегид
- Тетрозы : эритроза , треоза.
- Пентозы : рибоза , арабиноза , ксилоза , ликсоза.
- Гексозы : глюкоза
Наиболее часто обсуждаемой категорией альдоз являются альдозы с шестью атомами углерода, альдогексозы . Некоторые альдогексозы, которые широко называются общими именами: [4]
- D -(+)- Аллоза
- Д -(+)- Другое
- D -(+)- Глюкоза
- D -(+)- Манноза
- D -(-)- Чревоугодие
- D -(+)- Идоза
- D -(+)- Галактоза
- D -(+)- Талоза
Стереохимия
[ редактировать ]Альдозы обычно называют названиями, специфичными для одного стереоизомера соединения. Это различие особенно важно в биохимии, поскольку многие системы могут использовать только один энантиомер углевода, а не другой. Однако альдозы не привязаны к какой-либо одной конформации: они могут колебаться и колеблются между разными формами.
Альдозы могут таутомеризоваться в кетозы в динамическом процессе с промежуточным енолом (точнее, эндиолом). [1] Этот процесс обратим, поэтому можно считать, что альдозы и кетозы находятся в равновесии друг с другом. Однако альдегиды и кетоны почти всегда более стабильны, чем соответствующие енольные формы, поэтому обычно преобладают альдо- и кето-формы. Этот процесс с участием енольного промежуточного соединения также допускает стереоизомеризацию. Базовые растворы ускоряют взаимное превращение изомеров.
Углеводы с более чем четырьмя атомами углерода существуют в равновесии между замкнутым кольцом или циклической формой и формой с открытой цепью. Циклические альдозы обычно изображаются как проекции Хауорта , а формы с открытой цепью обычно изображаются как проекции Фишера , обе из которых представляют важную стереохимическую информацию о формах, которые они изображают. [1]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Мэтьюз, Кристофер К. (2000). Биохимия . Ван Холд, К.Э. (Кенсал Эдвард), 1928-, Ахерн, Кевин Г. (3-е изд.). Сан-Франциско, Калифорния: Бенджамин Каммингс. стр. 280–293. ISBN 0805330666 . OCLC 42290721 .
- ^ Берг, Дж. М. (2006). Биохимия (6-е изд.). Нью-Йорк: WH Freeman and Company.
- ^ «Тест Селиванова» . Харпер Колледж. Архивировано из оригинала 16 декабря 2017 г. Проверено 10 июля 2011 г.
- ^ Соломоновы, Т.В. Грэм (2008). Органическая химия . John Wiley & Sons Inc. с. 1044.