Акарбоза
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Глюкобай, Прекоза, Прандаза |
| Другие имена | (2 R ,3 R ,4 R ,5 S ,6 R )-5-{[(2 R ,3 R ,4 R ,5 S ,6 R )-5- {[(2 R ,3 R ,4 S , 5S ,6R ) -3,4-дигидрокси-6-метил-5-{[(1S , 4R , 5S , 6S ) -4,5,6-тригидрокси-3-(гидроксиметил) циклогекс-2-ен-1-ил]амино}тетрагидро- 2H- пиран-2-ил]окси}-3,4-дигидрокси-6-(гидроксиметил)тетрагидро-2H - пиран-2-ил]окси} - 6-(гидроксиметил)тетрагидро-2Н - пиран-2,3,4-триол |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а696015 |
| Данные лицензии | |
| Беременность категория |
|
| Маршруты администрация | Через рот |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Фармакокинетические данные | |
| Биодоступность | Чрезвычайно низкий |
| Метаболизм | Желудочно-кишечный тракт |
| Период полувыведения | 2 часа |
| Экскреция | Почки (менее 2%) |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ИЮФАР/БПС | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.054.555 |
| Химические и физические данные | |
| Формула | С 25 Н 43 Н О 18 |
| Молярная масса | 645.608 g·mol −1 |
| 3D model ( JSmol ) | |
| (проверять) | |
Акарбоза ( МНН ) [1] [2] — противодиабетический препарат, используемый для лечения сахарного диабета 2 типа и, в некоторых странах, предиабета . Это дженерик, продаваемый в Европе и Китае под названием Glucobay ( Bayer AG ), в Северной Америке под названием Precose ( Bayer Pharmaceuticals ) и в Канаде под названием Prandase ( Bayer AG ).
Акарбоза – блокатор крахмала. Он действует путем ингибирования альфа-глюкозидазы , кишечного фермента, который высвобождает глюкозу из более крупных углеводов, таких как крахмал и сахароза . Он состоит из акарвиозинового фрагмента с мальтозой на восстанавливающем конце. Он может разлагаться рядом кишечных бактерий . [3]
Акарбоза дешева и популярна в Китае, но не в США. Один врач объясняет, что ее использование в США ограничено, поскольку она недостаточно эффективна, чтобы оправдать побочные эффекты в виде диареи и метеоризма. [4] Однако в 2013 году крупное исследование пришло к выводу, что «акарбоза эффективна, безопасна и хорошо переносится большой группой азиатских пациентов с диабетом 2 типа». [5] Возможным объяснением различных мнений является наблюдение, что акарбоза значительно более эффективна у пациентов, соблюдающих восточную диету с относительно высоким содержанием крахмала. [6]
Медицинское использование
[ редактировать ]Дозирование
[ редактировать ]Поскольку акарбоза препятствует перевариванию сложных углеводов, препарат следует принимать в начале основного приема пищи (с первым укусом еды). [7]
Эффективность
[ редактировать ]У пациентов с диабетом II типа акарбоза в среднем приводит к абсолютному снижению на 0,8 процентных пункта HbA 1c , что представляет собой снижение примерно на 10% типичных значений HbA 1c в исследованиях диабета. [8] Лица с более высокими исходными уровнями демонстрируют более высокое снижение, примерно на 0,12% дополнительного снижения для каждой точки исходного уровня HbA 1c . [8] Его влияние на постпрандиальную глюкозу, но не на HbA 1c , зависит от дозы. [8] У пациентов с диабетом акарбоза может помочь уменьшить повреждение кровеносных сосудов и почек за счет снижения уровня глюкозы. [8]
В Кокрейновском систематическом обзоре оценивался эффект ингибиторов альфа-глюкозидазы у людей с предиабетом , определяемый как нарушение толерантности к глюкозе, нарушение уровня глюкозы в крови натощак , повышенный уровень гликированного гемоглобина A1c (HbA 1c ). [9] Было обнаружено, что акарбоза снижает заболеваемость сахарным диабетом 2 типа по сравнению с плацебо, однако не было убедительных доказательств того, что акарбоза по сравнению с диетой и физическими упражнениями, метформином , плацебо или отсутствием вмешательства улучшала смертность от всех причин , снижала или повышенный риск сердечно-сосудистой смертности, серьезных или несерьезных нежелательных явлений, несмертельного инсульта , застойной сердечной недостаточности или несмертельного инфаркта миокарда . [9]
Комбинированная терапия
[ редактировать ]Комбинация акарбозы с метформином приводит к более значительному снижению уровня HbA1c , уровня глюкозы в крови натощак и постпрандиальной глюкозы, чем любой из препаратов по отдельности. [10]
Побочные эффекты
[ редактировать ]Поскольку акарбоза предотвращает расщепление сложных углеводов на глюкозу, некоторая часть углеводов остается в кишечнике и доставляется в толстую кишку . В толстой кишке бактерии переваривают ( ферментируют ) сложные углеводы, вызывая побочные эффекты со стороны желудочно-кишечного тракта, такие как метеоризм (78% пациентов) и диарея (14% пациентов). Поскольку эти эффекты зависят от дозы, обычно рекомендуется начинать с низкой дозы и постепенно увеличивать дозу до желаемой величины. Одно исследование показало, что побочные эффекты со стороны желудочно-кишечного тракта значительно уменьшились (с 50% до 15%) в течение 24 недель даже при постоянном приеме. [11] Сахароза чаще вызывает побочные эффекты со стороны желудочно-кишечного тракта, чем крахмал. [8]
Если у пациента, принимающего акарбозу, возник приступ гипогликемии , пациент должен съесть что-нибудь, содержащее моносахариды , например, таблетки или гель глюкозы (GlucoBurst, Insta-Glucose, Glutose, Level One), и следует вызвать врача. Поскольку акарбоза блокирует расщепление столового сахара и других сложных сахаров, фруктовые соки или крахмалистые продукты не смогут эффективно обратить вспять эпизод гипогликемии у пациента, принимающего акарбозу. [12] Акарбоза сама по себе несет минимальный риск гипогликемии. [8]
Акарбоза очень редко связана с повышением трансаминаз (19 из 500 000). [8] еще более редких случаях гепатита Сообщалось о при использовании акарбозы. Обычно оно проходит после прекращения приема лекарства. Ферменты печени следует проверять до и во время применения этого лекарства в качестве меры предосторожности. [13] Метаанализ 2016 года подтверждает, что ингибиторы альфа-глюкозидазы, включая акарбозу, имеют статистически значимую связь с повышенным уровнем трансаминаз. [14]
Фармакология
[ редактировать ]Механизм действия
[ редактировать ]Акарбоза ингибирует ферменты ( гликозидгидролазы ), необходимые для переваривания углеводов , в частности, ферменты альфа-глюкозидазы в щеточной кайме тонкого кишечника и альфа-амилазу поджелудочной железы . Он блокирует ферменты, имитируя переходное состояние субстрата с его аминной связью. [15] Однако бактериальные альфа-амилазы кишечного микробиома способны расщеплять акарбозу. [16] [17] [18]
Панкреатическая альфа-амилаза гидролизует сложные крахмалы до олигосахаридов в просвете тонкого кишечника, тогда как мембраносвязанные кишечные альфа-глюкозидазы гидролизуют олигосахариды , трисахариды и дисахариды до глюкозы и других моносахаридов в тонком кишечнике. Ингибирование этих ферментных систем снижает скорость переваривания сложных углеводов. Меньше глюкозы усваивается, поскольку углеводы не расщепляются на молекулы глюкозы. У пациентов с диабетом краткосрочный эффект этой лекарственной терапии заключается в снижении текущего уровня глюкозы в крови; долгосрочный эффект – снижение уровня HbA 1c . [19]
Метаболизм
[ редактировать ]Деградация акарбозы является уникальной особенностью гликозидгидролаз в микробиоте кишечника , акарбозодеградирующей глюкозидазы , которая гидролизует акарбозу до акарвиозина-глюкозы и глюкозы. [18] Человеческие ферменты действительно трансформируют акарбозу: альфа-амилаза поджелудочной железы способна выполнять реакцию перегруппировки , перемещая единицу глюкозы из «хвоста» мальтозы в «голову» молекулы. Аналоговые препараты, у которых «хвостовая» глюкоза удалена или перевернута на связь α(1-6), сопротивляются этой трансформации. [15]
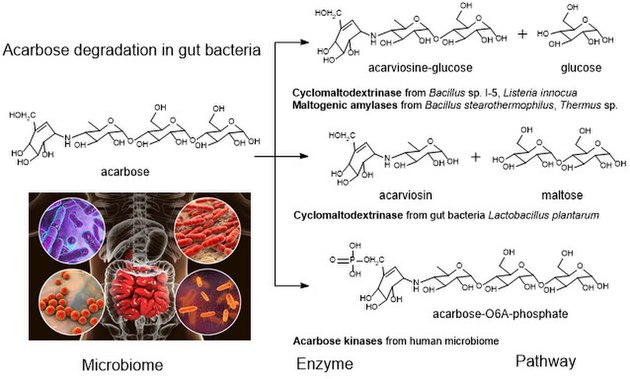
Сообщалось, что альфа-амилаза Thermus мальтогенная sp. IM6501 (ThMA) и циклодекстриназа (CDase) из Streptococcus pyogenes могут гидролизовать акарбозу до глюкозы и акарвиозин-глюкозы, ThMA может дополнительно гидролизовать акарвиозин-глюкозу до акарвиозина и глюкозы. [20] [21] Цикломальтодекстриназа ( CDase ) из кишечных бактерий Lactobacillus plantarum разлагала акарбозу двумя различными способами с образованием мальтозы и акарвиозина , а также глюкозы и акарвиозин-глюкозы, что позволяет предположить, что устойчивость к акарбозе вызвана микробиомом человека. [3] Акарбозокиназы, происходящие из микробиома, также специфичны к фосфорилированию и инактивации акарбозы. [22] Молекулярное моделирование показало взаимодействие между кишечной бактериальной глюкозидазой, разлагающей акарбозу, и α-амилазой человека. [23]

Естественное распространение
[ редактировать ]В природе акарбоза синтезируется почвенными бактериями Actinoplanes sp через предшественник валиенамин . [24] Акарбоза также разлагается кишечными бактериями Lactobacillus plantarum и почвенными бактериями Thermus разлагающих акарбозу sp под действием глюкозидаз, .
В молекулярной биологии
[ редактировать ]Акарбоза химически описывается как псевдотетрасахарид . [25] в частности, ингибитор, имитирующий мальтотетраозу . Как ингибитор, имитирующий некоторые природные субстраты, он полезен для выяснения структуры ферментов, расщепляющих сахар, путем связывания в том же кармане. [26]
Исследовать
[ редактировать ]У людей с СД2 акарбоза снижает общий уровень триглицеридов. [27] Акарбоза оказывает аналогичный эффект у пациентов без СД2 с изолированной семейной гипертриглицеридемией . [8]
В небольших выборках здоровых добровольцев акарбоза повышает постпрандиальные уровни GLP-1 . [8]
В исследованиях, проведенных тремя независимыми лабораториями в рамках Национального института старения США программы интервенционного тестирования , было показано, что акарбоза продлевает продолжительность жизни самок мышей на 5% и самцов мышей на 22%. [28] [29]
Ссылки
[ редактировать ]- ^ Элкс Дж., Ганеллин С.Р., ред. (1990). Словарь лекарств: Химические данные: Химические данные, структуры и библиография . Спрингер. стр. 1–. дои : 10.1007/978-1-4757-2085-3 . ISBN 978-1-4757-2085-3 .
- ^ «Международные непатентованные наименования фармацевтических веществ. Рекомендуемые международные непатентованные наименования (Рек. МНН): Список 19» (PDF) . Всемирная организация здравоохранения. 1979 год . Проверено 9 ноября 2016 г.
- ^ Jump up to: а б Чан МЮ, Кан Х.Дж., Чон С.К., Кан Ю, Пак Дж.Э., Ким ТиДжей (февраль 2018 г.). «Функциональная экспрессия и ферментативная характеристика цикломальтодекстриназы Lactobacillus plantarum, катализирующей новый гидролиз акарбозы». Журнал микробиологии . 56 (2): 113–118. дои : 10.1007/s12275-018-7551-3 . ПМИД 29392561 . S2CID 2660911 .
- ^ Кресге Н. (21 ноября 2011 г.). «Жажда Китая в новых лекарствах от диабета угрожает лидерству Bayer» . Деловая неделя Блумберга. Архивировано из оригинала 21 ноября 2011 года . Проверено 15 апреля 2016 г.
- ^ Чжан В., Ким Д., Филип Э., Миян З., Барыкина И., Шмидт Б., Штейн Х. (апрель 2013 г.). «Многонациональное наблюдательное исследование по изучению эффективности, безопасности и переносимости акарбозы в качестве дополнительной или монотерапии у ряда пациентов: исследование Gluco VIP». Клиническое исследование лекарственных средств . 33 (4): 263–274. дои : 10.1007/s40261-013-0063-3 . ПМИД 23435929 . S2CID 207483590 .
- ^ Чжу Ц, Тонг Ю, Ву Т, Ли Дж, Тонг Н (июнь 2013 г.). «Сравнение гипогликемического эффекта монотерапии акарбозой у пациентов с сахарным диабетом 2 типа, придерживающихся восточной или западной диеты: систематический метаанализ». Клиническая терапия . 35 (6): 880–899. doi : 10.1016/j.clinthera.2013.03.020 . ПМИД 23602502 .
- ^ Розак С., Ницше Г., Кениг П., Хофманн У. (ноябрь 1995 г.). «Влияние времени и введения акарбозы на постпрандиальную гипергликемию». Диабетическая медицина . 12 (11): 979–984. дои : 10.1111/j.1464-5491.1995.tb00409.x . ПМИД 8582130 . S2CID 36582205 .
- ^ Jump up to: а б с д и ж г час я ДиНиколантонио Дж.Дж., Бутани Дж., О'Киф Дж.Х. (2015). «Акарбоза: безопасна и эффективна для снижения постпрандиальной гипергликемии и улучшения сердечно-сосудистых исходов» . Открытое сердце . 2 (1): e000327. doi : 10.1136/openhrt-2015-000327 . ПМК 4620230 . ПМИД 26512331 .
- ^ Jump up to: а б Моландс С.В., Лукассен П.Л., Аккерманс Р.П., Де Грау В.Дж., Ван де Лаар Ф.А. и др. (Кокрейновская группа по метаболическим и эндокринным расстройствам) (декабрь 2018 г.). «Ингибиторы альфа-глюкозидазы для профилактики или замедления развития сахарного диабета 2 типа и связанных с ним осложнений у людей с повышенным риском развития сахарного диабета 2 типа» . Кокрановская база данных систематических обзоров . 2018 (12): CD005061. дои : 10.1002/14651858.CD005061.pub3 . ПМК 6517235 . ПМИД 30592787 .
- ^ Хедрингтон М.С., Дэвис С.Н. (декабрь 2019 г.). «Соображения при использовании ингибиторов альфа-глюкозидазы при лечении диабета 2 типа». Экспертное заключение по фармакотерапии . 20 (18): 2229–2235. дои : 10.1080/14656566.2019.1672660 . ПМИД 31593486 . S2CID 203985605 .
- ^ Хоффманн Дж., Шпенглер М. (декабрь 1997 г.). «Эффективность 24-недельной монотерапии акарбозой, метформином или плацебо у пациентов с ИНСД, получающих диетическое лечение: исследование Essen-II». Американский медицинский журнал . 103 (6): 483–490. дои : 10.1016/S0002-9343(97)00252-0 . ПМИД 9428831 .
- ^ «Акарбоза» . Информация о лекарствах MedlinePlus .
- ^ «Акарбоза: гепатит: Франция, Испания» . Информационный бюллетень ВОЗ по фармацевтическим препаратам . 1999. Архивировано из оригинала 15 октября 2009 года.
- ^ Чжан Л., Чен Ц., Ли Л., Квонг Дж.С., Цзя П., Чжао П. и др. (сентябрь 2016 г.). «Ингибиторы альфа-глюкозидазы и гепатотоксичность при диабете 2 типа: систематический обзор и метаанализ» . Научные отчеты . 6 (1): 32649. Бибкод : 2016NatSR...632649Z . дои : 10.1038/srep32649 . ПМК 5011653 . ПМИД 27596383 .
- ^ Jump up to: а б Ли С., Бегум А., Нумао С., Парк К.Х., Уизерс С.Г., Брайер Г.Д. (март 2005 г.). «Механизм перегруппировки акарбозы, предполагаемый кинетическим и структурным анализом альфа-амилазы поджелудочной железы человека в комплексе с аналогами и их удлиненными аналогами». Биохимия . 44 (9): 3347–3357. дои : 10.1021/bi048334e . ПМИД 15736945 .
- ^ Пак К.Х., Ким М.Дж., Ли Х.С., Хан Н.С., Ким Д., Робит Дж.Ф. (декабрь 1998 г.). «Реакции трансгликозилирования мальтогенной амилазы Bacillus stearothermophilus с акарбозой и различными акцепторами». Исследование углеводов . 313 (3–4): 235–246. дои : 10.1016/S0008-6215(98)00276-6 . ПМИД 10209866 .
- ^ О СВ, Чан МЮ, Чон С.К., Кан Х.Дж., Пак Дж.М., Ким ТиДжей (август 2008 г.). «Модуляция активности гидролиза и трансгликозилирования мальтогенной амилазы Thermus путем комбинаторного насыщающего мутагенеза» . Журнал микробиологии и биотехнологии . 18 (8): 1401–1407. ПМИД 18756100 .
- ^ Jump up to: а б Ким Т.Дж., Ким М.Дж., Ким Б.С., Ким Дж.С., Чеонг Т.К., Ким Дж.В., Пак К.Х. (апрель 1999 г.). «Способы действия гидролиза и трансгликозилирования акарбозы, катализируемые термостабильной мальтогенной амилазой, ген которой был клонирован из штамма Thermus» . Прикладная и экологическая микробиология . 65 (4): 1644–1651. Бибкод : 1999ApEnM..65.1644K . дои : 10.1128/АЕМ.65.4.1644-1651.1999 . ПМК 91232 . ПМИД 10103262 .
- ^ Лекарственная терапия в сестринском деле , 2-е издание.
- ^ Чан МЮ, Кан Х.Дж., Чон С.К., О Г.В., Ли Э.Х., Сон Б.С., Ким Ти.Дж. (2017). «Функциональная экспрессия и ферментативная характеристика цикломальтодекстриназы Streptococcus pyogenes». Корейский журнал микробиологии . 53 (3): 208–215. дои : 10.7845/kjm.2017.7062 . ISSN 0440-2413 .
- ^ Пэк Дж.С., Ким Х.И., Эбботт Т.П., Мун Т.В., Ли С.Б., Парк К.С., Пак К.Х. (март 2003 г.). «Акарвиозин-симмондсин, новое соединение, полученное из акарвиозина-глюкозы и симмондсина с помощью мальтогенной амилазы Thermus, и его влияние in vivo на потребление пищи и гипергликемию» . Бионауки, биотехнологии и биохимия . 67 (3): 532–539. дои : 10.1271/bbb.67.532 . ПМИД 12723600 . S2CID 2813481 .
- ^ Балайч Дж., Эстрелла М., Ву Дж., Джеффри П.Д., Бисвас А., Чжао Л. и др. (декабрь 2021 г.). «Микробиом человека кодирует устойчивость к противодиабетическому препарату акарбозе» . Природа . 600 (7887): 110–115. Бибкод : 2021Natur.600..110B . дои : 10.1038/s41586-021-04091-0 . ПМЦ 10258454 . ПМИД 34819672 . S2CID 244644880 .
- ^ Парк К.Х. (2006). «Функция и третичная и четвертичная структура циклодекстрин-гидролизующих ферментов (CDase), группы мультисубстратных специфических ферментов, принадлежащих к семейству α-амилаз» . Журнал прикладной гликонауки . 53 (1): 35–44. дои : 10.5458/jag.53.35 . ISSN 1344-7882 . S2CID 86894203 .
- ^ Цунода Т., Самади А., Бураде С., Махмуд Т. (июнь 2022 г.). «Полный путь биосинтеза противодиабетического препарата акарбозы» . Природные коммуникации . 13 (1): 3455. Бибкод : 2022NatCo..13.3455T . дои : 10.1038/s41467-022-31232-4 . ПМК 9200736 . ПМИД 35705566 .
- ^ Бозоннет С., Йенсен М.Т., Нильсен М.М., Агаджари Н., Йенсен М.Х., Крамхофт Б. и др. (октябрь 2007 г.). «Сайт «пара щипцов для сахара» на некаталитическом домене C альфа-амилазы ячменя участвует в связывании и активности субстрата». Журнал ФЭБС . 274 (19): 5055–5067. дои : 10.1111/j.1742-4658.2007.06024.x . ПМИД 17803687 . S2CID 25592455 .
- ^ Миядзаки Т., Park EY (июнь 2020 г.). «Структурно-функциональный анализ сахарозогидролазы тутового шелкопряда раскрывает механизм субстратной специфичности 17 экзо -α-глюкозидаз подсемейства GH13» . Журнал биологической химии . 295 (26): 8784–8797. дои : 10.1074/jbc.RA120.013595 . ПМЦ 7324511 . ПМИД 32381508 .
- ^ Юсефи М., Фатех С.Т., Никбаф-Шандиз М., Голами Ф., Растгу С., Багер Р. и др. (ноябрь 2023 г.). «Влияние акарбозы на липидный профиль у взрослых: систематический обзор и метаанализ рандомизированных клинических исследований» . BMC Фармакология и токсикология . 24 (1): 65. дои : 10.1186/s40360-023-00706-6 . ПМЦ 10664642 . ПМИД 37990256 .
- ^ Харрисон Д.Э., Стронг Р., Эллисон Д.Б., Эймс Б.Н., Астл К.М., Атамна Х. и др. (апрель 2014 г.). «Акарбоза, 17-альфа-эстрадиол и нордигидрогваяретовая кислота продлевают продолжительность жизни мышей преимущественно у самцов» . Стареющая клетка . 13 (2): 273–282. дои : 10.1111/acel.12170 . ПМЦ 3954939 . ПМИД 24245565 .
- ^ Ладиж В., Лиггитт Д. (2017). «Тестирование комбинаций препаратов для замедления старения» . Патобиология старения и возрастных заболеваний . 8 (1): 1407203. doi : 10.1080/20010001.2017.1407203 . ПМК 5706479 . ПМИД 29291036 .
Внешние ссылки
[ редактировать ]- «Исследование поджелудочной железы» - Крейг Д. Рид, доктор философии. (Потребительская статья FDA США)