агонист PPAR
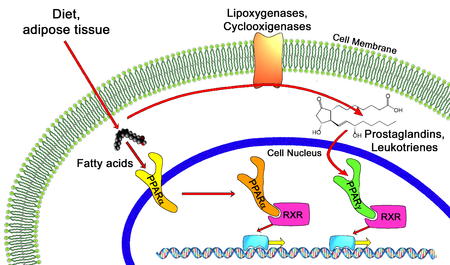
Агонисты PPAR — это препараты , которые действуют на рецептор, активирующий пролифератор пероксисом . Их используют для лечения симптомов метаболического синдрома , главным образом для снижения уровня триглицеридов и сахара в крови .
Классификация
[ редактировать ]PPAR-альфа и PPAR-гамма являются молекулярными мишенями ряда имеющихся на рынке лекарств. Основными классами агонистов PPAR являются:
Агонисты PPAR-альфа
[ редактировать ]Эндогенное соединение, 7(S)-гидроксидокозагексаеновая кислота (7(S)-HDHA), которое представляет собой докозаноидное производное жирной кислоты омега-3 DHA, было выделено в качестве эндогенного лиганда с высоким сродством к PPAR-альфа у крыс и мышей. мозг. Энантиомер 7(S) связывался с микромолярным сродством к PPAR-альфа с аффинностью, в 10 раз большей по сравнению с энантиомером (R), и мог запускать активацию дендритов. [ 1 ] PPARα (альфа) является основной мишенью , фибратов класса амфипатических карбоновых кислот ( клофибрат , гемфиброзил , ципрофибрат , безафибрат и фенофибрат ). Первоначально они были показаны при дислипидемии холестерина , а в последнее время – при нарушениях, характеризующихся высоким содержанием триглицеридов.
Агонисты PPAR-гамма
[ редактировать ]PPARγ (гамма) является основной мишенью лекарственного класса тиазолидиндионов (TZD), используемых при сахарном диабете и других заболеваниях, характеризующихся резистентностью к инсулину . Он также слегка активируется некоторыми НПВП (такими как ибупрофен ) и индолами , а также рядом природных соединений. Известные ингибиторы включают экспериментальный агент GW-9662.
Они также используются при лечении гиперлипидемии при атеросклерозе . Здесь они действуют путем увеличения экспрессии ABCA1 , который транспортирует внепеченочный холестерин в ЛПВП. Таким образом, следует увеличение поглощения и выведения из печени.
Исследования на животных показали их возможную роль в уменьшении воспаления легких, особенно при астме. [ 2 ]
Агонисты PPAR-дельта
[ редактировать ]PPARδ (дельта) является основной мишенью исследовательского химического вещества под названием GW501516 . Было показано, что агонизм PPARδ изменяет предпочтение организма к топливу с глюкозы на липиды. [ 3 ]
Двойные и пан-агонисты PPAR
[ редактировать ]Четвертый класс двойных агонистов PPAR, так называемые глитазары , которые связываются как с α-, так и с γ-изоформами PPAR, в настоящее время активно исследуются для лечения более широкого подмножества симптомов метаболического синдрома. [ 4 ] [ 5 ] К ним относятся экспериментальные соединения алеглитазар , мураглитазар и тесаглитазар . В июне 2013 года сароглитазар стал первым глитазаром, одобренным для клинического применения. [ 6 ]
Кроме того, продолжаются исследования и разработки новых двойных агонистов α/δ и γ/δ PPAR для дополнительных терапевтических показаний, а также «пан» агонистов, действующих на все три изоформы. [ 7 ] [ 8 ]
Исследовать
[ редактировать ]Относительно недавним направлением исследований лекарственных средств для лечения депрессии и наркозависимости является активация PPARα и PPARγ . [ 9 ] Как TLR4 -опосредованный, так и NF-κB- опосредованный сигнальные пути вовлечены в развитие зависимости от некоторых наркотиков, таких как опиоиды и кокаин, и поэтому являются привлекательными целями для фармакотерапии. [ 10 ] [ 11 ] [ 12 ] Несмотря на широту доклинических исследований, показывающих потенциал на животных моделях в лечении наркозависимости, включая алкоголь, никотин, кокаин, опиоиды и метамфетамин, доказательства на людях ограничены, поскольку количество исследований по использованию агонистов PPAR для людей все еще невелико; и пока (по состоянию на 2020 год) не представляет особых перспектив. Существует несколько предполагаемых гипотез о плохой трансляции результатов исследований с животных на человека, таких как эффективность и селективность лигандов PPAR, изменчивость, связанная с полом, и видовые различия в распределении и передаче сигналов PPAR. [ 13 ]
Ссылки
[ редактировать ]- ^ Цзябао Лю; и др. (2022). «Омега-3-гидроксижирная кислота 7(S)-HDHA представляет собой высокоаффинный лиганд PPARα, который регулирует морфологию нейронов головного мозга» . Научная сигнализация . 15 (741): eabo1857. дои : 10.1126/scisignal.abo1857 . ПМИД 35857636 .
- ^ Гу, Мексика; Лю, XC; Цзян, Л. (2013). «Влияние гамма-рецептора, активируемого пролифератором пероксисом, на пролиферацию гладкомышечных клеток дыхательных путей у мышей с астмой». Чжунго Данг Дай Эр Ке За Чжи = Китайский журнал современной педиатрии . 15 (7): 583–7. doi : 10.7499/j.issn.1008-8830.2013.07.018 (неактивен 27 апреля 2024 г.). ПМИД 23866284 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на апрель 2024 г. ( ссылка ) - ^ Б. Брюнмайр; и др. (2006). «Активация PPAR-δ в изолированных скелетных мышцах крыс переключает предпочтение топлива с глюкозы на жирные кислоты» . Диабетология . 49 (11): 2713–22. дои : 10.1007/s00125-006-0357-6 . ПМИД 16960684 . S2CID 31757997 .
- ^ Фьеве С., Фрюшар Дж.К., Стальс Б. (2006). «Двойные агонисты PPARalpha и PPARgamma для лечения диабета 2 типа и метаболического синдрома». Современное мнение в фармакологии . 6 (6): 606–14. дои : 10.1016/j.coph.2006.06.009 . ПМИД 16973418 .
- ^ Балакумар П., Роуз М., Ганти С.С., Кришан П., Сингх М. (2007). «Двойные агонисты PPAR: открывают ящик Пандоры?». Фармакол. Рез . 56 (2): 91–8. дои : 10.1016/j.phrs.2007.03.002 . ПМИД 17428674 .
- ^ http://www.wallstreet-online.de/nachrichten/6228479-zydus-gelingt-durchbruch-lipaglyn-wirkstoff-indien-markt-gelangt (на немецком языке)
- ^ Стальс Б., Фрухарт Дж.К. (2005). «Терапевтическая роль агонистов рецепторов, активируемых пролифератором пероксисом» . Диабет . 54 (8): 2460–70. дои : 10.2337/диабет.54.8.2460 . ПМИД 16046315 .
- ^ Невин Д.К., Фейн Д., Ллойд Д.Г. (2011). «Рациональное нацеливание на подтипы активированных рецепторов, пролиферирующих пероксисомы». Современная медицинская химия . 18 (36): 5598–623. дои : 10.2174/092986711798347243 . ПМИД 22172067 .
- ^ Ле Фолль Б., Ди Чиано П., Панлилио Л.В., Голдберг С.Р., Чиккочиоппо Р. (2013). «Агонисты рецепторов, активирующих пролифератор пероксисом (PPAR), как перспективные новые лекарства от наркозависимости: доклинические данные» . Текущие цели по борьбе с наркотиками . 14 (7): 768–776. дои : 10.2174/1389450111314070006 . ПМК 3826450 . ПМИД 23614675 .
- ^ Бахтелл Р., Хатчинсон М.Р., Ван Х, Райс К.К., Майер С.Ф., Уоткинс Л.Р. (2015). «Нацеливание на ущерб от злоупотребления наркотиками: трансляционный потенциал Toll-подобного рецептора 4» . Целевые препараты для лечения ЦНС и неврологических расстройств . 14 (6): 692–9. дои : 10.2174/1871527314666150529132503 . ПМК 5548122 . ПМИД 26022268 .
- ^ Ненниг С.Е., Шанк-младший (2013). «Роль NFkB в наркозависимости: помимо воспаления» . Алкоголь и алкоголизм . 14 (7): 768–776. дои : 10.1093/alcalc/agw098 . ПМК 6410896 . ПМИД 28043969 .
- ^ Руссо С.Дж., Уилкинсон М.Б., Мазеи-Робисон М.С., Дитц Д.М., Мейз I, Кришнан В., Рентал В., Грэм А., Бирнбаум С.Г., Грин Т.А., Робисон Б., Лесселонг А., Перротти Л.И., Боланьос К.А., Кумар А., Кларк М.С., Ноймайер Дж. Ф., Нив Р. Л., Бхакар А. Л., Баркер П. А., Нестлер Э. Дж. (2009). «Передача сигналов ядерного фактора κB регулирует морфологию нейронов и вознаграждение за кокаин» . Журнал неврологии . 29 (11): 3529–3537. doi : 10.1523/jneurosci.6173-08.2009 . ПМЦ 2677656 . ПМИД 19295158 .
- ^ Мэтисон, Джастин; Ле Фолль, Бернар (май 2020 г.). «Терапевтический потенциал агонистов рецепторов, активирующих пролифератор пероксисом (PPAR), при расстройствах, связанных с употреблением психоактивных веществ: синтез доклинических и человеческих данных» . Клетки . 9 (5): 1196. doi : 10.3390/cells9051196 . ПМЦ 7291117 . ПМИД 32408505 .