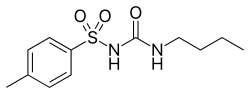
Толбутамид
Эта статья нуждается в дополнительных цитатах для проверки . ( июль 2014 г. ) |
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Бизнес |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а682481 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | Оральный (таблетка) |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Фармакокинетические данные | |
| Связывание с белками | 96% |
| Метаболизм | Печень ( опосредованная CYP2C19 ) |
| Период полувыведения | 4,5–6,5 часов |
| Экскреция | Реналь |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ИЮФАР/БПС | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.000.541 |
| Химические и физические данные | |
| Формула | С 12 Н 18 Н 2 О 3 С |
| Молярная масса | 270.35 g·mol −1 |
| 3D model ( JSmol ) | |
| Температура плавления | От 128,5 до 129,5 °C (от 263,3 до 265,1 °F) |
| (проверять) | |
Толбутамид первого поколения — блокатор калиевых каналов , препарат сульфонилмочевины пероральный гипогликемический . Этот препарат можно использовать для лечения диабета 2 типа , если одна только диета не эффективна. Толбутамид стимулирует секрецию инсулина поджелудочной железой .
Он не используется регулярно из-за более высокой частоты побочных эффектов по сравнению с более новыми препаратами сульфонилмочевины второго поколения, такими как глибенкламид . Обычно он имеет короткую продолжительность действия из-за быстрого метаболизма, поэтому безопасен для использования у пожилых людей.
Он был обнаружен в 1956 году. [1]
Побочные эффекты
[ редактировать ]- Гипогликемия
- Увеличение веса
- Гиперчувствительность: перекрестная аллергия с сульфаниламидами.
- Лекарственное взаимодействие (особенно препараты первого поколения): усиление гипогликемии при применении циметидина , инсулина , салицилатов и сульфаниламидов.
Салицилаты вытесняют толбутамид из места его связывания на связывающих белках плазмы, что приводит к увеличению концентрации свободного толбутамида и, как следствие, к гипогликемическому шоку. [2]
История
[ редактировать ]Ориназа была разработана компанией Upjohn Co. в то время, когда основным методом лечения диабета были инъекции инсулина. В то время компания Eli Lilly имела контроль над рынком производства инсулина. Практическая применимость Ориназы, как и других методов лечения болезненных состояний, выявленных по параклиническим признакам (таким как результаты лабораторных анализов), а не по клинически наблюдаемым признакам или симптомам, сообщаемым пациентами, выиграла от повышения чувствительности и доступности тестов (в данном случае анализа мочи) . определение уровня глюкозы , а затем и измерение уровня глюкозы в крови из пальца ). Милтон Московиц (редактор журнала «Лекарственная и косметическая промышленность » в 1961 году ) утверждал, что появление Ориназы «расширило общий рынок за счет привлечения к медицинской помощи диабетиков, которые раньше не лечились». [3] Это удалось сделать, изменив отношение к диабету даже больше, чем это сделал инсулин. Лечение этого хронического заболевания больше не рассматривалось как простое замедление «неумолимого вырождения», а рассматривалось как «модель наблюдения и раннего выявления». [3] : 84
Ориназа и другие сульфонилмочевины появились в результате европейских фармацевтических исследований антибиотиков, в частности, в результате попыток разработать сульфаниламидные соединения. У одного из претендентов на новый сульфаниламидный антибиотик во время клинических испытаний в Университете Монпелье были серьезные побочные эффекты , включая потерю сознания , судороги и кому . Побочные эффекты не наблюдались ни при каких других препаратах в группе сульфаниламида. Исследователь инсулина из того же университета услышал об этих побочных эффектах и признал их частыми последствиями гипогликемии. Возникший в результате класс препаратов для снижения уровня сахара в крови стал известен как сульфонилмочевины, начиная с Ориназы и до сих пор используемых в других формах.
К несчастью для диабетиков, зависимых от инсулина в качестве лечения своего заболевания, это исследование в Монпелье проводилось в начале 1940-х годов и было существенно прервано немецкой оккупацией Франции во время Второй мировой войны . Разработку этих соединений взяли на себя немецкие фармацевтические компании, которые явно не хотели делиться своей наградой со странами, против которых они вели войну. Немецкие исследования, в свою очередь, были прерваны поражением Германии в 1945 году и разделением Германии на Восточную и Западную Германию. Производные сульфонилмочевины были задержаны в Восточной Германии. В 1952 году кто-то контрабандой переправил образец западногерманской фармацевтической компании, и исследования возобновились. Клинические испытания на диабетиках начались в 1954 году в Берлине. В 1956 году на рынок Германии были выведены два разных препарата сульфонилмочевины под торговыми названиями Надисан и Растинон. Американские фармацевтические компании в послевоенный период стремились установить деловые отношения с остатками немецких фармацевтических гигантов, ослабленных войной и разделом Германии. Upjohn (базировался в Каламазу до момента его покупки компанией Pharmacia в 1990-е годы) заключила сделки с Hoechst , производителем Растинона. Результатом стало соглашение о перекрестном лицензировании, в результате которого была создана компания Orinase.
Апджон намеревался открыть совершенно новую арену лечения диабета, имеющую встроенный и устойчивый рынок, то есть популяцию пациентов. В тот же год, когда две немецкие компании вывели на рынок препараты сульфонилмочевины, Апджон обнаружил, что компания Eli Lilly начала клинические испытания карбутамида, еще одного перорального гипогликемического средства. Апджон настаивал на крупномасштабных клинических испытаниях в 1955–1957 годах, в которых приняли участие более 5000 пациентов в нескольких центрах.
Препарат Апджона был отдан предпочтение, когда препарат Лилли продемонстрировал доказательства токсичности в параллельных исследованиях в клинике Джослин . Компания Lilly отказалась от карбутамида и остановила разработку, оставив Upjohn открытым поле для продвижения на рынок своего нового препарата. В 1956 году Апджон подал заявку на одобрение Управления по контролю за продуктами и лекарствами . Джереми А. Грин обнаружил, что размер приложения – 10 580 страниц в 23 томах с 5 786 сообщениями о случаях – был необходим, чтобы «сделать видимыми относительно небольшие улучшения, достигнутые при менее тяжелых формах диабета». Действительно, компания Upjohn продавала Ориназу не как панацею для всех диабетиков, а конкретно как лекарство, которое «не является пероральным инсулином» и «работает не у всех диабетиков». Это были инструкции по маркетингу, данные продавцам Upjohn. Как указано в заявке FDA, было продемонстрировано, что Ориназа «не эффективна при тяжелом диабете, а только в более легких случаях заболевания». [3] : 93 Ориназа была одним из новых классов лекарств (включая лечение гипертонии и гиперхолестеринемии), направленных на обеспечение минимальных преимуществ по сравнению с существующими методами лечения для пациентов, которые ранее не были целевым рынком для фармацевтических препаратов.Поскольку тестирование уровня сахара в крови для диагностики диабета стало более распространенным, произошел любопытный побочный эффект: поскольку тестирование уровня сахара в крови не является абсолютно точным в диагностике диабета, все больше людей проходили пограничные тесты относительно их гликемического статуса. Этих пограничных людей можно считать находящимися в группе риска по развитию диабета – преддиабетическому состоянию. У пациентов с преддиабетом повышен уровень сахара в крови, но нормальный уровень сахара в моче (гликозурия). Апджон увидел возможность извлечь выгоду и, безусловно, продать продукцию для еще большего увеличения населения, страдающего диабетом, помимо даже «скрытых диабетиков», выявленных предыдущими кампаниями общественного здравоохранения. Апджон также нашел новое применение Ориназе: в качестве диагностики. Orinase Diagnostic была добавлена к линейке продуктов Orinase и к 1962 году продавалась как средство выявления предиабета, поскольку аномальная реакция на Orinase после введения кортизона в «стресс-тесте» могла быть принята за указание на преддиабет. Таким образом, Ориназа не только помогла выявить ранее скрытую популяцию пациентов, но также выявила группу пациентов, которые, скорее всего, будут заинтересованы в Ориназе для лечения недавно диагностированного предиабета. К концу 1960-х годов Ориназа Диагностика была снята с производства, и препарат вернулся к своему терапевтическому назначению. К этому моменту предиабет стал диагностируемым и излечимым заболеванием, что резко увеличило рынок Ориназы.
Ориназа начала терять популярность в мае 1970 года, когда бессимптомные люди с предиабетом, принимающие Ориназу в течение длительного времени, начали видеть сообщения в новостях (начиная с газеты Washington Post ) о том, что Ориназа может иметь серьезные побочные эффекты, включая смерть от сердечно-сосудистых проблем, согласно давним данным. срок обучения. Во многих случаях пациенты узнавали об этом раньше, чем их врачи, а также до того, как FDA могло посоветовать изменить маркировку лекарства или предложить изменения в правильном использовании. Вопрос о том, усугубляла ли Ориназа сердечно-сосудистые проблемы или нет, окончательно не решен. В результате FDA и практикующие врачи «отменили» прием Ориназы и других методов лечения преддиабета в попытке сосредоточиться на пациентах с симптомами, для которых риски лечения могут быть сбалансированы симптомами заболевания.
Pharmacia и Upjohn (теперь объединенные) прекратили производство Ориназы в 2000 году, хотя дженерик все еще доступен и иногда используется.
Исторические последствия
[ редактировать ]История толбутамида оказала длительное влияние на медицину и фармацевтическую промышленность. Сегодня у пациентов по-прежнему диагностируют преддиабет, многим из них удается отсрочить начало диабета за счет изменений в питании и образе жизни, но многие также имеют возможность принимать метформин , который продемонстрировал снижение на 31% трехлетней частоты развития диабета относительно к плацебо. [4] Хотя это и впечатляет, группа по изменению образа жизни в том же исследовании продемонстрировала снижение на 58%. [5]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Уокер С.Р. (2012). Тенденции и изменения в исследованиях и разработках лекарственных средств . Springer Science & Business Media. п. 109. ИСБН 978-94-009-2659-2 .
- ^ Калра С (2015). «Сульфонилмочевины и их применение в клинической практике» . Ветеринарная запись открыта . 1 (1). Издательство Термедиа: e000080. дои : 10.1136/vetreco-2014-000080 . ПМЦ 4562452 . ПМИД 26392882 .
- ^ Jump up to: а б с Грин Дж.А. (2007). Назначение лекарств в цифрах: лекарства и определение болезни . Балтимор, Мэриленд: Издательство Университета Джонса Хопкинса. ISBN 978-0-8018-8477-1 .
- ^ Лоуренс В.Л. (24 февраля 1957 г.). «Обзор науки: препарат для лечения диабета протестирован и признан очень важным» . Нью-Йорк Таймс .
- ^ Ноулер В.К., Барретт-Коннор Э., Фаулер С.Е., Хамман Р.Ф., Лачин Дж.М., Уокер Э.А., Натан Д.М. (февраль 2002 г.). «Снижение заболеваемости диабетом 2 типа с помощью изменения образа жизни или метформина» . Медицинский журнал Новой Англии . 346 (6): 393–403. дои : 10.1056/NEJMoa012512 . ПМК 1370926 . ПМИД 11832527 .