Дендротоксин
Дендротоксины представляют собой класс пресинаптических нейротоксинов, вырабатываемых мамба змеями ( Dendroaspis ), которые блокируют определенные подтипы потенциалзависимых калиевых каналов в нейронах , тем самым усиливая высвобождение ацетилхолина в нервно-мышечных соединениях . Благодаря своей высокой активности и селективности в отношении калиевых каналов дендротоксины оказались чрезвычайно полезными в качестве фармакологических инструментов для изучения структуры и функции этих ионных каналов белков .
Было показано, что дендротоксины блокируют определенные подтипы потенциалзависимого калия (K + ) каналы в нейрональной ткани. [ нужна ссылка ] В нервной системе потенциалзависимый K + каналы контролируют возбудимость нервов и мышц, контролируя мембранный потенциал покоя и реполяризуя мембрану во время потенциалов действия . Было показано, что дендротоксин связывает узлы Ранвье мотонейронов . [1] и блокировать активность этих калиевых каналов. Таким образом, дендротоксины продлевают продолжительность потенциалов действия и увеличивают высвобождение ацетилхолина в нервно-мышечных соединениях, что может привести к гипервозбудимости мышц и судорожным симптомам.
Структура дендротоксина
[ редактировать ]
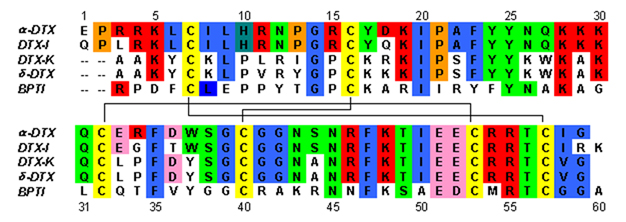
Дендротоксины представляют собой белки размером ~7 кДа, состоящие из одной пептидной цепи, состоящей примерно из 57-60 аминокислот . Было выделено несколько гомологов альфа-дендротоксина, каждый из которых имеет несколько отличающуюся последовательность. Однако молекулярная архитектура и фолдинг-конформация этих белков очень похожи. Дендротоксины обладают очень короткой 310 - спиралью вблизи N-конца пептида, тогда как двухвитковая альфа-спираль находится вблизи С-конца . Двухцепочечный антипараллельный β-лист занимает центральную часть молекулярной структуры. Эти две β-цепи соединены искаженной областью β-поворота. [2] Считается, что это важно для связывающей активности белка. Все дендротоксины сшиты тремя дисульфидными мостиками , которые придают белку стабильность и в значительной степени способствуют его структурной конформации. Остатки цистеина , образующие эти дисульфидные связи, консервативны среди всех членов семейства дендротоксинов и расположены в положениях C7-C57, C16-C40 и C32-C53 (нумерация в соответствии с альфа-дендротоксином).
Дендротоксины структурно гомологичны Кунитца ингибиторам сериновой протеазы , включая ингибитор бычьего панкреатического трипсина (BPTI). Было показано, что альфа-дендротоксин и BPTI имеют 35% идентичность последовательностей, а также идентичные дисульфидные связи. Несмотря на структурную гомологию между этими двумя белками, дендротоксины, по-видимому, не проявляют какой-либо измеримой ингибирующей протеазной активности, такой как BPTI. Эта потеря активности, по-видимому, является результатом отсутствия ключевых аминокислотных остатков, которые создают структурные различия, которые препятствуют ключевым взаимодействиям, необходимым для активности протеазы, наблюдаемой при BPTI.
Дендротоксины представляют собой основные белки, которые обладают суммарным положительным зарядом при нейтральном pH . Большинство положительно заряженных аминокислотных остатков дендротоксинов расположены в нижней части структуры, создавая катионный домен на одной стороне белка. Положительный заряд возникает за счет остатков лизина (Lys) и аргинина (Arg), которые сконцентрированы в трех основных областях белка: вблизи N-конца (Arg3, Arg4, Lys5), вблизи С-конца (Arg54, Arg55) и на узкая область β-поворота (Lys28, Lys29, Lys30). [3] Считается, что эти положительно заряженные остатки могут играть решающую роль в активности связывания дендротоксинов, поскольку они могут потенциально взаимодействовать с анионными сайтами (отрицательно заряженными аминокислотами) в порах калиевых каналов.
Биологическая активность
[ редактировать ]Фармакология
[ редактировать ]Отдельная молекула дендротоксина обратимо связывается с калиевым каналом, оказывая его ингибирующее действие. Предполагается, что это взаимодействие опосредовано электростатическими взаимодействиями между положительно заряженными аминокислотными остатками в катионном домене дендротоксина и отрицательно заряженными остатками в поре ионного канала . Считается, что калиевые каналы, как и другие катион-селективные каналы, имеют облако отрицательных зарядов, которые предшествуют открытию поры канала и помогают проводить ионы калия по пути проникновения. Обычно считается (хотя и не доказано), что молекулы дендротоксина связываются с анионными участками вблизи внеклеточной поверхности канала и физически закупоривают поры, тем самым предотвращая ионную проводимость. Однако Имреди и Маккиннон [4] предположили, что дельта-дендротоксин может иметь нецентральный сайт связывания на белках-мишенях и может ингибировать канал, изменяя структуру канала, а не физически блокируя поры.
Биологически важные остатки
[ редактировать ]Многие исследования пытались определить, какие аминокислотные остатки важны для активности связывания дендротоксинов с мишенями их калиевых каналов. Харви и др. [5] использовали модификации, специфичные для остатков, для идентификации положительно заряженных остатков, которые имеют решающее значение для блокирующей активности дендротоксина-I. Они сообщили, что ацетилирование Lys5 вблизи N-концевой области и Lys29 в области бета-поворота привело к существенному снижению аффинности связывания DTX-I. Аналогичные результаты были получены с дендротоксином-К с использованием сайт-направленного мутагенеза для замены положительно заряженных остатков лизина и аргинина на нейтральные аланины . Эти результаты, наряду со многими другими, указывают на то, что положительно заряженные лизины в N-концевой половине, особенно Lys5 в 310 - спирали, играют очень важную роль в связывании дендротоксина с мишенями их калиевых каналов. Остатки лизина в области β-поворота дали более противоречивые результаты, поскольку они кажутся биологически важными для некоторых гомологов дендротоксина и не являются необходимыми для других. Более того, мутация всего триплета лизина (K28-K29-K30) на Ala-Ala-Gly в альфа-DTX привела к очень небольшому изменению биологической активности.
Существует общее мнение, что консервативный остаток лизина вблизи N-конца (Lys5 в альфа-DTX) имеет решающее значение для биологической активности всех дендротоксинов, в то время как дополнительные остатки, например, в области бета-поворота, могут играть роль. в специфичности дендротоксина, опосредуя взаимодействие отдельных токсинов с их отдельными целевыми сайтами. Это не только помогает объяснить строгую специфичность некоторых дендротоксинов для разных подтипов потенциалзависимого K. + каналы, но также объясняет различия в эффективности дендротоксинов для обычных K + каналы. Например, Ван и др. [6] показали, что взаимодействие дендротоксина-К с K V 1.1 опосредовано его остатками лизина как на N-конце, так и в области β-поворота, тогда как альфа-дендротоксин, по-видимому, взаимодействует со своей мишенью исключительно через N-конец. Этот менее обширный интерактивный домен может помочь объяснить, почему альфа-дендротоксин менее избирательен, в то время как дендротоксин-K строго селективен в отношении K V 1.1.
Использование в исследованиях
[ редактировать ]Калиевые каналы нейронов позвоночных демонстрируют высокую степень разнообразия, что позволяет нейронам точно настраивать свои электрические сигнальные свойства путем экспрессии различных комбинаций субъединиц калиевых каналов. Более того, поскольку они регулируют поток ионов через биологические мембраны, они важны во многих аспектах клеточной регуляции и передачи сигналов различных типов клеток. Таким образом, потенциалзависимые калиевые каналы являются мишенью для широкого спектра мощных биологических токсинов таких организмов, как змеи, скорпионы , морские анемоны и конусные улитки . яда Таким образом, очистка привела к выделению пептидных токсинов, таких как дендротоксины, которые стали полезными фармакологическими инструментами для изучения калиевых каналов. Благодаря своей активности и селективности в отношении различных подтипов калиевых каналов дендротоксины стали полезны в качестве молекулярных зондов для структурных и функциональных исследований этих белков. Это может помочь улучшить наше понимание роли отдельных типов каналов, а также помочь в фармакологической классификации этих разнообразных типов каналов. [7] Кроме того, доступность меченых радиоактивным изотопом дендротоксинов обеспечивает инструмент для скрининга других источников в поисках новых токсинов калиевых каналов, таких как класс каликлудинов токсинов калиевых каналов в морских анемонах. Наконец, структурная информация, предоставляемая дендротоксинами, может дать ключ к синтезу терапевтических соединений, которые могут воздействовать на определенные классы калиевых каналов. Дендротоксин I также использовался для очистки и характеристики белка K+-канала, с которым он связывается, с помощью различных методов анализа связывания и хроматографии. [8]
Ссылки
[ редактировать ]- ^ Гаспарини С., Данс Дж.М., Ликок А., Пинкасфельд С., Зинн-Джастин С., Янг LC, CL де Медейрос С., Роуэн Э.Г., Харви А.Л. и Менез А. (1998). Определение функционального сайта альфа-дендротоксина: Функциональная топография дендротоксинов различна, но имеет общее консервативное ядро с топографией других K V токсинов, блокирующих калиевые каналы 1. Журнал биологической химии 273: 25393-25403.
- ^ Като Э., Нисио Х., Инуи Т., Нисиучи Ю., Кимура Т., Сакакибара С., Ямазаки Т. (2000). Структурная основа биологической активности дендротоксина-I, мощного блокатора калиевых каналов. Биополимеры 54:44-57
- ^ Сваминатан П., Харихаран М., Мурали Р., Сингх CU (1996). Молекулярная структура, конформационный анализ и исследование структуры-активности дендротоксина и его гомологов с использованием методов молекулярной механики и молекулярной динамики. Журнал медицинской химии . 39:2141-2155
- ^ Имреди Дж. П. и Маккиннон Р. (2000). Энергетические и структурные взаимодействия между дельта-дендротоксином и потенциалзависимым калиевым каналом. Журнал молекулярной биологии 296: 1283-1294.
- ^ Харви А.Л., Роуэн Э.Г., Ватанпур Х., Энгстрем А., Вестерлунд Б., Карлссон Э. (1997). Изменения биологической активности после ацетилирования дендротоксина I Dendroaspis polylepis (черная мамба). ' 35:1263-1273
- ^ Ван ФК, Белл Н., Рид П., Смит Л.А., Макинтош П., Робертсон Б. и Долли Дж.О. (1999). Идентификация остатков дендротоксина К, ответственных за его дискриминацию между нейрональными К. + каналы, содержащие K V 1,1 и 1,2 альфа-субъединицы. Европейский журнал биохимии 263:222-229.
- ^ Ёсида С. и Мацумото С. (2005). Влияние альфа-дендротоксина на K + токи и потенциалы действия в нейронах тройничного ганглия взрослых крыс, устойчивых к тетродотоксину. Журнал фармакологии и экспериментальной терапии 314: 437-445.
- ^ Рем, Х.; Лаздунски, М. (1 июля 1988 г.). «Очистка и структура субъединиц предполагаемого белка K+-канала, идентифицированного по его свойствам связывания с дендротоксином I». Труды Национальной академии наук . 85 (13): 4919–4923. Бибкод : 1988PNAS...85.4919R . дои : 10.1073/pnas.85.13.4919 . ISSN 0027-8424 . ПМЦ 80549 . ПМИД 2455300 .
Внешние ссылки
[ редактировать ]- дендротоксин Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)