AB 5 токсин
| Энтеротоксин (субъединица OB-фолда B) | |
|---|---|
| Идентификаторы | |
| Символ | Энтеротоксин |
| ИнтерПро | ИПР008992 |
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 2бос / СКОПе / СУПФАМ |
Токсины AB 5 представляют собой шестикомпонентные белковые комплексы, секретируемые некоторыми патогенными бактериями, которые, как известно, вызывают такие заболевания человека, как холера , дизентерия и гемолитико-уремический синдром . Один компонент известен как субъединица A, а остальные пять компонентов являются субъединицами B. Все эти токсины имеют схожую структуру и механизм проникновения в целевые клетки-хозяева. Субъединица B отвечает за связывание с рецепторами , открывая путь для проникновения субъединицы A в клетку. Субъединица А затем может использовать свой каталитический механизм, чтобы взять на себя обычные функции клетки-хозяина. [1] [2]
Семьи
[ редактировать ]


Существует четыре основных семейства токсина AB5. Эти семейства характеризуются последовательностью А (каталитической) субъединицы, а также каталитической активностью. [4]
Холерный токсин
[ редактировать ]Это семейство также известно как Ct или Ctx и включает также термолабильный энтеротоксин , известный как LT. [5] Многие приписывают открытие холерного токсина доктору Самбху Натху Де . Он проводил свои исследования в Калькутте (ныне Калькутта ), сделав свое открытие в 1959 году, хотя впервые оно было очищено Робертом Кохом в 1883 году. Холерный токсин состоит из белкового комплекса, секретируемого бактерией Vibrio cholerae . [6] Некоторые симптомы этого токсина включают хроническую и широко распространенную водянистую диарею и обезвоживание, что в некоторых случаях приводит к смерти.
Коклюшный токсин
[ редактировать ]Это семейство также известно как Ptx и содержит токсин, вызывающий коклюш . Токсин коклюша секретируется грамотрицательной бактерией Bordetella pertussis . Коклюш очень заразен, и количество случаев заболевания в Соединенных Штатах медленно растет, несмотря на вакцинацию. [7] Симптомы включают приступообразный кашель с коклюшем и даже рвотой. [8] Бактерия Bordetella pertussis была впервые идентифицирована как причина коклюша и выделена Жюлем Борде и Октавом Жангу во Франции в 1900 году. [9] Токсин имеет тот же механизм действия, что и холерный токсин. [5]
Токсин ArtAB Salmonella enterica имеет компоненты, сходные с компонентами, обнаруженными в двух разных семействах: субъединица ArtA ( Q404H4 ) гомологична коклюшному токсину A, а субъединица ArtB ( Q404H3 ) гомологична субъединице B, а также белкам, обнаруженным в других штаммах сальмонеллы . Согласно правилу классификации по А, это токсин семейства Ptx. [10] [4]
Введите токсин
[ редактировать ]Шига-токсин, также известный как Stx, представляет собой токсин, который продуцируется палочковидными Shigelladysenteriae и Escherichia coli (STEC). Еда и напитки, зараженные этими бактериями, являются источником инфекции и пути распространения этого токсина. [11] Симптомы включают боль в животе, а также водянистую диарею. Тяжелые, угрожающие жизни случаи характеризуются геморрагическим колитом (ГК). [12] Открытие токсина сига приписывают доктору Киёси Сига в 1898 году.
Цитотоксин субтилазы
[ редактировать ]Это семейство также известно как SubAB. [4] и был обнаружен в 1990-х годах. [13] Он продуцируется штаммами STEC, не имеющими локуса стирания энтероцитов (LEE), [14] и известно, что он вызывает гемолитико-уремический синдром (ГУС). Его называют субтилазным цитотоксином, поскольку его последовательность субъединицы А аналогична субтилазоподобной сериновой протеазе Bacillus anthracis . Некоторые симптомы, вызванные этим токсином, включают снижение количества тромбоцитов в крови или тромбоцитопению , увеличение количества лейкоцитов или лейкоцитоз и почек . повреждение клеток [15]
Субъединица субтилазного цитотоксина А (subA, Q6EZC2 ) представляет собой протеазу, которая, как известно, расщепляет связывающий белок иммуноглобулина (BiP), что приводит к стрессу эндоплазматического ретикулума и гибели клеток. Субъединицы B (subB, Q6EZC3 ) связываются с гликанами N-гликолилнейраминовой кислоты (Neu5Gc) на клетках с высоким сродством. [16] Одного лишь subB достаточно, чтобы вызвать вакуолизацию клеток Vero. [17] Neu5GC не вырабатывается человеком, а поступает в слизистую оболочку кишечника человека из пищевых источников, таких как красное мясо и молочные продукты, которые также являются частыми источниками инфекций STEC. [18]
Структура
[ редактировать ]Полный комплекс токсина AB5 содержит шесть белковых единиц. Пять единиц сходны или идентичны по структуре и составляют субъединицу B. Последняя белковая единица уникальна и известна как субъединица А.


Субъединица
[ редактировать ]Субъединица А токсина AB5 — это часть, ответственная за катализ конкретных мишеней. В семействе токсинов Шига субъединица А содержит трипсин -чувствительную область, которая при расщеплении выделяет два фрагментированных домена. Этот регион еще не подтвержден для других семейств токсинов AB5. [2] Как правило, два домена субъединицы А, называемые А1 и А2, связаны дисульфидной связью . Домен А1 (приблизительно 22 кДа в холерном токсине или термолабильных энтеротоксинах) является частью токсина, ответственной за его токсическое действие. Домен А2 (приблизительно 5 кДа в холерном токсине или термолабильном энтеротоксине) обеспечивает нековалентную связь с субъединицей B через центральную пору субъединицы B. [5] Цепь А1 холерного токсина катализирует перенос АДФ-рибозы от никотинамидадениндинуклеотида (НАД) к аргинину или другим соединениям гуанидина с использованием факторов АДФ-рибозилирования (ARF). В отсутствие аргинина или простых гуанидиновых соединений токсин-опосредованная активность НАД+нуклеозидазы (НАДАза) протекает с использованием воды в качестве нуклеофила . [19]
субъединица B
[ редактировать ]Субъединицы B образуют пятичленное или пентамерное кольцо, в которое входит и удерживается один конец субъединицы A. Это кольцо субъединицы B также способно связываться с рецептором , обычно гликопротеином или гликолипидом. [5] на поверхности клетки-хозяина. [20] Без субъединиц B субъединица A не имеет возможности прикрепиться к клетке или проникнуть в нее и, следовательно, не имеет возможности оказывать свое токсическое действие. Холерный токсин, шига-токсин и токсин SubAB имеют субъединицы B, которые состоят из пяти идентичных белковых компонентов, а это означает, что их субъединицы B являются гомопентамерами. Токсин коклюша отличается тем, что его пентамерное кольцо состоит из четырех различных белковых компонентов, причем один из компонентов повторяется с образованием гетеропентамера. [5]
Механизмы
[ редактировать ]Холерный токсин, коклюшный токсин и шига-токсин имеют свои мишени в цитозоле клетки. После того, как их B-субъединица связывается с рецепторами на поверхности клетки, токсин окутывается клеткой и транспортируется внутрь либо посредством клатрин-зависимого эндоцитоза , либо клатрин-независимого эндоцитоза . [21]
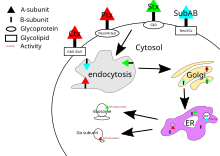
Для холерного токсина основным гликолипидным рецептором холерного токсина является ганглиозид GM1 . [20] После эндоцитоза в аппарате Гольджи токсин перенаправляется в эндоплазматический ретикулум . [5] Чтобы субъединица А достигла своей цели, необходимо разорвать дисульфидную связь между доменами А1 и А2. Этот разрыв катализируется протеиндисульфидизомеразой . [22] то есть в эндоплазматическом ретикулуме. После разделения домен А1 разворачивается и перенаправляется обратно в цитозоль, где он снова сворачивается. [5] и катализирует АДФ-рибозилирование некоторых альфа-субъединиц G-белка . При этом последующие эффекты пути передачи сигнала G-белка. нарушаются [4] путем активации аденилатциклазы . [20] Это вызывает повышение концентрации цАМФ в клетке, что нарушает регуляцию механизмов транспорта ионов. [5]
Токсин коклюша не имеет специфического рецептора и связывается с сиалилированными гликопротеинами . [13] После эндоцитоза механизм действия коклюшного токсина такой же, как и у холерного токсина.
Основным рецептором шига-токсина является глоботриаозилцерамид или Gb3. [23] Шига-токсин также доставляется в аппарат Гольджи, а затем направляется в эндоплазматический ретикулум, где PDI расщепляет дисульфидную связь. Субъединица А шига-токсина затем возвращается в цитозоль и ингибирует синтез эукариотического белка за счет своей РНК-N-гликозидазной активности. [4] путем расщепления специфического аденинового основания на 28S рибосомальной РНК. [5] это в конечном итоге приведет к гибели клеток.
Мишень SubAB находится в эндоплазматическом ретикулуме клетки и попадает в клетку посредством клатрин-опосредованного эндоцитоза . [20] Гликановый рецептор SubAB обычно заканчивается α2-3-связанной N-гликолилнейраминовой кислотой (Neu5Gc). [13] SubAB имеет субъединицу A, где он действует как сериновая протеаза и расщепляет Bip/GRP78 , эндоплазматического ретикулума шаперон . [4] Расщепление этого шаперона вызывает клеточный стресс за счет ингибирования белка. [14] и, как следствие, гибель клетки. [5]
Медицинское использование
[ редактировать ]Лечение рака
[ редактировать ]Субъединицы B токсинов AB5 обладают сродством к связыванию гликана, которым, по-видимому, обладают некоторые типы опухолей, что делает их легкой мишенью. Одним из примеров является StxB , который специфически связывается с CD77 (Gb3), который экспрессируется на поверхности раковых клеток, таких как толстая кишка, поджелудочная железа, грудь и многих других. Как только StxB нацеливается на раковую клетку, он доставляет субъединицу А токсина, которая в конечном итоге убивает раковую клетку. [5]
Еще один метод заключается в использовании препаратов, вызывающих стресс ER, которые были протестированы на мышах и показали положительные синергические реакции. Это достигается за счет слияния эпидермального фактора роста (EGF) с субъединицей A SubAB. Раковые клетки, которые экспрессируют рецепторы для EGF, будут испытывать токсичность SubAB. [24]
Вакцина
[ редактировать ]Другое применение токсинов AB5 — использование членов семейства LT в качестве адъювантов . Это позволяет токсину стимулировать иммунологические реакции, такие как IgG2a, IgA и Th17, для борьбы, например, с желудочной инфекцией Helicobacter pylori при вакцины . введении [25] [26]
Помимо того, что некоторые из этих токсинов AB5 используются для создания вакцин для предотвращения бактериальных инфекций, они также исследуются на предмет их действия в качестве конъюгата для предотвращения вирусных инфекций. Например, системная иммунизация вместе с одновременным интраназальным введением конъюгированной вакцины вирус-холерный токсин индуцировала реакцию вирус-специфических антител и продемонстрировала некоторую степень защиты верхних дыхательных путей от вируса Сендай . [27]
Последние области исследований
[ редактировать ]Новые достижения в области биотехнологических экспериментальных методов, такие как использование бесселевского луча микроскопии плоского освещения и сенсорных молекул на основе FRET, могут лучше демонстрировать динамические структуры бляшек щелевых соединений . В этих экспериментах можно использовать различные типы токсинов AB5, чтобы индуцировать быстрое образование tCDR в клетках E.Coli. Затем ответ можно записать с помощью колебаний концентрации цАМФ в клетках, связанных с щелевым соединением, с использованием сенсорных конструкций на основе FRET. Исследования показывают, что CDR, возможно, могут быть связаны с быстрой перестройкой липидов и белков в каналах коннексина внутри бляшек щелевых соединений. Это может также помочь нам понять сигнальный каскад, который следует за потерей клетками K+ при воздействии бактериальной инфекции. [28] [29]
Было замечено, что токсин SubAB демонстрирует специфичность к связывающему белку BiP . Эта характеристика была использована для изучения роли самого клеточного BiP, а также деградации, связанной с эндоплазматическим ретикулумом, в стрессированных HeLa . клетках [5]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Ле Нур, Ж.; Патон, AW; Байрс, Э.; Трой, С.; Хердман, БП; Джонсон, доктор медицины; Патон, Дж. К.; Россджон, Дж.; Беддо, Т. (6 августа 2013 г.). «Структурные основы сборки субАТ субтилазного цитотоксина» . Журнал биологической химии . 288 (38): 27505–27516. дои : 10.1074/jbc.M113.462622 . ПМЦ 3779744 . ПМИД 23921389 .
- ^ Jump up to: а б Миддлбрук, JL; Дорланд, РБ (сентябрь 1984 г.). «Бактериальные токсины: клеточные механизмы действия» . Микробиологические обзоры . 48 (3): 199–221. дои : 10.1128/мр.48.3.199-221.1984 . ПМК 373009 . ПМИД 6436655 .
- ^ Лохт, К; Антуан, Р. (1995). «Предлагаемый механизм АДФ-рибозилирования, катализируемый субъединицей S1 коклюшного токсина». Биохимия . 77 (5): 333–40. дои : 10.1016/0300-9084(96)88143-0 . ПМИД 8527486 .
- ^ Jump up to: а б с д и ж Ван, Х; Патон, Дж. К.; Хердман, БП; Роджерс, Ти Джей; Беддоу, Т; Патон, AW (март 2013 г.). «Субъединица B токсина AB5, продуцируемая сероваром Salmonella enterica Typhi, активирует хемокины, цитокины и молекулы адгезии в линиях макрофагов человека, эпителия толстой кишки и эндотелиальных клеток микрососудистых сосудов головного мозга» . Инфекция и иммунитет . 81 (3): 673–83. дои : 10.1128/IAI.01043-12 . ПМЦ 3584882 . ПМИД 23250951 .
- ^ Jump up to: а б с д и ж г час я дж к л Беддоу, Трэвис; Патон, Адриенн В.; Ле Нур, Жером; Россджон, Джейми; Патон, Джеймс К. (июль 2010 г.). «Структура, биологические функции и применение токсинов AB5» . Тенденции биохимических наук . 35 (7): 411–418. дои : 10.1016/j.tibs.2010.02.003 . ПМЦ 2929601 . ПМИД 20202851 .
- ^ Бхарати, К; Гангули, Северная Каролина (2011). «Холерный токсин: парадигма многофункционального белка» . Индийский журнал медицинских исследований . 133 (2): 179–187. ПМК 3089049 . ПМИД 21415492 .
- ^ Миллен, Ш.; Шнайдер, О.Д.; Миллер, МЫ; Монако, Джей Джей; Вайс, А.А. (2013). «Коклюшный токсин B-пентамер опосредует межклеточный перенос мембранных белков и липидов» . ПЛОС ОДИН . 8 (9): е72885. Бибкод : 2013PLoSO...872885M . дои : 10.1371/journal.pone.0072885 . ПМЦ 3760862 . ПМИД 24019885 .
- ^ Карбонетти, Нью-Хэмпшир (2010). «Коклюшный токсин и аденилатциклазный токсин: ключевые факторы вирулентности Bordetella pertussis и инструменты клеточной биологии» . Будущая микробиология . 5 (3): 455–469. дои : 10.2217/fmb.09.133 . ПМЦ 2851156 . ПМИД 20210554 .
- ^ Гуизо Н. 2009. Bordetella pertussis и вакцины против коклюша. Клин. Заразить. Дис . 49: 1565–1569
- ^ «1.C.72 Семейство коклюшного токсина (PTX)» . TCDB . Проверено 21 марта 2019 г.
- ^ Фарук, С.М.; Чоудхури, Н.; Хан, Р; Хасан, MR; Нахар, Дж; Ислам, MJ; Ямасаки, С; Гош, АН; Наир, Великобритания; Сак, Д.А. (2003). «Специфический бактериофаг Shigella Dysenteriae типа 1 из экологических вод Бангладеш» . Прикладная и экологическая микробиология . 69 (12): 7028–7031. Бибкод : 2003ApEnM..69.7028F . дои : 10.1128/АЕМ.69.12.7028-7031.2003 . ПМК 310026 . ПМИД 14660345 .
- ^ Беутин, Л; Мико, А; Краузе, Г; Прис, К; Хаби, С; Стидж, К; Альбрехт, Н. (2007). «Идентификация патогенных для человека штаммов Escherichia coli, продуцирующих шига-токсин, из пищевых продуктов путем сочетания серотипирования и молекулярного типирования генов шига-токсина» . Прикладная и экологическая микробиология . 73 (15): 4769–75. Бибкод : 2007ApEnM..73.4769B . дои : 10.1128/АЕМ.00873-07 . ПМК 1951031 . ПМИД 17557838 .
- ^ Jump up to: а б с Патон, AW; Патон, JC (1 февраля 2010 г.). «Субтилазный цитотоксин Escherichia coli» . Токсины . 2 (2): 215–228. дои : 10.3390/toxins2020215 . ПМЦ 2943149 . ПМИД 20871837 .
- ^ Jump up to: а б Микелаччи, В.; Тоццоли, Р.; Каприоли, А.; Мартинес, Р.; Шойц, Ф.; Гранде, Л.; Санчес, С.; Морабито, С.; Аллербергер, Ф. (2013). «Среди продуцентов шига-токсина человеческого и овечьего происхождения распространен новый остров патогенности, несущий аллельный вариант цитотоксина субтилазы» . Клиническая микробиология и инфекции . 19 (3): Е149–Е156. дои : 10.1111/1469-0691.12122 . ПМИД 23331629 .
- ^ Ван, Хуэй; Патон, Джеймс С.; Патон, Адриенн В. (октябрь 2007 г.). «Патологические изменения у мышей, вызванные субтилазным цитотоксином, новым мощным токсином AB, который поражает эндоплазматическую сеть» . Журнал инфекционных болезней . 196 (7): 1093–1101. дои : 10.1086/521364 . hdl : 2440/44452 . ПМИД 17763334 .
- ^ Патон, AW; Патон, Дж. К. (1 февраля 2010 г.). «Субтилазный цитотоксин Escherichia coli» . Токсины . 2 (2): 215–228. дои : 10.3390/toxins2020215 . ПМЦ 2943149 . ПМИД 20871837 .
- ^ Моринага, Н.; Яхиро, К; Мацуура, Г; Ватанабэ, М; Номура, Ф; Мосс, Дж; Нода, М. (январь 2007 г.). «Два различных цитотоксических действия субтилазного цитотоксина, продуцируемого шига-токсигенной Escherichia coli» . Инфекция и иммунитет . 75 (1): 488–96. дои : 10.1128/IAI.01336-06 . ПМК 1828409 . ПМИД 17101670 .
- ^ Байрс, Э; Патон, AW; Патон, Дж. К.; Лёфлинг, Дж. К.; Смит, Д.Ф.; Вилце, MC; Талбот, UM; Чонг, округ Колумбия; Ю, Х; Хуанг, С; Чен, X; Варки, Нью-Мексико; Варки, А; Россджон, Дж; Беддо, Т. (4 декабря 2008 г.). «Включение нечеловеческого гликана опосредует восприимчивость человека к бактериальному токсину» . Природа . 456 (7222): 648–52. Бибкод : 2008Natur.456..648B . дои : 10.1038/nature07428 . ПМЦ 2723748 . ПМИД 18971931 .
- ^ Финкель, Торен; Гуткинд, Дж. Сильвио, ред. (2003). Передача сигнала и болезни человека . Хобокен, Нью-Джерси: John Wiley & Sons. ISBN 0471448370 .
- ^ Jump up to: а б с д Ленсер В., Сасловски Д. (2005). «Незаконный оборот бактериальных токсинов субъединицы AB5» . Биохим Биофиз Акта . 1746 (3): 314–21. дои : 10.1016/j.bbamcr.2005.07.007 . ПМИД 16153723 .
- ^ Смит, Ричард Д.; Уиллетт, Роуз; Кудлык, Татьяна; Покровская Ирина; Патон, Адриенн В.; Патон, Джеймс С.; Лупашин, Владимир В. (октябрь 2009 г.). «Комплекс COG, Rab6 и COPI определяют новый путь ретроградного трафика по Гольджи, который используется токсином SubAB» . Трафик . 10 (10): 1502–1517. дои : 10.1111/j.1600-0854.2009.00965.x . ПМК 2756830 . ПМИД 19678899 .
- ^ Тетер, Кен (10 декабря 2013 г.). «Нестабильность токсина и ее роль в транслокации токсина из эндоплазматической сети в цитозоль» . Биомолекулы . 3 (4): 997–1029. дои : 10.3390/biom3040997 . ПМК 4030972 . ПМИД 24970201 . (ПДИ)
- ^ Торп, CM (1 мая 2004 г.). «Токсин Шига — вызывает инфекцию Escherichia coli» . Клинические инфекционные болезни . 38 (9): 1298–1303. дои : 10.1086/383473 . ПМИД 15127344 .
- ^ Бэкер, Дж. М.; Кривошеин А.В.; Хэмби, резюме; Пиццония, Дж; Гилберт, Канзас; Рэй, Ю.С.; Бренд, Х; Патон, AW; Патон, Дж. К.; Бэкер, М.В. (ноябрь 2009 г.). «Цитотоксин, нацеленный на шаперон, и препарат, вызывающий стресс эндоплазматического ретикулума, действуют синергично, убивая раковые клетки» . Неоплазия . 11 (11): 1165–73. дои : 10.1593/neo.09878 . ПМК 2767218 . ПМИД 19881952 .
- ^ Нортон, Э.Б.; Лоусон, LB; Махди, З.; Фрейтаг, ЖК; Клементс, JD (23 апреля 2012 г.). «Субъединица термолабильного энтеротоксина Escherichia coli действует как адъювант слизистой оболочки и способствует реакции IgG2a, IgA и Th17 на вакцинные антигены» . Инфекция и иммунитет . 80 (7): 2426–2435. дои : 10.1128/IAI.00181-12 . ПМЦ 3416479 . ПМИД 22526674 .
- ^ Вельцин, Р; Гай, Б; Томас В.Д., младший; Джаннаска, ПиДжей; Монат, ТП (май 2000 г.). «Парентеральная адъювантная активность термолабильного токсина Escherichia coli и его субъединицы B для иммунизации мышей против желудочной инфекции Helicobacter pylori» . Инфекция и иммунитет . 68 (5): 2775–82. дои : 10.1128/iai.68.5.2775-2782.2000 . ПМК 97487 . ПМИД 10768972 .
- ^ Лян, XP; Ламм, Мэн; Недруд, Дж. Г. (1 сентября 1988 г.). «Пероральное введение конъюгата холерного токсина и вируса Сендай усиливает кишечный и респираторный иммунитет против вируса Сендай» . Журнал иммунологии . 141 (5): 1495–501. дои : 10.4049/jimmunol.141.5.1495 . ПМИД 2842395 . S2CID 31084557 .
- ^ Мажуль, IV; Гао, Л; Бетциг, Э; Онищук, Д; Буткевич Э; Козлов Ю.; Букаускас, Ф; Беннетт, М.В.; Липпинкотт-Шварц, Дж; Дуден, Р. (29 октября 2013 г.). «Быстрые структурные реакции мембранных доменов щелевых соединений на токсины AB5» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (44): E4125–33. Бибкод : 2013PNAS..110E4125M . дои : 10.1073/pnas.1315850110 . ПМЦ 3816413 . ПМИД 24133139 .
- ^ Бёрнер, С; Шведе, Ф; Шлипп, А; Бериша, Ф; Калебиро, Д; Лозе, MJ; Николаев, ВО (апрель 2011 г.). «Измерения FRET внутриклеточных концентраций цАМФ и проницаемости аналога цАМФ в интактных клетках». Протоколы природы . 6 (4): 427–38. дои : 10.1038/нпрот.2010.198 . ПМИД 21412271 . S2CID 20671081 .
Внешние ссылки
[ редактировать ]- Бактериальные токсины AB5
- Держись, Пол. «Введение в технологию флуоресцентно-резонансной передачи энергии (FRET) и ее применение в биологии» . БиоТек Инструментс, Инк.