Clostridioides difficile токсин B
| Clostridioides difficile токсин B | |||
|---|---|---|---|
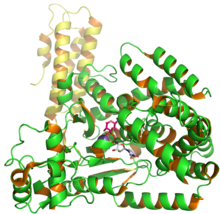 Структура токсина B глюкозилтрансферазы C. difficile, показывающая UDP и глюкозу из записи 2BVM в PDB. [1] | |||
| Идентификаторы | |||
| Организм | |||
| Символ | токсБ | ||
| Альт. символы | tcdB | ||
| Входить | 4914074 | ||
| ПДБ | 2БВМ | ||
| RefSeq (защита) | YP_001087135.1 | ||
| ЮниПрот | P18177 | ||
| Другие данные | |||
| Номер ЕС | 2.4.1.- | ||
| хромосома | геном: 0,79 - 0,8 Мб | ||
| |||
| N-концевой спиральный домен токсина TcdB | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ТкдБ_Н | ||
| Пфам | PF12918 | ||
| |||
| Домен каталитической гликозилтрансферазы TcdA/TcdB | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | TcdA_TcdB | ||
| Пфам | PF12919 | ||
| |||
| Семейство пептидаз C80 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Пептидаза_C80 | ||
| Пфам | ПФ11713 | ||
| ИнтерПро | ИПР020974 | ||
| |||
| Порообразующий домен TcdA/TcdB | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | TcdA_TcdB_pore | ||
| Пфам | ПФ12920 | ||
| TCDB | 1.С.57 | ||
| Суперсемейство OPM | 199 | ||
| белок OPM | 6белый6 | ||
| |||
Clostridioides difficile Токсин B ( TcdB ) представляет собой цитотоксин , продуцируемый бактериями Clostridioides difficile . Это один из двух основных видов токсинов , вырабатываемых C. difficile , второй — родственный энтеротоксин ( токсин А ). Оба очень сильны и смертоносны. [2] [3]
Структура
[ редактировать ]Токсин B (TcdB) представляет собой цитотоксин с молекулярной массой 270 кДа и изоэлектрической точкой pl 4,1. [4] Токсин B имеет четыре различных структурных домена: каталитический , цистеинпротеазный , транслокационный и рецепторсвязывающий . [5] Каталитический домен N-концевой глюкозилтрансферазы включает аминокислотные остатки 1–544, тогда как домен цистеиновой протеазы включает остатки 545–801. Кроме того, область транслокации включает аминокислотные остатки от 802 до 1664, тогда как область связывания рецептора является частью С-концевой области и включает аминокислотные остатки от 1665 до 2366. [5]

Гликозилирующая активность токсина В проявляется в N-концевой каталитической области (остатки 1–544). Эта область гликозилирует субстраты независимо от какой-либо цитотоксической активности. [6] Однако небольшая делеция области связывания рецептора вызывает ослабление активности токсина B. [6] Область транслокации содержит гидрофобную стебельчатую структуру, которая может способствовать остаткам 958–1130 в формировании пор , охватывающих мембрану . [5] Область связывания рецептора, включающая С-концевую повторяющуюся область (CRR), увеличивает мембранное взаимодействие TcdB, но не участвует в образовании пор. [7] Кроме того, цистеиновая протеаза и области транслокации имеют сложную структуру, которая играет важную функциональную роль в транслокации и связывании рецепторов. [8] Однако удаление области транслокации аминокислот снижает цитотоксическую активность в 4 раза. Как цистеиновые протеазы , так и большинство областей транслокации содержат гидрофобные белки, которые имеют доступ кк TcdB и другим токсинам, проникающим через клеточные мембраны . [8]
Рецептор-связывающий домен
[ редактировать ]С -конец TcdB (зеленая область на рис. 2) содержит область, известную как комбинированные повторяющиеся олигопептиды (CROP), которая содержит аминокислотные остатки 1831–2366. [9] Эти CROP составляют 19–24 коротких повтора (SR) аминокислот, примерно 31 длинный повтор (LR) аминокислот, токсина A и токсина B. [9] [10] Область TcdB CROPs состоит из 19 SR и 4 LR. Эта область SR и LR позволяет формировать мотивы связывания клеточной стенки, которые помогают связывать сахарные фрагменты клеточных поверхностей. [9]
Очистка
[ редактировать ]Для очистки токсина B из C. difficile культур клеток используется бульон из мозго-сердечного настоя , поскольку он способствует синтезу токсина B. [11] Метод фильтрации облегчает очистку токсина В от надосадочной жидкости C. difficile . токсина Концентрация в супернатанте пропорциональна количеству клеток организма. Во многих исследованиях было высказано предположение, что большинство токсинов высвобождаются либо в поздней лог-фазе , либо в ранних стационарных фазах , следовательно, токсин B постоянно секретируется клетками. [2] Хотя в различных исследованиях используется множество методов очистки токсина B, в большинстве исследований используются методы, включающие концентрацию ультрафильтрованного сульфата аммония или осаждение вместо гель-фильтрации или ионообменной хроматографии . Кроме того, эффективность метода ионообменной хроматографии помогает дифференцировать TcdA и TcdB. [ нужна ссылка ]
Функция
[ редактировать ]Когда каталитический треонина остаток глюкозилтрансферазы дезактивирует семейство малых ГТФаз , например семейство Rho ; Rac и Cdc42 внутри клеток- нарушают механизмы передачи сигнала , что приводит к нарушению функции актинового цитоскелета , межклеточного мишеней соединения и апоптозу (рис. 5). [12] [13] [14] Rho индуцирует активность актиновых стрессовых волокон . Rac Белки контролируют активность мембранных складок и НАДФН -оксидазы нейтрофилов . Cdc42 регулирует образование филаментов F-актина в филоподиях . [ нужна ссылка ]
Цитотоксичность
[ редактировать ]
Несколько исследований показали, что присутствие TcdB в клетках млекопитающих приводит к быстрым изменениям в клеток морфологии и передаче сигналов в клетках . В течение короткого периода времени клетки приобретают вид бляшек при небольших дозировках TcdB и TcdA. Кроме того, смерть клеток является основным воздействием этих токсинов после того, как клетки были отравлены . Исследование Донты и др. показало, что TcdB оказывает серьезное воздействие на другие клетки млекопитающих, такие как клетки яичника китайского хомячка , эпителиальные клетки шейки матки человека , надпочечников клетки мыши, гепатоциты крыс и астроциты крыс (рис. 3). [15] [16]
Цитотоксическая . активность зависит от типа клеток, которая может варьироваться от 4-кратной до 200-кратной Обычно, когда клетки инфицированы TcdB, они не только теряют свою структурную целостность, но и уменьшают количество F-актина филаментов . [17] Округление клеток с помощью TcdB занимает не более 2 часов (рис. 4), но что касается гибели клеток , то это может занять около 24 часов. [15] Что касается C. difficile диареи, связанной с (CDAD), эффекты цитопатии более важны, чем фактическая гибель клеток, поскольку, как только клетки теряют целостность цитоскелета актиновых филаментов , они также теряют свою нормальную функцию. [ нужна ссылка ]

Влияние на малые GTPases
[ редактировать ] этого раздела Фактическая точность оспаривается . ( июнь 2013 г. ) |
Причина цитотоксической активности TcdB в клетке-хозяине в основном опосредована эндоцитозом рецептора . [ нужна ссылка ] . Кислые эндосомы позволяют токсину B проникать в цитозоль . Это явление происходит за счет связывания рецепторной области, которая позволяет токсину проникать в клетки-хозяева. [ нужна ссылка ] . Благодаря доступности цитозоля клеток-хозяев TcdB дезактивирует малые GTPases (рис. 5), например, Rho семейства Rac и Cdc42, посредством процесса гликозилирования треонина членов 35 в Cdc42 и Rac и треонина 37 в Rho. [18] [19] Эти Rho-ГТФазы повсеместно обнаруживаются в цитозоле эукариотических клеток и отвечают за организацию актинового цитоскелета , поскольку токсины в цитозоле вызывают конденсацию актиновых филаментов вследствие округления клеток и образования мембранных пузырьков (рис. 3), что в конечном итоге приводит к приводит к апоптозу . [20] [21] TcdB вызывает критические изменения в динамике и морфологии клеток . На рисунке 3 показано возможное воздействие токсина B на поверхность клетки; мембранное пузырение (черные стрелки). [22] Кроме того, TcdB инактивирует Rho GTPases. Вследствие этого нарушаются межклеточные соединения, что усиливает проницаемость эпителия для токсина В и накопление жидкости в просвете. Это один из основных возбудителей заражения C. difficile -ассоциированной диареей (CDAD) (рис. 5). [23] [24]

Кроме того, скорость гидролиза TcdB УДФ-глюкозы примерно в пять раз выше, чем TcdA. [25] Несколько исследований показали, что Rho демонстрирует посттрансляционную модификацию посредством пренилирования и карбоксиметилирования, которое происходит на цитоплазматической стороне плазматической мембраны и, следовательно, происходит обмен ГТФ на ВВП . [26] Когда TcdB связывается с Rho и другими малыми GTPases , GTP гидролизуется до GDP , что приводит к GTP-связанному (активному) к GDP-связанному (неактивному) (рис. 5). Кроме того, эта обменная активность регулируется гуаниновыми факторами в цитозоле клетки. [27]
Нарушение сигнальных путей
[ редактировать ]Клеточная регуляция Rho, Rac и Cdc42 действует за пределами актиновых нитей цитоскелета (рис. 4). [17] Эти небольшие ГТФазы включены в клеточный цикл , который регулирует сигналы посредством митоген-активируемых протеинкиназных киназ (MAPKK). [28] Некоторые физиологические части клеток, которые не участвуют в актиновых нитях округления клеток или гибели клеток , могут не вызывать немедленного , но в результате активности последующих путей могут приводить к ухудшению актиновых нитей и, наконец, гибели клеток . [17]
В 1993 году исследование, проведенное Шошаном и др., показало, что клетки с TcdB изменили активность фосфолипазы А2 . Это событие было независимым от разрушения актинового цитоскелета . [29] Шошан и др. также показали, что TcdB ингибирует сигнальную активность рецептора путем деактивации белков Rho с помощью фосфолипазы D. [29]
Образование пор
[ редактировать ]TcdB проникает внутрь клетки посредством клатрин-опосредованного эндоцитоза . [30] Когда токсин B входит в состав цитозоля , глюкозилтрансфераза проходит через эндосомальную мембрану , что снижает pH, индуцирует транслокацию и, в конечном итоге, приводит к морфологическим изменениям остатков транслокационной области (958–1130). [31] Гидрофобные проходят области встроены в мембрану хозяина, образуя поры, через которые глюкозилтрансферазы . домены [31] Когда клетки заражаются TcdB в кислой среде, он ослабляет токсины и вызывает перестройку формы (рис. 6). [31] Вследствие кислого pH TcdB демонстрирует четкие различия в исходной флуоресценции триптофана , чувствительности к протеазам и гидрофобных поверхностях. [31] Другая группа показала, что подкисление приводит к конформационным изменениям токсина и, что более важно, способствует образованию пор. [7] Предполагаемая область транслокации (рис. 2) состоит примерно из 801–1400 аминокислот, из которых остатки 958–1130 являются гидрофобными и ответственны за образование трансмембранных пор. [20] В большинстве исследований использовался штамм TcdB 630, чтобы продемонстрировать активность токсинов C. difficile в формировании пор . [31]
Вызвано pH
[ редактировать ]ли эффект протеолитического расщепления Чтобы выяснить , происходит TcdB на поверхности клетки или в кислых эндосомах , в исследованиях использовался бафиломицин А1 , который, как известно, блокирует H v-типа. + -АТФазы эндосом. Это снижает кислотность эндосом. [31] Физиологический . путь поглощения TcdB предотвращает цитопатическую активность TcdB [31] Когда клетки находились в кислых условиях (pH 4,0) в течение 5 минут после связывания TcdB с поверхностью клетки при 37 градусах Цельсия, наблюдались перестройки формы и округление. Однако когда округлые клетки инкубировали в течение дополнительного часа при нейтральном pH (7,0) с аналогичными параметрами, округления клеток не наблюдалось. [15] [31] Оба исследования показали, что токсин В обладает свойством протеолитического расщепления , что имеет решающее значение для доступа в цитозоль . [7] [15] [31] Наличие кислого pH эндосомы приводит к топологическим изменениям TcdB (рис. 6). [7]

Генетика
[ редактировать ]Ген, кодирующий белок TcdB, , расположен в хромосомной области размером 19,6 т.п.н. tcdB Это известно как локус патогенности или PaLoc (рис . 2). [32] [33] открытой рамки считывания (ORF) tcdB составляет 7098 нуклеотидов . Длина [17] Важно отметить, что помимо основных генов токсина в регионе PaLoc, есть еще три дополнительных гена , которые кодируют регион PaLoc: tcdR (L), tcdC (R) и tcdE в середине. Эти гены помогают регулировать экспрессию TcdA и TcdB. Они также помогают секретировать или выводить токсины из клетки. [17] Кодирующий ген tcdE , расположенный между tcdB и tcdA, аналогичен белкам холина , таким образом, предполагается, что tcdE действует как ген- посредник , который усиливает высвобождение или секрецию TcdA и TcdB, тем самым увеличивая проницаемость хозяина мембраны клетки- . [17]

Обнаружение токсинов
[ редактировать ]Существуют разные плазмид размеры C. difficile . Обнаруженные молекулярные массы находятся в диапазоне 2,7x10 6 до 100x10 6 , но размеры плазмид не коррелируют с токсичностью . Чтобы определить уровень токсина B в C. difficile , врачи широко используют анализы клеточных культур, полученных из образцов стула пациентов с ПМК . [2] [3] Анализ клеточной культуры считается «золотым стандартом» для выявления токсичности C. difficile , поскольку небольшое количество токсина B способно вызывать округление клеток (рис. 4). корреляции с CDAD, вызванные TcdB. [2] [3] Хотя цитотоксическая активность крупных клостридиальных токсинов (LCT) была обнаружена в образцах стула пациентов с ПМК, активность токсина B имела более вредные цитотоксические эффекты по сравнению с токсином A. [2] Следовательно, активность токсина А снижается, если он не изолирован от токсина В. [2] [3] Обнаружение C. difficile токсичности чрезвычайно чувствительно, однако использование анализа клеточной культуры позволяет клиническим лабораториям решить эту проблему; использования дозы всего лишь 1 пг/мл токсина B достаточно, чтобы вызвать округление клеток. [2] [3] Это главное преимущество использования анализа культуральной ткани для выявления токсичности у пациентов с ПМК . [2] Несмотря на то, что клинические лаборатории пытались использовать иммуноферментный анализ на микротитрационном планшете (ELISA) и другие методы для обнаружения цитотоксической активности токсина B в фекалиях пациентов с ПМК , результаты не так точны, как те, которые проводились при клеточных культур. анализе были использованы. [2] [3] [34]
Производственный фактор
[ редактировать ]при добавлении противомикробного препарата , например клиндамицина Исследования показали, что , в питательную среду культуры цитотоксическая активность в культурах C. difficile увеличивается в 4–8 раз. [35] [36] Более того, зная роль антибиотиков в причинах ПМК, многие более ранние исследования были сосредоточены на влиянии противомикробных препаратов на выработку токсинов. В результате исследования смогли прийти к выводу, что субингибирующая природа уровней ванкомицина и пенициллина увеличивает выработку токсина в культурах C. difficile . [37] Количество продукции токсинов коррелировало с использованием питательной среды для организмов. Другое исследование показало, что высокие уровни продукции токсина TcdB наблюдались в сложных средах, таких как бульон для настоя мозга и сердца . [38] [39] Высокие уровни токсинов были получены при выделении высоковирулентных видов . И наоборот, низкие уровни токсинов были получены при выделении слабовирулентных токсинов . Таким образом, это показывает, что выработка токсинов регулировалась совместно. Хотя механизм участия окружающей среды в модуляции сигналов, экспрессирующих токсины, не понятен, исследования in vitro показали, что экспрессия токсина усиливается за счет катаболитной репрессии и стресса, например, антибиотиков . [40] [41] [42] Другое исследование показало, что ограничение биотина в хорошо изученной среде увеличивает выработку TcdB в 64 раза, а TcdA — в 35 раз. Это было сделано с C. difficile и дозами биотина всего 0,05 нМ. [41] Несколько других ранних исследований выступили против теории о том, что выработка токсина как-то связана со стрессом или катаболитной репрессией токсина TcdA или TcdB. [42] Кроме того, во многих исследованиях говорится, что основная причина различий между другими исследованиями связана с тем, что продукция токсина происходит не со всеми изолятами C. difficile . [ нужна ссылка ]
Клиническое значение
[ редактировать ]Многие ранние исследования показали, что токсин А (также известный как TcdA) является основным белком-токсином, вызывающим диарею, связанную с приемом антибиотиков (ААД); однако ученые-исследователи за последнее десятилетие или около того показали, что токсин B (или TcdB) играет более важную роль в заболеваниях, чем кто-либо прогнозировал. Благодаря этим знаниям токсин B был идентифицирован как основной фактор вирулентности , вызывающий открытие плотных соединений эпителиальных клеток кишечника , что позволяет токсину увеличивать проницаемость сосудов и вызывать кровотечение . Следовательно, это приводит к тому, что фактор некроза опухоли α (TNF α) и провоспалительные интерлейкины становятся основными возбудителями псевдомембранозного колита (ПМК) и антибиотикоассоциированной диареи (ААД). [2] [3] [43]
Участие токсина А и, что наиболее важно, токсина В является ключевым элементом, определяющим заболевание, вызываемое C. difficile . Клинические лаборатории идентифицировали эти токсины в кале пациентов на основании на антитела и анализов цитотоксичности . [44] Было показано, что эти бактериальные токсины связаны с токсином Clostridium sordellii геморрагическим (TcsH), летальным токсином (TcsL) и альфа-токсином Clostridium novyi (Tcn α), что делает эту когорту большим семейством клостридиальных токсинов. [17] Из-за сходства этих токсинов с другими исследователи отнесли их к семейству крупных клостридиальных токсинов (LCT). [9]
Механизм действия безлотоксумаба с TcdB
[ редактировать ]Безлотоксумаб — человеческое моноклональное антитело, разработанное для профилактики рецидивов инфекций, вызванных Clostridium difficile. С помощью рентгеновской кристаллизации N-конца TcdB было идентифицировано, что токсин состоит из трех доменов: домена глюкозилтрансферазы (GTD), цистеиновой протеазы и домена комбинированного повторяющегося олигопептида (CROP). Безлотоксумаб специфически связывается с двумя гомологичными сайтами в CROP-домене TcdB. Структурный анализ с помощью рентгеновской кристаллографии показывает, что связывание антител частично закупоривает предполагаемые карманы связывания углеводов. В соответствии с этой идеей безлотоксумаб блокирует связывание TcdB с клетками млекопитающих. [45]
Роль в псевдомембранозном колите
[ редактировать ]на ранних стадиях заболевания ПМК Многие исследования предполагают, что TcdA более эффективен, чем TcdB. Это было установлено на основе экспериментов in vivo, в которых продукция токсина TcdA была более серьезной, чем TcdB, при цеците, вызванном антибиотиками. [38] [46] Позже несколько исследований показали, что TcdB играет важную роль в заболевании ПМК и СДВ. Исследование показало, что, хотя C. difficile не продуцирует TcdA, у него все равно проявляются симптомы заболевания. [47] Более того, более поздние исследования показали, что очищенная форма TcdB является более летальным энтеротоксином по сравнению с TcdA, а также что эпителий кишечника сильно повреждается и вызывает острую воспалительную реакцию. [48] Благодаря лучшему пониманию токсина исследователи смогли заявить, что TcdB является основным фактором вирулентности , вызывающим CDI, а не TcdA. Однако когда TcdA присутствует в кишечнике, это помогает облегчить активность TcdB, оказывая более широкое воздействие и, следовательно, затрагивая несколько систем органов. [49] Кроме того, когда хомяков вакцинировали против TcdA, выяснилось, что хомяки не были полностью защищены от болезни C. difficile , и это привело исследования к выводу, что TcdB очень смертелен и эффективен. [50] Более того, введение небольшой дозы TcdA вместе со смертельной дозой TcdB внутривенно или внутрибрюшинно оказалось достаточным для того, чтобы вызвать смерть животного. Таким образом, TcdA способствует выходу TcdB из кишечника. [50]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Райнерт DJ, Янк Т, Акториес К, Шульц Г.Е. (сентябрь 2005 г.). «Структурная основа функции токсина B Clostridium difficile ». Журнал молекулярной биологии . 351 (5): 973–81. дои : 10.1016/j.jmb.2005.06.071 . ПМИД 16054646 .
- ^ Jump up to: а б с д и ж г час я дж Лиерли Д.М., Криван Х.К., Уилкинс Т.Д. (январь 1988 г.). « Clostridium difficile : ее болезни и токсины» . Обзоры клинической микробиологии . 1 (1): 1–18. дои : 10.1128/cmr.1.1.1 . ПМК 358025 . ПМИД 3144429 .
- ^ Jump up to: а б с д и ж г Бартлетт Дж.Г. (1990). « Clostridium difficile : клинические соображения». Обзоры инфекционных болезней . 12 (Приложение 2): С243–51. doi : 10.1093/clinids/12.Supplement_2.S243 . ПМИД 2406876 .
- ^ фон Эйхель-Штрайбер С (1997). «Энтеротоксин А и цитотоксин В ( Clostridium difficile )». В Монтекукко С., Раппуоли Р. (ред.). Путеводитель по белковым токсинам и их использованию в клеточной биологии . Оксфорд [Оксфордшир]: Издательство Оксфордского университета. п. 72. ИСБН 978-0-19-859954-8 .
- ^ Jump up to: а б с Альбеса-Хове Д., Бертран Т., Карпентер Э.П., Суэйн Г.В., Лим Дж., Чжан Дж., Хайре Л.Ф., Васишт Н., Браун В., Ланге А., фон Эйхель-Штрайбер К., Свергун Д.И., Фэйрвезер Н.Ф., Браун К.А. (март 2010 г.) . «Четыре различных структурных домена токсина B Clostridium difficile , визуализированные с помощью SAXS». Журнал молекулярной биологии . 396 (5): 1260–70. дои : 10.1016/j.jmb.2010.01.012 . ПМИД 20070948 .
- ^ Jump up to: а б Хофманн Ф., Буш К., Препенс Ю, Джаст И, Акториес К. (апрель 1997 г.). «Локализация глюкозилтрансферазной активности токсина B Clostridium difficile в N-концевой части голотоксина» . Журнал биологической химии . 272 (17): 11074–8. дои : 10.1074/jbc.272.17.11074 . ПМИД 9111001 .
- ^ Jump up to: а б с д Барт Х., Пфайфер Г., Хофманн Ф., Майер Э., Бенц Р., Акториес К. (апрель 2001 г.). «Образование ионных каналов токсином B Clostridium difficile в клетках-мишенях, вызванное низким pH» . Журнал биологической химии . 276 (14): 10670–6. дои : 10.1074/jbc.M009445200 . ПМИД 11152463 .
- ^ Jump up to: а б Янк Т., Aktories K (май 2008 г.). «Структура и механизм действия клостридиальных глюкозилирующих токсинов: модель ABCD». Тенденции в микробиологии . 16 (5): 222–9. дои : 10.1016/j.tim.2008.01.011 . ПМИД 18394902 .
- ^ Jump up to: а б с д фон Эйхель-Штрайбер С., Буке П., Зауэрборн М., Телестам М. (октябрь 1996 г.). «Большие клостридиальные цитотоксины - семейство гликозилтрансфераз, модифицирующих небольшие GTP-связывающие белки». Тенденции в микробиологии . 4 (10): 375–82. дои : 10.1016/0966-842X(96)10061-5 . ПМИД 8899962 .
- ^ Янк Т., Гиземанн Т., Акториес К. (апрель 2007 г.). «Роглюкозилирующие токсины A и B Clostridium difficile: новый взгляд на структуру и функцию» . Гликобиология . 17 (4): 15П–22П. дои : 10.1093/гликоб/cwm004 . ПМИД 17237138 .
- ^ Мидор Дж., Тветен Р.К. (июль 1988 г.). «Очистка и характеристика токсина B Clostridium difficile » . Инфекция и иммунитет . 56 (7): 1708–14. дои : 10.1128/iai.56.7.1708-1714.1988 . ПМК 259466 . ПМИД 3384474 .
- ^ Aktories K, Just I (декабрь 1995 г.). «Моноглюкозилирование низкомолекулярных GTP-связывающих белков Rho клостридиальными цитотоксинами». Тенденции в клеточной биологии . 5 (12): 441–3. дои : 10.1016/S0962-8924(00)89107-2 . ПМИД 14732022 .
- ^ Диллон С.Т., Рубин Э.Дж., Якубович М., Потулакис С., Ламонт Дж.Т., Фейг Л.А., Гилберт Р.Дж. (апрель 1995 г.). «Участие Ras-родственных Rho-белков в механизмах действия Clostridium difficile токсина A и токсина B » . Инфекция и иммунитет . 63 (4): 1421–6. дои : 10.1128/iai.63.4.1421-1426.1995 . ПМК 173169 . ПМИД 7890404 .
- ^ Уилкинс Т.Д., Лайерли Д.М. (февраль 1996 г.). « Токсины Clostridium difficile атакуют Ро». Тенденции в микробиологии . 4 (2): 49–51. дои : 10.1016/0966-842X(96)81508-3 . ПМИД 8820565 .
- ^ Jump up to: а б с д Пфайфер Дж., Ширмер Дж., Лимхейс Дж., Буш С., Мейер Д.К., Акториес К., Барт Х. (ноябрь 2003 г.). «Клеточное поглощение токсина B Clostridium difficile . Транслокация N-концевого каталитического домена в цитозоль эукариотических клеток» . Журнал биологической химии . 278 (45): 44535–41. дои : 10.1074/jbc.M307540200 . ПМИД 12941936 .
- ^ Донта С.Т., Салливан Н., Уилкинс Т.Д. (июнь 1982 г.). «Дифференциальное воздействие токсинов Clostridium difficile на клетки, культивируемые в тканях» . Журнал клинической микробиологии . 15 (6): 1157–8. doi : 10.1128/jcm.15.6.1157-1158.1982 . ПМЦ 272271 . ПМИД 7107845 .
- ^ Jump up to: а б с д и ж г Вот Д.Э., Баллард Дж.Д. (апрель 2005 г.). « Токсины Clostridium difficile : механизм действия и роль в заболевании» . Обзоры клинической микробиологии . 18 (2): 247–63. doi : 10.1128/CMR.18.2.247-263.2005 . ПМЦ 1082799 . ПМИД 15831824 .
- ^ Просто я, Зельцер Дж., Вильм М., фон Эйхель-Штрайбер С., Манн М., Актерес К. (июнь 1995 г.). «Глюкозилирование белков Rho токсином B Clostridium difficile ». Природа . 375 (6531): 500–3. Бибкод : 1995Natur.375..500J . дои : 10.1038/375500a0 . ПМИД 7777059 . S2CID 4334048 .
- ^ Джаст Я, Вильм М., Зельцер Дж., Рекс Г., фон Эйхель-Штрайбер С., Манн М., Актерес К. (июнь 1995 г.). «Энтеротоксин Clostridium difficile (ToxA) моноглюкозилирует белки Rho» . Журнал биологической химии . 270 (23): 13932–6. дои : 10.1074/jbc.270.23.13932 . ПМИД 7775453 .
- ^ Jump up to: а б фон Эйхель-Штрайбер С., Варфоломеов I, Кнауц Д., Зауэрборн М., Хаддинг У. (ноябрь 1991 г.). «Морфологические изменения в прикрепившихся клетках, вызванные токсинами Clostridium difficile » (PDF) . Труды Биохимического общества . 19 (4): 1154–60. дои : 10.1042/bst0191154 . ПМИД 1794484 .
- ^ Телестам М., Чавес-Оларте Э. (2000). «Цитотоксические эффекты токсинов Clostridium difficile». Клостридия диффициле . Актуальные темы микробиологии и иммунологии. Том. 250. С. 85–96. дои : 10.1007/978-3-662-06272-2_4 . ISBN 978-3-642-08668-7 . ПМИД 10981358 .
- ^ Фиорентини С, Фаббри А, Фальцано Л, Фатторосси А, Матаррезе П, Ривабене Р, Донелли Г (июнь 1998 г.). « Токсин B Clostridium difficile индуцирует апоптоз в культивируемых клетках кишечника» . Инфекция и иммунитет . 66 (6): 2660–5. дои : 10.1128/IAI.66.6.2660-2665.1998 . ПМЦ 108253 . ПМИД 9596731 .
- ^ Фелтис Б.А., Виснер С.М., Ким А.С., Эрландсен С.Л., Лайерли Д.Л., Уилкинс Т.Д., Уэллс К.Л. (декабрь 2000 г.). « Токсины A и B Clostridium difficile могут изменять проницаемость эпителия и способствовать межклеточной миграции бактерий через энтероциты HT-29» . Шок . 14 (6): 629–34. дои : 10.1097/00024382-200014060-00010 . ПМИД 11131913 .
- ^ Джохал С.С., Соломон К., Додсон С., Борриелло С.П., Махида Ю.Р. (июнь 2004 г.). «Дифференциальное влияние различных концентраций токсина А Clostridium difficile на функцию эпителиального барьера и экспрессию цитокинов» . Журнал инфекционных болезней . 189 (11): 2110–9. дои : 10.1086/386287 . ПМИД 15143480 .
- ^ Чесла В.П., Бобак Д.А. (июнь 1998 г.). « Токсины А и В Clostridium difficile представляют собой катион-зависимые УДФ-глюкозогидролазы с различной каталитической активностью» . Журнал биологической химии . 273 (26): 16021–6. дои : 10.1074/jbc.273.26.16021 . ПМИД 9632652 .
- ^ Адамсон П., Маршалл С.Дж., Зал А, Тилбрук, Пенсильвания (октябрь 1992 г.). «Посттрансляционные модификации белков p21rho» . Журнал биологической химии . 267 (28): 20033–8. дои : 10.1016/S0021-9258(19)88661-1 . ПМИД 1400319 .
- ^ Чжоу К., Ван Ю., Горски Дж.Л., Номура Н., Коллард Дж., Бокоч Г.М. (июль 1998 г.). «Факторы обмена гуаниновых нуклеотидов регулируют специфичность последующей передачи сигналов от Rac и Cdc42» . Журнал биологической химии . 273 (27): 16782–6. дои : 10.1074/jbc.273.27.16782 . ПМИД 9642235 .
- ^ Чжан И, Донг С. (ноябрь 2007 г.). «Регуляторные механизмы передачи сигналов митоген-активируемой киназы» . Клеточные и молекулярные науки о жизни . 64 (21): 2771–89. дои : 10.1007/s00018-007-7012-3 . ПМЦ 11136274 . ПМИД 17726577 . S2CID 21440134 .
- ^ Jump up to: а б Шошан MC, Флорин I, Телестам М (май 1993 г.). «Активация клеточной фосфолипазы А2 токсином B Clostridium difficile ». Журнал клеточной биохимии . 52 (1): 116–24. дои : 10.1002/jcb.240520115 . ПМИД 8320270 . S2CID 2724637 .
- ^ Папатеодору П., Замбоглу С., Генисюерек С., Гуттенберг Г., Акториес К. (май 2010 г.). «Клостридиальные глюкозилирующие токсины проникают в клетки посредством клатрин-опосредованного эндоцитоза» . ПЛОС ОДИН . 5 (5): е10673. Бибкод : 2010PLoSO...510673P . дои : 10.1371/journal.pone.0010673 . ПМЦ 2871790 . ПМИД 20498856 .
- ^ Jump up to: а б с д и ж г час я Ка'Дан М., Спайрс Л.М., Баллард Дж.Д. (май 2000 г.). «РН-индуцированные конформационные изменения токсина B Clostridium difficile » . Инфекция и иммунитет . 68 (5): 2470–4. дои : 10.1128/IAI.68.5.2470-2474.2000 . ПМК 97448 . ПМИД 10768933 .
- ^ Картер Г.П., Руд Дж.И., Лирас Д. (январь 2012 г.). «Роль токсина А и токсина В в вирулентности Clostridium difficile ». Тенденции в микробиологии . 20 (1): 21–9. дои : 10.1016/j.tim.2011.11.003 . ПМИД 22154163 .
- ^ Браун В., Хундсбергер Т., Лейкель П., Зауэрборн М., фон Эйхель-Штрайбер С. (ноябрь 1996 г.). «Определение единого сайта интеграции локуса патогенности Clostridium difficile ». Джин . 181 (1–2): 29–38. дои : 10.1016/S0378-1119(96)00398-8 . ПМИД 8973304 .
- ^ Мушер Д.М., Манхас А., Джайн П., Нуила Ф., Вакар А., Логан Н., Марино Б., Грависс Э.А. (август 2007 г.). «Обнаружение токсина Clostridium difficile : сравнение результатов иммуноферментного анализа с результатами, полученными методом цитотоксичности» . Журнал клинической микробиологии . 45 (8): 2737–9. дои : 10.1128/JCM.00686-07 . ЧВК 1951241 . ПМИД 17567791 .
- ^ Накамура С., Микава М., Танабэ Н., Ямакава К., Нисида С. (1982). «Влияние клиндамицина на продукцию цитотоксина Clostridium difficile » . Микробиология и иммунология . 26 (11): 985–92. дои : 10.1111/j.1348-0421.1982.tb00248.x . ПМИД 7167065 .
- ^ Джордж Р.Х., Джонсон М., Янгс Д., Бердон Д.В. (1980). «Индукция токсина Clostridium difficile антибиотиками». Современная химиотерапия и инфекционные заболевания . 2 (1): 955–56.
- ^ Ондердонк А.Б., Лоу Б.Р., Бартлетт Дж.Г. (октябрь 1979 г.). «Влияние экологического стресса на уровень токсина Clostridium difficile во время непрерывного культивирования» . Прикладная и экологическая микробиология . 38 (4): 637–41. Бибкод : 1979ApEnM..38..637O . doi : 10.1128/aem.38.4.637-641.1979 . ПМЦ 243552 . ПМИД 44176 .
- ^ Jump up to: а б Лайерли Д.М., Салливан Н.М., Уилкинс Т.Д. (январь 1983 г.). «Имуноферментный анализ на токсин А Clostridium difficile » . Журнал клинической микробиологии . 17 (1): 72–8. doi : 10.1128/jcm.17.1.72-78.1983 . ПМК 272577 . ПМИД 6338036 .
- ^ Салливан Н.М., Пеллетт С., Уилкинс Т.Д. (март 1982 г.). «Очистка и характеристика токсинов А и В Clostridium difficile » . Инфекция и иммунитет . 35 (3): 1032–40. дои : 10.1128/iai.35.3.1032-1040.1982 . ПМК 351151 . ПМИД 7068210 .
- ^ Дюпюи Б., Соненшейн А.Л. (январь 1998 г.). «Регулируемая транскрипция генов токсина Clostridium difficile » . Молекулярная микробиология . 27 (1): 107–20. дои : 10.1046/j.1365-2958.1998.00663.x . ПМИД 9466260 .
- ^ Jump up to: а б Ямакава К., Карасава Т., Икома С., Накамура С. (февраль 1996 г.). «Усиление выработки токсина Clostridium difficile в условиях ограниченного биотина». Журнал медицинской микробиологии . 44 (2): 111–4. CiteSeerX 10.1.1.623.71 . дои : 10.1099/00222615-44-2-111 . ПМИД 8642571 .
- ^ Jump up to: а б Мани Н., Дюпюи Б. (май 2001 г.). «Регуляция синтеза токсина у Clostridium difficile с помощью альтернативного сигма-фактора РНК-полимеразы» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (10): 5844–9. Бибкод : 2001PNAS...98.5844M . дои : 10.1073/pnas.101126598 . ПМК 33301 . ПМИД 11320220 .
- ^ Бартлетт Дж. Г. (май 1994 г.). « Clostridium difficile : история ее роли как кишечного патогена и современное состояние знаний об организме». Клинические инфекционные болезни . 18 (Приложение 4): С265–72. doi : 10.1093/clinids/18.Supplement_4.S265 . ПМИД 8086574 .
- ^ Картер Г.П., Руд Дж.И., Лирас Д. (январь 2012 г.). «Роль токсина А и токсина В в вирулентности Clostridium difficile ». Тенденции в микробиологии . 20 (1): 21–9. дои : 10.1016/j.tim.2011.11.003 . ПМИД 22154163 .
- ^ Орт П., Сяо Л., Эрнандес Л.Д., Райхерт П., Шет П.Р., Бомонт М. и др. (июнь 2014 г.). «Механизм действия и эпитопы токсина Clostridium difficile B-нейтрализующего антитела безлотоксумаба, выявленные с помощью рентгеновской кристаллографии» . Журнал биологической химии . 289 (26): 18008–21. дои : 10.1074/jbc.m114.560748 . ПМК 4140266 . ПМИД 24821719 .
- ^ Арнон С.С., Миллс, округ Колумбия, Дэй П.А., Хенриксон Р.В., Салливан Н.М., Уилкинс Т.Д. (январь 1984 г.). «Быстрая смерть детенышей макак-резусов, которым вводили токсины A и B Clostridium difficile : физиологические и патологические основы». Журнал педиатрии . 104 (1): 34–40. дои : 10.1016/S0022-3476(84)80585-5 . ПМИД 6690674 .
- ^ Друди Д., Фэннинг С., Кайн Л. (январь 2007 г.). «Токсин А-отрицательный, токсин В-положительный Clostridium difficile » . Журнал инфекционных болезней . 11 (1): 5–10. дои : 10.1016/j.ijid.2006.04.003 . ПМИД 16857405 .
- ^ Сэвидж Т.К., Пан У.Х., Ньюман П., О'Брайен М., Антон П.М., Потулакис К. (август 2003 г.). « Токсин B Clostridium difficile представляет собой воспалительный энтеротоксин в кишечнике человека». Гастроэнтерология . 125 (2): 413–20. дои : 10.1016/S0016-5085(03)00902-8 . ПМИД 12891543 .
- ^ Добсон Дж., Хики С., Триндер Дж. (июнь 2003 г.). « Колит Clostridium difficile , вызывающий токсический мегаколон, тяжелый сепсис и синдром полиорганной дисфункции». Интенсивная медицина . 29 (6): 1030. doi : 10.1007/s00134-003-1754-7 . ПМИД 12734650 . S2CID 33185625 .
- ^ Jump up to: а б Лерли, DM; Робертс, доктор медицины; Фелпс, CJ; Уилкинс, Т.Д. (январь 1986 г.). «Очистка и свойства токсинов А и В Clostridium difficile » . Письма FEMS по микробиологии . 33 (1): 31–35. дои : 10.1111/j.1574-6968.1986.tb01206.x .