Холерный токсин

Холерный токсин (также известный как холераген и иногда сокращенно CTX , Ctx или CT ) представляет собой AB5 мультимерный белковый комплекс , секретируемый бактерией Vibrio cholerae . [1] [2] СТХ ответственен за массивную водянистую диарею, характерную для холерной инфекции. [3] Он принадлежит к семейству термолабильных энтеротоксинов .
История
[ редактировать ]Роберт Кох , немецкий врач и микробиолог, был первым человеком, постулировавшим существование холерного токсина. В 1886 году Кох предположил, что холерный вибрион выделяет вещество, вызывающее симптомы холеры . [4] Постуляция Коха была подтверждена индийским микробиологом Самбху Нат Де , который в 1951 году изучил и задокументировал последствия инъекции кроликам убитых нагреванием бактерий холеры. [5] На основании этого эксперимента Де пришел к выводу, что причиной симптомов холеры является эндотоксин, выделяющийся при распаде бактерий. [5] В 1959 году Де провел еще один эксперимент, на этот раз с использованием фильтрата культуры V. Cholera, не содержащего бактерии, введенного в тонкий кишечник кроликов. [6] В результате скопление жидкости в кишечнике окончательно доказало существование токсина. [7]
Структура
[ редактировать ]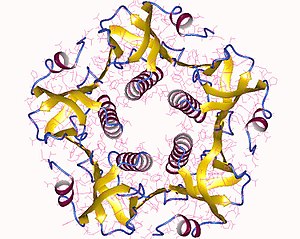
Полный токсин представляет собой гексамер, состоящий из одной копии субъединицы A (часть A, ферментативная, P01555 ) и пяти копий субъединицы B (часть B, связывание с рецептором, P01556 ), обозначаемых как AB 5 . Субъединица B связывается, а субъединица A активирует белок G, который активирует аденилатциклазу . Трехмерная структура токсина была определена с помощью рентгеновской кристаллографии Zhang et al. в 1995 году. [8]
Пять субъединиц B, каждая массой 11 кДа , образуют пятичленное кольцо. Субъединица А массой 28 кДа состоит из двух важных сегментов. Часть A1 цепи (CTA1) представляет собой глобулярную ферментативную нагрузку, которая ADP-рибозилирует G-белки , тогда как цепь A2 (CTA2) образует удлиненную альфа-спираль , которая плотно прилегает к центральной поре кольца субъединицы B. [9]
Эта структура по форме, механизму и последовательности сходна с термолабильным энтеротоксином, секретируемым некоторыми штаммами бактерии Escherichia coli .
Патогенез
[ редактировать ]Холерный токсин действует по следующему механизму: во-первых, кольцо субъединицы B холерного токсина связывается с GM1 ганглиозидами на поверхности клеток-мишеней. Если в клетке отсутствует GM1, токсин, скорее всего, связывается с другими типами гликанов , такими как Lewis Y и Lewis X , прикрепленными к белкам вместо липидов. [10] [11] [12] После связывания весь токсиновый комплекс эндоцитируется клеткой , и восстановление дисульфидного мостика высвобождает цепь холерного токсина А1 (СТА1). Эндосома шапероном перемещается в аппарат Гольджи , где белок А1 распознается эндоплазматического ретикулума (ER протеиндисульфидизомеразой , ) . Затем цепь А1 разворачивается и доставляется к мембране, где Ero1 запускает высвобождение белка А1 путем окисления комплекса протеиндисульфидизомеразы. [13] Когда белок А1 перемещается из ЭР в цитоплазму по каналу Sec61 , он рефолдируется и избегает дезактивации в результате убиквитинирования .
Затем CTA1 может свободно связываться с белком-партнером человека, называемым ARF6 (фактор АДФ-рибозилирования 6); связывание с Arf6 вызывает изменение формы CTA1, которое обнажает его активный сайт и обеспечивает его каталитическую активность. [14] Фрагмент СТА1 катализирует АДФ-рибозилирование белков субъединицы Gs-альфа (Gαs ) с использованием НАД . ADP-рибозилирование приводит к тому, что субъединица Gα s теряет свою каталитическую активность гидролиза GTP до GDP + Pi , тем самым поддерживая Gα s в активированном состоянии. Повышенная активация Gαs приводит к увеличению активности аденилатциклазы , которая увеличивает внутриклеточную концентрацию 3',5'-циклического АМФ (цАМФ) более чем в 100 раз по сравнению с нормальной и сверхактивирует цитозольную ПКА . Эти активные PKA затем фосфорилируют регулятора трансмембранной проводимости муковисцидоза (CFTR) белки хлоридных каналов что приводит к АТФ -опосредованному оттоку ионов хлора , и секреции H 2 O , Na. + , К + , и HCO 3 − в просвет кишечника . Кроме того, введение Na + и, следовательно, поступление воды в энтероциты уменьшается. Совместное воздействие приводит к быстрой потере жидкости из кишечника, до 2 литров в час, что приводит к тяжелому обезвоживанию в виде рисового отвара и другим факторам, связанным с холерой, включая стул . [15]
Токсин коклюша (также белок AB 5 ), продуцируемый Bordetella pertussis, действует аналогичным образом, за исключением того, что он ADP-рибозилирует Gα i субъединицу , что делает ее неспособной ингибировать выработку цАМФ. [16]
Источник
[ редактировать ]
Ген, кодирующий холерный токсин, был введен в V. cholerae методом горизонтального переноса генов . Вирулентные штаммы V. cholerae O1 и O139 ( серогруппы ) содержат гены вируса, известного как бактериофаг CTXφ . [17] Интегрированный ген CTXφ содержит многие гены RS1, нитчатого «сателлитного» фага, включая элементы репликации (RstA), интеграции (RstB) и регуляции экспрессии генов (RstR), а также гены, кодирующие белки, необходимые для упаковку и секрецию фагов (Psh, Cep, OrfU, Ace и Zot), которые очень похожи на гены нитчатых колифагов Ff. [17] Эти (и другие) гены обеспечивают репликацию и последующую секрецию бактериофага CTXφ, а также кодирование CTX, обеспечивая горизонтальный перенос гена CTXφ в другие восприимчивые клетки. [17]
Приложения
[ редактировать ]Поскольку субъединица B кажется относительно нетоксичной, исследователи нашли для нее ряд применений в клеточной и молекулярной биологии. Его обычно используют в качестве индикатора нейронов . [18]
Обработка культивируемых нейральных стволовых клеток грызунов холерным токсином вызывает изменения локализации транскрипционного фактора Hes3 и увеличивает их количество. [19]
Ганглиозиды GM1 обнаруживаются в липидных рафтах на поверхности клеток. Комплексы субъединиц B, меченные флуоресцентными метками или впоследствии нацеленные на антитела, можно использовать для идентификации рафтов.
Вакцина
[ редактировать ]В настоящее время существует две вакцины от холеры: Дукорал и Шанчол. В обеих вакцинах используются цельные убитые клетки V. cholerae , однако Дукорал также содержит рекомбинантный холерный токсин β (rCTB). Некоторые исследования показывают, что включение rCTB может улучшить эффективность вакцины у детей раннего возраста (2–10 лет) и увеличить продолжительность защиты. Этому противодействуют затраты на защиту и хранение rCTB от деградации. [20]
Вакцинный адъювант
[ редактировать ]Другое применение субъединицы CTB может заключаться в качестве вакцинного адъюванта к другим вакцинам. Было показано, что сочетание СТВ и антигенов улучшает реакцию вакцины. В настоящее время адъювантный потенциал CTB продемонстрирован на моделях крупных животных, поэтому необходимы дальнейшие исследования. Это может позволить использовать СТВ в качестве вспомогательного средства для вакцинации против многих видов заболеваний. Это могут быть бактериальные и вирусные инфекции, аллергия и диабет. Следует отметить, что, поскольку было показано, что СТВ индуцирует слизистой оболочки гуморальные иммунные реакции , потенциальной мишенью являются вакцины против вирусов слизистых оболочек, таких как ВИЧ. [20]
Мембранная биология
[ редактировать ]Липидные рафты
[ редактировать ]Поскольку было показано, что холерный токсин преимущественно связывается с ганглиозидами GM1, эту характеристику можно использовать для исследований мембран. Липидные рафты трудно изучать, поскольку они различаются по размеру и времени жизни, а также являются частью чрезвычайно динамичного компонента клеток. Используя холерный токсин β в качестве маркера, мы можем лучше понять свойства и функции липидных рафтов. [21]
Эндоцитоз
[ редактировать ]Эндоцитоз в общих чертах разделяют на клатрин -зависимый и клатрин-независимый процесс, и холерный токсин использует оба пути. Было показано, что холерный токсин проникает в клетки посредством эндоцитоза несколькими путями. Эти пути включают кавеолы , покрытые клатрином ямки, клатрин-независимые носители (CLIC) и GPI -обогащенных эндоцитарных компартментов ( GEECs путь ), ARF6 -опосредованный эндоцитоз и быстрый эндофилин-опосредованный эндоцитоз (FEME). Как холерный токсин запускает эти пути эндоцитоза, до конца не понятно, но тот факт, что холерный токсин запускает эти пути, показывает, что токсин можно использовать в качестве важного маркера для исследования этих механизмов. [21]
Ретроградный трафик
[ редактировать ]Одним из наиболее важных аспектов холерного токсина является механизм ретроградного движения, который транспортирует токсин из клеточной мембраны обратно в транс-сеть Гольджи и эндоплазматический ретикулум. Поскольку как холерный токсин, так и виды GM1 можно пометить флуоресцентными метками, можно отслеживать механизм ретроградного движения. Это открывает возможности для мониторинга механизма в режиме реального времени. Это может открыть новые открытия о том, как работает внутриклеточный транспорт и как происходит сортировка белков и липидов на эндоцитозном пути . [21]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Райан К.Дж.; Рэй К.Г., ред. (2004). Медицинская микробиология Шерриса (4-е изд.). МакГроу Хилл. п. 375. ИСБН 978-0-8385-8529-0 .
- ^ Фарук, Шах М; Наир, Г. Балакриш, ред. (июль 2008 г.). Холерный вибрион: геномика и молекулярная биология . Кайстер Академик Пресс. ISBN 978-1-904455-33-2 .
- ^ Айзпуруа-Олайсола, Ойер; Састре Торано, Хавьер; Пукин, Алексей; Фу, Оу; Бунс, Герт Ян; де Йонг, Герхардус Дж.; Питерс, Роланд Дж. (2018). «Аффинный капиллярный электрофорез для оценки аффинности связывания ингибиторов холерного токсина на основе углеводов». Электрофорез . 39 (2): 344–347. дои : 10.1002/elps.201700207 . ISSN 1522-2683 . ПМИД 28905402 . S2CID 33657660 .
- ^ Бхарати, Кошик; Гангули, Нирмал К. (февраль 2011 г.). «Холерный токсин: парадигма многофункционального белка» . Индийский журнал медицинских исследований . 133 (2): 179–187. ISSN 0971-5916 . ПМК 3089049 . ПМИД 21415492 .
- ^ Jump up to: а б Де, СН; Саркар, Дж.К.; Трибеди, БП (1951). «Экспериментальное исследование действия холерного токсина». Журнал патологии и бактериологии . 63 (4): 707–717. дои : 10.1002/путь.1700630417 . ПМИД 14898376 .
- ^ Де, С.Н. (30 мая 1959 г.). «Энтеротоксичность бесбактериальной культуры-фильтрата холерного вибриона» . Природа . 183 (4674): 1533–1534. дои : 10.1038/1831533a0 . ISSN 0028-0836 . ПМИД 13666809 .
- ^ Бхарати, Кошик; Гангули, Нирмал К. (февраль 2011 г.). «Холерный токсин: парадигма многофункционального белка» . Индийский журнал медицинских исследований . 133 (2): 179–187. ISSN 0971-5916 . ПМК 3089049 . ПМИД 21415492 .
- ^ Чжан Р., Скотт Д., Уэстбрук М., Нэнс С., Спенглер Б., Шипли Г., Уэстбрук Э. (1995). «Трехмерная кристаллическая структура холерного токсина» . Дж Мол Биол . 251 (4): 563–73. дои : 10.1006/jmbi.1995.0456 . ПМИД 7658473 .
- ^ Де Хаан Л., Херст Т.Р. (2004). «Холерный токсин: парадигма многофункционального задействования клеточных механизмов (обзор)» . Мол. Член Биол . 21 (2): 77–92. дои : 10.1080/09687680410001663267 . ПМИД 15204437 . S2CID 22270979 .
- ^ Эмберлин М. Вандс; Акико Фудзита (октябрь 2015 г.). «Фукозилирование и гликозилирование белков создают функциональные рецепторы для холерного токсина» . электронная жизнь . 4 : e09545. doi : 10.7554/eLife.09545 . ПМЦ 4686427 . ПМИД 26512888 .
- ^ Сервин Дж., Вандс А.М., Кассельбрант А., Ву Х., Кришнамурти С., Цветкович А. и др. (2018). «Ганглиозиднезависимая интоксикация GM1 холерным токсином» . ПЛОС Патогены . 14 (2): e1006862. дои : 10.1371/journal.ppat.1006862 . ПМЦ 5825173 . ПМИД 29432456 .
- ^ Уандс А.М., Сервин Дж., Хуан Х., Чжан Ю., Юн Г., Бротигам К.А., Мэтсон Дзебо М., Бьорклунд П., Валлениус В., Брайт Д.К., Беннетт К.С., Виттунг-Стафшеде П., Сэмпсон Н.С., Йрлид У., Колер Дж.Дж. (7 февраля) , 2018). «Фукозилированные молекулы конкурентно препятствуют связыванию холерного токсина с клетками-хозяевами» . ОКС Инфекционные болезни . 4 (5): 758–770. doi : 10.1021/acsinfecdis.7b00085 . ПМЦ 5948155 . ПМИД 29411974 .
- ^ Цай, Билли; Рапопорт, Том А. (2002). «Развернутый холерный токсин переносится на мембрану ЭР и высвобождается из протеиндисульфидизомеразы при окислении Ero1» . Журнал клеточной биологии . 159 (2): 207–216. дои : 10.1083/jcb.200207120 . ПМК 2173060 . ПМИД 12403808 . S2CID 3111310 .
- ^ О'Нил С., Джоблинг М., Холмс Р., Хол В. (2005). «Структурная основа активации холерного токсина человеком ARF6-GTP». Наука . 309 (5737): 1093–6. Бибкод : 2005Sci...309.1093O . дои : 10.1126/science.1113398 . ПМИД 16099990 . S2CID 8669389 .
- ^ Хоакин Санчес; Ян Холмгрен (февраль 2011 г.). «Холерный токсин – враг и друг» (PDF) . Индийский журнал медицинских исследований . 133 : 158. Архивировано из оригинала (PDF) 3 февраля 2013 г. Проверено 9 июня 2013 г.
- ^ Борон, В.Ф., и Булпап, Э.Л. (2009). Медицинская физиология: клеточный и молекулярный подход (2-е изд.). Филадельфия, Пенсильвания: Сондерс/Эльзевир.
- ^ Jump up to: а б с д Дэвис, Бриджит М; Уолдор, Мэтью К. (1 февраля 2003 г.). «Нитчатые фаги связаны с вирулентностью холерного вибриона» . Современное мнение в микробиологии . 6 (1): 35–42. дои : 10.1016/S1369-5274(02)00005-X . ISSN 1369-5274 .
- ^ Пьер-Эрве Луппи. «Открытие холерного токсина как мощного нейроанатомического инструмента» . Проверено 23 марта 2011 г.
- ^ Андруцеллис-Теотокис А., Уолбридж С., Парк Д.М., Лонсер Р.Р., Маккей Р.Д. (2010). «Холерный токсин регулирует сигнальный путь, критически важный для распространения культур нервных стволовых клеток из мозга плода и взрослых грызунов» . ПЛОС ОДИН . 5 (5): е10841. Бибкод : 2010PLoSO...510841A . дои : 10.1371/journal.pone.0010841 . ПМК 2877108 . ПМИД 20520777 .
- ^ Jump up to: а б Балдауф, Киган; Роял, Джошуа; Хаморский, Кристалл; Матоба, Нобуюки (2015). «Холерный токсин B: одна субъединица с множеством фармацевтических применений» . Токсины . 7 (3): 974–996. дои : 10.3390/toxins7030974 . ПМЦ 4379537 . ПМИД 25802972 .
- ^ Jump up to: а б с Кенворти, Энн К.; Шмидер, Стефани С.; Рагунатан, Кришнан; Тивари, Аджит; Ван, Тин; Келли, Кристофер В.; Ленсер, Уэйн И. (2021). «Холерный токсин как исследование мембранной биологии» . Токсины . 13 (8): 543. doi : 10.3390/toxins13080543 . ПМЦ 8402489 . ПМИД 34437414 .
Внешние ссылки
[ редактировать ]- Де, Шамбху Натх. Энтеротоксичность бесбактериального фильтрата культуры холерного вибриона . Природа. 30 мая 1959 г. 183:1533–4.
- Макдауэлл, Дженнифер (сентябрь 2005 г.). «Холерный токсин» . Белок месяца (POTM). Банк данных белков в Европе (PDBe). Архивировано из оригинала 27 апреля 2019 года.
- Гудселл, Дэвид (сентябрь 2005 г.). «Холерный токсин» . Банк данных белков RCSB . Молекула месяца (MOTM). Банк данных белков (PDB). дои : 10.2210/rcsb_pdb/mom_2005_9 . Архивировано из оригинала 25 октября 2011 года.
- Холера + токсин Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt : P01555 (субъединица A холерного энтеротоксина) в PDBe-KB .
- Обзор всей структурной информации, доступной в PDB для UniProt : P01556 (субъединица B холерного энтеротоксина) в PDBe-KB .