Фактор шнура
 | |
| Идентификаторы | |
|---|---|
3D model ( JSmol ) | |
ПабХим CID | |
| Характеристики | |
| С 130 Ч 250 О 15 | |
| Молярная масса | 2 053 .415 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |

Корд-фактор , или димиколат трегалозы (TDM), представляет собой гликолипидную молекулу, обнаруженную в клеточной стенке Mycobacterium Tuberculosis и подобных видов. Это основной липид, обнаруженный на внешней поверхности клеток M. Tuberculosis . [1] Кордовый фактор влияет на расположение клеток M. Tuberculosis в длинные и тонкие образования, отсюда и название. [2] Кордовый фактор вирулентен по отношению к клеткам млекопитающих и имеет решающее значение для выживания M.tuberculosis внутри хозяев, но не вне хозяев. [3] [4] Было замечено, что корд-фактор влияет на иммунные реакции , индуцирует образование гранулем и ингибирует рост опухоли . [5] антимикобактериальный препарат SQ109 ингибирует уровень продукции TDM и, таким образом, нарушает сборку его клеточной стенки. Считается, что [6]
Структура
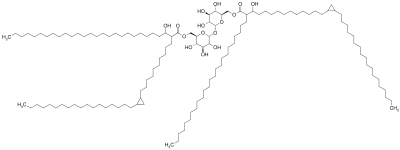
[ редактировать ]Молекула кордового фактора состоит из сахара молекулы трегалозы ( дисахарида ), состоящей из двух глюкозы связанных вместе молекул . Трегалоза этерифицирована двумя остатками миколевой кислоты . [7] [8] Один из двух остатков миколевой кислоты присоединен к шестому углероду одной глюкозы, а другой остаток миколевой кислоты присоединен к шестому углероду другой глюкозы. [7] Поэтому корд-фактор также называют трегалозо-6,6'-димиколат. [7] Углеродная цепь остатков миколевой кислоты различается по длине в зависимости от вида бактерий, в которых она обнаружена, но общий диапазон составляет от 20 до 80 атомов углерода. [3] природа корд-фактора Амфифильная приводит к образованию различных структур, когда многие молекулы корд-фактора находятся в непосредственной близости. [3] На гидрофобной поверхности они самопроизвольно образуют кристаллический монослой. [9] Этот кристаллический монослой чрезвычайно прочен и тверд; он сильнее любого другого амфифила, обнаруженного в биологии. [10] Этот монослой также образуется на поверхностях масло-вода, пластик-вода и воздух-вода. [1] В водной среде, свободной от гидрофобных поверхностей, корд-фактор образует мицеллу. [11] Кроме того, корд-фактор взаимодействует с липоарабиноманнаном (LAM), который также обнаруживается на поверхности клеток M. Tuberculosis , образуя асимметричный бислой. [1] [12] Эти свойства приводят к тому, что бактерии, вырабатывающие кордовый фактор, вырастают в длинные переплетающиеся нити, придавая им вид веревки или шнура при окрашивании и просмотре через микроскоп (отсюда и название). [13]
Доказательства вирулентности
[ редактировать ]
Большое количество корд-фактора обнаружено у вирулентных микобактерий туберкулеза , но не у авирулентных микобактерий туберкулеза . [1] Более того, M.tuberculosis теряет свою вирулентность, если нарушается его способность продуцировать молекулы корд-фактора. [1] Следовательно, когда все липиды удаляются из клеток M. Tuberculosis , выживаемость бактерий внутри хозяина снижается. [14] Когда к этим клеткам снова добавляется кордовый фактор, M.tuberculosis выживает со скоростью, аналогичной скорости его исходного состояния. [14] Корд-фактор повышает вирулентность туберкулеза у мышей, но оказывает минимальное влияние на другие инфекции. [1]
Биологическая функция
[ редактировать ]Функция шнурового фактора во многом зависит от того, в какой среде он расположен, а следовательно, и от его конформации. [15] Это очевидно, поскольку корд-фактор вреден при введении масляного раствора, но не при введении солевого раствора, даже в очень больших количествах. [15] Кордовый фактор защищает M.tuberculosis от защиты хозяина. [1] В частности, корд-фактор на поверхности клеток M.tuberculosis предотвращает слияние фагосомальных везикул, содержащих клетки M.tuberculosis , с лизосомами , которые могут их разрушить. [5] [16] Отдельные компоненты корд-фактора, сахара трегалозы и остатки миколевой кислоты, не способны проявлять такую активность; Молекулы корд-фактора должны быть полностью неповрежденными. [5] Активность эстеразы, направленная на корд-фактор, приводит к лизису клеток M. Tuberculosis . [17] Однако, чтобы предотвратить это слияние, клетки M. Tuberculosis должны быть еще живы; убитые теплом клетки с корд-фактором не могут предотвратить переваривание. [16] дополнительная молекула M.tuberculosis . Это предполагает, что необходима [16] В любом случае, способность кордового фактора предотвращать слияние связана с повышенной силой гидратации или стерическими препятствиями. [5] Корд-фактор остается на поверхности клеток M. Tuberculosis до тех пор, пока не соединится с липидной каплей , где он образует монослой. [15] Тогда, поскольку корд-фактор находится в однослойной конфигурации, он имеет другую функцию; оно становится смертельным или вредным для организма хозяина. [18] Макрофаги могут погибнуть при контакте с монослоями корд-фактора, но не тогда, когда корд-фактор находится в других конфигурациях. [1] По мере увеличения площади монослоя корд-фактора увеличивается и его токсичность. [19] Было также показано, что длина углеродной цепи корд-фактора влияет на токсичность; более длинная цепь показывает более высокую токсичность. [20] Кроме того, было показано, что фибриноген адсорбируется на монослоях корд-фактора и действует как кофактор для его биологических эффектов. [21]
кордовый фактор, выделенный из видов Nocardia, Было показано, что вызывает кахексию у мышей. Тяжелая мышечная атрофия произошла в течение 48 часов после введения токсина. [22]
Реакции хозяина и цитокины
[ редактировать ]Многочисленные реакции, которые различаются по эффекту, являются результатом присутствия корд-фактора в клетках-хозяевах. После воздействия корд-фактора в течение 2 часов в геноме мыши активируется активация 125 генов. [23] Через 24 часа активность 503 генов повышается, а активность 162 генов снижается. [23] Точные химические механизмы действия корд-фактора полностью не известны. Однако вполне вероятно, что миколовые кислоты корд-фактора должны подвергнуться циклопропильной модификации, чтобы вызвать реакцию иммунной системы хозяина на начальную инфекцию. [24] Кроме того, сложноэфирные связи в корд-факторе важны из-за его токсических эффектов. [25] Имеются данные о том, что корд-фактор распознается рецептором Минкла , который обнаружен на макрофагах. [26] [27] Активированный рецептор Mincle приводит к производству нескольких цитокинов . [28] [29] Эти цитокины могут привести к дальнейшей выработке цитокинов, которые способствуют воспалительным реакциям. [30] Корд-фактор через рецептор Минкла также вызывает рекрутирование нейтрофилов, что также приводит к выработке провоспалительных цитокинов. [31] Однако есть также доказательства того, что за выработку цитокинов ответственен толл-подобный рецептор 2 (TLR2) в сочетании с белком MyD-88, а не рецептор Mincle. [23]
Присутствие кордового фактора увеличивает выработку цитокинов интерлейкина-12 (IL-12), интерлейкина-1 бета (IL-1β), интерлейкина-6 (IL-6), фактора некроза опухоли (TNFα) и воспалительного белка макрофагов-2. (MIP-2), которые являются провоспалительными цитокинами, важными для образования гранулем. [16] [28] [32] IL-12 особенно важен для защиты от M.tuberculosis ; без него M.tuberculosis распространяется беспрепятственно. [33] [34] IL-12 запускает выработку большего количества цитокинов посредством Т-клеток и естественных клеток-киллеров (NK), а также приводит к образованию зрелых клеток Th1 и, таким образом, к иммунитету. [35] Затем, при наличии IL-12, клетки Th1 и NK-клетки производят молекулы гамма-интерферона (IFN-γ) и впоследствии высвобождают их. [36] Молекулы IFN-γ, в свою очередь, активируют макрофаги. [37]
Когда макрофаги активируются корд-фактором, они могут образовывать гранулемы вокруг M.tuberculosis . клеток [15] [38] Активированные макрофаги и нейтрофилы также вызывают увеличение фактора роста эндотелия сосудов (VEGF), который важен для ангиогенеза, этапа формирования гранулемы. [39] Гранулемы могут образовываться как с Т-клетками, так и без них, что указывает на то, что они могут быть типа инородного тела или типа гиперчувствительности. [37] Это означает, что корд-фактор может стимулировать ответную реакцию, действуя как чужеродная молекула или вызывая вредные реакции иммунной системы, если хозяин уже иммунизирован. [37] Таким образом, корд-фактор может действовать как неспецифический раздражитель или Т-клеточно-зависимый антиген. [37] Гранулемы окружают клетки M. Tuberculosis , чтобы остановить распространение бактерий, но они также позволяют бактериям оставаться в организме хозяина. [16] В результате ткань может быть повреждена, и болезнь может передаваться дальше с помощью корд-фактора. [40] Альтернативно, активированные макрофаги могут убивать клетки M. Tuberculosis посредством реактивных промежуточных продуктов азота, чтобы удалить инфекцию. [41]
Помимо индукции образования гранулем, активированные макрофаги, образующиеся в результате действия IL-12 и IFN-γ, способны ограничивать рост опухоли. [42] Кроме того, стимуляция кордовым фактором производства TNF-α, также известного как кахектин, также способна вызывать кахексию или потерю веса у хозяев. [43] [44] Корд-фактор также увеличивает активность НАДазы в организме хозяина и, таким образом, снижает НАД; ферменты, которым требуется НАД, соответственно снижают активность. [3] Таким образом, корд-фактор способен препятствовать окислительному фосфорилированию и цепи переноса электронов в митохондриальных мембранах. [3] Было показано, что у мышей кордовый фактор вызывает атрофию тимуса посредством апоптоза; атрофия тимуса и селезенки . аналогично у кроликов произошла [45] [46] Эта атрофия возникает в сочетании с образованием гранулемы, и если образование гранулемы нарушено, то происходит и прогрессирование атрофии. [46]
Научное применение и использование
[ редактировать ]Заражение M.tuberculosis остается серьезной проблемой в мире, и знание пуповинного фактора может оказаться полезным в борьбе с этим заболеванием. [24] Например, гликопротеин, известный как лактоферрин, способен смягчать выработку цитокинов и образование гранулем, вызванное кордовым фактором. [47] Однако кордовый фактор может служить полезной моделью для всех патогенных гликолипидов и, следовательно, может дать представление не только о себе как о факторе вирулентности. [11] [48] Гидрофобные шарики, покрытые корд-фактором, являются эффективным инструментом для таких исследований; они способны воспроизводить реакцию организма на кордовый фактор из M. Tuberculosis . клеток [11] [48] Бусины корд-фактора легко создаются и применяются к организмам для изучения, а затем легко восстанавливаются. [48]
Липосомы корд-фактора можно формировать посредством водной эмульсии; эти липосомы нетоксичны и могут использоваться для поддержания постоянного поступления активированных макрофагов. [49] Корд-фактор при правильном контроле потенциально может быть полезен в борьбе с раком, поскольку IL-12 и IFN-γ способны ограничивать рост опухолей. [50]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: Перейти обратно: а б с д и ж г час Хантер, РЛ; Олсен, MR; Джаганнатх, К; Актер, Дж. К. (осень 2006 г.). «Множественные роли пуповинного фактора в патогенезе первичного, вторичного и полостного туберкулеза, включая пересмотренное описание патологии вторичного заболевания». Анналы клинической и лабораторной науки . 36 (4): 371–86. ПМИД 17127724 .
- ^ Сайта, Н.; Фудзивара, Н.; Яно, И.; Соэдзима, К.; Кобаяши, К. (1 октября 2000 г.). «Трегалоза-6,6'-димиколат (корд-фактор) микобактерии туберкулеза индуцирует ангиогенез роговицы у крыс» . Инфекция и иммунитет . 68 (10): 5991–5997. дои : 10.1128/IAI.68.10.5991-5997.2000 . ПМК 101563 . ПМИД 10992511 .
- ^ Jump up to: Перейти обратно: а б с д и Раджни; Рао, Н; Мина, Л.С. (2011). «Биосинтез и вирулентное поведение липидов, продуцируемых микобактериями туберкулеза: LAM и фактор Корда: обзор» . Международное исследование биотехнологии . 2011 : 274693. doi : 10.4061/2011/274693 . ПМК 3039431 . ПМИД 21350659 .
- ^ Сильва, CL; Экизлерян С.М.; Фазиоли, РА (февраль 1985 г.). «Роль кордового фактора в модуляции инфекции, вызванной микобактериями» . Американский журнал патологии . 118 (2): 238–47. ПМЦ 1887869 . ПМИД 3881973 .
- ^ Jump up to: Перейти обратно: а б с д Спарго, Би Джей; Кроу, LM; Ионеда, Т; Биман, БЛ; Кроу, Дж. Х. (1 февраля 1991 г.). «Корд-фактор (альфа, альфа-трегалозо-6,6'-димиколат) ингибирует слияние фосфолипидных везикул» . Труды Национальной академии наук Соединенных Штатов Америки . 88 (3): 737–40. Бибкод : 1991PNAS...88..737S . дои : 10.1073/pnas.88.3.737 . ПМК 50888 . ПМИД 1992465 .
- ^ ТАЛАН, К., Р. УИЛСОН, Д.Б. КАСТРИНСКИЙ, К. АРОРА, В. НАИР, Э. ФИШЕР, С.В. БАРНС, МЛАДШИЙ УОКЕР, Д. АЛЛАНД, С.Э. БАРРИ и ПРИВЕТ БОШОФФ. SQ109 нацелен на MmpL3, мембранный переносчик мономиколата трегалозы, участвующий в донорстве миколевой кислоты ядру клеточной стенки микобактерии туберкулеза. Антимикробные средства и химиотерапия. 16 марта 2012 г., том. 56, вып. 4, с. 1797-1809. DOI: 10.1128/AAC.05708-11. http://aac.asm.org/cgi/doi/10.1128/AAC.05708-11
- ^ Jump up to: Перейти обратно: а б с НОЛЛ, Х; БЛОХ, Х; АССЕЛИНО, Дж.; ЛЕДЕРЕР, Э. (май 1956 г.). «Химическая структура кордового фактора микобактерии туберкулеза». Биохимика и биофизика Acta . 20 (2): 299–309. дои : 10.1016/0006-3002(56)90289-x . ПМИД 13328853 .
- ^ Йонссон, Бельгия; Гиллджем, М.; Линдблад, А.; Риделл, М.; Уолд, А.Е.; Велиндер-Олссон, К. (21 марта 2007 г.). «Молекулярная эпидемиология Mycobacterium abscessus с акцентом на муковисцидоз» . Журнал клинической микробиологии . 45 (5): 1497–1504. дои : 10.1128/JCM.02592-06 . ПМЦ 1865885 . ПМИД 17376883 .
- ^ Ретцингер, Г.С.; Мередит, Южная Каролина; Хантер, РЛ; Такаяма, К; Кезди, Ф.Дж. (август 1982 г.). «Идентификация физиологически активного состояния микобактериального гликолипида трегалозо-6,6'-димиколата и роли фибриногена в биологической активности монослоев трегалозо-6,6'-димиколата» . Журнал иммунологии . 129 (2): 735–44. дои : 10.4049/jimmunol.129.2.735 . ПМИД 6806381 . S2CID 45693526 .
- ^ Хантер, РЛ; Венкатапрасад, Н.; Олсен, MR (сентябрь 2006 г.). «Роль димиколата трегалозы (корд-фактора) на морфологию вирулентного туберкулеза in vitro». Туберкулез (Эдинбург, Шотландия) . 86 (5): 349–56. дои : 10.1016/j.tube.2005.08.017 . ПМИД 16343989 .
- ^ Jump up to: Перейти обратно: а б с Ретцингер, Г.С.; Мередит, Южная Каролина; Такаяма, К; Хантер, РЛ; Кезди, Ф.Дж. (10 августа 1981 г.). «Роль поверхности в биологической активности трегалозо-6,6'-димиколата. Поверхностные свойства и разработка модельной системы» . Журнал биологической химии . 256 (15): 8208–16. дои : 10.1016/S0021-9258(18)43410-2 . ПМИД 7263645 .
- ^ Бреннан, П.Дж. (2003). «Структура, функции и биогенез клеточной стенки микобактерии туберкулеза». Туберкулез (Эдинбург, Шотландия) . 83 (1–3): 91–7. дои : 10.1016/s1472-9792(02)00089-6 . ПМИД 12758196 .
- ^ Бартельт, Массачусетс. (2000). Диагностическая бактериология: Учебное пособие . Филадельфия, США: Компания FA Davis. п. 500. ИСБН 978-0-8036-0301-1 .
- ^ Jump up to: Перейти обратно: а б Индриго, Дж; Хантер Р.Л., младший; Актер, JK (июль 2002 г.). «Влияние трегалозо-6,6'-димиколата (ТДМ) при микобактериальной инфекции макрофагов костного мозга» . Микробиология . 148 (Часть 7): 1991–8. дои : 10.1099/00221287-148-7-1991 . ПМИД 12101287 .
- ^ Jump up to: Перейти обратно: а б с д Хантер, Роберт Л.; Олсен, Маргарет; Джаганнатх, Чиннасвами; Актер Джеффри К. (апрель 2006 г.). «Трегалозо-6,6'-димиколат и липид в патогенезе казеозных гранулем туберкулеза у мышей» . Американский журнал патологии . 168 (4): 1249–1261. дои : 10.2353/ajpath.2006.050848 . ПМК 1606544 . ПМИД 16565499 .
- ^ Jump up to: Перейти обратно: а б с д и Индриго, Дж; Хантер Р.Л., младший; Актер, Дж. К. (август 2003 г.). «Кордовый фактор трегалозо-6,6'-димиколат (TDM) опосредует события трафика во время микобактериальной инфекции мышиных макрофагов» . Микробиология . 149 (Часть 8): 2049–59. дои : 10.1099/mic.0.26226-0 . ПМИД 12904545 .
- ^ Ян, Ю.; Бхатти, А.; Ке, Д.; Гонсалес-Хуарреро, М.; Ленартс, А.; Кремер, Л.; Герардель, Ю.; Чжан, П.; Оджа, АК (15 ноября 2012 г.). «Воздействие кутиназоподобной сериновой эстеразы вызывает быстрый лизис нескольких видов микобактерий» . Журнал биологической химии . 288 (1): 382–392. дои : 10.1074/jbc.M112.419754 . ПМЦ 3537035 . ПМИД 23155047 .
- ^ Шаббинг, РВ; Гарсия, А; Хантер, РЛ (февраль 1994 г.). «Характеристика поверхностного монослоя трегалозы-6,6'-димиколата с помощью сканирующей туннельной микроскопии» . Инфекция и иммунитет . 62 (2): 754–6. дои : 10.1128/IAI.62.2.754-756.1994 . ПМК 186174 . ПМИД 8300239 .
- ^ Гейзель, Р.Э.; Сакамото, К; Рассел, генеральный директор; Роудс, скорая помощь (15 апреля 2005 г.). «In vivo активность высвобождаемых липидов клеточной стенки Mycobacterium bovis bacillus Calmette-Guérin обусловлена главным образом миколатами трегалозы» . Журнал иммунологии . 174 (8): 5007–15. doi : 10.4049/jimmunol.174.8.5007 . ПМИД 15814731 .
- ^ Фудзита, Ю; Окамото, Ю; Уэниши, Ю; Сунагава, М; Утияма, Т; Яно, я (июль 2007 г.). «Различия в токсичности и гранулематогенной активности микобактериального корд-фактора у мышей, связанные с молекулярной и супрамолекулярной структурой». Микробный патогенез . 43 (1): 10–21. дои : 10.1016/j.micpath.2007.02.006 . ПМИД 17434713 .
- ^ Сакамото, К.; Гейзель, Р.Э.; Ким, М.-Дж.; Вятт, Британская Колумбия; Селлерс, LB; Смайли, ST; Купер, AM; Рассел, генеральный директор; Роудс, ER (22 декабря 2009 г.). «Фибриноген регулирует цитотоксичность микобактериального димиколата трегалозы, но не требуется для набора клеток, цитокинового ответа или контроля микобактериальной инфекции» . Инфекция и иммунитет . 78 (3): 1004–1011. дои : 10.1128/IAI.00451-09 . ПМЦ 2825938 . ПМИД 20028811 .
- ^ Сильва, CL; Тинкани, И.; Фильо, СЛБ; Фаччоли, Л.Х. (1 июня 1988 г.). «Мышиная кахексия, вызванная димиколатом трегалозы из астероидов Nocardia» . Микробиология . 134 (6): 1629–1633. дои : 10.1099/00221287-134-6-1629 . ISSN 1350-0872 . ПМИД 3065451 .
- ^ Jump up to: Перейти обратно: а б с Сакамото, К.; Ким, MJ; Роудс, скорая помощь; Аллавена, RE; Эрт, С.; Уэйнрайт, ХК; Рассел, генеральный директор; Роде, К.Х. (21 декабря 2012 г.). «Микобактериальный димиколат трегалозы перепрограммирует глобальную экспрессию генов макрофагов и активирует матриксные металлопротеиназы» . Инфекция и иммунитет . 81 (3): 764–776. дои : 10.1128/IAI.00906-12 . ПМЦ 3584883 . ПМИД 23264051 .
- ^ Jump up to: Перейти обратно: а б Рао, В; Фудзивара, Н.; Порчелли, SA; Гликман, М.С. (21 февраля 2005 г.). «Микобактерия туберкулеза контролирует активацию врожденного иммунитета хозяина посредством модификации циклопропаном эффекторной молекулы гликолипида» . Журнал экспериментальной медицины . 201 (4): 535–43. дои : 10.1084/jem.20041668 . ПМК 2213067 . ПМИД 15710652 .
- ^ Като, М. (март 1970 г.). «Действие токсичного гликолипида Corynebacterium diphtheriae на структуру и функцию митохондрий» . Журнал бактериологии . 101 (3): 709–16. дои : 10.1128/JB.101.3.709-716.1970 . ПМК 250382 . ПМИД 4314542 .
- ^ Исикава, Э; Исикава, Т; Морита, Ю.С.; Тойонага, К; Ямада, Х; Такеучи, О; Киношита, Т; Акира, С; Ёсикай, Ю; Ямасаки, С. (21 декабря 2009 г.). «Прямое распознавание микобактериального гликолипида, димиколата трегалозы, лектином С-типа Минкле» . Журнал экспериментальной медицины . 206 (13): 2879–88. дои : 10.1084/jem.20091750 . ПМК 2806462 . ПМИД 20008526 .
- ^ Шенен, Х; Бодендорфер, Б; Хитченс, К; Мансанеро, С; Вернингхаус, К; Ниммерьян, Ф; Аггер, Э.М.; Стенгер, С; Андерсен, П; Руланд, Дж; Браун, Джорджия; Уэллс, К; Ланг, Р. (15 марта 2010 г.). «Авангард: Минкл необходим для распознавания и адъювантного действия микобактериального корд-фактора и его синтетического аналога трегалозо-дибегената» . Журнал иммунологии . 184 (6): 2756–60. doi : 10.4049/jimmunol.0904013 . ПМЦ 3442336 . ПМИД 20164423 .
- ^ Jump up to: Перейти обратно: а б Вернингхаус, К.; Бабяк, А.; Гросс, О.; Холшер, К.; Дитрих, Х.; Аггер, Э.М.; Магес, Дж.; Моксай, А.; Шенен, Х.; Фингер, К.; Ниммерьян, Ф.; Браун, Джорджия; Киршнинг, К.; Хейт, А.; Андерсен, П.; Вагнер, Х.; Руланд, Дж.; Ланг, Р. (12 января 2009 г.). «Адъювантность синтетического аналога кордового фактора для субъединичной вакцинации Mycobacterium Tuberculosis требует FcR-Syk-Card9-зависимой активации врожденного иммунитета» . Журнал экспериментальной медицины . 206 (1): 89–97. дои : 10.1084/jem.20081445 . ПМК 2626670 . ПМИД 19139169 .
- ^ Ямасаки, С; Исикава, Э; Сакума, М; Хара, Х; Огата, К; Сайто, Т. (октябрь 2008 г.). «Минкл — это связанный с ITAM активирующий рецептор, который обнаруживает поврежденные клетки». Природная иммунология . 9 (10): 1179–88. дои : 10.1038/ni.1651 . ПМИД 18776906 . S2CID 205361789 .
- ^ Уэлш, К.Дж.; Эбботт, АН; Хван, С.-А.; Индриго Дж.; Армитидж, Луизиана; Блэкберн, MR; Хантер, РЛ; Актер, JK (1 июня 2008 г.). «Роль фактора некроза опухоли, комплемента C5 и интерлейкина-6 в инициировании и развитии гранулематозного ответа, индуцированного микобактериальным фактором корда трегалозо-6,6'-димиколатом» . Микробиология . 154 (6): 1813–1824. дои : 10.1099/mic.0.2008/016923-0 . ПМК 2556040 . ПМИД 18524936 .
- ^ Ли, ВБ; Канг, Дж. С.; Ян, Джей-Джей; Ли, MS; Чон, BY; Чо, С.Н.; Ким, YJ (2012). «Нейтрофилы способствуют микобактериальному воспалению легких, вызванному димиколатом трегалозы, через путь Минкла» . ПЛОС Патогены . 8 (4): e1002614. дои : 10.1371/journal.ppat.1002614 . ПМЦ 3320589 . ПМИД 22496642 .
- ^ Роуч, ДР; Бин, АГ; Демангель, К; Франция, депутат; Бриско, Х; Бриттон, WJ (1 мая 2002 г.). «ФНО регулирует индукцию хемокинов, необходимую для рекрутирования клеток, образования гранулем и устранения микобактериальной инфекции» . Журнал иммунологии . 168 (9): 4620–7. дои : 10.4049/jimmunol.168.9.4620 . ПМИД 11971010 .
- ^ Купер, AM (1 декабря 1993 г.). «Диссеминированный туберкулез у мышей с нарушенным геном гамма-интерферона» . Журнал экспериментальной медицины . 178 (6): 2243–2247. дои : 10.1084/jem.178.6.2243 . ПМК 2191280 . ПМИД 8245795 .
- ^ Купер, AM; Маграм, Дж; Ферранте, Дж; Орм, IM (7 июля 1997 г.). «Интерлейкин 12 (IL-12) имеет решающее значение для развития защитного иммунитета у мышей, внутривенно инфицированных микобактерией туберкулеза» . Журнал экспериментальной медицины . 186 (1): 39–45. дои : 10.1084/jem.186.1.39 . ПМК 2198958 . ПМИД 9206995 .
- ^ Тринкьери, Дж. (1995). «Интерлейкин-12: провоспалительный цитокин с иммунорегуляторными функциями, который соединяет врожденную резистентность и антигенспецифический адаптивный иммунитет». Ежегодный обзор иммунологии . 13 (1): 251–76. дои : 10.1146/annurev.iy.13.040195.001343 . ПМИД 7612223 .
- ^ Маграм, Жанна; Коннотон, Сюзанна Э; Уорриер, Раджив Р.; Карвахаль, Дейзи М; У, Чан-ю; Ферранте, Джессика; Стюарт, Колин; Сармьенто, Улла; Фаэрти, Дениз А; Гейтли, Морис К. (май 1996 г.). «Мыши с дефицитом IL-12 дефектны в производстве IFNγ и реакциях цитокинов 1 типа» . Иммунитет . 4 (5): 471–481. дои : 10.1016/S1074-7613(00)80413-6 . ПМИД 8630732 .
- ^ Jump up to: Перейти обратно: а б с д Ямагами, Х; Мацумото, Т; Фудзивара, Н.; Аракава, Т; Канеда, К; Яно, я; Кобаяши, К. (февраль 2001 г.). «Трегалозо-6,6'-димиколат (корд-фактор) микобактерий туберкулеза вызывает у мышей гранулемы типа инородных тел и гиперчувствительности» . Инфекция и иммунитет . 69 (2): 810–5. дои : 10.1128/IAI.69.2.810-815.2001 . ПМК 97956 . ПМИД 11159972 .
- ^ Бекеркунст, А (октябрь 1968 г.). «Острая гранулематозная реакция, вызванная у мышей трегалозо-6,6-димиколатом» . Журнал бактериологии . 96 (4): 958–61. дои : 10.1128/JB.96.4.958-961.1968 . ПМК 252404 . ПМИД 4971895 .
- ^ Сакагути, И; Икеда, Н.; Накаяма, М; Като, Ю; Яно, я; Канеда, К. (апрель 2000 г.). «Трегалозо-6,6'-димиколат (Корд-фактор) усиливает неоваскуляризацию за счет выработки фактора роста эндотелия сосудов нейтрофилами и макрофагами» . Инфекция и иммунитет . 68 (4): 2043–52. дои : 10.1128/iai.68.4.2043-2052.2000 . ПМК 97384 . ПМИД 10722600 .
- ^ Кобаяши, Кадзуо; Канеда, Кенджи; Касама, Цуёси (15 мая 2001 г.). «Иммунопатогенез гиперчувствительности замедленного типа» . Микроскопические исследования и техника . 53 (4): 241–245. дои : 10.1002/jemt.1090 . ПМИД 11340669 . S2CID 1851137 .
- ^ Чан, Дж; Син, Ю; Мальоццо, РС; Блум, БР (1 апреля 1992 г.). «Уничтожение вирулентной микобактерии туберкулеза реактивными промежуточными соединениями азота, продуцируемыми активированными мышиными макрофагами» . Журнал экспериментальной медицины . 175 (4): 1111–22. дои : 10.1084/jem.175.4.1111 . ПМК 2119182 . ПМИД 1552282 .
- ^ Освальд, IP; Дозуа, CM; Пети, Дж. Ф.; Лемэр, Дж. (апрель 1997 г.). «Синтез интерлейкина-12 является необходимым этапом индуцированной трегалозодимиколатом активации перитонеальных макрофагов мыши» . Инфекция и иммунитет . 65 (4): 1364–9. дои : 10.1128/IAI.65.4.1364-1369.1997 . ПМК 175141 . ПМИД 9119475 .
- ^ Семензато, Дж. (март 1990 г.). «Фактор некроза опухоли: цитокин с множественной биологической активностью» . Британский журнал рака . 61 (3): 354–361. дои : 10.1038/bjc.1990.78 . ЧВК 1971301 . ПМИД 2183871 .
- ^ Сильва, CL; Фаччоли, Л.Х. (декабрь 1988 г.). «Фактор некроза опухоли (кахектин) опосредует индукцию кахексии корд-фактором микобактерий» . Инфекция и иммунитет . 56 (12): 3067–71. дои : 10.1128/IAI.56.12.3067-3071.1988 . ПМК 259702 . ПМИД 3053451 .
- ^ Хамасаки, Н; Исова, К; Камада, К; Терано, Ю; Мацумото, Т; Аракава, Т; Кобаяши, К; Яно, я (июнь 2000 г.). «Введение in vivo микобактериального кордового фактора (трегалозы 6,6'-димиколата) может вызвать у кроликов гранулемы легких и печени, а также атрофию тимуса» . Инфекция и иммунитет . 68 (6): 3704–9. дои : 10.1128/iai.68.6.3704-3709.2000 . ПМК 97662 . ПМИД 10816531 .
- ^ Jump up to: Перейти обратно: а б Озеки, Ю; Канеда, К; Фудзивара, Н.; Моримото, М; Ока, С; Яно, Я (май 1997 г.). «In vivo индукция апоптоза в тимусе введением микобактериального кордового фактора (6,6'-димиколата трегалозы)» . Инфекция и иммунитет . 65 (5): 1793–9. дои : 10.1128/IAI.65.5.1793-1799.1997 . ПМК 175219 . ПМИД 9125563 .
- ^ Уэлш, Керри Дж.; Хван, Шэнь-Ань; Хантер, Роберт Л.; Крузель, Мэриан Л.; Актер Джеффри К. (октябрь 2010 г.). «Модуляция лактоферрином микобактериального фактора корда трегалозо-6'-димиколата, индуцированная гранулематозным ответом» . Трансляционные исследования . 156 (4): 207–215. дои : 10.1016/j.trsl.2010.06.001 . ПМК 2948024 . ПМИД 20875896 .
- ^ Jump up to: Перейти обратно: а б с Ретцингер, Г.С. (апрель 1987 г.). «Десеминация шариков, покрытых трегалозо-6,6'-димиколатом: возможная роль коагуляции в процессе диссеминации». Экспериментальная и молекулярная патология . 46 (2): 190–8. дои : 10.1016/0014-4800(87)90065-7 . ПМИД 3556532 .
- ^ Лепуавр, М; Тену, Япония; Лемэр, Дж; Пети, Дж. Ф. (август 1982 г.). «Противоопухолевая активность и высвобождение перекиси водорода макрофагами, вызываемое диэфирами трегалозы» . Журнал иммунологии . 129 (2): 860–6. дои : 10.4049/jimmunol.129.2.860 . ПМИД 6806386 .
- ^ Освальд, IP; Афроун, С; Брей, Д; Пети, Дж. Ф.; Лемэр, Дж. (сентябрь 1992 г.). «Низкая реакция макрофагов BALB/c на прайминг и активирующие сигналы». Журнал биологии лейкоцитов . 52 (3): 315–22. дои : 10.1002/jlb.52.3.315 . ПМИД 1381743 . S2CID 2190434 .