новообразование
| новообразование | |
|---|---|
| Другие имена | Опухоль, опухоль, карциноциты |
 | |
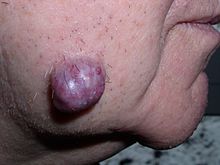
| Образец колэктомии, содержащий злокачественное новообразование, а именно инвазивный пример колоректального рака (кратерообразная, красноватая опухоль неправильной формы вверху в центре) | |
| Специальность | онкология |
| Симптомы | Кусок |
| Осложнения | Рак |
| Причины | Радиация , фактор окружающей среды , некоторые инфекции |
Новообразование ) ( / ˈ n iː oʊ p l æ z əm , ˈ n iː ə / - [1] [2] Это тип аномального и чрезмерного роста ткани . Процесс, который происходит с образованием новообразования, называется неоплазией . Рост новообразования не координируется с ростом нормальной окружающей ткани и продолжает расти аномально, даже если первоначальный триггер удален. [3] [4] [5] Этот аномальный рост обычно образует массу, которую можно назвать опухолью или опухолью . [6]
МКБ-10 классифицирует новообразования на четыре основные группы: доброкачественные новообразования , новообразования in situ , злокачественные новообразования и новообразования неопределенного или неизвестного поведения. [7] Злокачественные новообразования также известны просто как рак и являются фокусом онкологии .
До аномального роста ткани, такого как неоплазия, клетки часто подвергаются аномальному типу роста, такому как метаплазия или дисплазия . [8] Однако метаплазия или дисплазия не всегда перерастают в неоплазию и могут возникать и при других состояниях. [3] Слово «новоплазма» происходит от древнегреческого νέος- нео «новый» и πλάσμα «плазма » «формирование, создание».
Типы [ править ]
| -плазия и -трофия |
|---|
|
|
Новообразование может быть доброкачественным , потенциально злокачественным или злокачественным ( рак ). [9]
- Доброкачественные опухоли включают миому матки , остеофиты и меланоцитарные невусы (родинки на коже). Они ограничены и локализованы и не трансформируются в рак. [8]
- К потенциально злокачественным новообразованиям относятся карциномы in situ . Они локализованы, не вторгаются и не разрушают, но со временем могут трансформироваться в рак.
- Злокачественные новообразования принято называть раком. Они проникают в окружающие ткани и разрушают их, могут образовывать метастазы и, если их не лечить или не реагировать на лечение, обычно приводят к летальному исходу.
- Вторичное новообразование относится к любому классу раковых опухолей, которые являются либо метастатическим ответвлением первичной опухоли, либо явно неродственной опухолью, частота которой увеличивается после определенных методов лечения рака, таких как химиотерапия или лучевая терапия .
- В редких случаях может возникнуть метастатическое новообразование без известного места первичного рака, и это классифицируется как рак неизвестного первичного происхождения .
Клональность [ править ]
Неопластические опухоли часто гетерогенны и содержат более одного типа клеток, но их возникновение и продолжение роста обычно зависят от одной популяции неопластических клеток. Предполагается, что эти клетки являются моноклональными , то есть происходят из одной и той же клетки. [10] и все они несут одну и ту же генетическую или эпигенетическую аномалию, очевидную клональность. Для лимфоидных новообразований, например лимфомы и лейкемии , клональность доказывается амплификацией одной реаранжировки гена иммуноглобулина (при поражениях В-клеток ) или рецептора Т-клеток гена (при поражениях Т-клеток ). В настоящее время считается, что демонстрация клональности необходима для идентификации пролиферации лимфоидных клеток как неопластической. [11]
по сравнению с Новообразование опухолью
Слово опухоль или опухоль происходит от латинского слова, обозначающего отек , который является одним из кардинальных признаков воспаления. Первоначально это слово относилось к любой форме отека , неопластической или нет. В современном английском языке опухоль (неамериканское написание: тумор) используется как синоним новообразования (твердого или заполненного жидкостью кистозного поражения , которое может образоваться или не образоваться в результате аномального роста неопластических клеток), которое кажется увеличенным в размерах. . [12] [13] Некоторые новообразования не образуют опухоли — к ним относятся лейкемия и большинство форм карциномы in situ . Опухоль также не является синонимом рака . Хотя рак по определению является злокачественным, опухоль может быть доброкачественной , предраковой или злокачественной . [ нужна ссылка ]
Термины «масса» и «узел» часто используются как синонимы опухоли . Однако в целом термин «опухоль» используется в общем, без привязки к физическому размеру поражения. [3] Более конкретно, термин «масса» часто используется, когда максимальный диаметр поражения составляет не менее 20 миллиметров (мм) в наибольшем направлении, тогда как термин «узел» обычно используется, когда размер поражения составляет менее 20 мм в наибольшем направлении. размер (25,4 мм = 1 дюйм). [3]
Причины [ править ]

Опухоли у людей возникают в результате накопления генетических и эпигенетических изменений внутри отдельных клеток, которые заставляют клетку бесконтрольно делиться и расширяться. [14] Новообразование может быть вызвано аномальным разрастанием тканей, которое может быть вызвано генетическими мутациями . Однако не все типы новообразований вызывают опухолевый разрастание ткани (например, лейкемия или карцинома in situ ), и было отмечено сходство между неоплазменным ростом и регенеративными процессами, например, дедифференцировкой и быстрой пролиферацией клеток. [15]
Рост опухоли изучался с использованием математики и механики сплошных сред . Таким образом, сосудистые опухоли, такие как гемангиомы и лимфангиомы (образованные из кровеносных или лимфатических сосудов), представляют собой смесь твердого скелета, образованного липкими клетками, и органической жидкости, заполняющей пространства, в которых клетки могут расти. [16] В рамках этого типа модели можно учитывать механические напряжения и напряжения, а также выяснять их влияние на рост опухоли, а также окружающих тканей и сосудов. Недавние результаты экспериментов, в которых используется эта модель, показывают, что активный рост опухоли ограничивается внешними краями опухоли и что усиление подлежащей нормальной ткани также подавляет рост опухоли. [17]
Однако доброкачественные состояния, которые не связаны с аномальной пролиферацией тканей (например, кисты сальных желез ), также могут проявляться как опухоли, но не имеют злокачественного потенциала. Еще одним примером являются кисты молочной железы (которые часто возникают во время беременности и в других случаях), а также опухоли других инкапсулированных желез (щитовидной железы, надпочечников, поджелудочной железы). [ нужна ссылка ]
Инкапсулированные гематомы, инкапсулированная некротическая ткань (от укуса насекомого, инородного тела или другого вредного механизма), келоиды (отдельные разрастания рубцовой ткани) и гранулемы также могут проявляться как опухоли. [ нужна ссылка ]
Дискретные локализованные увеличения нормальных структур (мочеточников, кровеносных сосудов, внутрипеченочных или внепеченочных желчных протоков, легочных включений или удвоений желудочно-кишечного тракта ) из-за обструкции или сужения оттока или аномальных соединений также могут проявляться как опухоль. Примерами являются артериовенозные фистулы или аневризмы (с тромбозом или без него), желчные свищи или аневризмы, склерозирующий холангит, цистицеркоз или гидатидные кисты, удвоения кишечника и легочные включения, наблюдаемые при муковисцидозе. может быть опасной Биопсия некоторых типов опухолей , утечка их содержимого может иметь катастрофические последствия. При обнаружении таких типов опухолей до (или во время) биопсии или хирургического исследования/удаления используются диагностические методы, такие как УЗИ, КТ, МРТ, ангиограммы и сканирование ядерной медицины, чтобы избежать таких серьезных осложнений. [ нужна ссылка ]
Злокачественные новообразования [ править ]
Повреждение ДНК [ править ]

Повреждение ДНК считается основной причиной злокачественных новообразований, известных как рак. [18] Его центральная роль в развитии рака показана на рисунке в этом разделе в рамке вверху. (Основные особенности повреждения ДНК, эпигенетических изменений и недостаточной репарации ДНК при прогрессировании рака показаны красным.) Повреждение ДНК встречается очень часто. Естественные повреждения ДНК (в основном из-за клеточного метаболизма и свойств ДНК в воде при температуре тела) происходят со скоростью более 10 000 новых повреждений в среднем на одну человеческую клетку в день. [19] Дополнительные повреждения ДНК могут возникнуть в результате воздействия экзогенных агентов. Табачный дым вызывает повышенное экзогенное повреждение ДНК, и эти повреждения ДНК являются вероятной причиной рака легких из-за курения. [20] Ультрафиолетовый свет солнечного излучения вызывает повреждение ДНК, что важно при меланоме . [21] Инфекция Helicobacter pylori производит высокие уровни активных форм кислорода , которые повреждают ДНК и способствуют развитию рака желудка. [22] Желчные кислоты , находящиеся в больших количествах в толстой кишке людей, соблюдающих диету с высоким содержанием жиров, также вызывают повреждение ДНК и способствуют развитию рака толстой кишки . [23] Кацурано и др. показали, что макрофаги и нейтрофилы в воспаленном эпителии толстой кишки являются источником активных форм кислорода, вызывающих повреждения ДНК, которые инициируют онкогенез толстой кишки (создание опухолей в толстой кишке). [24] [ ненадежный источник? ] Некоторые источники повреждения ДНК указаны в прямоугольниках вверху рисунка в этом разделе. [ нужны разъяснения ]
Лица с мутацией зародышевой линии, вызывающей дефицит любого из 34 генов репарации ДНК (см. статью « Расстройство, связанное с недостаточностью репарации ДНК »), подвергаются повышенному риску развития рака . Некоторые зародышевые мутации в генах репарации ДНК вызывают до 100% шанс развития рака на протяжении всей жизни (например, мутации р53 ). [25] Эти мутации зародышевой линии обозначены в рамке слева от рисунка стрелкой, указывающей их вклад в дефицит репарации ДНК.
Около 70% злокачественных (раковых) новообразований не имеют наследственного компонента и называются «спорадическими раками». [26] Лишь в небольшом количестве случаев спорадического рака наблюдается нарушение репарации ДНК из-за мутации в гене репарации ДНК. Однако в большинстве случаев спорадического рака наблюдается дефицит репарации ДНК из-за эпигенетических изменений, которые снижают или подавляют экспрессию генов репарации ДНК. Например, из 113 случаев последовательного колоректального рака только четыре имели миссенс-мутацию в гене репарации ДНК MGMT , в то время как у большинства наблюдалось снижение экспрессии MGMT из-за метилирования области промотора MGMT (эпигенетическое изменение). [27] В пяти отчетах представлены доказательства того, что от 40% до 90% случаев колоректального рака снижают экспрессию MGMT из-за метилирования области промотора MGMT. [28] [29] [30] [31] [32]
Аналогичным образом, из 119 случаев колоректального рака с дефицитом репарации ошибочного спаривания, при котором отсутствовала экспрессия гена репарации ДНК PMS2, PMS2 был дефицитным в 6 из-за мутаций в гене PMS2, тогда как в 103 случаях экспрессия PMS2 была недостаточной, потому что его партнер по спариванию MLH1 был подавлен из-за метилированию промотора (белок PMS2 нестабильен в отсутствие MLH1). [33] В остальных 10 случаях потеря экспрессии PMS2, вероятно, была связана с эпигенетической сверхэкспрессией микроРНК, miR-155 , которая подавляет MLH1. [34]
В дальнейших примерах эпигенетические дефекты были обнаружены с частотой от 13% до 100% для генов репарации ДНК BRCA1 , WRN , FANCB , FANCF , MGMT, MLH1 , MSH2 , MSH4 , ERCC1 , XPF , NEIL1 и ATM . Эти эпигенетические дефекты встречаются при различных видах рака, включая рак молочной железы, яичников, колоректальный рак, а также рак головы и шеи. Два или три нарушения экспрессии ERCC1, XPF или PMS2 встречаются одновременно в большинстве из 49 случаев рака толстой кишки, оцененных Facista et al. [35] Эпигенетические изменения, вызывающие снижение экспрессии генов репарации ДНК, показаны в центральном блоке на третьем уровне сверху рисунка в этом разделе, а последующий дефицит репарации ДНК показан на четвертом уровне.
Когда экспрессия генов репарации ДНК снижается, повреждения ДНК накапливаются в клетках на уровне, превышающем нормальный, и эти избыточные повреждения вызывают увеличение частоты мутаций или эпимутаций. Частота мутаций сильно увеличивается в клетках, дефектных в восстановлении несоответствия ДНК [36] [37] или в гомологичной рекомбинационной репарации (HRR). [38]
Во время восстановления двухцепочечных разрывов ДНК или восстановления других повреждений ДНК не полностью очищенные участки восстановления могут вызвать эпигенетическое молчание генов . [39] [40] Дефицит репарации ДНК (уровень 4 на рисунке) вызывает усиление повреждений ДНК (уровень 5 на рисунке), что приводит к увеличению соматических мутаций и эпигенетических изменений (уровень 6 на рисунке).
Дефекты поля, нормальная на вид ткань с множественными изменениями (обсуждаемые в разделе ниже), являются частыми предшественниками развития нарушенного и неправильно пролиферирующего клона ткани в злокачественном новообразовании. Такие дефекты поля (второй уровень снизу рисунка) могут иметь множественные мутации и эпигенетические изменения.
Как только рак формируется, он обычно имеет нестабильность генома . Эта нестабильность, вероятно, связана с уменьшением репарации ДНК или чрезмерным повреждением ДНК. Из-за такой нестабильности рак продолжает развиваться и производить субклоны. Например, рак почки, отобранный в 9 областях, имел 40 распространенных мутаций, демонстрирующих гетерогенность опухоли (т.е. присутствующих во всех областях рака), 59 мутаций, общих для некоторых (но не всех областей), и только 29 «частных» мутаций. присутствует в одной из областей рака. [41]
Дефекты полей [ править ]

использовались различные другие термины Для описания этого явления , в том числе «полевой эффект», «полевой канцерогенез» и «полевой канцерогенез ». Термин «поле канцерообразования» был впервые использован в 1953 году для описания области или «поля» эпителия, который был предварительно обусловлен (в то время) в значительной степени неизвестными процессами, предрасполагающими его к развитию рака. [42] С тех пор термины «полевая канцеризация» и «полевой дефект» используются для описания предраковой ткани, в которой вероятно возникновение нового рака. [ нужна ссылка ]
Дефекты поля играют важную роль в развитии рака. [43] [44] Однако в большинстве исследований рака, как отметил Рубин, [45] «Подавляющее большинство исследований в области рака было проведено на четко определенных опухолях in vivo или на отдельных неопластических очагах in vitro. Тем не менее, есть доказательства того, что более 80% соматических мутаций, обнаруженных в колоректальных опухолях человека с мутаторным фенотипом, возникают раньше. начало терминальной клональной экспансии. [46] Аналогично, Фогельштейн и др. [47] отмечают, что более половины соматических мутаций, выявленных в опухолях, возникали в предопухолевой фазе (в полевом дефекте), во время роста внешне нормальных клеток. Аналогично, эпигенетические изменения, присутствующие в опухолях, могли возникать в преднеопластических дефектах полей. [ нужна ссылка ]
Расширенный взгляд на полевой эффект получил название «этиологический полевой эффект», который охватывает не только молекулярные и патологические изменения в предопухолевых клетках, но также влияние экзогенных факторов окружающей среды и молекулярных изменений в локальном микроокружении на эволюцию неоплазии от инициации опухоли до пациента. смерть. [48]
В толстой кишке дефект поля, вероятно, возникает в результате естественного отбора мутантной или эпигенетически измененной клетки среди стволовых клеток в основании одного из кишечных крипт на внутренней поверхности толстой кишки. Мутантная или эпигенетически измененная стволовая клетка может заменить другие близлежащие стволовые клетки путем естественного отбора. Таким образом, может возникнуть участок аномальной ткани. На рисунке в этом разделе представлена фотография только что удаленного и продольно открытого сегмента толстой кишки, на которой виден рак толстой кишки и четыре полипа. Под фотографией приведена схематическая диаграмма того, как мог образоваться большой участок мутантных или эпигенетически измененных клеток, показанный на диаграмме большой областью желтого цвета. Внутри этого первого большого участка на диаграмме (большого клона клеток) может произойти вторая подобная мутация или эпигенетическое изменение, так что данная стволовая клетка приобретает преимущество по сравнению с другими стволовыми клетками внутри участка, и эта измененная стволовая клетка может размножиться. клонально образуя вторичный патч или субклон внутри исходного патча. На схеме это обозначено четырьмя меньшими пятнами разного цвета внутри большой желтой исходной области. Внутри этих новых участков (субклонов) процесс может повторяться несколько раз, на что указывают еще меньшие участки внутри четырех вторичных участков (все еще разных цветов на диаграмме), которые клонально расширяются, пока не возникнут стволовые клетки, генерирующие либо небольшие участки, либо субклоны. полипы или же злокачественное новообразование (рак). [ нужна ссылка ]
На фотографии видимый дефект поля в этом сегменте толстой кишки привел к образованию четырех полипов (на маркировке указаны размеры полипов: 6 мм, 5 мм и два по 3 мм, а также рак диаметром около 3 см в самом длинном измерении). Эти новообразования также обозначены на схеме под фотографией 4 маленькими коричневыми кружками (полипами) и более крупной красной областью (рак). Рак на фотографии возник в слепокишечной области толстой кишки, где толстая кишка соединяется с тонкой кишкой (помечено) и где находится аппендикс (помечено). Жир на фотографии находится снаружи внешней стенки толстой кишки. В показанном здесь сегменте толстой кишки толстая кишка была разрезана вдоль, чтобы обнажить внутреннюю поверхность толстой кишки и выявить рак и полипы, возникающие во внутренней эпителиальной выстилке толстой кишки. [ нужна ссылка ]
Если общий процесс возникновения спорадического рака толстой кишки представляет собой образование предопухолевого клона, который распространяется путем естественного отбора, с последующим образованием внутренних субклонов внутри исходного клона и субсубклонов внутри них, то рак толстой кишки как правило, должно быть связано с областями возрастающих отклонений, отражающих последовательность предраковых событий, и предшествовать им. Самая обширная область аномалии (крайняя желтая область неправильной формы на диаграмме) отражает самое раннее событие формирования злокачественного новообразования. [ нужна ссылка ]
При экспериментальной оценке специфических нарушений репарации ДНК при раке было также показано, что многие специфические нарушения репарации ДНК возникают в полевых дефектах, окружающих эти виды рака. В таблице ниже приведены примеры, для которых было показано, что дефицит репарации ДНК при раке вызван эпигенетическими изменениями, а также несколько более низкие частоты, с которыми тот же эпигенетически вызванный дефицит репарации ДНК обнаруживался в дефекте окружающего поля.
| Рак | Ген | Частота в Раке | Частота в дефекте поля | Ссылка. |
|---|---|---|---|---|
| Колоректальный | МГМТ | 46% | 34% | [28] |
| Колоректальный | МГМТ | 47% | 11% | [30] |
| Колоректальный | МГМТ | 70% | 60% | [49] |
| Колоректальный | МШ2 | 13% | 5% | [30] |
| Колоректальный | ЭРСС1 | 100% | 40% | [35] |
| Колоректальный | ПМС2 | 88% | 50% | [35] |
| Колоректальный | XPF | 55% | 40% | [35] |
| Голова и шея | МГМТ | 54% | 38% | [50] |
| Голова и шея | МЛХ1 | 33% | 25% | [51] |
| Голова и шея | МЛХ1 | 31% | 20% | [52] |
| Желудок | МГМТ | 88% | 78% | [53] |
| Желудок | МЛХ1 | 73% | 20% | [54] |
| пищевод | МЛХ1 | 77%-100% | 23%-79% | [55] |
Некоторые из мелких полипов в области дефекта, показанных на фотографии вскрытого сегмента толстой кишки, могут быть относительно доброкачественными новообразованиями. Из полипов размером менее 10 мм, обнаруженных во время колоноскопии и последующих повторных колоноскопий в течение 3 лет, 25% не изменились в размере, 35% регрессировали или уменьшились в размерах, а 40% увеличились в размерах. [56]
Нестабильность генома [ править ]
Известно, что рак демонстрирует нестабильность генома или мутаторный фенотип. [57] Кодирующая белок ДНК в ядре составляет около 1,5% от общей геномной ДНК. [58] Внутри этой кодирующей белок ДНК (называемой экзомом ) средний рак молочной железы или толстой кишки может иметь от 60 до 70 мутаций, изменяющих белок, из которых около 3 или 4 могут быть «драйверными» мутациями, а остальные могут быть «драйверными» мутациями. пассажирские» мутации. [47] Однако среднее количество мутаций последовательности ДНК во всем геноме (включая некодирующие белки области ) в образце ткани рака молочной железы составляет около 20 000. [59] В среднем образце ткани меланомы (где меланомы имеют более высокую экзома ) частоту мутаций [47] ) общее количество мутаций последовательности ДНК составляет около 80 000. [60] Это можно сравнить с очень низкой частотой мутаций — около 70 новых мутаций во всем геноме между поколениями (от родителей к детям) у людей. [61] [62]
Высокая частота мутаций в полных нуклеотидных последовательностях при раке предполагает, что часто ранние изменения в дефектах поля, вызывающие рак (например, желтая область на диаграмме в этом разделе), являются дефицитом репарации ДНК. Большие дефекты поля вокруг рака толстой кишки (распространяющиеся примерно на 10 см с каждой стороны рака) были показаны Facista et al. [35] часто иметь эпигенетические дефекты в 2 или 3 белках репарации ДНК ( ERCC1 , XPF или PMS2 ) во всей области дефекта поля. Нарушение репарации ДНК приводит к увеличению частоты мутаций. [36] [37] [38] Дефицит репарации ДНК сам по себе может привести к накоплению повреждений ДНК, а склонный к ошибкам синтез транслезий мимо некоторых из этих повреждений может привести к мутациям. Кроме того, неправильное восстановление этих накопленных повреждений ДНК может привести к эпимутациям. Эти новые мутации или эпимутации могут обеспечить пролиферативное преимущество, вызывая дефект поля. Хотя мутации/эпимутации в генах репарации ДНК сами по себе не дают селективного преимущества, они могут переноситься в качестве «пассажиров» в клетках, когда клетки приобретают дополнительные мутации/эпимутации, которые действительно обеспечивают пролиферативное преимущество. [ нужна ссылка ]
Этимология [ править ]
Термин «новообразование» является синонимом опухоли . Неоплазия обозначает процесс образования новообразований/опухолей, и этот процесс называется неопластическим процессом. Само слово «неопластика» происходит от греческого neo «новый» и «пластик » «сформированный, отлитый в форму». [ нужна ссылка ]
Термин «опухоль» происходит от латинского существительного опухоль «опухоль», в конечном итоге от глагола tumēre «набухать». В Британском Содружестве обычно используется написание слово опухоль , тогда как в США это слово обычно пишется как опухоль . [ нужна ссылка ]
В медицинском смысле опухоль традиционно означает аномальное опухание плоти. Римский медицинский энциклопедист Цельс ( ок. 30 г. до н. э. – 38 г. н. э.) описал четыре основных признака острого воспаления : опухоль , болезненность , жар и покраснение (отек, боль, повышенный жар и покраснение). (Его трактат « О медицине » был первой медицинской книгой, напечатанной в 1478 году после изобретения печатного станка с подвижным шрифтом.)
В современном английском языке слово « опухоль» часто используется как синоним кистозного (заполненного жидкостью) образования или солидного новообразования (ракового или неракового). [63] с другими формами отека, часто называемыми «отеками» . [64]
Родственные термины часто встречаются в медицинской литературе, где существительные набухание и набухание (производные от прилагательного набухание ). [65] — это современные медицинские термины, обозначающие неопухолевый отек. Этот тип отека чаще всего вызван воспалением, вызванным травмой, инфекцией и другими факторами. [ нужна ссылка ]
Однако опухоли могут быть вызваны и другими причинами, а не чрезмерным ростом неопластических клеток. Кисты (например, кисты сальных желез) также называют опухолями, даже если они не содержат неопластических клеток. Это стандартная терминология в сфере медицинских счетов (особенно при выставлении счетов за новообразование, патология которого еще не определена). [ нужна ссылка ]
См. также [ править ]
- Эпидемиология рака
- Список нарушений биологического развития
- Плеоморфизм
- Соматическая эволюция при раке
Ссылки [ править ]
- ^ «новообразование» . Lexico Британский словарь английского языка . Издательство Оксфордского университета . Архивировано из оригинала 28 апреля 2021 года.
- ^ «новообразование» . Dictionary.com Полный (онлайн). nd
- ^ Jump up to: Перейти обратно: а б с д Бирбрайр А., Чжан Т., Ван З.М., Месси М.Л., Олсон Дж.Д., Минц А., Дельбоно О. (июль 2014 г.). «Перициты типа 2 участвуют в нормальном и опухолевом ангиогенезе» . Являюсь. J. Physiol., Cell Physiol . 307 (1): C25–38. doi : 10.1152/ajpcell.00084.2014 . ПМК 4080181 . ПМИД 24788248 .
- ^ Купер GM (1992). Элементы рака человека . Бостон: Издательство Jones and Bartlett. п. 16. ISBN 978-0-86720-191-8 .
- ^ Тейлор, Элизабет Дж. (2000). Иллюстрированный медицинский словарь Дорланда (29-е изд.). Филадельфия: Сондерс. п. 1184 . ISBN 978-0721662541 .
- ^ Медицинский словарь Стедмана (28-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. 2006. с. Новообразование. ISBN 978-0781733908 .
- ^ «II Новообразования» . Международная статистическая классификация болезней и проблем, связанных со здоровьем, 10-е издание (МКБ-10), версия 2010 г. Всемирная организация здравоохранения. Архивировано из оригинала 24 июля 2018 года . Проверено 19 июня 2014 г.
- ^ Jump up to: Перейти обратно: а б Абрамс, Джеральд. «Неоплазия I» . Архивировано из оригинала 31 октября 2015 года . Проверено 23 января 2012 г.
- ^ «Рак – Задание 1 – Глоссарий, стр. 4 из 5» . Архивировано из оригинала 9 мая 2008 г. Проверено 8 января 2008 г.
- ^ «Медицинское определение клона» . Архивировано из оригинала 25 октября 2012 г. Проверено 10 февраля 2015 г.
- ^ Ли Э.С., Локер Дж., Налесник М., Рейес Дж., Джаффе Р., Алашари М., Нур Б., Цакис А., Дикман П.С. (январь 1995 г.). «Ассоциация вируса Эпштейна-Барр с гладкомышечными опухолями, возникающими после трансплантации органов» . Н. англ. Дж. Мед . 332 (1): 19–25. дои : 10.1056/NEJM199501053320104 . ПМИД 7990861 .
- ^ «Рак поджелудочной железы: словарь терминов» . Архивировано из оригинала 5 июня 2010 г. Проверено 8 января 2008 г.
- ^ «Опухоль». Иллюстрированный медицинский словарь Дорланда (31-е изд.). Сондерс . 2007. ISBN 978-1-84972-348-0 .
- ^ Таммела, Туомас; Сейдж, Жюльен (2020). «Исследование гетерогенности опухоли на мышиных моделях» . Ежегодный обзор биологии рака . 4 (1): 99–119. doi : 10.1146/annurev-cancerbio-030419-033413 . ПМЦ 8218894 . ПМИД 34164589 .
- ^ Асашима М., Ойнума Т., Мейер-Рохов В.Б. (1987). «Опухоли у амфибий». Зоологическая наука . 4 : 411–425.
- ^ Амбрози Д., Моллика Ф (2002). «О механике растущей опухоли». Международный журнал инженерных наук . 40 (12): 1297–316. дои : 10.1016/S0020-7225(02)00014-9 .
- ^ Волох К.Ю. (сентябрь 2006 г.). «Стрессы в растущих мягких тканях». Акта Биоматер . 2 (5): 493–504. doi : 10.1016/j.actbio.2006.04.002 . ПМИД 16793355 .
- ^ Кастан М.Б. (2008). «Реакция на повреждение ДНК: механизмы и роль в заболеваниях человека: лекция на премию Мемориала ГСГ Клоуза 2007 г.» . Мол. Рак Рез . 6 (4): 517–24. дои : 10.1158/1541-7786.MCR-08-0020 . ПМИД 18403632 .
- ^ Эймс Б.Н., Сигенага МК, Хаген ТМ. Оксиданты, антиоксиданты и дегенеративные заболевания старения. Proc Natl Acad Sci, США, 1993, 1 сентября; 90 (17): 7915-22. дои: 10.1073/pnas.90.17.7915. ПМИД 8367443; PMCID: PMC47258.
- ^ Каннингем Ф.Х., Фибелькорн С., Джонсон М., Мередит С. (ноябрь 2011 г.). «Новое применение подхода предела воздействия: разделение токсикантов табачного дыма». Пищевая хим. Токсикол . 49 (11): 2921–33. дои : 10.1016/j.fct.2011.07.019 . ПМИД 21802474 .
- ^ Канави Х.Э., Герстенблит М.Р. (декабрь 2011 г.). «Ультрафиолетовое излучение и меланома». Семин Кутан Мед Хирург . 30 (4): 222–8. дои : 10.1016/j.sder.2011.08.003 . ПМИД 22123420 .
- ^ Ханда О, Найто Ю, Ёсикава Т (2011). «Окислительно-восстановительная биология и канцерогенез желудка: роль Helicobacter pylori» . Представитель Redox . 16 (1): 1–7. дои : 10.1179/174329211X12968219310756 . ПМЦ 6837368 . ПМИД 21605492 .
- ^ Бернштейн С., Голубец Х., Бхаттачария А.К., Нгуен Х., Пейн С.М., Зайтлин Б., Бернштейн Х. (август 2011 г.). «Канцерогенность дезоксихолата, вторичной желчной кислоты» . Арх. Токсикол . 85 (8): 863–71. дои : 10.1007/s00204-011-0648-7 . ПМК 3149672 . ПМИД 21267546 .
- ^ Кацурано М., Нива Т., Ясуи Ю., Сигемацу Ю., Ямасита С., Такэсима Х., Ли М.С., Ким Ю.Дж., Танака Т., Ушидзима Т. (январь 2012 г.). «Ранняя стадия формирования дефекта эпигенетического поля в модели колита у мышей и несущественная роль Т- и В-клеток в индукции метилирования ДНК» . Онкоген . 31 (3): 342–51. дои : 10.1038/onc.2011.241 . ПМИД 21685942 .
- ^ Малкин Д. (апрель 2011 г.). «Синдром Ли-фраумени» . Гены рака . 2 (4): 475–84. дои : 10.1177/1947601911413466 . ПМЦ 3135649 . ПМИД 21779515 .
- ^ Лихтенштейн П., Холм Н.В., Веркасало П.К., Илиаду А., Каприо Дж., Коскенвуо М., Пуккала Е., Скитте А., Хемминки К. (июль 2000 г.). «Экологические и наследственные факторы, вызывающие рак – анализ когорт близнецов из Швеции, Дании и Финляндии» . Н. англ. Дж. Мед . 343 (2): 78–85. дои : 10.1056/NEJM200007133430201 . ПМИД 10891514 .
- ^ Хэлфорд С., Роуэн А., Сойер Э., Талбот I, Томлинсон I (июнь 2005 г.). «О (6)-метилгуанин метилтрансфераза при колоректальном раке: обнаружение мутаций, потеря экспрессии и слабая связь с переходами G: C> A: T» . Гут . 54 (6): 797–802. дои : 10.1136/gut.2004.059535 . ПМЦ 1774551 . ПМИД 15888787 .
- ^ Jump up to: Перейти обратно: а б Шен Л., Кондо Ю., Рознер Г.Л., Сяо Л., Эрнандес Н.С., Вилайтонг Дж., Хулихан П.С., Крауз Р.С., Прасад А.Р., Эйнспар Дж.Г., Бакмайер Дж., Альбертс Д.С., Гамильтон С.Р., Исса Дж.П. (сентябрь 2005 г.). «Метилирование промотора MGMT и дефект поля при спорадическом колоректальном раке» . Дж. Натл. Онкологический институт . 97 (18): 1330–8. дои : 10.1093/jnci/dji275 . ПМИД 16174854 .
- ^ Псофаки В., Калогера С., Цамбурас Н., Стефану Д., Цианос Е., Сефериадис К., Колиос Г. (июль 2010 г.). «Статус метилирования промотора hMLH1, MGMT и CDKN2A/p16 при колоректальных аденомах» . Мир Дж. Гастроэнтерол . 16 (28): 3553–60. дои : 10.3748/wjg.v16.i28.3553 . ПМК 2909555 . ПМИД 20653064 .
- ^ Jump up to: Перейти обратно: а б с Ли К.Х., Ли Дж.С., Нам Дж.Х., Чой С., Ли MC, Пак К.С., Джунг С.В., Ли Дж.Х. (октябрь 2011 г.). «Статус метилирования промотора генов hMLH1, hMSH2 и MGMT при колоректальном раке, связанном с последовательностью аденома-карцинома». Архивная хирургия Лангенбекса . 396 (7): 1017–26. дои : 10.1007/s00423-011-0812-9 . ПМИД 21706233 . S2CID 8069716 .
- ^ Амату А, Сарторе-Бьянки А, Моутинью С, Белотти А, Бенкардино К, Кирико Г, Кассингена А, Рускони Ф, Эспозито А, Никелатти М, Эстеллер М, Сиена С (апрель 2013 г.). «Гиперметилирование промоторного CpG-островка фермента репарации ДНК MGMT предсказывает клинический ответ на дакарбазин в исследовании фазы II метастатического колоректального рака» . Клин. Рак Рез . 19 (8): 2265–72. дои : 10.1158/1078-0432.CCR-12-3518 . ПМИД 23422094 .
- ^ Мокаррам П., Замани М., Кавусипур С., Нагибальхоссайни Ф., Ираджи С., Моради Сараби М. и др. (май 2013 г.). «Различные закономерности метилирования ДНК двух различных областей промотора O6-метилгуанин-ДНК-метилтрансферазы (O6-MGMT) при колоректальном раке». Мол. Биол. Представитель . 40 (5): 3851–7. дои : 10.1007/s11033-012-2465-3 . ПМИД 23271133 . S2CID 18733871 .
- ^ Трунингер К., Менигатти М., Луз Дж., Рассел А., Хайдер Р., Гебберс Дж.О. и др. (май 2005 г.). «Иммуногистохимический анализ выявляет высокую частоту дефектов PMS2 при колоректальном раке» . Гастроэнтерология . 128 (5): 1160–71. дои : 10.1053/j.gastro.2005.01.056 . ПМИД 15887099 .
- ^ Валери Н., Гаспарини П., Фаббри М., Бракони С., Веронезе А., Ловат Ф. и др. (апрель 2010 г.). «Модуляция репарации ошибочных спариваний и стабильности генома с помощью миР-155» . Учеб. Натл. акад. наук. США . 107 (15): 6982–7. Бибкод : 2010PNAS..107.6982V . дои : 10.1073/pnas.1002472107 . ПМЦ 2872463 . ПМИД 20351277 .
- ^ Jump up to: Перейти обратно: а б с д и Фациста А., Нгуен Х., Льюис С., Прасад А.Р., Рэмси Л., Зайтлин Б. и др. (2012). «Недостаточная экспрессия ферментов репарации ДНК на ранней стадии развития спорадического рака толстой кишки» . Геномная интеграция . 3 (1): 3. дои : 10.1186/2041-9414-3-3 . ПМК 3351028 . ПМИД 22494821 .
- ^ Jump up to: Перейти обратно: а б Нарайанан Л., Фритцелл Дж.А., Бейкер С.М., Лискай Р.М., Глейзер П.М. (апрель 1997 г.). «Повышенные уровни мутаций во многих тканях мышей с дефицитом гена репарации несоответствия ДНК Pms2» . Учеб. Натл. акад. наук. США . 94 (7): 3122–7. Бибкод : 1997PNAS...94.3122N . дои : 10.1073/pnas.94.7.3122 . ЧВК 20332 . ПМИД 9096356 .
- ^ Jump up to: Перейти обратно: а б Хеган Д.С., Нараянан Л., Жирик Ф.Р., Эдельманн В., Лискай Р.М., Глейзер П.М. (декабрь 2006 г.). «Различные модели генетической нестабильности у мышей с дефицитом генов репарации ошибочного спаривания Pms2, Mlh1, Msh2, Msh3 и Msh6» . Канцерогенез . 27 (12): 2402–8. doi : 10.1093/carcin/bgl079 . ПМК 2612936 . ПМИД 16728433 .
- ^ Jump up to: Перейти обратно: а б Тутт А.Н., ван Остром КТ, Росс ГМ, ван Стиг Х., Эшворт А. (март 2002 г.). «Нарушение Brca2 увеличивает частоту спонтанных мутаций in vivo: синергизм с ионизирующим излучением» . Представитель ЭМБО . 3 (3): 255–60. дои : 10.1093/embo-reports/kvf037 . ПМК 1084010 . ПМИД 11850397 .
- ^ О'Хаган Х.М., Мохаммад Х.П., Бэйлин С.Б. (2008). Ли Джей Ти (ред.). «Двухнитевые разрывы могут инициировать молчание генов и SIRT1-зависимое начало метилирования ДНК на экзогенном промоторном острове CpG» . ПЛОС Генет . 4 (8): е1000155. дои : 10.1371/journal.pgen.1000155 . ПМЦ 2491723 . ПМИД 18704159 .
- ^ Куоццо С, Порчеллини А, Ангрисано Т, Морано А, Ли Б, Ди Пардо А, Мессина С, Юлиано Р, Фуско А, Сантильо М.Р., Мюллер М.Т., Кьяриотти Л., Готтесман М.Е., Авведименто Э.В. (июль 2007 г.). «Повреждение ДНК, репарация, направленная на гомологию, и метилирование ДНК» . ПЛОС Генет . 3 (7): е110. дои : 10.1371/journal.pgen.0030110 . ЧВК 1913100 . ПМИД 17616978 .
- ^ Герлингер М., Роуэн А.Дж., Хорсвелл С., Ларкин Дж., Эндесфельдер Д., Гронроос Е. и др. (март 2012 г.). «Внутриопухолевая гетерогенность и разветвленная эволюция, выявленная с помощью многорегионального секвенирования» . Н. англ. Дж. Мед . 366 (10): 883–92. дои : 10.1056/NEJMoa1113205 . ПМЦ 4878653 . ПМИД 22397650 .
- ^ Слотер ДП, Саутвик HW, Смейкал В (сентябрь 1953 г.). «Полевая канцеризация многослойного плоского эпителия полости рта; клинические последствия мультицентрического происхождения» . Рак . 6 (5): 963–8. doi : 10.1002/1097-0142(195309)6:5<963::AID-CNCR2820060515>3.0.CO;2-Q . ПМИД 13094644 . S2CID 6736946 .
- ^ Бернштейн С., Бернштейн Х., Пейн С.М., Дворжак К., Гаревал Х. (февраль 2008 г.). «Полевые дефекты при прогрессировании рака желудочно-кишечного тракта» . Рак Летт . 260 (1–2): 1–10. дои : 10.1016/j.canlet.2007.11.027 . ПМЦ 2744582 . ПМИД 18164807 .
- ^ Нгуен Х., Лустаунау С., Фасиста А., Рэмси Л., Хассуна Н., Тейлор Х., Круз Р., Пейн С.М., Цикитис В.Л., Гольдшмид С., Банерджи Б., Перини Р.Ф., Бернштейн С. (2010). «Дефицит Pms2, ERCC1, Ku86, CcOI в дефектах поля во время прогрессирования рака толстой кишки» . J Vis Exp (41): 1931. doi : 10.3791/1931 . ПМК 3149991 . ПМИД 20689513 .
- ^ Рубин Х (март 2011 г.). «Поля и канцеризация полей: предопухолевые источники рака: бессимптомные гиперпластические поля являются предшественниками неоплазии, и их прогрессирование в опухоли можно отследить по плотности насыщения в культуре». Биоэссе . 33 (3): 224–31. doi : 10.1002/bies.201000067 . ПМИД 21254148 . S2CID 44981539 .
- ^ Цао Дж.Л., Ятабе Ю., Саловаара Р., Ярвинен Х.Дж., Меклин Дж.П., Аалтонен Л.А., Тавари С., Шибата Д. (февраль 2000 г.). «Генетическая реконструкция историй отдельных колоректальных опухолей» . Учеб. Натл. акад. наук. США . 97 (3): 1236–41. Бибкод : 2000PNAS...97.1236T . дои : 10.1073/pnas.97.3.1236 . ПМК 15581 . ПМИД 10655514 .
- ^ Jump up to: Перейти обратно: а б с Фогельштейн Б., Пападопулос Н., Велкулеску В.Е., Чжоу С., Диас Л.А., Кинцлер К.В. (март 2013 г.). «Пейзажи генома рака» . Наука . 339 (6127): 1546–58. Бибкод : 2013Sci...339.1546V . дои : 10.1126/science.1235122 . ПМЦ 3749880 . ПМИД 23539594 .
- ^ Локхед П., Чан А.Т., Нишихара Р., Фукс К.С., Бек А.Х., Джованнуччи Э., Огино С. (2014). «Этиологический полевой эффект: переоценка концепции полевого эффекта в предрасположенности и прогрессировании рака» . Мод Патол . 28 (1): 14–29. дои : 10.1038/modpathol.2014.81 . ПМК 4265316 . ПМИД 24925058 .
- ^ Сврчек М., Бухард О., Колас С., Куле Ф., Дюмон С., Массауди И. и др. (ноябрь 2010 г.). «Толерантность к метилированию из-за дефекта поля O6-метилгуанин-ДНК-метилтрансферазы (MGMT) в слизистой оболочке толстой кишки: начальный этап в развитии колоректального рака с дефицитом репарации несоответствия». Гут . 59 (11): 1516–26. дои : 10.1136/gut.2009.194787 . ПМИД 20947886 . S2CID 206950452 .
- ^ Палущак Ю., Мисяк П., Вежбицка М., Возняк А., Баер-Дубовска В. (февраль 2011 г.). «Частое гиперметилирование DAPK, RARbeta, MGMT, RASSF1A и FHIT при плоскоклеточном раке гортани и прилегающей нормальной слизистой оболочке». Оральный онкол . 47 (2): 104–7. doi : 10.1016/j.oraloncology.2010.11.006 . ПМИД 21147548 .
- ^ Цзо С., Чжан Х., Спенсер Х.Дж., Вурал Э., Суен Дж.Ю., Шихман С.А., Смоллер Б.Р., Кокоска М.С., Фан С.И. (октябрь 2009 г.). «Повышенная микросателлитная нестабильность и эпигенетическая инактивация гена hMLH1 при плоскоклеточном раке головы и шеи». Отоларингольная хирургия головы и шеи . 141 (4): 484–90. дои : 10.1016/j.otohns.2009.07.007 . ПМИД 19786217 . S2CID 8357370 .
- ^ Тауфик Х.М., Эль-Максуд Н.М., Хак Б.Х., Эль-Щербини Ю.М. (2011). «Плоскоклеточный рак головы и шеи: иммуногистохимия восстановления несоответствия и гиперметилирование промотора гена hMLH1». Ам Дж Отоларингол . 32 (6): 528–36. дои : 10.1016/j.amjoto.2010.11.005 . ПМИД 21353335 .
- ^ Цзоу XP, Чжан Б, Чжан XQ, Чен М, Цао Дж, Лю WJ (ноябрь 2009 г.). «Промоторное гиперметилирование нескольких генов при ранней аденокарциноме желудка и предраковых поражениях». Хм. Патол . 40 (11): 1534–42. дои : 10.1016/j.humpath.2009.01.029 . ПМИД 19695681 .
- ^ Вани М, Афроз Д, Махдуми М, Хамид И, Вани Б, Бхат Дж, Вани Р, Вани К (2012). «Статус метилирования промотора гена репарации ДНК (hMLH1) у пациентов с карциномой желудка в Кашмирской долине» . Азиатский Пак. Дж. Рак Пред . 13 (8): 4177–81. дои : 10.7314/APJCP.2012.13.8.4177 . ПМИД 23098428 .
- ^ Агарвал А., Полинени Р., Хусейн З., Вигода И., Бхагат Т.Д., Бхаттачарья С., Майтра А., Верма А. (2012). «Роль эпигенетических изменений в патогенезе пищевода Барретта и аденокарциномы пищевода» . Int J Clin Exp Pathol . 5 (5): 382–96. ПМК 3396065 . ПМИД 22808291 .
- ^ Хофстад Б., Ватн М.Х., Андерсен С.Н., Хуитфельдт Х.С., Рогнум Т., Ларсен С., Оснес М. (сентябрь 1996 г.). «Рост колоректальных полипов: повторное выявление и оценка нерезецированных полипов в течение трех лет» . Гут . 39 (3): 449–56. дои : 10.1136/gut.39.3.449 . ПМЦ 1383355 . ПМИД 8949653 .
- ^ Шмитт М.В., Приндл М.Дж., Леб Л.А. (сентябрь 2012 г.). «Последствия генетической гетерогенности при раке» . Энн. Н-Й Акад. Наука . 1267 (1): 110–6. Бибкод : 2012NYASA1267..110S . дои : 10.1111/j.1749-6632.2012.06590.x . ПМЦ 3674777 . ПМИД 22954224 .
- ^ Ландер Э.С., Линтон Л.М., Биррен Б., Нусбаум С., Зоди М.С., Болдуин Дж., Девон К., Дьюар К., Дойл М., ФитцХью В. и др. (февраль 2001 г.). «Первичное секвенирование и анализ генома человека» (PDF) . Природа . 409 (6822): 860–921. Бибкод : 2001Natur.409..860L . дои : 10.1038/35057062 . ПМИД 11237011 . Архивировано из оригинала 29 июля 2020 г. Проверено 2 сентября 2019 г.
- ^ Йост С.Е., Смит Э.Н., Шваб Р.Б., Бао Л., Юнг Х., Ван Х, Воест Э., Пирс Дж.П., Мессер К., Паркер Б.А., Харисменди О., Фрейзер К.А. (август 2012 г.). «Идентификация соматических мутаций с высокой степенью достоверности в полногеномной последовательности фиксированных формалином образцов рака молочной железы» . Нуклеиновые кислоты Рез . 40 (14): е107. дои : 10.1093/nar/gks299 . ПМЦ 3413110 . ПМИД 22492626 .
- ^ Бергер М.Ф., Ходис Э., Хеффернан Т.П., Дерибе Ю.Л., Лоуренс М.С., Протопопов А. и др. (май 2012 г.). «Секвенирование генома меланомы выявило частые мутации PREX2» . Природа . 485 (7399): 502–6. Бибкод : 2012Natur.485..502B . дои : 10.1038/nature11071 . ПМЦ 3367798 . ПМИД 22622578 .
- ^ Роуч Дж.К., Глусман Дж., Смит А.Ф., Хафф К.Д., Хабли Р., Шеннон П.Т. и др. (апрель 2010 г.). «Анализ генетического наследования в семейном квартете методом полногеномного секвенирования» . Наука . 328 (5978): 636–9. Бибкод : 2010Sci...328..636R . дои : 10.1126/science.1186802 . ПМК 3037280 . ПМИД 20220176 .
- ^ Кэмпбелл С.Д., Чонг Дж.К., Малиг М., Ко А., Дюмон Б.Л., Хан Л. и др. (ноябрь 2012 г.). «Оценка частоты мутаций у человека с использованием аутозиготности в популяции основателей» . Нат. Жене . 44 (11): 1277–81. дои : 10.1038/ng.2418 . ПМЦ 3483378 . ПМИД 23001126 .
- ^ Опухоль в Медицинской энциклопедии
- ^ "Припухлость" . Медицинская энциклопедия MedlinePlus . 14 октября 2012 г.
- ^ «набухание» . Оксфордский словарь английского языка (онлайн-изд.). Издательство Оксфордского университета . (Требуется подписка или членство участвующей организации .)