Гетерогенность опухоли
Гетерогенность опухоли описывает наблюдение, согласно которому разные опухолевые клетки могут демонстрировать различные морфологические и фенотипические профили, включая клеточную морфологию, экспрессию генов, метаболизм, подвижность, пролиферацию и метастатический потенциал. [1] Это явление происходит как между опухолями (межопухолевая гетерогенность), так и внутри опухолей (внутриопухолевая гетерогенность). Минимальный уровень внутриопухолевой гетерогенности является простым следствием несовершенства репликации ДНК несколько мутаций. : всякий раз, когда клетка (нормальная или раковая) делится, возникает [2] — что приводит к разнообразию популяции раковых клеток. [3] Гетерогенность . раковых клеток создает серьезные проблемы при разработке эффективных стратегий лечения Однако исследования, направленные на понимание и характеристику гетерогенности, могут позволить лучше понять причины и прогрессирование заболевания. В свою очередь, это может способствовать созданию более совершенных стратегий лечения, которые включают знание гетерогенности для достижения более высокой эффективности. [4]
Гетерогенность опухоли наблюдалась при лейкозах , [5] грудь , [6] простата , [7] [8] [9] толстая кишка , [10] [11] [12] мозг , [13] пищевод , [14] голова и шея , [15] мочевой пузырь [16] и гинекологические карциномы , [17] липосаркома , [18] и множественная миелома . [19]
Модели неоднородности
[ редактировать ]Существуют две модели, используемые для объяснения гетерогенности опухолевых клеток. Это модель раковых стволовых клеток и модель клональной эволюции . Модели не являются взаимоисключающими, и считается, что они обе в разной степени способствуют гетерогенности разных типов опухолей. [20]
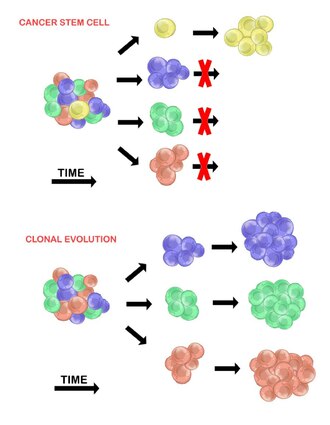
Раковые стволовые клетки
[ редактировать ]Модель раковых стволовых клеток утверждает, что в популяции опухолевых клеток существует лишь небольшая подгруппа клеток, которые являются опухолегенными (способными образовывать опухоли). Эти клетки называются раковыми стволовыми клетками ( РСК ) и характеризуются способностью как к самообновлению, так и к дифференцировке в неопухолевое потомство. Модель CSC утверждает, что гетерогенность, наблюдаемая между опухолевыми клетками, является результатом различий в стволовых клетках, из которых они произошли. Вариабельность стволовых клеток часто вызвана эпигенетическими изменениями, но также может быть результатом клональной эволюции популяции РСК, при которой выгодные генетические мутации могут накапливаться в РСК и их потомстве (см. ниже). [20]
Доказательства эффективности модели раковых стволовых клеток были продемонстрированы при различных типах опухолей, включая лейкемии , [21] [22] глиобластома , [23] рак молочной железы , [24] и рак простаты . [25]
Однако существование CSC все еще остается предметом дискуссий. Одна из причин этого заключается в том, что маркеры РСК трудно воспроизвести во многих опухолях. Кроме того, в методах определения канцерогенного потенциала используются модели ксенотрансплантатов . Эти способы страдают от присущих им ограничений, таких как необходимость контроля иммунного ответа у животных, которым трансплантировали трансплантат, и значительная разница в условиях окружающей среды от первичного участка опухоли до места ксенотрансплантата ( например, отсутствие необходимых экзогенных молекул или кофакторов). [26] Это вызвало некоторые сомнения в точности результатов РСК и выводов о том, какие клетки обладают онкогенным потенциалом. [ нужна ссылка ]
Клональная эволюция
[ редактировать ]Модель клональной эволюции была впервые предложена в 1976 году Питером Ноуэллом . [27] В этой модели опухоли возникают из одной мутировавшей клетки, накапливая дополнительные мутации по мере своего развития. Эти изменения приводят к появлению дополнительных субпопуляций, и каждая из этих субпопуляций обладает способностью делиться и мутировать дальше. Эта гетерогенность может привести к появлению субклонов, обладающих эволюционным преимуществом перед другими в опухолевой среде , и эти субклоны со временем могут стать доминантными в опухоли. [28] [29] Когда эта модель была предложена, она позволила понять рост опухоли, неудачу лечения и агрессию опухоли, которая возникает во время естественного процесса образования опухоли. [28]
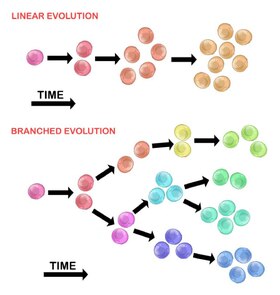
Эволюция исходной опухолевой клетки может происходить двумя способами:
Линейное расширение
[ редактировать ]Последовательно упорядоченные мутации накапливаются в генах-драйверах, генах-супрессорах опухолей и ферментах репарации ДНК , что приводит к клональной экспансии опухолевых клеток. Линейное расширение с меньшей вероятностью отражает конечную точку злокачественной опухоли. [30] поскольку накопление мутаций в гетерогенных опухолях носит стохастический характер.
Разветвленное расширение
[ редактировать ]Расширение на несколько субклональных популяций происходит за счет механизма расщепления. [28] Этот метод больше связан с гетерогенностью опухоли, чем с линейным расширением. Приобретение мутаций является случайным в результате увеличения геномной нестабильности с каждым последующим поколением. Долгосрочное накопление мутаций может обеспечить селективное преимущество на определенных стадиях прогрессирования опухоли. Микроокружение опухоли также может способствовать распространению опухоли, поскольку оно способно изменять селективное давление, которому подвергаются опухолевые клетки. [30]
Виды и причины неоднородности
[ редактировать ]Между опухолевыми клетками наблюдаются множественные типы гетерогенности, обусловленные как генетической, так и негенетической изменчивостью. [31]
Генетическая гетерогенность
[ редактировать ]Генетическая гетерогенность является общей чертой опухолевых геномов и может возникать из нескольких источников. Некоторые виды рака возникают, когда экзогенные факторы вызывают мутации, такие как ультрафиолетовое излучение (рак кожи) и табак (рак легких). Более распространенным источником является геномная нестабильность, которая часто возникает, когда в клетках нарушаются ключевые регуляторные пути. Некоторые примеры включают нарушения механизмов репарации ДНК , которые могут привести к увеличению количества ошибок репликации, а также дефекты в механизме митоза , которые приводят к крупномасштабному увеличению или потере целых хромосом . [32] Более того, некоторые методы лечения рака могут еще больше увеличить генетическую изменчивость ( например, лечение темозоломидом и другими химиотерапевтическими препаратами). [33] [34]
Мутационная гетерогенность опухоли относится к вариациям частоты мутаций в разных генах и образцах и может быть изучена MutSig , заархивировано 3 октября 2017 г. на Wayback Machine . Этиология мутационных процессов может существенно различаться в образцах опухолей одного и того же или разных типов рака и проявляться в различных контекстно-зависимых мутационных профилях. Его можно исследовать с помощью мутационных сигнатур COSMIC или MutaGene .
Другая неоднородность
[ редактировать ]Опухолевые клетки также могут демонстрировать гетерогенность профилей экспрессии. Это часто вызвано лежащими в основе эпигенетическими изменениями. [31] Вариации в сигнатурах экспрессии были обнаружены в различных областях образцов опухолей у человека. Исследователи показали, что конвергентные мутации, затрагивающие H3K36 метилтрансферазу SETD2 и деметилазу гистона H3K4 KDM5C, возникают в пространственно разделенных участках опухоли. Аналогично, MTOR , ген, кодирующий клеточную регуляторную киназу , оказался конститутивно активным, тем самым увеличивая фосфорилирование S6 . Это активное фосфорилирование может служить биомаркером светлоклеточной карциномы. [30]
Механохимическая гетерогенность является отличительной чертой живых эукариотических клеток. Он оказывает влияние на эпигенетическую регуляцию генов . Гетерогенные динамические механохимические процессы регулируют взаимоотношения внутри группы клеточных поверхностей посредством адгезии . [35] Развитие и распространение опухоли сопровождается изменением гетерогенной хаотичной динамики процесса механохимического взаимодействия в групповых клетках, в том числе в клетках внутри опухоли, и носит иерархический характер для хозяина онкологических больных. [36] Биологические явления механохимической гетерогенности могут быть использованы для дифференциальной диагностики рака желудка у больных с воспалением . слизистой оболочки желудка [37] и для повышения антиметастатической активности дендритных клеток на основе вакцин механически гетерогенизированных микрочастиц опухолевых клеток. при использовании для их загрузки [38] Возможен также методический подход, основанный на одновременной ультразвуковой диагностике и терапии, касающийся механохимического воздействия на конгломераты нанопузырьков с лекарственными средствами в опухоли. [ нужна ссылка ]
Микроокружение опухоли
[ редактировать ]Гетерогенность между опухолевыми клетками может еще больше увеличиваться из-за неоднородности микроокружения опухоли . Региональные различия в опухоли ( например, наличие кислорода) оказывают различное селективное давление на опухолевые клетки, что приводит к более широкому спектру доминантных субклонов в разных пространственных областях опухоли. Влияние микроокружения на клональное доминирование также является вероятной причиной гетерогенности между первичными и метастатическими опухолями, наблюдаемой у многих пациентов, а также межопухолевой гетерогенности, наблюдаемой между пациентами с одним и тем же типом опухоли. [39]
Последствия и проблемы
[ редактировать ]Устойчивость к лечению
[ редактировать ]Гетерогенные опухоли могут проявлять разную чувствительность к цитотоксическим препаратам в разных клональных популяциях. Это связано с клональными взаимодействиями, которые могут ингибировать или изменять терапевтическую эффективность, что создает проблему для успешной терапии гетерогенных опухолей (и их гетерогенных метастазов). [1]
Введение лекарств при гетерогенных опухолях редко приводит к уничтожению всех опухолевых клеток. Первоначальная гетерогенная популяция опухолей может стать узким местом , так что выживут лишь немногие клетки, устойчивые к лекарственным препаратам (если таковые имеются). Это позволяет устойчивым опухолевым популяциям реплицироваться и выращивать новую опухоль посредством механизма разветвленной эволюции (см. выше). Образовавшаяся репопуляция опухоли является гетерогенной и резистентной к первоначальной лекарственной терапии. Репопуляция опухоли также может вернуться более агрессивным образом. [ нужна ссылка ]
Введение цитостатиков часто приводит к первоначальному уменьшению опухоли. Это представляет собой разрушение исходных нерезистентных субклональных популяций внутри гетерогенной опухоли, в результате чего остаются только устойчивые клоны. Эти устойчивые клоны теперь обладают селективным преимуществом и могут реплицироваться для повторного заселения опухоли. Репликация, вероятно, будет происходить посредством ветвящейся эволюции, что способствует гетерогенности опухоли. Репопуляция опухоли может оказаться более агрессивной. Это объясняется селективным преимуществом опухолевых клеток в отношении устойчивости к лекарствам. [ нужна ссылка ]

Прогноз при множественной миеломе
[ редактировать ]При множественной миеломе генетический анализ опухоли используется для выявления маркеров риска, таких как специфические мутации, делеции, вставки и т. д. Помогает оценить прогноз пациента . Но между пациентами есть расхождения: у некоторых пациентов с хорошим риском рецидив наступит раньше, чем ожидалось. Кроме того, у некоторых пациентов аномалия риска будет наблюдаться только при рецидиве. Исследование 2023 года [40] Использование одиночных клеток показало, что субклоны с маркером риска присутствуют у некоторых пациентов с момента постановки диагноза, но с такой низкой частотой, что их невозможно обнаружить с помощью стандартной генетической оценки. Кроме того, это исследование показало, что пациенты с маркерами риска, обнаруживаемыми только при рецидиве, действительно связаны с плохим прогнозом. При некоторой аномалии риска нет разницы в ожидаемой продолжительности жизни ( общая выживаемость ) между пациентами с аномалией, обнаруженной при диагностике, и пациентами, у которых аномалия обнаружена только при рецидиве. Открытым остается вопрос о влиянии лечения на клональную селекцию. Терапевтическое значение этого результата широко развито в статье: «Таким образом, необходимы чувствительные подходы к обнаружению этих субклонов при постановке диагноза вместе с инновационными стратегиями лечения, чтобы искоренить низкочастотные субклоны с высоким риском и предотвратить их доминирование. ...] Наконец, маловероятно, что описанное явление ограничивается ММ" [41] (Множественная миелома).
Открытие биомаркеров
[ редактировать ]Из-за генетических различий внутри и между опухолями биомаркеры , которые могут предсказать ответ на лечение или прогноз, могут не иметь широкого применения. Однако было высказано предположение, что уровень гетерогенности сам по себе может использоваться в качестве биомаркера, поскольку более гетерогенные опухоли с большей вероятностью будут содержать субклоны, устойчивые к лечению. [31] Дальнейшие исследования по разработке биомаркеров, учитывающих гетерогенность, все еще продолжаются.
Модельные системы
[ редактировать ]Существующим модельным системам обычно не хватает гетерогенности, наблюдаемой при раке человека. [42] Чтобы точно изучить гетерогенность опухоли, мы должны разработать более точные доклинические модели. Одна из таких моделей, ксенотрансплантат опухоли, полученный от пациента , продемонстрировала превосходную полезность в сохранении гетерогенности опухоли, в то же время позволяя детально изучить факторы клональной пригодности. [43] Однако даже эта модель не может отразить всю сложность рака.
Текущие стратегии
[ редактировать ]Хотя проблема выявления, характеристики и лечения гетерогенности опухолей все еще находится в стадии активных исследований, были предложены некоторые эффективные стратегии, включая как экспериментальные, так и вычислительные решения. [ нужна ссылка ]
Экспериментальный
[ редактировать ]- Целенаправленный подход: анализ конкретного генетического локуса или набора локусов. Это может произойти путем обнаружения аллельного дисбаланса (ДНК опухоли сравнивается с ДНК зародышевой линии), амплификации хромосомных областей ( FISH ) и/или секвенирования определенных генов. Этот метод используется для отслеживания эволюции конкретной интересующей мутации или для подтверждения мутации, которую исследователи могут заподозрить в опухоли. [1]
- Преимущество: позволяет анализировать специфические гены ( т. е. гены-драйверы, супрессоры опухолей). Процесс прост и дает прямую интерпретацию результатов. FISH и иммунофлуоресценция позволяют сосредоточиться на подтипах опухолевых клеток. [1]
- Недостаток: ограниченный анализ не позволит пропустить дополнительные важные мутации и закономерности клональной экспансии. Аллельный дисбаланс может быть трудно проверить с помощью микросателлитных маркеров, поэтому требуется проверка независимым методом ( например, FISH). FISH требует большого количества клеток и является трудоемким. [1]
- Полногеномный подход: анализ всего генома в образцах опухолей. Это можно сделать посредством кариотипирования или сравнительной геномной гибридизации (CGH) для выявления хромосомных аномалий. Секвенирование биопсий опухолей становится все более распространенным. [1]
- Преимущество: не полагается на предварительные знания для определения вариантов. кариотипирование выявляет области крупных хромосомных аномалий. CGH обеспечивает беспристрастный охват и позволяет выявлять небольшие аллельные дисбалансы (массивы SNP) . Секвенирование позволит выявить любые варианты, которые способствуют гетерогенности опухоли. [1]
- Недостаток: Трудно определить функциональное влияние вариантов ( т.е. нейтральное или патогенное). Ограниченное разрешение. Кариотипирование культивируемых клеток может быть смещено в сторону преимущественного роста избранных субпопуляций опухолевых клеток. Ограниченное разрешение в обоих методах. [1] Полногеномный подход может генерировать большие объемы данных и быть трудным для интерпретации.
- Стратегия отбора проб из нескольких областей: обычно требуется несколько образцов послеоперационной опухоли из отдельных областей микрорассеченной опухоли. Важно избегать загрязнения доброкачественных клеток, чтобы обеспечить точное представление об экспрессии генов и генетическом составе, наблюдаемом только в опухолевых клетках. Анализ опухолевой ДНК в пространственно разделенных областях позволяет построить трехмерную эволюционную модель гетерогенности опухоли. [1] Многорегиональная выборка часто используется в сочетании с полногеномным подходом для создания этой трехмерной модели расширения гетерогенности.
- Продольный отбор проб: в некоторых случаях при прогрессировании опухоли или ходе лечения получали образцы опухоли в несколько моментов времени. Это было предложено как надежный метод отслеживания клональной эволюции. [34] [44] [45] Однако на практике этот метод оказывается сложным, поскольку требует периодической инвазивной биопсии. Новое исследование по использованию циркулирующей бесклеточной опухолевой ДНК в крови может обеспечить неинвазивный способ выявления биомаркеров на протяжении всего лечения. [46] Продольный отбор проб, используемый в сочетании с полногеномным подходом, позволит идентифицировать накопленные мутации опухолевых клеток с течением времени. Это, в свою очередь, может выявить ключевые мутации-драйверы (видимые в первоначальных образцах опухолей).
- Адаптивная терапия может использоваться для предотвращения дальнейшего роста опухоли путем корректировки дозы препарата и времени введения препарата в зависимости от реакции опухоли. Предполагается, что эта стратегия предотвращает доминирование резистентных вариантов в опухоли. Однако необходимы дополнительные исследования его применимости. [47]
Секвенирование
[ редактировать ]- Можно использовать массовое секвенирование опухолей , при котором ДНК извлекается из смеси опухолевых клеток и анализируется сразу. Наличие гетерогенных популяций опухолей (субклонов) создает дополнительные проблемы, такие как:
- Невозможность обнаружить мутации в редких субклонах. Поскольку эти мутации будут происходить с низкой частотой в объединенной выборке, они могут быть неотличимы от фонового шума. Тем не менее, активно разрабатываются многие варианты, вызывающие данные, специально предназначенные для данных о раке и направленные на выявление редких вариантов, присутствующих в небольших субклональных популяциях. [48] [49] [50] [51] Обычно они используют совпадающую нормальную ДНК как средство различения истинных соматических вариаций от вариаций зародышевой линии и ошибок фонового секвенирования.
- Невозможность определить, какие субклоны содержат каждую мутацию. Поскольку данные объединены, неясно, какие мутации происходят одновременно и из каких популяций они происходят. Разрабатываются новые инструменты, которые пытаются определить клональную структуру, используя частоты аллелей наблюдаемых мутаций. [52]
- Секвенирование отдельных клеток — это новый метод, ценный для оценки внутриопухолевой гетерогенности опухоли, который считается решающим для разработки эффективных персонализированных методов лечения рака, поскольку он может характеризовать отдельные опухолевые клетки. Это означает, что весь мутационный профиль множества различных клеток может быть определен без двусмысленности. Лучшее понимание внутриопухолевой гетерогенности позволит лучше предотвращать рецидивы после лечения, поскольку современные методы лечения рака в основном нацелены на доминирующий субклон, позволяя вторичным субклонам расширяться после лечения. [53] Хотя при использовании современных технологий трудно оценить достаточно большое количество одиночных клеток для получения статистической достоверности, данные об одноклеточных опухолях имеют множество преимуществ, в том числе:
- Возможность построить филогенетическое дерево, показывающее эволюцию опухолевых популяций. Используя полногеномные последовательности или SNP псевдопоследовательности на основе из отдельных клеток, можно оценить эволюцию субклонов. Это позволяет идентифицировать популяции, которые сохранились с течением времени, и может сузить список мутаций, которые потенциально дают преимущество в росте или устойчивость к лечению конкретным субклонам. [54] Алгоритмы определения филогении опухоли на основе данных секвенирования одноклеточной ДНК включают SCITE, [55] ОнкоНЕМ, [56] СиФит, [57] СиКлонФит, [58] ФИСНЦ, [59] и ФИСКС-БнБ. [60] Современные методологии сталкиваются с проблемами анализа крупномасштабных наборов данных. Подходы, основанные на комбинаторной оптимизации, демонстрируют экспоненциальный рост времени выполнения с увеличением количества ячеек (m) и мутаций (n). [61] Решение задачи реконструкции дерева прогрессирования опухоли является NP-трудной задачей. [62] что указывает на то, что найти решение за полиномиальное время маловероятно. Стандартные подходы к реконструкции идеальной филогении не были применимы из-за высокой частоты ошибок в экспериментах на одной клетке. [63] Вероятностные подходы оказались альтернативным методом работы с противоречивыми данными. Эти байесовские подходы используют эвристику выборки Монте-Карло (MCMC) цепи Маркова , которая работает за полиномиальное время для исследования обширного пространства поиска возможных историй прогрессирования опухоли. Используя всю информацию, содержащуюся в данных, эти подходы предлагают многообещающее решение проблемы противоречивых данных. [64] Чтобы понять эффективность методов MCMC дерева мутаций и необходимое время их выполнения, важно понять, насколько быстро эмпирическое распределение MCMC сходится к апостериорному распределению . Количественная оценка заднего исследования активно исследуется в этой области. Недавно новое применение диагностики сходимости, установленное в непрерывном пространстве к дискретному пространству деревьев посредством сходства деревьев, привело к многообещающим результатам. [65] а также, в частности, для деревьев мутаций. [66]
- Секвенирование срезов можно проводить на нескольких участках одной солидной опухоли, а вариации частот мутаций в срезах можно анализировать, чтобы сделать вывод о клональной структуре. Преимущества этого подхода перед однократным секвенированием включают большую статистическую мощность и доступность более точной информации о пространственном положении образцов. Последнее можно использовать для определения частоты клонов в срезах и получения информации о том, как опухоль развивается в космосе. Чтобы определить генотипы клонов и филогенетические деревья, моделирующие эволюцию опухоли во времени, было разработано несколько вычислительных методов. [67] [68] [69] в том числе Кломиал, [70] клонHD, [71] ФилоРГС, [72] Пиклон, [73] Хлоя, [74] фиС, [75] Навес, [76] Таргетклон , ddClone, [77] КОНДИТЕРСКИЕ, [78] ГЛКлон, [79] Черта, [80] ВСКУнмикс, [81] Б-ЗНАТЬ. [82] ТэтА, [83] ХАРАКТЕРИСТИКИ, [84] Скласт, [85] SeqClone [86] КАЛДЕР, [87] ТЕДДИ, [88] Мелтос, [89] Субмарина, [90] РНДКЛОН, [91] хвойное дерево, [92] ПЕРЕДАЧА, [93] и RDAClone. [94]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я Марусик, А; Поляк, К (2010). «Опухолевая гетерогенность: причины и последствия» . Biochimica et Biophysical Acta (BBA) - Обзоры о раке . 1805 (1): 105–117. дои : 10.1016/j.bbcan.2009.11.002 . ПМЦ 2814927 . ПМИД 19931353 .
- ^ Фогельштейн, Берт; Пападопулос, Н.; Велкулеску, ВЕ; Чжоу, С.; Диас, Луизиана; Кинцлер, К.В. (2013). «Пейзажи генома рака» . Наука . 373 (6127): 1546–1556. Бибкод : 2013Sci...339.1546V . дои : 10.1126/science.1235122 . ПМК 3749880 . ПМИД 23539594 .
- ^ Хеппнер, Джорджия (1984). «Опухолевая гетерогенность». Исследования рака . 44 (6): 2259–2265. ПМИД 6372991 .
- ^ Райтер, Йоханнес Г; Макохон-Мур, Элвин П.; Джерольд, Джеффри М; Хейде, Александр; Аттие, Марк А; Кохутек, Закари А; Токхайм, Коллин Дж; Браун, Алексия; ДеБлазио, Рейн; Ниязов, Юлиана; Цукер, Аманда; Карчин, Рэйчел; Кинзлер, Кеннет В.; Якобузио-Донахью, Кристина А; Фогельштейн, Берт; Новак, Мартин А (2018). «Минимальная функциональная гетерогенность генов-драйверов среди нелеченых метастазов» . Наука . 361 (6406): 1033–1037. Бибкод : 2018Sci...361.1033R . дои : 10.1126/science.aat7171 . ПМК 6329287 . ПМИД 30190408 .
- ^ Кэмпбелл, ПиДжей; Плезанс, ЭД; Стивенс, П.Дж.; Дикс, Э; Рэнс, Р; Гудхед, я; Следует, Г.А.; Грин, Арканзас; Фуреал, Пенсильвания; Страттон, MR (2008). «Субклональные филогенетические структуры рака, выявленные с помощью сверхглубокого секвенирования» . Труды Национальной академии наук . 105 (35): 13081–13086. Бибкод : 2008PNAS..10513081C . дои : 10.1073/pnas.0801523105 . ПМК 2529122 . ПМИД 18723673 .
- ^ Шипицин М.; Кэмпбелл, LL; Аргани, П; Веремович, С; Блуштейн-Кимрон, Н.; Яо, Дж; Никольская Т; Серебрянская, Т; Берухим, Р; Ху, М; Галушка, МК; Сукумар, С; Паркер, Л.М.; Андерсон, Канзас; Харрис, Л.Н.; Гарбер, Дж. Э.; Ричардсон, Алабама; Шнитт, С.Дж.; Никольский Ю.; Гельман, Р.С.; Поляк, К (2007). «Молекулярное определение гетерогенности опухоли молочной железы» . Раковая клетка . 11 (3): 259–273. дои : 10.1016/j.ccr.2007.01.013 . ПМИД 17349583 .
- ^ Макинтош, Калифорния; Стоуэр, М; Рид, Н.; Мейтленд, Нью-Джерси (1998). «Точная микродиссекция рака предстательной железы человека выявляет генотипическую гетерогенность». Исследования рака . 58 (1): 23–28. ПМИД 9426051 .
- ^ Альварадо, К; Бейтель, ЛК; Сиркар, К; Априкян А; Трифиро, М; Готлиб, Б. (2005). «Соматический мозаицизм и рак: микрогенетическое исследование роли гена рецептора андрогена при раке простаты» . Исследования рака . 65 (18): 8514–8518. doi : 10.1158/0008-5472.CAN-05-0399 . ПМИД 16166332 .
- ^ Кониши, Н; Хиаса, Ю; Мацуда, Х; Тао, М; Цузуки, Т; Хаяши, я; Китахори, Ю; Сираиси, Т; Ятани, Р; Симадзаки, Дж (1995). «Внутриопухолевая клеточная гетерогенность и изменения в онкогене ras и гене-супрессоре опухоли р53 при карциноме простаты человека» . Американский журнал патологии . 147 (4): 1112–1122. ПМК 1871010 . ПМИД 7573356 .
- ^ Гонсалес-Гарсия, я; Соле, Р.В.; Коста, Дж (2002). «Метапопуляционная динамика и пространственная гетерогенность при раке» . Труды Национальной академии наук . 99 (20): 13085–13089. Бибкод : 2002PNAS...9913085G . дои : 10.1073/pnas.202139299 . ПМК 130590 . ПМИД 12351679 .
- ^ Самовитц, WS; Слэттери, МЛ (1999). «Региональная воспроизводимость микросателлитной нестабильности при спорадическом колоректальном раке». Гены, хромосомы и рак . 26 (2): 106–114. doi : 10.1002/(SICI)1098-2264(199910)26:2<106::AID-GCC2>3.0.CO;2-F . ПМИД 10469448 . S2CID 5643190 .
- ^ Джаретти, Ж; Монако, Р; Пуич, Н; Рапалло, А; Нигро, С; Гейдо, Э. (1996). «Внутриопухолевая гетерогенность мутаций K-ras2 при колоректальных аденокарциномах: связь со степенью анеуплоидии ДНК» . Американский журнал патологии . 149 (1): 237–245. ПМК 1865212 . PMID 8686748 .
- ^ Хеппнер, GH (1984). «Опухолевая гетерогенность». Исследования рака . 44 (6): 2259–2265. ПМИД 6372991 .
- ^ Малей, CC; Галипо, ПК; Финли, Джей Си; Вонгсурават, виджей; Ли, Х; Санчес, Калифорния; Полсон, Т.Г.; Блаунт, Польша; Рискес, РА; Рабинович, П.С.; Рид, Би Джей (2006). «Генетическое клональное разнообразие предсказывает прогрессирование аденокарциномы пищевода». Природная генетика . 38 (4): 468–473. дои : 10.1038/ng1768 . ПМИД 16565718 . S2CID 1898396 .
- ^ Калифано, Дж; Ван дер Рит, П; Вестра, Вт; Навруз, Х; Клейман, Дж; Пиантадоси, С; Корио, Р; Ли, Д; Гринберг, Б; Кох, В; Сидранский, Д. (1996). «Модель генетического прогрессирования рака головы и шеи: последствия для полевой канцерализации». Исследования рака . 56 (11): 2488–2492. ПМИД 8653682 .
- ^ Заутер, Г; Мох, Х; Гассер, ТК; Михач, MJ; Уолдман, FM (1995). «Гетерогенность хромосомы 17 и числа копий гена erbB-2 при первичном и метастатическом раке мочевого пузыря» . Цитометрия . 21 (1): 40–46. дои : 10.1002/cyto.990210109 . ПМИД 8529469 .
- ^ Фуджи, Х; Ёсида, М; Гонг, ZX; Мацумото, Т; Хамано, Ю; Фукунага, М; Хрубан, Р.Х.; Габриэльсон, Э; Шираи, Т (2000). «Частая генетическая гетерогенность в клональной эволюции гинекологической карциносаркомы и ее влияние на фенотипическое разнообразие». Исследования рака . 60 (1): 114–120. ПМИД 10646862 .
- ^ Хорвай, А.Э.; Деврис, С; Рой, Р; О'Доннелл, Р.Дж.; Уолдман, Ф (2009). «Сходство генетических изменений между парными хорошо дифференцированными и дедифференцированными компонентами дедифференцированной липосаркомы» . Современная патология . 22 (11): 1477–1488. дои : 10.1038/modpathol.2009.119 . ПМИД 19734852 .
- ^ Панту, Д; Ризо, Х; Царуха, Х; Пули, А; Папанастасиу, К; Стамателлу, М; Трангас, Т; Пандис, Н.; Барди, Дж. (2005). «Цитогенетические проявления гетерогенности множественной миеломы». Гены, хромосомы и рак . 42 (1): 44–57. дои : 10.1002/gcc.20114 . ПМИД 15495197 . S2CID 43218546 .
- ^ Jump up to: а б Шеклтон, М; Кинтана, Э; Фирон, скорая помощь; Моррисон, SJ (2009). «Гетерогенность рака: раковые стволовые клетки против клональной эволюции» . Клетка . 138 (5): 822–829. дои : 10.1016/j.cell.2009.08.017 . ПМИД 19737509 .
- ^ Лапидот, Т; Сирар, К; Формур, Дж; Мердок, Б; Хоанг, Т; Касерес-Кортес, Дж; Минден, М; Патерсон, Б; Калиджури, Массачусетс; Дик, Дж. Э. (1994). «Клетка, инициирующая острый миелоидный лейкоз человека, после трансплантации мышам SCID». Природа . 367 (6464): 645–648. Бибкод : 1994Natur.367..645L . дои : 10.1038/367645a0 . ПМИД 7509044 . S2CID 4330788 .
- ^ Ван, JC; Лапидот, Т; Кэшман, Джей Ди; Доеденс, М; Адди, Л; Сазерленд, ДР; Наяр, Р; Ларая, П; Минден, М; Китинг, А; Ивз, AC; Ивз, CJ; Дик, Дж. Э. (1998). «Высокий уровень приживления мышей NOD/SCID примитивными нормальными и лейкозными гемопоэтическими клетками от пациентов с хроническим миелолейкозом в хронической фазе» . Кровь . 91 (7): 2406–2414. дои : 10.1182/blood.V91.7.2406 . ПМИД 9516140 .
- ^ Сингх, СК; Хокинс, К; Кларк, ID; Сквайр, Дж.А.; Баяни, Дж; Скрыть, Т; Хенкельман, Р.М.; Кузимано, доктор медицины; Диркс, П.Б. (2004). «Идентификация клеток, инициирующих опухоль головного мозга человека». Природа . 432 (7015): 396–401. Бибкод : 2004Natur.432..396S . дои : 10.1038/nature03128 . ПМИД 15549107 . S2CID 4430962 .
- ^ Аль-Хадж, М; Вича, Миссисипи; Бенито-Эрнандес, А; Моррисон, SJ; Кларк, МФ (2003). «Проспективная идентификация туморогенных клеток рака молочной железы» . Труды Национальной академии наук . 100 (7): 3983–3988. Бибкод : 2003PNAS..100.3983A . дои : 10.1073/pnas.0530291100 . ПМК 153034 . ПМИД 12629218 .
- ^ Мейтленд, Нью-Джерси; Коллинз, AT (2008). «Стволовые клетки рака простаты: новая мишень для терапии». Журнал клинической онкологии . 26 (17): 2862–2870. дои : 10.1200/JCO.2007.15.1472 . ПМИД 18539965 .
- ^ Мичем, CE; Моррисон, SJ (2013). «Гетерогенность опухоли и пластичность раковых клеток» . Природа . 501 (7467): 328–337. Бибкод : 2013Natur.501..328M . дои : 10.1038/nature12624 . ПМЦ 4521623 . ПМИД 24048065 .
- ^ Ноуэлл, ПК (1976). «Клональная эволюция популяций опухолевых клеток». Наука . 194 (4260): 23–28. Бибкод : 1976Sci...194...23N . дои : 10.1126/science.959840 . ПМИД 959840 . S2CID 38445059 .
- ^ Jump up to: а б с Суонтон, К. (2012). «Внутриопухолевая гетерогенность: эволюция в пространстве и времени» . Исследования рака . 72 (19): 4875–4882. дои : 10.1158/0008-5472.CAN-12-2217 . ПМЦ 3712191 . ПМИД 23002210 .
- ^ Мерло, LMF; Пеппер, Дж.В.; Рид, Би Джей; Малей, CC (2006). «Рак как эволюционный и экологический процесс». Обзоры природы Рак . 6 (12): 924–935. дои : 10.1038/nrc2013 . ПМИД 17109012 . S2CID 8040576 .
- ^ Jump up to: а б с Герлингер, М; Роуэн, Эй Джей; Хорсвелл, С; Ларкин, Дж; Эндесфельдер, Д; Гронрос, Э; Мартинес, П; Мэтьюз, Н.; Стюарт, А; Тарпи, П; Варела, я; Филлимор, Б; Бегум, С; Макдональд, Северная Каролина; Батлер, А; Джонс, Д; Рейн, К; Латимер, К; Сантос, ЧР; Нохадани, М; Эклунд, AC; Спенсер-Дин, Б; Кларк, Дж; Пикеринг, Л; Штамп, Г; Гор, М; Салласи, З; Вниз, Дж; Фуреал, Пенсильвания; Суонтон, К. (2012). «Внутриопухолевая гетерогенность и разветвленная эволюция, выявленная с помощью многорегионального секвенирования» . Медицинский журнал Новой Англии . 366 (10): 883–892. дои : 10.1056/NEJMoa1113205 . ПМЦ 4878653 . ПМИД 22397650 .
- ^ Jump up to: а б с Марусик, А; Альмендро, В; Поляк, К (2012). «Внутриопухолевая гетерогенность: зеркало рака?». Обзоры природы Рак . 12 (5): 323–334. дои : 10.1038/nrc3261 . ПМИД 22513401 . S2CID 24420285 .
- ^ Баррелл, РА; МакГранахан, Н.; Бартек, Дж; Суонтон, К. (2013). «Причины и последствия генетической гетерогенности в эволюции рака». Природа . 501 (7467): 338–345. Бибкод : 2013Natur.501..338B . дои : 10.1038/nature12625 . ПМИД 24048066 . S2CID 4457392 .
- ^ Джонсон, Б.Э.; Мазор, Т; Хонг, К; Барнс, М; Айхара, К; Маклин, Калифорния; Фаус, С.Д.; Ямамото, С; Уэда, Х; Тацуно, К; Астана, С; Жальбер, Ле; Нельсон, С.Дж.; Боллен, AW; Густафсон, WC; Чаррон, Э; Вайс, Вашингтон; Смирнов И.В.; Сонг, Дж.С.; Ольшен, АБ; Ча, С; Чжао, Ю; Мур, РА; Мунгалл, Эй Джей; Джонс, С.Дж.; Херст, М; Марра, Массачусетс; Сайто, Н.; Абуратани, Х; Мукаса, А (2014). «Мутационный анализ раскрывает происхождение и эволюцию рецидивирующей глиомы, обусловленную терапией» . Наука . 343 (6167): 189–193. Бибкод : 2014Sci...343..189J . дои : 10.1126/science.1239947 . ПМЦ 3998672 . ПМИД 24336570 .
- ^ Jump up to: а б Дин, Л; Лей, Ти Джей; Ларсон, Делавэр; Миллер, Калифорния; Кобольдт, округ Колумбия; Уэлч, Дж. С.; Ричи, Дж. К.; Янг, Массачусетс; Лампрехт, Т; Маклеллан, доктор медицины; МакМайкл, Дж. Ф.; Уоллис, JW; Лу, С; Шен, Д; Харрис, CC; Дулинг, диджей; Фултон, РС; Фултон, Луизиана; Чен, К; Шмидт, Х; Калицкий-Вейзер, Дж; Магрини, виджей; Кук, Л; МакГрат, SD; Викери, ТЛ; Вендл, MC; Хит, С; Уотсон, Массачусетс; Линк, округ Колумбия; Томассон, Миннесота (2012). «Клональная эволюция при рецидиве острого миелолейкоза, выявленная с помощью полногеномного секвенирования» . Природа . 481 (7382): 506–510. Бибкод : 2012Natur.481..506D . дои : 10.1038/nature10738 . ПМЦ 3267864 . ПМИД 22237025 .
- ^ Г.М.Эдельман (1989). «Топобиология». Научный американец . 260 (5): 76–88. Бибкод : 1989SciAm.260e..76E . doi : 10.1038/scientificamerican0589-76 . ПМИД 2717916 .
- ^ ВЕ Орел; Н. Н. Дзятьковская; М.И. Данко; А.В. Романов; Ю.И. Мельник; Ю.А. Гриневич; С.В. Мартыненко (2004). «Пространственный и механоэмиссионный хаос механически деформированных опухолевых клеток» . Журнал механики в медицине и биологии . 4 (1): 31–45. дои : 10.1142/s0219519404000886 .
- ^ ВЕ Орел; А.В. Романов; Н. Н. Дзятьковская; Ю.И. Мельник (2002). «Прибор и алгоритм оценки механоэмиссонного хаоса в крови больных раком желудка» . Медицинская инженерия и физика . 24 (5): 365–371. дои : 10.1016/s1350-4533(02)00022-x . ПМИД 12052364 .
- ^ Н. Храновская; В. Орел; Ю. Гриневич; О. Алексеенко; А. Романов; О. Скачкова; Н.Дзятьковская; А. Бурлака; С.Лукин (2012). «Механическая гетерогенизация клеток карциномы легких Льюиса может улучшить антиметастатический эффект дендритных клеток». Журнал механики в медицине и биологии . 3 (12): 22. дои : 10.1142/S0219519411004757 .
- ^ Юнттила, MR; Де Соваж, Ф.Дж. (2013). «Влияние неоднородности микроокружения опухоли на терапевтический ответ». Природа . 501 (7467): 346–354. Бибкод : 2013Natur.501..346J . дои : 10.1038/nature12626 . ПМИД 24048067 . S2CID 4452486 .
- ^ Ланн, Ромен; Самур, Мехмет; Перро, Аврора; Маццотти, Селин; Диву, Марион; Казобиль, Титуан; Леле, Ксавье; Шавгулидзе, Анаис; Кретьен, Мари-Лотарингия; Манье, Саломон; Адико, Дидье; Орсини-Пиочелле, Фредерик; Лиферманн, Франсуа; Брешиньяк, Сабина; Гасто, Лорис; Бускари, Дидье; Макро, Маргарет; Клейнен, Алиса; Мохти, Мохамад; Мунши, Нихил; Корр, Джилл; Аве-Луазо, Эрве (2023). «При множественной миеломе вторичные генетические события высокого риска, наблюдаемые при рецидиве, присутствуют на основании диагноза в крошечных, неопределяемых субклональных популяциях» . Журнал клинической онкологии . 41 (9): 1695–1702. дои : 10.1200/JCO.21.01987 . ПМЦ 10043564 . ПМИД 36343306 . S2CID 253395684 .
- ^ Бойл, Эйлин М.; Дэвис, Фейт Э. (2023). «Из маленьких субклонов вырастают могучие дубы» . Обзоры природы Клиническая онкология . 20 (3): 141–142. дои : 10.1038/s41571-022-00727-w . ПМИД 36624303 . S2CID 255567626 .
- ^ Ауман, Джеймс Тодд; Маклеод, Ховард Л. (1 января 2010 г.). «Клеточные линии колоректального рака лишены молекулярной гетерогенности клинических колоректальных опухолей». Клинический колоректальный рак . 9 (1): 40–47. дои : 10.3816/ccc.2010.n.005 . ПМИД 20100687 .
- ^ Кэссиди, Джон В.; Кальдас, Карлос; Бруна, Алехандра (01 августа 2015 г.). «Поддержание гетерогенности опухоли в опухолевых ксенотрансплантатах, полученных от пациента» . Исследования рака . 75 (15): 2963–2968. дои : 10.1158/0008-5472.CAN-15-0727 . ISSN 0008-5472 . ПМЦ 4539570 . ПМИД 26180079 .
- ^ Бай Х., Харманджи А.С., Эрсон-Омай А.З., Ли Дж., Джошкун С., Саймон М. и др. (ноябрь 2015 г.). «Комплексная геномная характеристика злокачественного прогрессирования глиомы с мутацией IDH1» . Природная генетика . 48 (1): 59–66. дои : 10.1038/ng.3457 . ПМЦ 4829945 . ПМИД 26618343 .
- ^ Бедард, Польша; Хансен, Арканзас; Ратен, MJ; Сиу, LL (2013). «Неоднородность опухоли в клинике» . Природа . 501 (7467): 355–364. Бибкод : 2013Natur.501..355B . дои : 10.1038/nature12627 . ПМК 5224525 . ПМИД 24048068 .
- ^ Доусон, SJ ; Цуй, Д.В.; Муртаза, М; Биггс, Х; Руэда, ОМ; Чин, Сан-Франциско; Даннинг, MJ; Гейл, Д; Форшоу, Т; Малер-Араужо, Б; Раджан, С; Хамфри, С; Бек, Дж; Холсолл, Д; Уоллис, М; Бентли, Д; Кальдас, К; Розенфельд, Н. (2013). «Анализ циркулирующей опухолевой ДНК для мониторинга метастатического рака молочной железы» . Медицинский журнал Новой Англии . 368 (13): 1199–1209. дои : 10.1056/NEJMoa1213261 . ПМИД 23484797 .
- ^ Гейтенби, РА; Сильва, А.С.; Гиллис, Р.Дж.; Фриден, БР (2009). «Адаптивная терапия» . Исследования рака . 69 (11): 4894–4903. дои : 10.1158/0008-5472.CAN-08-3658 . ПМЦ 3728826 . ПМИД 19487300 .
- ^ Цибульскис, К; Лоуренс, MS; Картер, СЛ; Сиваченко А; Яффе, Д; Суньез, К; Габриэль, С; Мейерсон, М; Ландер, ЕС; Гетц, Г (2013). «Чувствительное выявление точковых соматических мутаций в нечистых и гетерогенных образцах рака» . Природная биотехнология . 31 (3): 213–219. дои : 10.1038/nbt.2514 . ПМЦ 3833702 . ПМИД 23396013 .
- ^ Кобольдт, округ Колумбия; Чжан, Вопрос; Ларсон, Делавэр; Шен, Д; Маклеллан, доктор медицины; Лин, Л; Миллер, Калифорния; Мардис, скорая помощь; Дин, Л; Уилсон, РК (2012). «Var Scan 2: обнаружение соматических мутаций и изменений числа копий при раке путем секвенирования экзома» . Геномные исследования . 22 (3): 568–576. дои : 10.1101/гр.129684.111 . ПМК 3290792 . ПМИД 22300766 .
- ^ Сондерс, Коннектикут; Вонг, WS; Свами, С; Бек, Дж; Мюррей, LJ; Читам, РК (2012). «Стрелка: Точный вызов соматических малых вариантов из секвенированных пар образцов опухоль-нормальный» . Биоинформатика . 28 (14): 1811–1817. doi : 10.1093/биоинформатика/bts271 . ПМИД 22581179 .
- ^ Картер, СЛ; Цибульскис, К; Хелман, Э; Маккенна, А; Шен, Х; Зак, Т; Лэрд, П.В.; Онофрио, RC; Винклер, В; Вейр, бакалавр; Берухим, Р; Пеллман, Д; Левин, Д.А.; Ландер, ЕС; Мейерсон, М; Гетц, Г (2012). «Абсолютная количественная оценка изменений соматической ДНК при раке человека» (PDF) . Природная биотехнология . 30 (5): 413–421. дои : 10.1038/nbt.2203 . ПМЦ 4383288 . ПМИД 22544022 .
- ^ Шах, СП; Рот, А; Гойя, Р; Олуми, А; Ха, Г; Чжао, Ю; Турашвили, Г; Дин, Дж; Це, К; Хаффари, Дж; Башашати, А; Прентис, LM; Хаттра, Дж; Берли, А; Яп, Д; Бернар, В.; Макферсон, А; Шуманский, К; Крисан, А; Джулиани, Р; Херави-Мусави, А; Рознер, Дж; Проложенный; Бироль, я; Вархол, Р; Тэм, А; Дхалла, Н.; Цзэн, Т; Ма, К; Чан, СК (2012). «Спектр клональной и мутационной эволюции первичного тройного негативного рака молочной железы» . Природа . 486 (7403): 395–399. Бибкод : 2012Natur.486..395S . дои : 10.1038/nature10933 . ПМЦ 3863681 . ПМИД 22495314 .
- ^ Гиллис, Роберт Дж.; Вердуско, Дэниел; Гейтенби, Роберт А. (июль 2012 г.). «Эволюционная динамика канцерогенеза и почему таргетная терапия не работает» . Обзоры природы Рак . 12 (7): 487–493. дои : 10.1038/nrc3298 . ПМК 4122506 . ПМИД 22695393 .
- ^ Навин, Н; Кендалл, Дж; Троге, Дж; Эндрюс, П; Роджерс, Л; МакИнду, Дж; Кук, К; Степанский А; Леви, Д; Эспозито, Д; Мутусвами, Л; Красниц, А; МакКомби, WR; Хикс, Дж; Виглер, М. (2011). «Эволюция опухоли, выявленная с помощью секвенирования отдельных клеток» . Природа . 472 (7341): 90–94. Бибкод : 2011Natur.472...90N . дои : 10.1038/nature09807 . ПМК 4504184 . ПМИД 21399628 .
- ^ Ян, Катарина (2016). «Древовидный вывод для одноячеечных данных» . Геномная биология . 17:86 . дои : 10.1186/s13059-016-0936-x . ПМЦ 4858868 . ПМИД 27149953 .
- ^ Росс, Эдит (2016). «OncoNEM: определение эволюции опухоли на основе данных секвенирования отдельных клеток» . Геномная биология . 17:69 . дои : 10.1186/s13059-016-0929-9 . ПМЦ 4832472 . ПМИД 27083415 .
- ^ Зафар, Хамим (2017). «SiFit: определение деревьев опухолей на основе данных секвенирования отдельных клеток в рамках моделей с конечными участками» . Геномная биология . 18 (1): 178. дои : 10.1186/s13059-017-1311-2 . ПМК 5606061 . ПМИД 28927434 .
- ^ Зафар, Хамим (2019). «SiCloneFit: байесовский вывод о структуре популяции, генотипе и филогении опухолевых клонов на основе данных секвенирования одноклеточного генома» . Геномные исследования . 29 (11): 1847–1859. дои : 10.1101/гр.243121.118 . ПМЦ 6836738 . ПМИД 31628257 .
- ^ Маликич, Салем; Рашиди Мехрабади, Фарид (2019). «PhISCS: комбинаторный подход к несовершенной реконструкции филогении опухолей посредством интегративного использования данных одноклеточного и массового секвенирования» . Геномные исследования . 29 (11): 1860–1877. дои : 10.1101/гр.234435.118 . ПМК 6836735 . ПМИД 31628256 .
- ^ Садеки Азер, Эрфан; Рашиди Мехрабади, Фарид (2020). «PhISCS-BnB: быстрый алгоритм ветвей и границ для решения идеальной задачи реконструкции филогении опухолей» . Биоинформатика . 36 (Дополнение_1): i169–i176. doi : 10.1093/биоинформатика/btaa464 . ПМЦ 7355310 . ПМИД 32657358 .
- ^ Замок, Кан; старейшина Мехрабади Фарид; Садеки Азер, Эрфан; Перес-Гихарро, Ева; Мари, Керри Л.; Ли, Максвелл П.; Дэй, Чи-Пин; Мерлино, Гленн; Эргюн, Фонд; Пол, Айдын; Сахинальп, С. Дженк; Маликич, Салем (сентябрь 2022 г.). «Быстрый вывод о внутриопухолевой гетерогенности на основе данных секвенирования отдельных клеток» . Природа вычислительной науки . 2 (9): 577–583. дои : 10.1038/s43588-022-00298-x . PMC10765963 . ПМИД 38177468 . S2CID 252171836 .
- ^ Эль-Кебир, Мохаммед (2018). «SPhyR: Оценка филогении опухоли на основе данных секвенирования одиночных клеток с учетом потерь и ошибок» . Биоинформатика . 34 (17): i671–i679. doi : 10.1093/биоинформатика/bty589 . ПМК 6153375 . ПМИД 30423070 .
- ^ Ян, Катарина; Койперс, Джек; Беренвинкель, Нико (декабрь 2016 г.). «Древовидный вывод для одноячеечных данных» . Геномная биология . 17 (1): 86. дои : 10.1186/s13059-016-0936-x . ПМЦ 4858868 . ПМИД 27149953 .
- ^ Ян, Катарина; Койперс, Джек; Беренвинкель, Нико (декабрь 2016 г.). «Древовидный вывод для одноячеечных данных» . Геномная биология . 17 (1): 86. дои : 10.1186/s13059-016-0936-x . ПМЦ 4858868 . ПМИД 27149953 .
- ^ Уидден, Крис; Матсен, Фредерик А. (1 мая 2015 г.). «Количественная оценка MCMC-исследования пространства филогенетического дерева» . Систематическая биология . 64 (3): 472–491. дои : 10.1093/sysbio/syv006 . ПМЦ 4395846 . ПМИД 25631175 .
- ^ Кён, Гордон (23 октября 2023 г.). Количественная оценка цепи Маркова Монте-Карло Исследование пространств дерева прогрессии опухоли: стратегии инициализации, диагностика конвергенции и мультимодальности . Коллекция ETH Zürich (магистерская диссертация). ETH Цюрих. doi : 10.3929/ethz-b-000642011 .
- ^ Койперс, Джек (2017). «Достижения в понимании эволюции опухолей посредством секвенирования отдельных клеток» . Biochimica et Biophysical Acta (BBA) - Обзоры о раке . 1867 (2): 127–138. дои : 10.1016/j.bbcan.2017.02.001 . ПМЦ 5813714 . ПМИД 28193548 .
- ^ Шварц, Рассел (13 февраля 2017 г.). «Эволюция филогенетики опухолей: принципы и практика» . Обзоры природы Генетика . 18 (4): 213–229. дои : 10.1038/nrg.2016.170 . ПМК 5886015 . ПМИД 28190876 .
- ^ Фарахани, Хосейн; де Соуза, Камила П.Е.; Биллингс, Рэвин; Да, Дамиан; Шуманский, Карей; Ван, Адриан; Лай, Дэниел; Мес-Массон, Анн-Мари; Апарисио, Самуэль; П. Шах, Сохраб (18 октября 2017 г.). «Создание смесей клеточных линий in vitro и надежная оценка вычислительных методов клонального разложения и продольной динамики рака» . Научные отчеты . 7 (1): 13467. Бибкод : 2017NatSR...713467F . дои : 10.1038/s41598-017-13338-8 . ПМЦ 5647443 . ПМИД 29044127 .
- ^ Заре, Хабиль (2014). «Вывод клонального состава на основе нескольких участков рака молочной железы» . PLOS Вычислительная биология . 10 (7): e1003703. Бибкод : 2014PLSCB..10E3703Z . дои : 10.1371/journal.pcbi.1003703 . ПМК 4091710 . ПМИД 25010360 .
- ^ Фишер, Андрей (2014). «Реконструкция клонального состава при раке в высоком разрешении» . Отчеты по ячейкам . 7 (5): 1740–1752. дои : 10.1016/j.celrep.2014.04.055 . ПМК 4062932 . ПМИД 24882004 .
- ^ Дешвар, Амит (2015). «Мониторинг прогрессирования хронического лимфоцитарного лейкоза с помощью полногеномного секвенирования выявляет гетерогенные закономерности клональной эволюции» . Геномная биология . 16 (1): 35. дои : 10.1186/s13059-015-0602-8 . ПМЦ 4359439 . ПМИД 25786235 .
- ^ Рот, Эндрю (2014). «PyClone: статистический вывод о структуре клональной популяции при раке» . Природные методы . 11 (4): 396–398. дои : 10.1038/nmeth.2883 . ПМК 4864026 . ПМИД 24633410 .
- ^ Марас, Франческо (2015). «Филогенетическая модель скрытых признаков клональной деконволюции». Анналы прикладной статистики . 10 (4): 2377–2404. arXiv : 1604.01715 . дои : 10.1214/16-AOAS986 . S2CID 14986879 .
- ^ Мацуи, Юсуке (2016). «phyC: Кластеризация эволюционных деревьев рака» . PLOS Вычислительная биология . 13 (5): e1005509. Бибкод : 2017PLSCB..13E5509M . bioRxiv 10.1101/069302 . дои : 10.1371/journal.pcbi.1005509 . ПМЦ 5432190 . ПМИД 28459850 .
- ^ Цзян, Ючао; Цю, Ю; Минн, Энди Дж.; Чжан, Нэнси Р. (29 августа 2016 г.). «Оценка внутриопухолевой гетерогенности и отслеживание продольной и пространственной истории клональной эволюции с помощью секвенирования следующего поколения» . Труды Национальной академии наук . 113 (37): E5528–37. Бибкод : 2016PNAS..113E5528J . дои : 10.1073/pnas.1522203113 . ПМК 5027458 . ПМИД 27573852 .
- ^ Салехи, Сохраб (2017). «ddClone: совместный статистический вывод о клональных популяциях на основе данных секвенирования отдельных клеток и объемных опухолей» . Геномная биология . 18 (1): 44. дои : 10.1186/s13059-017-1169-3 . ПМЦ 5333399 . ПМИД 28249593 .
- ^ Сатас, Грите (2017). «Выводы о филогении опухолей с использованием выборки по важности с ограничением по дереву» . Биоинформатика . 33 (14): i152–i160. doi : 10.1093/биоинформатика/btx270 . ПМК 5870673 . ПМИД 28882002 .
- ^ Гэн, Ю (2017). «Идентификация закономерностей гетерогенности аллельного дисбаланса в вариантах зародышевой линии для определения клональной архитектуры». Теории и приложения интеллектуальных вычислений . Конспекты лекций по информатике. Том. 10362. стр. 286–297. дои : 10.1007/978-3-319-63312-1_26 . ISBN 978-3-319-63311-4 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Рамазотти, Даниэле; Грауденци, Алекс; Сано, Лука Де; Антониотти, Марко; Караванья, Джулио (4 сентября 2017 г.). «Изучение мутационных графиков эволюции отдельных опухолей на основе данных секвенирования нескольких образцов». bioRxiv 10.1101/132183 .
- ^ Роман, Теодор; Се, Лу; Шварц, Рассел; Рафаэль, Бенджамин Дж. (23 октября 2017 г.). «Автоматическая деконволюция структурированных смесей из гетерогенных геномных данных опухолей» . PLOS Вычислительная биология . 13 (10): e1005815. arXiv : 1604.02487 . Бибкод : 2017PLSCB..13E5815R . дои : 10.1371/journal.pcbi.1005815 . ПМЦ 5695636 . ПМИД 29059177 .
- ^ Маликич, Салем (2017). «Интегративный вывод об эволюции субклональных опухолей на основе данных одноклеточного и массового секвенирования». bioRxiv 10.1101/234914 .
- ^ Эспер, Лейла; Махмуди, Ахмад; Рафаэль, Бенджамин Дж. (29 июля 2013 г.). «THetA: вывод о внутриопухолевой гетерогенности на основе данных высокопроизводительного секвенирования ДНК» . Геномная биология . 14 (7): 80 рандов. дои : 10.1186/gb-2013-14-7-r80 . ISSN 1474-760X . ПМК 4054893 . ПМИД 23895164 .
- ^ Цзэн, Бай (2018). «Идентификация субклонов опухолей на основе филогении с использованием байесовской модели распределения признаков». arXiv : 1803.06393 [ стат.AP ].
- ^ Цун, Юпэн; Ян, Цун-По; Ахтер, Виктор; Ланг, Ульрих; Пайфер, Мартин (24 мая 2018 г.). «Анализ числа копий и вывод субклональных популяций в геномах рака с использованием Sclust». Протоколы природы . 13 (6): 1488–1501. дои : 10.1038/nprot.2018.033 . ISSN 1754-2189 . ПМИД 29844525 . S2CID 44070107 .
- ^ Ван, Сяодун; Огундиджо, Оетунджи Э. (01 декабря 2019 г.). «SeqClone: последовательный вывод субклонов опухолей на основе Монте-Карло» . БМК Биоинформатика . 20 (1): 6. дои : 10.1186/s12859-018-2562-y . ISSN 1471-2105 . ПМК 6320595 . ПМИД 30611189 .
- ^ Рафаэль, Бенджамин Дж.; Сатас, Грите; Майерс, Мэтью А. (22 января 2019 г.). «Выводы об эволюции опухоли на основе продольных образцов» . bioRxiv : 526814. doi : 10.1101/526814 .
- ^ Туси, Хосейн; Мойни, Али; Хаджирасулиха, Иман (6 июня 2019 г.). «BAMSE: выбор байесовской модели для вывода о филогении опухолей среди нескольких образцов» . БМК Биоинформатика . 20 (11): 282. дои : 10.1186/s12859-019-2824-3 . ISSN 1471-2105 . ПМК 6551234 . ПМИД 31167637 .
- ^ Рикеттс, Камир; Зейдман, Дэниел; Попич, Виктория; Хормоздиари, Ферейдун; Бацоглу, Серафим; Хаджирасулиха, Иман (4 октября 2019 г.). «Мелтос: реконструкция филогении опухолей из нескольких образцов для структурных вариантов» . Биоинформатика . 36 (4): 1082–1090. doi : 10.1093/биоинформатика/btz737 . ПМЦ 8215921 . ПМИД 31584621 .
- ^ Сундерманн, Линда (2021). «Реконструкция истории эволюции опухолей и деревьев клонов за полиномиальное время с помощью SubMARine» (PDF) . PLOS Вычислительная биология . 17 (1): e1008400. Бибкод : 2021PLSCB..17E8400S . дои : 10.1371/journal.pcbi.1008400 . ПМЦ 7845980 . ПМИД 33465079 . Проверено 22 июня 2020 г.
- ^ Чжоу, Тяньцзянь (2020). «RNDClone: реконструкция субклона опухоли на основе интеграции данных последовательностей ДНК и РНК» . Анналы прикладной статистики . 14 (4). дои : 10.1214/20-aoas1368 . S2CID 220632005 .
- ^ Багхаарабани, Лейла; Голиаи, Сама; Форугманд-Арааби, Мохаммад-Хади; Шариатпанахи, Сейед Пейман; Голиаи, Бахрам (1 марта 2021 г.). «Хвойное дерево: определение клонального дерева для определения гетерогенности опухоли на основе данных одноклеточного и массового секвенирования» . БМК Биоинформатика . 22 (1): 416. doi : 10.1186/s12859-021-04338-7 . ПМЦ 8404257 . ПМИД 34461827 .
- ^ Андерссон, Натали; Чаттопадхьяй, Субхаян; Валинд, Андерс; Карлссон, Дженни; Гиссельссон, Дэвид (20 сентября 2021 г.). «ДЕВОЛЮЦИЯ — метод филогенетической реконструкции анеуплоидного рака на основе данных мультирегионального генотипирования» . Коммуникационная биология . 4 (1): 1103. doi : 10.1038/s42003-021-02637-6 . ISSN 2399-3642 . ПМЦ 8452746 . ПМИД 34545199 .
- ^ Ся, Цзе; Ван, Лецюнь; Чжан, Гуйцзюнь; Цзо, Чуньман; Чен, Луонань (декабрь 2021 г.). «RDAClone: расшифровка гетерозиготности опухоли посредством анализа данных одноклеточной геномики с помощью надежного глубокого автоэнкодера» . Гены . 12 (12): 1847. doi : 10.3390/genes12121847 . ПМК 8701080 . ПМИД 34946794 .