Мышиные модели метастазов рака молочной железы
Модели метастатического рака молочной железы на мышах представляют собой экспериментальные подходы, в которых мышами генетически манипулируют для развития опухоли молочной железы , приводящей к отдаленным очаговым поражениям эпителия молочной железы, создаваемым метастазами . Рак молочной железы у мышей может быть вызван генетическими мутациями , обнаруженными при раке человека. Это означает, что модели могут быть созданы на основе молекулярных повреждений, соответствующих заболеванию человека.
Метастазирование рака молочной железы
[ редактировать ]Метастазирование — это процесс миграции опухолевых клеток из первичного очага рака в отдаленное место, где раковые клетки образуют вторичные опухоли. Метастатический рак молочной железы представляет собой наиболее разрушительный признак рака и считается заболеванием на поздней стадии. [1] Рак молочной железы человека метастазирует во многие отдаленные органы, такие как мозг , легкие , кости и печень .
Генетическое разнообразие между первичной и метастатической опухолью
[ редактировать ]Классическая теория, разработанная в начале 70-х годов, предполагала, что метастазы возникают из-за генетически детерминированных субпопуляций первичных опухолей. [2] Генетическая изменчивость между метастатическими очагами значима только для определенного локуса и внутри определенных клеточных популяций или только в одной клеточной популяции наблюдаются различия, а некоторые локусы расходятся только в одной клеточной субпопуляции. Это объясняет концепцию гетерогенности опухоли и порядок генетических событий во время эволюции опухоли . Многие гены, управляющие ростом первичного участка, могут определять распространение и колонизацию эктопического участка . [3] [4] [5] Рак молочной железы по общему мнению генетически и клинически рассматривается как гетерогенное заболевание, поскольку он отражает гетерогенность нормальной ткани молочной железы в его источнике17873350. [6] Чтобы отдельные опухолевые клетки могли расти на эктопическом участке, должен произойти ряд дискретных генетических событий. Метастатическое прогрессирование зависит от регуляции программ развития и событий окружающей среды. [7] Метастатический потенциал субпопуляций в клетках молочной железы мышей в настоящее время считается относительно ранним событием, и распространение происходит одновременно с преинвазивными или микроинвазивными поражениями. [8] [9] Генетические профили первичных и метастатических поражений молочной железы карциномы демонстрируют значительную степень клонального соответствия между поражениями. [10] [11] Существуют различные закономерности распространенности генетических мутаций в геномах первичной опухоли молочной железы и ее метастазов. [12] [13] [14] Это также подтверждает генетическую гетерогенность между первичным новообразованием у больных раком молочной железы и соответствующими метастазами. [15] [16]
Гены, участвующие в органоспецифическом метастазировании
[ редактировать ]рака молочной железы Фенотипы периодически экспрессируют в метастазах гены , необходимые для метастатического процесса. Метастатическое разнообразие опосредовано активацией генов, которые действуют как связь с органоспецифичным ростом. [17] Рост поражений на эктопическом участке зависит от множества сложных взаимодействий между метастатическими клетками и гомеостатическими механизмами хозяина. Летальные белок-белковые взаимодействия в месте метастазирования способствуют выживанию адаптированных клеток. [18]
Создание мышиных моделей рака молочной железы
[ редактировать ]Направленная экспрессия онкогенов в эпителиальных клетках молочной железы мышей является способом моделирования рака молочной железы человека. Мутацию или чрезмерную экспрессию онкогенов можно держать под контролем в очень специфическом клеточном контексте, а не во всем организме. Другой способ моделирования рака молочной железы человека заключается в целенаправленном ингибировании гена-супрессора опухоли. [19]
Мыши в генетических исследованиях
[ редактировать ]- В 1909 году Кларенс К. Литтл разработал первую инбредную линию - мышь DBA (разбавленная, коричневая, не агути).
- В 1915 году Н. М. Холдейн выявил первую связь у мышей между мышами -альбиносами и разбавлением розового глаза на хромосоме . седьмой
- В 1921 году C57BL стала одной из наиболее широко используемых в генетике мышей и первой линией, геном которой был секвенирован .
- В 1982 году Пальмитер и Бринстер имплантировали чужеродный ген в оплодотворенную яйцеклетку , в результате чего были созданы первые трансгенные мыши, генетически модифицированные для экспрессии доминантных онкогенов. [20]
- В 1982 году стимуляция экспрессии MMTV -LTR (длинный терминальный повтор вируса опухоли молочной железы мыши) была проведена в ходе нескольких циклов беременности и лактации чтобы оценить значимость клеточного протоонкогена , c-myc . [21]
Человек и мышь: геномное сравнение
[ редактировать ]Генетические исследования распространенных заболеваний у людей имеют значительные ограничения по практическим и этическим причинам. [22] человека Линии клеток можно использовать для моделирования заболеваний, но трудно изучать процессы на уровне тканей , внутри органа или во всем организме. Мыши могут быть хорошим представителем заболеваний у людей, потому что: [23]
- Между мышами и людьми существует большое сходство в физиологии , развитии и клеточной биологии.
- И у людей, и у мышей имеется около 30 000 генов, кодирующих белок. Количество мышиных генов без соответствующего человеческого гомолога составляет менее 1%.
- 90% геномов человека и мыши являются синтенными .
- 40% геномов человека и мыши могут быть выровнены на уровне нуклеотидов .
- У мышей относительно короткий период беременности .
- Мышам требуется некоторое время, чтобы достичь половой зрелости.
- Мыши имеют большие размеры помета.
- Наличие сотен мутаций, затрагивающих практически каждую ткань и аспект развития.
Мыши, возможно, не являются идеальной моделью рака молочной железы. В основном это связано с недостаточной точностью многих моделей. При взгляде на метастазы трудно определить точное местоположение, а также их частоту. Другая проблема связана с подтипами эпителия и невозможностью целенаправленно воздействовать на них при воздействии на мутацию. Примером этого может быть определение развития опухолей у мышей K14-Cre BRCA2. В стандартном случае удаление BRCA2 не приводило к опухолеобразованию, но если р53 был мутирован и инактивирован, опухолеобразование могло произойти. Таким образом, однозначного ответа на вопрос о происхождении опухоли нет из-за дополнительной мутации р53. [24]
Метастатические клеточные линии карциномы молочной железы мышей
[ редактировать ]Различные клеточные линии карциномы молочной железы мышей, такие как 4T1. [25] и TS/A метастазируют у сингенных иммунокомпетентных мышей и могут использоваться для идентификации генов и путей, участвующих в метастатическом процессе. [26]
Простые модели трансплантации опухоли
[ редактировать ]Трансплантация опухолевых клеток мышам с иммунодефицитом — инструмент для изучения рака молочной железы и его метастатических эффектов. Трансплантация происходит либо в виде аллотрансплантатов , либо в виде ксенографических трансплантатов. [27] Обычно человеческие клетки инокулируют -реципиентам с ослабленным иммунитетом мышам . Инокуляция клеток посредством внутрипротоковой трансплантации, [28] путем инъекций очищенной жировой ткани молочной железы [29] [30] или путем трансплантации в хвостовую вену. [31] [32] [33] Различные органы могут быть засеяны клетками рака молочной железы в зависимости от способа инъекции. [34]
- Сердечная инъекция: Кость
- Инъекция в хвостовую вену: легкие
- Селезеночная инъекция: Печень
- Сонная артерия Инъекция: мозг
Модели трансплантации опухолевой ткани
[ редактировать ]В качестве мышей со специфическим иммунодефицитом использовали мыши NOD/SCID (диабет без ожирения/тяжелый условный иммунодефицит). Эти мутации позволяют интегрировать новую ткань ксенотрансплантата. Сначала мышам необходимо гуманизировать жировые подушечки молочной железы путем инъекции иммортализованных человеческой телеморазой стромальных фибробластов молочной железы человека (фибробластов RMF/EG) в жировые подушечки молочной железы. Без этой инъекции эпителиальные клетки молочной железы человека, привитые на подушечку, не могут колонизироваться и расти. Затем фибробласт RMF/EG необходимо облучить, чтобы обеспечить экспрессию ключевых белков и факторов роста. Через 4 недели развития вновь привитые эпителиальные клетки молочной железы человека разрослись в жировой подушечке. [35]
Генно-инженерные мыши будут изучать метастазы
[ редактировать ]Генно-инженерные мыши созданы для моделирования человеческих фенотипов и патологий . Мутантные мыши могут включать трансгены, используя разные способы доставки:
- Использование бактериальной индуцируемой тетрациклином системы, позволяющей включать и выключать (система Tet-On/Tet-Off) [36]
- Направленные мутации путем нокаута гена и нокаутной последовательности с использованием рекомбинации Cre-Lox. системы [37]
- Введение ретровирусных мутаций [38]
- Введение химически индуцированных мутаций
Трансгенные мышиные модели рака молочной железы
[ редактировать ]Мыши, подвергающиеся процессу трансгенеза, известны как трансгенные мыши. Базовый трансген имеет промоторную область, кодирующую белок последовательность, интрон и стоп-кодон . Вирус опухоли молочной железы мыши (MMTV) представляет собой ретро-вирус, который, как известно, является промотором, вызывающим опухоли молочной железы после активации. [39] MMTV — наследственный соматический мутаген, радиус действия которого ограничен. Он содержит регуляторную последовательность ДНК, называемую длинным терминальным повтором (LTR), которая способствует транскрипции, индуцируемой стероидными гормонами. [40] [41] Онкогенез, индуцированный вирусом опухоли молочной железы мышей, также может быть осуществлен путем интеграции вирусного генома. Известно, что сайты интеграции являются критически важными генами для клеточной регуляции. [42] Сывороточный кислый белок (WAP), [43] является еще одним распространенным промотором, используемым для создания моделей рака молочной железы у мышей. Список других промоутеров, специфичных для молочной железы, и моделей мышей см. [44]
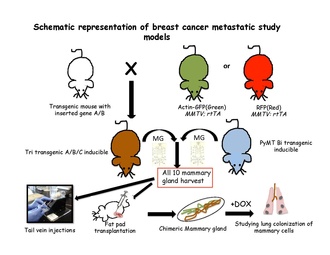
ММТВ-ПыМТ
[ редактировать ]MMTV-PyMT представляет собой модель метастазирования рака молочной железы, в которой MMTV-LTR используется для стимулирования экспрессии специфического полиомавируса среднего Т-антигена молочной железы , что приводит к быстрому развитию высокометастатических опухолей. [45] MMTV-PyMT является наиболее часто используемой моделью для изучения прогрессирования и метастазирования опухоли молочной железы. Затем мышей MMTV-PyMT скрещивают с другими генетически модифицированными мышами для создания различных типов моделей рака молочной железы, в том числе:
- Передача сигналов PI3K/Akt при метастазах может быть продемонстрирована в MMTV-PyMT; Akt1-/- мыши. [46]
- Хемоаттрактивная паракринная петля колониестимулирующего фактора-1 (CSF-1) и лигандов EGF между опухолеассоциированными макрофагами (ТАМ) и опухолевыми клетками, а также метастазы в легких могут быть изучены путем скрещивания мышей MMTV-PyMT с Csf-1-/- мыши. [47]
- Роль врожденного и адаптивного иммунного ответа в содействии метастазированию можно изучить с помощью MMTV-PyMT; Мыши Rag1-/-, у которых CD4+ Т-клетки избирательно утрачиваются . Интерлейкин-4 (IL4) без модели MMTV-PyMT; IL4-/- мыши. [48]
- Роль молекулы адгезии CD44 в метастазах в легкие. [49]
- Условная абляция клеток рака молочной железы MMTV-PyMT была проведена для выявления прометастатического действия ангиогенных факторов , фактора роста эндотелия сосудов А (VEGF-A). [50]
- Роль передачи сигналов аутокринного трансформирующего фактора роста бета 1 (TGF-β1) на подвижность и выживаемость в клетках PymT, полученных из рака молочной железы мышей MMTV-PymT. [51]
- Другие — MMTV-PyMT; уПА-/- [52] и ММТВ-ПыМТ; МЕКК1-/-. [53]
ММТВ- HER2/новый
[ редактировать ]MMTV-LTR также можно использовать для стимулирования рецепторной тирозин-протеинкиназы ErbB2 для трансформации эпителия молочной железы мышей. ErbB2 представляет собой онкоген, амплифицированный и сверхэкспрессируемый примерно в 20% случаев рака молочной железы человека. У мышей, несущих этот онкоген, примерно через 15 недель после беременности развиваются мультифокальные аденокарциномы с метастазами в легких. [54] [55] Чтобы создать более точное представление о мутациях гена HER2, исследователи объединили ген мыши, содержащий neu, и ген крысы, содержащий neu. Это решает проблему с точки зрения моделирования амплификации HER2 в развитии мышей. У несросшихся мышей молочная железа становилась почти девственной, но при этом добавлении молочная железа сохраняла развитую функцию. [56]
Битрансгенные модели
[ редактировать ]Мышиные модели, имеющие два трансгена, называются битрансгенными. Чтобы проверить взаимодействие двух онкогенов, Тим Стюерт и его группа в 1987 году создали первые модели битрансгенных мышей: мышей MMTV- Myc и MMTV- Ras скрестили, что привело к ускорению онкогенеза. [57] Экспрессия TGFβ в клетках рака молочной железы MMTV-ErbB2; Двойные трансгенные мыши MMTV-TGFβ могут индуцировать более высокие уровни циркулирующих опухолевых клеток и метастазов в легкие. [58] Ген Ras можно комбинировать с rtTA (обратным трансактиватором тетрациклина) для создания битрансгенной индуцируемой мышиной модели посредством контролируемой тетрациклином активации транскрипции, например, мыши, несущие TetO-KrasG12D (TOR) и MMTV-rtTA (MTB), имеют трансген, экспрессирующий обратный тетрациклиновый трансактиватор (rtTA) в эпителиальных клетках молочной железы. [59]
Тритрансгенные модели
[ редактировать ]Модели тритрансгенных мышей состоят из более чем двух генов. Множественные комбинации и генетические модификации производятся таким образом, что либо один, либо все гены переводятся в постоянно экспрессируемый статус или контролируемым образом для их активации в разные моменты времени. Например, ТОМ(TetO-myc); ТЗ; Мыши MTB, у которых гены myc (M) и ras (R) находятся под контролем операторов тетрациклина. Их также можно активировать или деактивировать добавлением доксициклина. Другие комбинации в этом отношении: ТОМ; Крас; MTB, где myc может индуцироваться и неиндуцироваться в различные моменты времени, пока Kras находится в непрерывном экспрессированном состоянии, и myc; ТЗ; Модель MTB наоборот. [60]
Применение генетически модифицированных мышей для изучения метастазов
[ редактировать ]Метастатический каскад можно изучить, контролируя активацию гена или добавляя репортерный ген, например, бета-актин GFP (зеленый флуоресцентный белок) или RFP (красный флуоресцентный белок).
Идентификация генов, регулирующих метастазирование
[ редактировать ]Путем выключения/выключения определенных генов путем гомологичной рекомбинации можно измерить степень метастазирования и достичь идентификации новых генов-мишеней, например, гена, который последовательно регулирует метастатическое поведение раковых клеток, представляет собой TGF-β1. Острое устранение передачи сигналов TGF-β в опухолевых клетках молочной железы MMTV-PyMT приводит к пятикратному увеличению количества метастазов в легких. [61] Некоторые области энхансера также могут быть проанализированы и могут быть определены как важнейшая часть пролиферации клеток, например, область усиления, которая связана с критическим для рака геном p53, который был определен с помощью CRISPR-Cas9. [62]
Отслеживание происхождения в моделях метастазов
[ редактировать ]Стратегии количественного отслеживания клонов оказались успешными в определении судеб клеток в нормальных эпителиальных тканях с использованием тканеспецифичных или специфичных для стволовых клеток трансгенов. Для проведения эксперимента по индуцируемому отслеживанию происхождения в геном мыши необходимо внедрить два компонента: переключатель и репортер. Переключатель обычно представляет собой регулируемую лекарственными средствами форму бактериального фермента Cre-рекомбиназы. Этот фермент распознает определенные последовательности, называемые сайтами LoxP. [63] Белки, которые способны улучшить идентификацию меченых клеток или определенной популяции в немеченых клетках, кодируются репортерными трансгенами. После сбора всех десяти мышиных молочных желез у трансгенных мышей обычно готовят суспензию отдельных клеток и трансплантируют либо в хвостовую вену нетрансгенных мышей-реципиентов. [31] или в очищенном жировом слое нетрансгенных мышей, повторно заселяющем жировой слой молочной железы. [64] Затем эти клетки исследуют в кровотоке, легких, костном мозге и печени в поисках благоприятного места для метастазирования. Эти трансгенные клетки можно отследить по их особым характеристикам либо флуоресценции, либо по индуцируемым путем помещения реципиентов на пищу с доксициклином. [ нужна ссылка ]
Циркулирующие опухолевые клетки
[ редактировать ]Еще одним инструментом изучения метастазов рака молочной железы является поиск циркулирующих опухолевых клеток у трансгенных мышей, например, мыши MMTV-PyMT могут реагировать на различные методы лечения, выделяя опухолевые клетки в кровь, что приводит к метастазам в легкие. [65] Не только в крови, но и клетки могут быть обнаружены в костном мозге, например, цитокератин -положительные клетки в костном мозге трансгенных мышей MMTV-pyMT и MMTV-Neu были идентифицированы, но не в контрольной группе дикого типа. [66]
Ограничения
[ редактировать ]В отсутствие специфических маркеров для клеток молочной железы модели с генетической маркировкой опухолевых клеток дают лучшее экспериментальное преимущество, однако низкий объем периферической крови, который можно получить от живых животных, ограничивает применение этого метода.
Визуализация in vivo моделей метастатических мышей
[ редактировать ]Модели трансгенных мышей можно визуализировать с помощью различных неинвазивных методов.
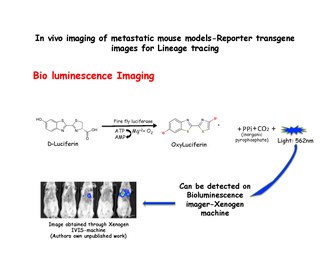
Биолюминесцентная визуализация
[ редактировать ]Биолюминесцентная визуализация основана на обнаружении света, образующегося в результате ферментативного окисления экзогенного субстрата. Субстрат люциферин окисляется до оксилюциферина в присутствии люциферазы и излучает свет, который можно обнаружить с помощью системы IVIS, такой как ксеногенный аппарат. Диссоциированные клетки молочной железы из MMTV-PyMT: IRES: Luc; Животным MTB ( внутреннее место входа рибосомы : люциферин ) (которые не подвергались воздействию доксициклина) можно вводить инъекции в боковые хвостовые вены мышам с иммунодефицитом, находящимся на диете без доксициклина. Никакого сигнала биолюминесценции не будет наблюдаться в легких мышей-реципиентов до тех пор, пока им не дадут пищу с доксициклином. Биолюминесценция может быть обнаружена в грудной клетке в течение 2 недель после начала воздействия доксициклина. [31] Люцифераза вводится непосредственно перед съемкой изображений.
Флуоресцентная визуализация
[ редактировать ]Прижизненная микроскопия с многофотонным возбуждением — это метод визуализации генно-инженерных клеток непосредственно in vivo. Многоступенчатые метастатические каскады можно визуализировать путем мечения уникальным флуоресцентным цветом под флуоресцентным микроскопом . [67] [68]
Радиоизотопная визуализация
[ редактировать ]Позитронно-эмиссионная томография (ПЭТ), однофотонная эмиссионная компьютерная томография (ОФЭКТ) и компьютерная томография (КТ) использовались для сравнения эффективности этих методов визуализации in vivo для выявления поражений на ранней стадии и для оценки ответа на химиотерапию. [69]
МРТ-изображение
[ редактировать ]Магнитно-резонансная томография требует использования наночастиц (липосом) и контрастного вещества для МРТ, называемого гадолинием. Затем частицы помещали в везикулы через поликарбонатный мембранный фильтр. Наночастицы вводят в метастазы мышей и оставляют там на двадцать четыре часа. Затем этих мышей сканируют, и в программном обеспечении для визуализации обнаруживаются скопления этих частиц в определенных областях, где клетки метастазировали. [22]
См. также
[ редактировать ]- База данных геномов Ensembl модельных организмов
- Картирование судьбы
- Люциферин светлячка
- Нацеливание на гены
- Генная ловушка
- Генетическая рекомбинация
- История модельных организмов
- Гомологичная рекомбинация
- Обмен кассет, опосредованный рекомбиназой
- Технология сайт-специфической рекомбиназы
Ссылки
[ редактировать ]- ^ Ханахан, Д.; Вайнберг, Р. (2000). «Признаки рака» . Клетка . 100 (1): 57–70. дои : 10.1016/S0092-8674(00)81683-9 . ПМИД 10647931 .
- ^ Фидлер, Эй-Джей (1973). «Отбор последовательных линий опухолей для метастазирования». Новая биология природы . 242 (118): 148–9. дои : 10.1038/newbio242148a0 . ПМИД 4512654 .
- ^ Мартинс, ФК; Де, С; Альмендро, В; Генен, М; Парк, Ю.Ю.; Блюм, Дж.Л.; Херлихи, В; Этингтон, Дж; Шнитт, С.Дж.; Тунг, Н; Гарбер, Дж. Э.; Феттен, К; Михор, Ф; Поляк, К (2012). «Эволюционные пути BRCA1-ассоциированных опухолей молочной железы» . Открытие рака . 2 (6): 503–11. дои : 10.1158/2159-8290.CD-11-0325 . ПМЦ 3738298 . ПМИД 22628410 .
- ^ Шах, СП; Морин, РД; Хаттра, Дж; Прентис, Л; Пью, Т; Берли, А; Делани, А; Гельмон, К; Гуляны, Р; Сенц, Дж; Стейдл, К; Холт, РА; Джонс, С; Солнце, М; Люнг, Дж; Мур, Р; Северсон, Т; Тейлор, Джорджия; Тешендорф, А.Э.; Це, К; Турашвили, Г; Вархол, Р; Уоррен, РЛ; Уотсон, П; Чжао, Ю; Кальдас, К; Хантсман, Д; Херст, М; Марра, Массачусетс; Апарисио, С (2009). «Мутационная эволюция дольковой опухоли молочной железы, профилированная с разрешением в один нуклеотид» . Природа . 461 (7265): 809–13. Бибкод : 2009Natur.461..809S . дои : 10.1038/nature08489 . ПМИД 19812674 .
- ^ Гейер, ФК; Вайгельт, Б; Натраян, Р; Ламброс, МБ; Де Биасе, Д; Ватчева Р; Сэвидж, К; Маккей, А; Эшворт, А; Рейс-Фильо, Дж.С. (2010). «Молекулярный анализ раскрывает генетическую основу фенотипического разнообразия метапластических карцином молочной железы» . Журнал патологии . 220 (5): 562–73. дои : 10.1002/путь.2675 . ПМИД 20099298 .
- ^ Ашкенази, Р; Джексон, ТЛ; Донту, Г; Вича, М.С. (2007). «Возможности исследования стволовых клеток рака молочной железы с использованием математического моделирования». Обзоры стволовых клеток . 3 (2): 176–82. дои : 10.1007/s12015-007-0026-2 . ПМИД 17873350 . S2CID 22296676 .
- ^ Мюллер, А; Домашний, Б; Сото, Х; Ге, Н; Катрон, Д; Бьюкенен, Мэн; МакКланахан, Т; Мерфи, Э; Юань, Вт; Вагнер, С.Н.; Баррера, Дж.Л.; Мохар, А; Верастеги, Э; Злотник, А (2001). «Вовлечение хемокиновых рецепторов в метастазирование рака молочной железы». Природа . 410 (6824): 50–6. Бибкод : 2001Природа.410...50М . дои : 10.1038/35065016 . ПМИД 11242036 . S2CID 4321110 .
- ^ Кляйн, Калифорния (2009). «Параллельное прогрессирование первичных опухолей и метастазов». Обзоры природы Рак . 9 (4): 302–12. дои : 10.1038/nrc2627 . ПМИД 19308069 . S2CID 9161392 .
- ^ Венг, Д; Пенцнер, Дж. Х.; Песня, Б; Койдо, С; Колдервуд, СК; Гонг, Дж (2012). «Метастазы являются ранним явлением рака молочной железы у мышей и связаны с клетками, несущими маркеры стволовых клеток» . Исследование рака молочной железы . 14 (1): Р18. дои : 10.1186/bcr3102 . ПМК 3496135 . ПМИД 22277639 .
- ^ Лю, В; Лайтинен, С; Хан, С; Вихинен, М; Ковальски, Дж; Ю, Г; Чен, Л; Юинг, CM; Айзенбергер, Массачусетс; Кардуччи, Массачусетс; Нельсон, В.Г.; Егнасубраманян, С; Луо, Дж; Ван, Ю; Сюй, Дж; Айзекс, Всемирный банк; Вискорпи, Т; Бова, Г.С. (2009). «Анализ числа копий указывает на моноклональное происхождение летального метастатического рака простаты» . Природная медицина . 15 (5): 559–65. дои : 10.1038/нм.1944 . ПМК 2839160 . ПМИД 19363497 .
- ^ Торрес, Л; Рибейро, Франция; Пандис, Н.; Андерсен, Дж.А.; Хейм, С; Тейшейра, MR (2007). «Внутриопухолевая геномная гетерогенность при раке молочной железы с клональной дивергенцией между первичными карциномами и метастазами в лимфатических узлах». Исследование и лечение рака молочной железы . 102 (2): 143–55. дои : 10.1007/s10549-006-9317-6 . ПМИД 16906480 . S2CID 33824409 .
- ^ Пандис, Н.; Тейшейра, MR; Адейинка, А; Ризо, Х; Барди, Дж; Мертенс, Ф; Андерсен, Дж.А.; Бондесон, Л; Сфикас, К; Квист, Х; Апостоликас, Н; Мительман, Ф; Хайм, С. (1998). «Цитогенетическое сравнение первичных опухолей и метастазов в лимфатические узлы у больных раком молочной железы». Гены, хромосомы и рак . 22 (2): 122–9. doi : 10.1002/(SICI)1098-2264(199806)22:2<122::AID-GCC6>3.0.CO;2-Z . ПМИД 9598799 . S2CID 22599771 .
- ^ Куукасъярви, Т; Медведь, Р; Таннер, М; Кяхконен, М; Шеффер, А; Нуппонен, Н; Пеннанен, С; Каллиониеми, А; Каллиониеми, ОП; Изола, Дж (1997). «Генетическая гетерогенность и клональная эволюция, лежащие в основе развития асинхронного метастазирования при раке молочной железы человека». Исследования рака . 57 (8): 1597–604. ПМИД 9108466 .
- ^ Бонсинг, бакалавр; Корвер, МЫ; Флерен, Дж.Дж.; Клетон-Янсен, AM; Девили, П; Корнелис, CJ (2000). «Анализ аллелотипов проточно-сортированных клеток рака молочной железы демонстрирует генетически связанные диплоидные и анеуплоидные субпопуляции в первичных опухолях и метастазах в лимфатических узлах». Гены, хромосомы и рак . 28 (2): 173–83. doi : 10.1002/(SICI)1098-2264(200006)28:2<173::AID-GCC6>3.0.CO;2-1 . ПМИД 10825002 . S2CID 36147250 .
- ^ Ву, Дж. М.; Факлер, MJ; Галушка, МК; Молави, Д.В.; Тейлор, Мэн; Тео, WW; Гриффин, К; Феттинг, Дж; Дэвидсон, штат Невада; Де Марзо, AM; Хикс, Дж.Л.; Читале, Д; Ладани, М; Сукумар, С; Аргани, П. (2008). «Гетерогенность метастазов рака молочной железы: сравнение терапевтической целевой экспрессии и метилирования промотора между первичными опухолями и их мультифокальными метастазами» . Клинические исследования рака . 14 (7): 1938–46. doi : 10.1158/1078-0432.CCR-07-4082 . ПМК 2965068 . ПМИД 18381931 .
- ^ Шмидт-Киттлер, О; Рэгг, Т; Даскалакис, А; Гранцов, М; Ар, А; Бланкенштейн, Ти Джей; Кауфманн, М; Диболд, Дж; Арнхольдт, Х; Мюллер, П; Бишофф, Дж; Харич, Д; Шлимок, Г; Ритмюллер, Г; Эйлс, Р; Кляйн, Калифорния (2003). «От латентных диссеминированных клеток к явным метастазам: генетический анализ прогрессирования системного рака молочной железы» . Труды Национальной академии наук . 100 (13): 7737–42. Бибкод : 2003PNAS..100.7737S . дои : 10.1073/pnas.1331931100 . ПМК 164657 . ПМИД 12808139 .
- ^ Мартин, Б; Санс, Р; Арагес, Р; Олива, Б; Сьерра, А. (2008). «Функциональная кластеризация белков метастазов описывает ресурсы пластической адаптации клеток рака молочной железы к новому микроокружению». Журнал исследований протеома . 7 (8): 3242–53. дои : 10.1021/pr800137w . ПМИД 18582095 .
- ^ Лэнгли, РР; Фидлер, Эй Джей (2007). «Взаимодействие микроокружения опухолевых клеток и органов в патогенезе метастазирования рака» . Эндокринные обзоры . 28 (3): 297–321. дои : 10.1210/er.2006-0027 . ПМИД 17409287 .
- ^ Гупта, ПБ; Купервассер, К. (2004). Модели заболевания раком молочной железы. Открытие лекарств сегодня: модели заболеваний 1 (1), 9–16. doi: 10.1016/j.ddmod.2004.05.001
- ^ Пальмитер, РД; Бринстер, РЛ; Хаммер, Р.Э.; Трумбауэр, Мэн; Розенфельд, МГ; Бирнберг, Северная Каролина; Эванс, Р.М. (1992). «Резкий рост мышей, которые развиваются из яиц, которым микроинъецировали слитые гены металлотионеина и гормона роста. 1982». Биотехнология (Ридинг, Массачусетс) . 24 : 429–33. ПМИД 1422050 .
- ^ Нусс, Р; Вармус, HE (1982). «Многие опухоли, индуцированные вирусом опухоли молочной железы мышей, содержат провирус, интегрированный в одну и ту же область генома хозяина». Клетка . 31 (1): 99–109. дои : 10.1016/0092-8674(82)90409-3 . ПМИД 6297757 . S2CID 46024617 .
- ^ Перейти обратно: а б Гольдман, Э; Зингер, А; Сильва, Д.Д.; Яари, З; Варди-Окнин, Д; Гольдфедер, М; Шредер, Дж. Э.; Шаинский-Ройтман, Дж; Гершковитц, Д; Шредер, А; (2017). Наночастицы воздействуют на метастазы рака молочной железы на ранних стадиях in vivo. Нанотехнологии 28(43), 1-13. дои: 10.1086/13616528/aa8a3d
- ^ Чинвалла, Арканзас; Уотерстон, LL; Линдблад-То, К.Д.; Бирни, Джорджия; Роджерс, Луизиана; Абриль, РС; Агарвал, штат Техас; Агарвала, LW; Эйнскоу, скорая помощь; Александерссон, доктор юридических наук; Ан, ТЛ; Антонаракис, МЫ; Эттвуд, Джо; Берч, Миннесота; Бейли, К.Х.; Барлоу, CS; Бек, TC; Берри, Б.; Биррен, Дж.; Блум, Э.; Борк, Р.Х.; Ботчерби, MC; Брей, РК; Брент, СП; Браун, П.; Браун, Э.; Булт, Б.; Бертон, Т.; Батлер, генеральный директор; и др. (2002). «Первичное секвенирование и сравнительный анализ генома мыши» . Природа . 420 (6915): 520–562. Бибкод : 2002Natur.420..520W . дои : 10.1038/nature01262 . ПМИД 12466850 .
- ^ Вагнер, К.В. (2003). Модели рака молочной железы: quo vadis, моделирование на животных? Исследования рака молочной железы 6(31), 31-38.doi: 10.1186/bcr723
- ^ Пуласки Б.А., С. Остранд-Розенберг. 2001. «Модель опухоли молочной железы 4T1 у мыши».Карр Проток Иммунол. Глава 20: Раздел 20.2. дои: 10.1002/0471142735.im2002s39
- ^ Нотт СРВ, Э. Вагенбласт, С. Хан, С. Ю. Ким, М. Сото, М. Вагнер, М. О. Терджен, Л. Фиш, Н. Эрард, А. Л. Гейбл, А. Р. Масели, С. Дикопф, Е. К. Папахристу, К. С. Д'Сантос, Л. А. Кэри, Дж. Э. Уилкинсон , Дж. К. Харрелл, К. М. Перу, Х. Гударзи, Г. Пулогианнис и Г. Дж. Хэннон. 2018. «Биодоступность аспарагина регулирует метастазирование на модели рака молочной железы». Природа. дои: 10.1038/nature25465
- ^ Ханна, К; Хантер, К. (2005). «Моделирование метастазов in vivo» . Канцерогенез . 26 (3): 513–23. дои : 10.1093/carcin/bgh261 . ПМИД 15358632 .
- ^ Бехбод, Ф; Киттрелл, Ф.С.; Ламарка, Х; Эдвардс, Д; Кербави, С; Хистанд, JC; Янг, Э; Мухопадхьяй, П; Да, ХВ; Оллред, округ Колумбия; Ху, М; Поляк, К; Розен, Дж. М.; Медина, Д. (2009). «Модель внутрипротоковой трансплантации человека-мыши имитирует подтипы протоковой карциномы in situ» . Исследование рака молочной железы . 11 (5): С66. дои : 10.1186/bcr2358 . ПМЦ 2790841 . ПМИД 19735549 .
- ^ Аслаксон, CJ; Миллер, Франция (1992). «Выборочные события в метастатическом процессе, определенные путем анализа последовательного распространения субпопуляций опухоли молочной железы мышей». Исследования рака . 52 (6): 1399–405. ПМИД 1540948 .
- ^ Ян, Цзин; Мани, Сендурай А; Донахер, Джоана Лю; Рамасвами, Шридхар; Ицыксон, Рафаэль А; Пойдем, Кристоф; Саваньер, Пьер; Гительман, Инна; Ричардсон, Андреа; Вайнберг, Роберт А. (2004). «Твист, главный регулятор морфогенеза, играет важную роль в метастазировании опухоли» . Клетка . 117 (7): 927–39. дои : 10.1016/j.cell.2004.06.006 . ПМИД 15210113 .
- ^ Перейти обратно: а б с Подсыпанина, К; Ду, ЮК; Йехлингер, М; Беверли, Эл Джей; Амбарцумян, Д; Вармус, Х (2008). «Посев и размножение нетрансформированных клеток молочной железы мыши в легких» . Наука . 321 (5897): 1841–4. Бибкод : 2008Sci...321.1841P . дои : 10.1126/science.1161621 . ПМК 2694414 . ПМИД 18755941 .
- ^ Талмадж, Дж. Э.; Сингх, РК; Фидлер, Эй-Джей; Раз, А (2007). «Мышиные модели для оценки новых и традиционных стратегий лечения рака» . Американский журнал патологии . 170 (3): 793–804. дои : 10.2353/ajpath.2007.060929 . ПМК 1864878 . ПМИД 17322365 .
- ^ Ким, МОЙ; Оскарссон, Т; Ачарья, С; Нгуен, DX; Чжан, XH; Нортон, Л; Массаге, Дж (2009). «Самосеяние опухоли за счет циркулирующих раковых клеток» . Клетка . 139 (7): 1315–26. дои : 10.1016/j.cell.2009.11.025 . ПМЦ 2810531 . ПМИД 20064377 .
- ^ Варго-Гогола, Т; Розен, Дж. М. (2007). «Моделирование рака молочной железы: один размер не подходит всем». Обзоры природы Рак . 7 (9): 659–72. дои : 10.1038/nrc2193 . ПМИД 17721431 . S2CID 44649920 .
- ^ Купервассер, К; Чаваррия, Т; Ву, М; Магран, Г; Грей, Дж.В.; Кэри, Л; Ричардсон, А; Вайнберг, РА. (2004). Реконструкция функционально нормальной и злокачественной ткани молочной железы человека на мышах. Пнас 101(14), 4966-4971. дои: 10.1073/pnas.0401064101
- ^ Госсен, М; Бужар, Х. (1992). «Жесткий контроль экспрессии генов в клетках млекопитающих с помощью тетрациклин-чувствительных промоторов» . Труды Национальной академии наук Соединенных Штатов Америки . 89 (12): 5547–51. Бибкод : 1992PNAS...89.5547G . дои : 10.1073/pnas.89.12.5547 . ПМК 49329 . ПМИД 1319065 .
- ^ Зауэр, Б; Хендерсон, Н. (1989). «Cre-стимулированная рекомбинация loxP-содержащих последовательностей ДНК, помещенных в геном млекопитающих» . Исследования нуклеиновых кислот . 17 (1): 147–61. дои : 10.1093/нар/17.1.147 . ПМК 331541 . ПМИД 2783482 .
- ^ Ду, З; Подсыпанина, К; Хуанг, С; МакГрат, А; Тонефф, MJ; Богословская Е; Чжан, X; Мораес, RC; Флюк, М; Оллред, округ Колумбия; Льюис, Монтана; Вармус, HE; Ли, Ю (2006). «Введение онкогенов в молочные железы in vivo с помощью птичьего ретровирусного вектора инициирует и способствует канцерогенезу на мышиных моделях» . Труды Национальной академии наук . 103 (46): 17396–401. Бибкод : 2006PNAS..10317396D . дои : 10.1073/pnas.0608607103 . ПМК 1635021 . ПМИД 17090666 .
- ^ Каллахан, Р; Смит, GH (2000). «Онкогенез молочной железы, индуцированный MMTV: открытие генов, прогрессирование к злокачественным новообразованиям и клеточным путям» . Онкоген . 19 (8): 992–1001. дои : 10.1038/sj.onc.1203276 . ПМИД 10713682 .
- ^ Ринголд, генеральный менеджер; Ямамото, КР; Томкинс, генеральный директор; Бишоп, М; Вармус, HE (1975). «Дексаметазон-опосредованная индукция РНК вируса опухоли молочной железы мышей: система для изучения действия глюкокортикоидов». Клетка . 6 (3): 299–305. дои : 10.1016/0092-8674(75)90181-6 . ПМИД 212202 . S2CID 20773799 .
- ^ Ямамото, КР; Пайвар, Ф; Файерстоун, GL; Малер, бакалавр; Вранге, О; Карлстедт-Дюк, Дж; Густафссон, Дж. А.; Чендлер, В.Л. (1983). «Биологическая активность клонированных фрагментов ДНК вируса опухоли молочной железы, которые связывают очищенный белок рецептора глюкокортикоида in vitro». Симпозиумы Колд-Спринг-Харбор по количественной биологии . 47 (2): 977–84. дои : 10.1101/sqb.1983.047.01.111 . ПМИД 6305596 .
- ^ Росс, РС. (2010). Молекулярная биология и онкогенез вируса опухоли молочной железы мышей. Вирусы 2(9), 2000–2012 гг. дои: 10.3390/v2092000
- ^ Кэмпбелл, С.М.; Розен, Дж. М.; Хеннигаузен, LG; Стрех-Юрк, У; Сиппель, А.Е. (1984). «Сравнение генов сывороточного кислого белка крысы и мыши» . Исследования нуклеиновых кислот . 12 (22): 8685–97. дои : 10.1093/нар/12.22.8685 . ПМК 320407 . ПМИД 6095207 .
- ^ Фантоцци, А; Христофори, Дж. (2006). «Мышиные модели метастазов рака молочной железы» . Исследование рака молочной железы . 8 (4): 212. дои : 10.1186/bcr1530 . ПМК 1779475 . ПМИД 16887003 .
- ^ Гай, Коннектикут; Кардифф, Род-Айленд; Мюллер, WJ (1992). «Индукция опухолей молочной железы экспрессией онкогена среднего Т полиомавируса: трансгенная мышиная модель метастатического заболевания» . Молекулярная и клеточная биология . 12 (3): 954–61. дои : 10.1128/mcb.12.3.954 . ПМК 369527 . ПМИД 1312220 .
- ^ Кларенбек, С; Ван Мильтенбург, Миннесота; Джонкерс, Дж (2013). «Генетически-инженерные мышиные модели передачи сигналов PI3K при раке молочной железы» . Молекулярная онкология . 7 (2): 146–64. дои : 10.1016/j.molonc.2013.02.003 . ПМК 5528412 . ПМИД 23478237 .
- ^ Лин, Э.Ю.; Нгуен, А.В.; Рассел, Р.Г.; Поллард, JW (2001). «Колониестимулирующий фактор 1 способствует прогрессированию опухолей молочной железы в злокачественные» . Журнал экспериментальной медицины . 193 (6): 727–40. дои : 10.1084/jem.193.6.727 . ПМК 2193412 . ПМИД 11257139 .
- ^ Денардо, генеральный директор; Баррето, Дж.Б.; Андреу, П; Васкес, Л; Тауфик, Д; Колхаткар, Н; Куссенс, LM (2009). «CD4(+) Т-клетки регулируют метастазирование рака молочной железы в легкие путем усиления проопухолевых свойств макрофагов» . Раковая клетка . 16 (2): 91–102. дои : 10.1016/j.ccr.2009.06.018 . ПМЦ 2778576 . ПМИД 19647220 .
- ^ Лопес, Дж.И.; Камениш, Т.Д.; Стивенс, М.В.; Сэндс, Би Джей; Макдональд, Дж; Шредер, Дж. А. (2005). «CD44 ослабляет метастатическую инвазию во время прогрессирования рака молочной железы» . Исследования рака . 65 (15): 6755–63. дои : 10.1158/0008-5472.CAN-05-0863 . ПМИД 16061657 .
- ^ Шеффнер, диджей; Матени, СЛ; Акахане, Т; Фактор, В; Берри, А; Мерлино, Дж; Торгейрссон, UP (2005). «VEGF способствует росту опухоли молочной железы у трансгенных мышей посредством паракринных и аутокринных механизмов» . Лабораторное исследование . 85 (5): 608–23. дои : 10.1038/labinvest.3700258 . ПМИД 15765121 .
- ^ Мураока-Кук, RS; Курокава, Х; Кох, Ю; Форбс, Джей Ти; Робак, ЛР; Барселлос-Хофф, Миннесота; Муди, SE; Ходош, Луизиана; Артеага, CL (2004). «Условная сверхэкспрессия активного трансформирующего фактора роста бета1 in vivo ускоряет метастазы трансгенных опухолей молочной железы» . Исследования рака . 64 (24): 9002–11. дои : 10.1158/0008-5472.CAN-04-2111 . ПМИД 15604265 .
- ^ Альмхольт, К; Лунд, LR; Райгаард, Дж; Нильсен, бакалавр наук; Дано, К; Рёмер, Дж; Джонсен, М. (2005). «Уменьшение метастазирования трансгенного рака молочной железы у мышей с дефицитом урокиназы» . Международный журнал рака . 113 (4): 525–32. дои : 10.1002/ijc.20631 . ПМИД 15472905 .
- ^ Куэвас, Б.Д.; Винтер-Ванн, AM; Джонсон, Нидерланды; Джонсон, Г.Л. (2006). «MEKK1 контролирует деградацию матрикса и распространение опухолевых клеток во время метастазирования рака молочной железы, вызванного полиомой среднего Т-типа» . Онкоген . 25 (36): 4998–5010. дои : 10.1038/sj.onc.1209507 . ПМИД 16568086 .
- ^ Сламон, диджей; Кларк, генеральный директор; Вонг, С.Г.; Левин, WJ; Ульрих, А; Макгуайр, WL (1987). «Рак молочной железы человека: корреляция рецидива и выживаемости с амплификацией онкогена HER-2/neu». Наука . 235 (4785): 177–82. Бибкод : 1987Sci...235..177S . дои : 10.1126/science.3798106 . ПМИД 3798106 .
- ^ Мюллер, В.Дж.; Синн, Э; Паттенгейл, ПК; Уоллес, Р.; Ледер, П. (1988). «Одноэтапная индукция аденокарциномы молочной железы у трансгенных мышей, несущих активированный онкоген c-neu». Клетка . 54 (1): 105–15. дои : 10.1016/0092-8674(88)90184-5 . ПМИД 2898299 . S2CID 33754359 .
- ^ Фрай, Э.А.; Танека, П; Иноуэ, К. (2016). Онкогенные и опухолесупрессирующие мышиные модели рака молочной железы с участием HER2/neu. Международный журнал рака 140(3), 495-503. doi:10.1002/ijc.30399
- ^ Синн, Э; Мюллер, В; Паттенгейл, П; Теплер, Я; Уоллес, Р.; Ледер, П. (1987). «Коэкспрессия генов MMTV/v-Ha-ras и MMTV/c-myc у трансгенных мышей: синергическое действие онкогенов in vivo». Клетка . 49 (4): 465–75. дои : 10.1016/0092-8674(87)90449-1 . ПМИД 3032456 . S2CID 43820016 .
- ^ Сигел, премьер-министр; Шу, В; Кардифф, Род-Айленд; Мюллер, В.Дж.; Массаге, Дж (2003). «Трансформация передачи сигналов бета-фактора роста ухудшает Neu-индуцированный онкогенез молочной железы, одновременно способствуя метастазированию в легкие» . Труды Национальной академии наук . 100 (14): 8430–5. Бибкод : 2003PNAS..100.8430S . дои : 10.1073/pnas.0932636100 . ПМК 166246 . ПМИД 12808151 .
- ^ Гюнтер, Э.Дж.; Белка, ГК; Вертхайм, Великобритания; Ван, Дж; Хартман, Дж.Л.; Боксер, РБ; Чодош, Луизиана (2002). «Новая индуцируемая доксициклином система для трансгенного анализа биологии молочной железы» . Журнал ФАСЭБ . 16 (3): 283–92. дои : 10.1096/fj.01-0551com . ПМИД 11874978 . S2CID 34303003 .
- ^ Подсыпанина, К; Полити, К; Беверли, Эл Джей; Вармус, HE (2008). «Сотрудничество онкогенов в поддержании опухоли и рецидиве опухоли молочной железы у мышей, индуцированной Myc и мутантным Kras» . Труды Национальной академии наук . 105 (13): 5242–7. Бибкод : 2008PNAS..105.5242P . дои : 10.1073/pnas.0801197105 . ПМК 2278195 . ПМИД 18356293 .
- ^ Бири, Б; Стовер, Д.Г.; Абель, ТВ; Хитил, А; Горская, А.Е.; Аакре, М; Форрестер, Э; Ян, Л; Вагнер, КУ; Моисей, HL (2008). «Трансформирующий фактор роста-бета регулирует выживаемость клеток карциномы молочной железы и взаимодействие с прилегающим микроокружением» . Исследования рака . 68 (6): 1809–19. дои : 10.1158/0008-5472.CAN-07-5597 . ПМИД 18339861 .
- ^ Коркмаз, Г; Лопес, Р; Угальде, AP; Неведомская, Е; Хан, Р; Мячева, К; Цварт, В; Элкон, Р; Агами, Р. (2016). Функциональная генетика проверяет элементы-энхансеры в геноме человека с помощью CRISPR-Cas9. Природная биотехнология 34, 192–198. дои: 10.1038/nbt.3450
- ^ Шринивас, С; Ватанабэ, Т; Лин, CS; Уильям, CM; Танабэ, Ю; Джесселл, ТМ; Константини, Ф (2001). «Репортерные штаммы Cre, полученные путем целенаправленной вставки EYFP и ECFP в локус ROSA26» . Биология развития BMC . 1 : 4. дои : 10.1186/1471-213X-1-4 . ПМК 31338 . ПМИД 11299042 .
- ^ Ляо, MJ; Чжан, CC; Чжоу, Б; Зимонич, Д.Б.; Мани, ЮАР; Каба, М; Гиффорд, А; Рейнхардт, Ф; Попеску, Северная Каролина; Го, В; Итон, EN; Лодиш, ХФ; Вайнберг, РА (2007). «Обогащение популяции клеток молочной железы, образующих маммосферы и обладающих репопуляционной активностью in vivo» . Исследования рака . 67 (17): 8131–8. дои : 10.1158/0008-5472.CAN-06-4493 . ПМИД 17804725 .
- ^ Бисвас, С; Гикс, М; Райнхарт, К; Даггер, TC; Хитил, А; Моисей, Х.Л.; Фриман, ML; Артеага, CL (2007). «Ингибирование TGF-бета нейтрализующими антителами предотвращает радиационно-индуцированное ускорение метастатического прогрессирования рака» . Журнал клинических исследований . 117 (5): 1305–13. дои : 10.1172/JCI30740 . ПМЦ 1838926 . ПМИД 17415413 .
- ^ Хюземан, Ю; Гейгл, Дж.Б.; Шуберт, Ф; Мусиани, П; Мейер, М; Бургхарт, Э; Форни, Дж; Эйлс, Р; Фем, Т; Ритмюллер, Г; Кляйн, Калифорния (2008). «Системное распространение — это ранняя стадия рака молочной железы» . Раковая клетка . 13 (1): 58–68. дои : 10.1016/j.ccr.2007.12.003 . ПМИД 18167340 .
- ^ Эгеблад, М; Накасоне, ES; Верб, З (2010). «Опухоли как органы: сложные ткани, взаимодействующие со всем организмом» . Развивающая клетка . 18 (6): 884–901. дои : 10.1016/j.devcel.2010.05.012 . ПМЦ 2905377 . ПМИД 20627072 .
- ^ Энтенберг, Д; Вайкофф, Дж; Глигориевич, Б; Руссос, ET; Верхуша, В.В.; Поллард, Дж.В.; Конделис, Дж (2011). «Настройка и использование двухлазерного многофотонного микроскопа для многоканальной прижизненной флуоресцентной визуализации» . Протоколы природы . 6 (10): 1500–20. дои : 10.1038/nprot.2011.376 . ПМК 4028841 . ПМИД 21959234 .
- ^ Альберини, Жан-Луи; Буасгар, Рафаэль; Гильерме, Стефани; Сикье, Карин; Жего, Бенуа; Тезе, Бенуа; Уриен, Сайк; Резай, Кейван; Мене, Эммануэль (01 августа 2016 г.). «Мультимодальная визуализация опухолевого процесса и реакции на химиотерапию in vivo в модели рака молочной железы на трансгенных мышах» . Молекулярная визуализация и биология . 18 (4): 617–626. дои : 10.1007/s11307-015-0916-7 . ISSN 1860-2002 . ПМЦ 4927598 . ПМИД 26630973 .
Внешние ссылки
[ редактировать ]- http://www.la-press.com/tetracycline-regulated-systems-in-functional-oncogenomics-article-a200 Подробный обзор Tet-систем в функциональной онкогеномике.