Путь PI3K/AKT/mTOR
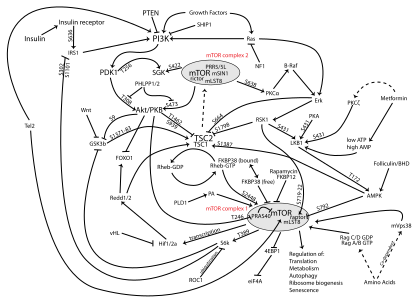
Путь PI3K/AKT/mTOR представляет собой внутриклеточный сигнальный путь, важный в регуляции клеточного цикла . Следовательно, это напрямую связано с клеточным спокойствием , пролиферацией , раком и долголетием. PI3K Активация фосфорилирует и активирует АКТ , локализуя ее в плазматической мембране . [1] AKT может иметь ряд последующих эффектов, таких как активация CREB , [2] ингибирование р27 , [3] локализация FOXO в цитоплазме, [3] активация PtdIns -3ps, [4] и активация mTOR [3] который может влиять на транскрипцию p70 или 4EBP1. [3] Существует много известных факторов, которые усиливают путь PI3K/AKT, включая EGF , [5] тсс , [2] ИФР-1 , [2] инсулин , [3] и КаМ. [4] И лептин , и инсулин задействуют передачу сигналов PI3K для метаболической регуляции. [6] Этому пути противодействуют различные факторы, включая PTEN , [7] ГСК3Б , [2] и НВ9. [5]
Во многих случаях рака этот путь сверхактивен, что снижает апоптоз и способствует пролиферации. Однако этот путь необходим для стимулирования роста и пролиферации, а не дифференцировки взрослых стволовых клеток , нервных стволовых клеток . особенно [2] Именно сложность поиска подходящего количества пролиферации и дифференцировки исследователи пытаются определить, чтобы использовать этот баланс при разработке различных методов лечения. [2] Кроме того, было обнаружено, что этот путь является необходимым компонентом долгосрочной потенциации нейронов . [4] [8]
Пролиферация нервных стволовых клеток
[ редактировать ]Реакция на глюкозу
[ редактировать ]Нейральные стволовые клетки (НСК) в головном мозге должны найти баланс между сохранением своей мультипотентности путем самообновления и пролиферации, а не дифференцировкой и состоянием покоя. Путь PI3K/AKT имеет решающее значение в этом процессе принятия решений. НСК способны ощущать и реагировать на изменения в мозге или во всем организме. Когда уровень глюкозы в крови резко повышается, инсулин высвобождается из поджелудочной железы. Активация рецепторов инсулина активирует путь PI3K/AKT, что способствует пролиферации. [3] Таким образом, когда в организме высокий уровень глюкозы и избыток энергии, активируется путь PI3K/AKT и НСК имеют тенденцию к пролиферации. Когда количество доступной энергии мало, путь PI3K/AKT менее активен, и клетки переходят в состояние покоя.Частично это происходит, когда AKT фосфорилирует FOXO, сохраняя FOXO в цитоплазме. [3] FOXO при дефосфорилировании может проникать в ядро и работать как фактор транскрипции, способствуя экспрессии различных опухолевых супрессоров, таких как p27 и p21 . [3] Эти супрессоры опухоли подталкивают НСК к состоянию покоя. Нокауты FOXO теряют способность клеток переходить в состояние покоя, а также клетки теряют способность нервных стволовых клеток, возможно, переходя в состояние, подобное раку. [3]
ПТЭН
[ редактировать ]Путь PI3K/AKT имеет природный ингибитор под названием фосфатаза и гомолог тензина ( PTEN ), функция которого заключается в ограничении пролиферации в клетках, помогая предотвратить рак. Было показано, что нокаут PTEN увеличивает массу мозга из-за происходящей нерегулируемой пролиферации. [3] PTEN работает путем дефосфорилирования PIP3 в PIP2, что ограничивает способность AKT связываться с мембраной, снижая ее активность. Дефицит PTEN можно компенсировать в дальнейшем, чтобы спасти дифференцировку или состояние покоя. По этой причине выбить PTEN не так серьезно, как выбить FOXO. [3]
КРЕБ
[ редактировать ]Элемент ответа цАМФ CREB тесно связан с решением клетки пролиферировать или нет. Клетки, которые вынуждены сверхэкспрессировать AKT, увеличивают количество CREB и пролиферацию по сравнению с клетками дикого типа. Эти клетки также экспрессируют меньше маркеров глиальных и нервных клеток, таких как GFAP или β-тубулин . [2] Это связано с тем, что CREB является фактором транскрипции, который влияет на транскрипцию циклина А , который способствует пролиферации. [2] Например, взрослым нейрональным клеткам-предшественникам гиппокампа необходимо приостановить работу в качестве стволовых клеток, чтобы позже дифференцироваться. Это регулируется Shh . Shh действует посредством зависимости от медленного синтеза белка, что стимулирует другие каскады, которые работают синергетически с путем PI3K/AKT, индуцируя пролиферацию. Затем другой путь может быть отключен, и эффекты пути PI3K/AKT станут недостаточными для остановки дифференцировки. [2] Особенности этого пути неизвестны.
Роль в раке
[ редактировать ]Рак яичников
[ редактировать ]Путь PI3K / AKT / mTOR является центральным регулятором рака яичников . PIM- киназы чрезмерно экспрессируются при многих типах рака, и они также способствуют регуляции рака яичников . Установлено, что PIM прямо или косвенно активирует mTOR и его вышестоящие эффекторы, такие как AKT. Кроме того, киназы PIM могут вызывать фосфорилирование IRS, что может изменить PI3K. Это указывает на тесное взаимодействие PIM с каскадом PI3K/AKT/mTOR и его компонентами. Аналогичным образом сообщалось, что АКТ осуществляет фосфорилирование BAD в клетках OC. PIM и сеть PI3K/AKT/mTOR могут ингибировать экспрессию P21 и P27 в клетках OC. Эти данные предполагают высокую вероятность взаимодействия и значимости киназ PIM и сети PI3K/AKT/mTOR в регуляции рака яичников. [9] Однако нацеливание на этот путь при раке яичников оказалось сложной задачей, поскольку в нескольких исследованиях не удалось достичь достаточной клинической пользы. [10] [11]
Рак молочной железы
[ редактировать ]При многих видах рака молочной железы аберрации пути PI3K/AKT/mTOR являются наиболее распространенными геномными аномалиями. Наиболее распространенные известные отклонения включают мутацию гена PIK3CA и мутации потери функции или эпигенетическое молчание PTEN. [12] Путь фосфоинозитид-3-киназа (PI3K)/протеинкиназа B (Akt)/мишень рапамицина (mTOR) у млекопитающих активируется примерно в 30–40% случаев РМЖ. При трижды негативном раке молочной железы (ТНРМЖ) онкогенная активация пути PI3K/AKT/mTOR может происходить в результате сверхэкспрессии вышестоящих регуляторов, таких как EGFR , активации мутаций PIK3CA , потери функции или экспрессии гомолога фосфатазы и тензина (PTEN). ) и богатая пролином инозитол-полифосфатаза, которые являются понижающими регуляторами PI3K. [13] Это согласуется с гипотезой о том, что ингибиторы PI3K могут преодолевать резистентность к эндокринной терапии при ее приобретении. [ нужна ссылка ]
Уротелиальный рак
[ редактировать ]PIK3CA часто имеет мутации усиления функции при уротелиальном раке. [14] Подобно PI3Ka, PI3Kb экспрессируется во многих различных клетках и в основном участвует в активации тромбоцитов и развитии тромботических заболеваний. Исследования показали, что PI3Kb также способствует пролиферации опухолей. В частности, он играет важную роль в онкогенезе при PTEN-негативном раке. [15] Сообщается, что вмешательство в ген PI3Kb может быть терапевтическим подходом при раке мочевого пузыря высокого риска с мутантным PTEN и потерей E-кадгерина . Специфические ингибиторы изоформ PI3Kb являются потенциальным средством лечения рака с дефицитом PTEN. [16]
Рак простаты
[ редактировать ]Путь PI3K является основным источником лекарственной устойчивости при раке простаты . Это особенно актуально для резистентного к кастрации рака простаты, когда опухоли становятся устойчивыми к андроген-депривационной терапии , которая блокирует способность опухоли использовать гормон андроген для роста. [17] Это связано со сложным механизмом обратной связи, который существует между рецептором андрогена и путем PI3K. [18] Как и в других типах опухолей, мутации в ключевых генах этого пути могут привести к гиперактивации этого пути, например, в PIK3CA. [19] [20] Увеличение количества копий PIK3CA и усиление экспрессии мРНК также увеличивает активацию пути, среди прочего, при раке простаты. [21] Было показано, что усиление соседней генетической области 3q26.31-32 происходит одновременно с рядом близлежащих членов семейства PI3K, включая PIK3CA , PIK3CB и PIK3R4 , что приводит к транскрипционным изменениям в PIK3C2G , PIK3CA, PIK3CB, PIK3R4 , а также связанных с ними путях. с пролиферацией клеток . [22] Такое значительное увеличение связано со степенью Глисона , стадией опухоли , метастазами в лимфатические узлы и другими агрессивными клиническими признаками. [22] У пациентов, получавших ингибиторы PI3K, у пациентов с увеличением числа копий PIK3CB наблюдается повышенная чувствительность к препарату. [23]
Терапия
[ редактировать ]Ингибитор PI3K
[ редактировать ]Ингибиторы PI3K могут преодолеть лекарственную устойчивость и улучшить исходы рака молочной железы на поздних стадиях (ABC). [12] Различные ингибиторы PI3K проявляют разное действие в отношении разных типов PI3K. Ингибиторы пан-PI3K класса IA изучены более тщательно, чем ингибиторы, специфичные для изоформы; Пиктилисиб является еще одним ингибитором пан-PI3K с большей активностью ингибитора субъединицы α, чем бупарлисиб. [13] Иделалисиб является первым ингибитором PI3K, одобренным Управлением по контролю за продуктами и лекарствами США и используется для лечения рецидивирующего/рефрактерного хронического лимфоцитарного лейкоза/мелколимфоцитарной лимфомы и фолликулярной лимфомы. Копанлисиб одобрен для лечения рецидива фолликулярной лимфомы у пациентов, которые ранее получали как минимум два системных лечения. [24] Дувелисиб одобрен для лечения рецидивирующего/рефрактерного хронического лимфоцитарного лейкоза /мелкой лимфоцитарной лимфомы (ХЛЛ/МЛЛ) и рецидивирующей/рефрактерной фолликулярной лимфомы (оба показания для пациентов, получивших как минимум два предшествующих курса лечения). [25]
Ингибитор Акт
[ редактировать ]АКТ находится ниже PI3K и ингибируется ипатасертибом. [13] Akt представляет собой киназу семейства AGC и центральный интегральный сигнальный узел пути PAM . Существует три изофермента Akt: Akt1, Akt2 и Akt3. Низкомолекулярные ингибиторы Akt1 могут быть особенно полезны для воздействия на опухоли с высокой распространенностью мутаций, активирующих Akt1 E17K, что наблюдается в 4–6% случаев рака молочной железы и 1–2% случаев колоректального рака. [26] Исследования ингибирования Akt были сосредоточены на ингибировании двух различных сайтов связывания:
- аллостерический карман неактивного фермента и
- сайт связывания АТФ.
Аллостерические ингибиторы Akt, выделенные MK-2206, широко оценивались в клинических условиях; Недавно были идентифицированы дополнительные аллостерические ингибиторы Akt. ARQ-092 является мощным ингибитором Pan-Akt, который может ингибировать рост опухоли на доклинических стадиях и в настоящее время находится на I фазе клинических исследований. [26]
ингибитор mTOR
[ редактировать ]Существует значительная корреляция фосфорилированного mTOR с выживаемостью пациентов с ТНРМЖ I и II стадий. На модели ксенотрансплантата TNBC, полученной от пациента, при тестировании ингибитора mTOR рапамицина было обнаружено торможение роста опухоли на 77–99%, что значительно больше, чем наблюдалось при использовании доксорубицина; исследования фосфорилирования белков показали, что конститутивная активация пути mTOR уменьшалась на фоне лечения. [13]
Двойные ингибиторы PI3K/AKT/mTOR
[ редактировать ]Было высказано предположение, что блокировка пути PI3K/AKT/mTOR может привести к повышению противоопухолевой активности при ТНРМЖ. Доклинические данные показали, что комбинация соединений, нацеленных на разные родственные молекулы в пути PI3K/AKT/mTOR, приводит к синергетическому действию. На основе этих результатов продолжают разрабатываться новые соединения, одновременно воздействующие на различные компоненты пути PI3K/AKT/mTOR. Например, гедатолисиб ингибирует мутантные формы PI3K-α с повышенной киназной активностью в концентрациях, эквивалентных IC50 для PI3K-α дикого типа. Изоформы PI3K-β, -δ и -γ ингибировались гедатолисибом в концентрациях, примерно в 10 раз превышающих те, которые наблюдались для PI3K-α. [13] Еще одним преимуществом одновременного воздействия на PI3K и mTOR является последующее более сильное ингибирование рецепторных тирозинкиназ-положительных петель обратной связи, наблюдаемое при изолированном ингибировании PI3K . [27] Гедатолисиб в настоящее время находится в стадии разработки для лечения ТНРМЖ в сочетании с конъюгатом антитело PTK7-лекарственное средство. Апитолисиб (GDC-0980) представляет собой ингибитор PI3K (субъединицы α, δ и γ), который также нацелен на mTORC. [28]
Совместная терапия пути PI3K
[ редактировать ]Существует множество клеточных сигнальных путей, которые взаимодействуют с путем PI3K, что потенциально позволяет раковым клеткам избежать ингибирования PI3K. [29] Таким образом, ингибирование пути PI3K наряду с другими мишенями может обеспечить синергический ответ, например, наблюдаемый при совместном ингибировании PI3K и MEK в клетках рака легких. [30] Совсем недавно было предложено совместное воздействие на путь PI3K с помощью киназ PIM, а многочисленные доклинические исследования показали потенциальную пользу этого подхода. [31] [32] Разработка панелей клеточных линий, устойчивых к ингибированию пути PI3K, может привести к идентификации будущих сопутствующих мишеней и лучшему пониманию того, какие пути могут компенсировать потерю передачи сигналов PI3K после лечения лекарственными препаратами. [33] Комбинированное ингибирование PI3K с более традиционными методами лечения, такими как химиотерапия, также может обеспечить лучший ответ по сравнению с ингибированием только PI3K. [34]
Нейральные стволовые клетки
[ редактировать ]Тип передачи сигналов фактора роста может влиять на то, дифференцируются ли НСК в мотонейроны или нет. Праймирование среды FGF2 снижает активность пути PI3K/AKT, который активирует GSK3β. Это увеличивает экспрессию HB9. [5] Непосредственное ингибирование PI3K в НСК приводит к образованию популяции клеток, которые являются чисто HB9+ и с повышенной эффективностью дифференцируются в мотонейроны. Прививка этих клеток в разные части крыс приводит к образованию мотонейронов независимо от микроокружения трансплантированных клеток. [5] После травмы нервные стволовые клетки вступают в фазу восстановления и экспрессируют высокие уровни PI3K для усиления пролиферации. Это лучше для выживания нейронов в целом, но происходит за счет генерации мотонейронов. Поэтому поврежденным мотонейронам может быть трудно восстановить свою способность. [5] Целью современных исследований является создание нервных стволовых клеток, которые могут пролиферировать, но при этом дифференцироваться в мотонейроны. Снижение эффекта пути PI3K и усиление эффекта GSK3β и HB9 в НСК является потенциальным способом создания этих клеток. [5]
Ингибиторы ПТЭН
[ редактировать ]PTEN представляет собой супрессор опухоли, ингибирующий путь PI3K/AKT. Ингибиторы PTEN, такие как биспероксованадий, [35] может улучшить путь PI3K/AKT, способствуя миграции клеток, [36] выживание [37] и распространение. [7] Хотя существуют некоторые опасения по поводу возможного нарушения регуляции клеточного цикла и возникновения опухолей, временное и умеренное ингибирование PTEN может обеспечить нейропротекцию против черепно-мозговой травмы. [38] и улучшить восстановление ЦНС путем восстановления утраченных связей путем аксоногенеза . [7] Лекарственное значение ингибиторов PTEN еще предстоит определить. [ нужна ссылка ]
Долгосрочное потенцирование
[ редактировать ]Для того чтобы долговременная потенциация произошла (LTP), должна произойти стимуляция рецепторов NMDA , которая вызывает рецепторов AMPA включение постсинаптическое . PI3K связывается с рецепторами AMPA в консервативной области, ориентируя рецепторы в мембране, особенно на субъединице GluR. [4] Активность PI3K увеличивается в ответ на ионы кальция и CaM . Кроме того, AKT локализует PtdIns-3P в постсинапсе, который рекрутирует стыковочные белки, такие как tSNARE и Vam7. Это напрямую приводит к стыковке АМРА в постсинапсе. [4] mTOR активировал p70S6K и инактивировал 4EBP1, который изменяет экспрессию генов, позволяя реализовать LTP. [8] У крыс было затронуто долгосрочное обучение выработке страха, но не было никакого эффекта при краткосрочном обучении. В частности, была потеряна обусловленность страхом миндалевидного тела. Это тип следового обусловливания, который представляет собой форму обучения, требующую ассоциации условного стимула с безусловным стимулом. Этот эффект терялся при нокдауне PI3K и усиливался при сверхэкспрессии PI3K. [8]
Роль в росте мозга
[ редактировать ]Помимо описанной выше роли в синаптической пластичности, сигнальный путь PI3K-AKT также играет важную роль в росте мозга, который изменяется, когда передача сигналов PI3K нарушается. Например, внутричерепной объем также связан с этим путем, в частности с интронными вариантами AKT3 . [39] Гормон щитовидной железы первоначально был идентифицирован как основной регулятор роста мозга и когнитивных функций, а недавние данные показали, что гормон щитовидной железы оказывает некоторое влияние на созревание и пластичность синапсов посредством PI3K. [40]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Кинг Д., Йомансон Д., Брайант Х.Э. (май 2015 г.). «PI3King lock: нацеливание на путь PI3K/Akt/mTOR как новая терапевтическая стратегия при нейробластоме». Журнал детской гематологии/онкологии . 37 (4): 245–51. дои : 10.1097/MPH.0000000000000329 . ПМИД 25811750 . S2CID 42323379 .
- ^ Jump up to: а б с д и ж г час я Пельтье Дж., О'Нил А., Шаффер Д.В. (сентябрь 2007 г.). «PI3K / Akt и CREB регулируют пролиферацию и дифференцировку предшественников нейронов гиппокампа взрослых». Развивающая нейробиология . 67 (10): 1348–61. дои : 10.1002/днеу.20506 . ПМИД 17638387 . S2CID 16337839 .
- ^ Jump up to: а б с д и ж г час я дж к Рафальский В.А., Брюне А (февраль 2011 г.). «Энергетический метаболизм в судьбе нервных стволовых клеток взрослых». Прогресс нейробиологии . 93 (2): 182–203. дои : 10.1016/j.pneurobio.2010.10.007 . ПМИД 21056618 . S2CID 16305263 .
- ^ Jump up to: а б с д и Ман Х.И., Ван Ц., Лу В.И., Джу В., Ахмадиан Г., Лю Л. и др. (май 2003 г.). «Активация PI3-киназы необходима для внедрения рецептора AMPA во время ДПМ мВПСК в культивируемых нейронах гиппокампа» . Нейрон . 38 (4): 611–24. дои : 10.1016/s0896-6273(03)00228-9 . ПМИД 12765612 . S2CID 17419450 .
- ^ Jump up to: а б с д и ж Охеда Л., Гао Дж., Хутен К.Г., Ван Э., Тонхофф Дж.Р., Данн Т.Дж. и др. (2011). «Критическая роль PI3K/Akt/GSK3β в спецификации мотонейронов нервных стволовых клеток человека в ответ на FGF2 и EGF» . ПЛОС ОДИН . 6 (8): e23414. Бибкод : 2011PLoSO...623414O . дои : 10.1371/journal.pone.0023414 . ПМК 3160859 . ПМИД 21887250 .
- ^ Гарсия-Галиано Д., Борхес БК, Аллен С.Дж., Элиас К.Ф. (2019). «Передача сигналов PI3K в клетках рецепторов лептина: роль в росте и размножении» . Журнал нейроэндокринологии . 31 (5): e12685. дои : 10.1111/jne.12685 . ПМК 6533139 . ПМИД 30618188 .
- ^ Jump up to: а б с Вятт Л.А., Филбин М.Т., Кейрстед Х.С. (август 2014 г.). «Ингибирование PTEN усиливает рост нейритов в нейрональных клетках-предшественниках эмбриональных стволовых клеток человека». Журнал сравнительной неврологии . 522 (12): 2741–55. дои : 10.1002/cne.23580 . ПМИД 24610700 . S2CID 205683500 .
- ^ Jump up to: а б с Суй Л., Ван Дж., Ли Б.М. (октябрь 2008 г.). «Роль фосфоинозитид-3-киназы-Akt-мишени млекопитающих сигнального пути рапамицина в долговременной потенциации и отслеживании памяти, обусловленной страхом, в медиальной префронтальной коре крыс» . Обучение и память . 15 (10): 762–76. дои : 10.1101/lm.1067808 . ПМИД 18832563 .
- ^ Азиз А.У., Фарид С., Цинь К., Ван Х., Лю Б. (февраль 2018 г.). «Киназы PIM и их значение для пути PI3K/AKT/mTOR в регуляции рака яичников» . Биомолекулы . 8 (1): 7. дои : 10.3390/biom8010007 . ПМК 5871976 . ПМИД 29401696 .
- ^ Чикконе, Марсия А.; Маоз, Асаф; Касабар, Дженнифер К.; Мачида, Хироко; Мабути, Сейджи; Мацуо, Кодзи (июль 2016 г.). «Клинический результат лечения ингибиторами серин-треониновой киназы при рецидивирующем эпителиальном раке яичников: систематический обзор литературы» . Экспертное заключение об исследуемых препаратах . 25 (7): 781–796. дои : 10.1080/13543784.2016.1181748 . ISSN 1744-7658 . ПМЦ 7534810 . ПМИД 27101098 . S2CID 28717797 .
- ^ Маоз, Асаф; Чикконе, Марсия А.; Мацузаки, Шинья; Коулман, Роберт Л.; Мацуо, Кодзи (22 ноября 2019 г.). «Новые ингибиторы серин-треониновой киназы для лечения рака яичников» . Мнение экспертов о новых лекарствах . 24 (4): 239–253. дои : 10.1080/14728214.2019.1696773 . ISSN 1744-7623 . ПМЦ 7526049 . PMID 31755325 . S2CID 208227849 .
- ^ Jump up to: а б Рафаэль Дж., Десотель Д., Причард К.И., Петкова Е., Шах П.С. (март 2018 г.). «Ингибиторы фосфоинозитид-3-киназы при распространенном раке молочной железы: систематический обзор и метаанализ». Европейский журнал рака . 91 : 38–46. дои : 10.1016/j.ejca.2017.12.010 . ПМИД 29331750 .
- ^ Jump up to: а б с д и Коста Р.Л., Хан Х.С., Градишар В.Дж. (июнь 2018 г.). «Нацеливание на путь PI3K/AKT/mTOR при тройном негативном раке молочной железы: обзор». Исследование и лечение рака молочной железы . 169 (3): 397–406. дои : 10.1007/s10549-018-4697-y . ПМИД 29417298 . S2CID 19888056 .
- ^ Серра В., Маркман Б., Скальтрити М., Эйххорн П.Дж., Валеро В., Гузман М. и др. (октябрь 2008 г.). «NVP-BEZ235, двойной ингибитор PI3K/mTOR, предотвращает передачу сигналов PI3K и подавляет рост раковых клеток за счет активации мутаций PI3K» . Исследования рака . 68 (19): 8022–30. дои : 10.1158/0008-5472.CAN-08-1385 . ПМИД 18829560 .
- ^ Лю С.Т., Хуэй Дж., Матис С., Чами К., Пантак А.Дж., Дракаки А. (апрель 2018 г.). «Текущий статус и будущая роль сигнального пути фосфоинозитид-3-киназы/АКТ при уротелиальном раке: старый путь в новую эпоху иммунотерапии». Клинический рак мочеполовой системы . 16 (2): e269–e276. дои : 10.1016/j.clgc.2017.10.011 . ПМИД 29199023 . S2CID 4533538 .
- ^ Винклер Д.Г., Файя К.Л., ДиНитто Дж.П., Али Дж.А., Уайт К.Ф., Брофи Э.Э. и др. (ноябрь 2013 г.). «Ингибирование PI3K-δ и PI3K-γ с помощью IPI-145 отменяет иммунные реакции и подавляет активность на моделях аутоиммунных и воспалительных заболеваний» . Химия и биология . 20 (11): 1364–74. doi : 10.1016/j.chembiol.2013.09.017 . ПМИД 24211136 .
- ^ Пак, Сунбум; Ким, Янг Сик; Ким, Дэвис Йен; Итак, Инсук; Чон, Джу-Хонг (декабрь 2018 г.). «Путь PI3K при раке простаты: все резистентные пути ведут к PI3K». Biochimica et Biophysical Acta (BBA) - Обзоры о раке . 1870 (2): 198–206. дои : 10.1016/j.bbcan.2018.09.001 . ISSN 1879-2561 . ПМИД 30300679 . S2CID 52947672 .
- ^ Карвер, Бретт С.; Чапински, Карен; Вонгвипат, Джон; Иероним, Хейли; Чен, Ю; Чандарлапати, Сарат; Арора, Вивек К.; Ле, Карл; Каутчер, Джейсон; Шер, Ховард; Скардино, Питер Т. (17 мая 2011 г.). «Взаимная обратная регуляция передачи сигналов PI3K и андрогенных рецепторов при PTEN-дефицитном раке простаты» . Раковая клетка . 19 (5): 575–586. дои : 10.1016/j.ccr.2011.04.008 . ISSN 1878-3686 . ПМК 3142785 . ПМИД 21575859 .
- ^ Захари, Мухаммад Саддик; У, Синьян; Блэр, Брайан Г.; Пинто, Снеха М.; Нируджоги, Раджа С.; Елинек, Кристина А.; Малхотра, Радхика; Ким, Мин-Сик; Пак, Бен Хо; Пандей, Ахилеш (4 сентября 2015 г.). «Активация мутаций в PIK3CA приводит к широко распространенной модуляции тирозинового фосфопротеома» . Журнал исследований протеома . 14 (9): 3882–3891. doi : 10.1021/acs.jproteome.5b00302 . ISSN 1535-3907 . ПМЦ 4641567 . ПМИД 26267517 .
- ^ Пирсон, Хелен Б.; Ли, Джейсон; Мениэль, Валери С.; Феннелл, Кристина М.; Уоринг, Пол; Монтгомери, Карен Г.; Ребелло, Ричард Дж.; Макферсон, Арти А.; Кушьяр, Сара; Фурик, Люк; Куллинан, Карлин (июнь 2018 г.). «Идентификация мутации Pik3ca как генетической движущей силы рака простаты, которая взаимодействует с потерей Pten, ускоряя прогрессирование и рост, устойчивый к кастрации» . Открытие рака . 8 (6): 764–779. дои : 10.1158/2159-8290.CD-17-0867 . ISSN 2159-8290 . ПМИД 29581176 .
- ^ Агелль, Лайя; Эрнандес, Сильвия; Салидо, Марта; де Муга, Сильвия; Хуанпере, Нурия; Аруми-Урия, Монтсеррат; Менендес, Сильвия; Лоренцо, Марта; Лоренте, Хосе А.; Серрано, Серджио; Льорета, Хосеп (март 2011 г.). «Сигнальный путь PI3K активируется сверхэкспрессией мРНК PIK3CA и увеличением копий в опухолях простаты, но мутации PIK3CA, BRAF, KRAS и AKT1 являются нечастыми событиями» . Современная патология . 24 (3): 443–452. дои : 10.1038/modpathol.2010.208 . ISSN 1530-0285 . ПМИД 21113138 . S2CID 27405431 .
- ^ Jump up to: а б Симпсон, Бенджамин С.; Камачо, Недзица; Лакстон, Хейли Дж.; Пай, Хейли; Финн, Рон; Хиви, Сьюзен; Питт, Джейсон; Мур, Кэролайн М.; Уитакер, Хейли К. (14 августа 2020 г.). «Генетические изменения в локусе 3q26.31-32 придают агрессивный фенотип рака простаты» . Коммуникационная биология . 3 (1): 440. doi : 10.1038/s42003-020-01175-x . ISSN 2399-3642 . ПМЦ 7429505 . ПМИД 32796921 . S2CID 221118233 .
- ^ Боно, Иоганн де; Аркенау, Хендрик-Тобиас; Матео, Хоакин; Инфанте, Джеффри Р.; Беррис, Ховард А.; Банг, Юнг-Джуэ; Эдер, Джозеф; Шарма, Сунил; Чунг, Хён С.; Декордова, Шон; Суэйлс, Карен Э. (01 августа 2015 г.). «Резюме CT328: Исследовательский генетический анализ опухолей в ходе исследования фазы I/II с увеличением дозы GSK2636771 у пациентов (больных) с распространенным опухолями с дефицитом PTEN» . Исследования рака . 75 (дополнение 15): CT328. дои : 10.1158/1538-7445.AM2015-CT328 . ISSN 0008-5472 .
- ^ Гринвелл И.Б., Ип.А., Коэн Дж.Б. (ноябрь 2017 г.). «Ингибиторы PI3K: понимание механизмов токсичности и управление ею». Онкология . 31 (11): 821–8. ПМИД 29179250 .
- ^ «дувелисиб (COPIKTRA, Verastem, Inc.) для взрослых пациентов с рецидивирующим или рефрактерным хроническим лимфоцитарным лейкозом (ХЛЛ) или малой лимфоцитарной лимфомой (МЛЛ)» . Управление по контролю за продуктами и лекарствами США . Проверено 23 октября 2018 г.
- ^ Jump up to: а б Гек Б.Р., Мочалкин I (июль 2017 г.). «Недавний прогресс в направлении клинически значимых АТФ-конкурентных ингибиторов Akt». Письма по биоорганической и медицинской химии . 27 (13): 2838–2848. дои : 10.1016/j.bmcl.2017.04.090 . ПМИД 28506751 .
- ^ Чакрабарти А., Санчес В., Куба М.Г., Райнхарт С., Артеага С.Л. (февраль 2012 г.). «Повышение экспрессии и активности HER3 (ErbB3) по обратной связи ослабляет противоопухолевый эффект ингибиторов PI3K» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (8): 2718–23. Бибкод : 2012PNAS..109.2718C . дои : 10.1073/pnas.1018001108 . ПМЦ 3286932 . ПМИД 21368164 .
- ^ Каппеллен Д., Хиль Диес де Медина С., Шопен Д., Тьери Дж.П., Радвани Ф. (июнь 1997 г.). «Частая потеря гетерозиготности по хромосоме 10q при мышечно-инвазивном переходноклеточном раке мочевого пузыря» . Онкоген . 14 (25): 3059–66. дои : 10.1038/sj.onc.1201154 . ПМИД 9223669 .
- ^ Хиви, Сьюзен; О'Бирн, Кеннет Дж.; Гейтли, Кэти (апрель 2014 г.). «Стратегии совместного воздействия на путь PI3K/AKT/mTOR при НМРЛ». Обзоры лечения рака . 40 (3): 445–456. дои : 10.1016/j.ctrv.2013.08.006 . ISSN 1532-1967 . ПМИД 24055012 .
- ^ Хиви, Сьюзен; Кафф, Шинейд; Финн, Стивен; Янг, Винсент; Райан, Ронан; Николсон, Шивон; Леонард, Ниам; Маквей, Найл; Барр, Мартин; О'Бирн, Кеннет; Гейтли, Кэти (29 ноября 2016 г.). «В поисках синергии: исследование стратегии совместного ингибирования PI3K/mTOR/MEK при НМРЛ» . Онкотаргет . 7 (48): 79526–79543. дои : 10.18632/oncotarget.12755 . ISSN 1949-2553 . ПМЦ 5346733 . ПМИД 27765909 .
- ^ Лущак, Сабина; Кумар, Кристофер; Сатьядеван, Винеш Кришна; Симпсон, Бенджамин С.; Гейтли, Кэти А.; Уитакер, Хейли С.; Хиви, Сьюзен (2020). «Ингибирование киназы PIM: совместные терапевтические подходы при раке простаты» . Сигнальная трансдукция и таргетная терапия . 5 :7. дои : 10.1038/s41392-020-0109-y . ISSN 2059-3635 . ПМК 6992635 . ПМИД 32025342 .
- ^ Мэлоун, Том; Шефер, Леа; Саймон, Натали; Хиви, Сьюзен; Кафф, Шинейд; Финн, Стивен; Мур, Джиллиан; Гейтли, Кэти (март 2020 г.). «Текущие перспективы использования киназ PIM для преодоления механизмов лекарственной устойчивости и уклонения от иммунитета при раке» (PDF) . Фармакология и терапия . 207 : 107454. doi : 10.1016/j.pharmthera.2019.107454 . ISSN 1879-016X . ПМИД 31836451 . S2CID 209357486 .
- ^ Хиви, Сьюзен; Даулинг, Пол; Мур, Джиллиан; Барр, Мартин П.; Келли, Ниам; Махер, Стивен Г.; Кафф, Шинейд; Финн, Стивен П.; О'Бирн, Кеннет Дж.; Гейтли, Кэти (26 января 2018 г.). «Разработка и характеристика панели фосфатидилинозитид-3-киназы - мишени млекопитающих для линий клеток рака легких, устойчивых к ингибитору рапамицина» . Научные отчеты . 8 (1): 1652. Бибкод : 2018NatSR...8.1652H . дои : 10.1038/s41598-018-19688-1 . ISSN 2045-2322 . ПМЦ 5786033 . ПМИД 29374181 .
- ^ Хиви, Сьюзен; Годвин, Питер; Бэрд, Энн-Мари; Барр, Мартин П.; Умедзава, Кадзуо; Кафф, Шинеад; Финн, Стивен П.; О'Бирн, Кеннет Дж.; Гейтли, Кэти (октябрь 2014 г.). «Стратегическое нацеливание оси PI3K-NFκB при цисплатин-резистентном НМРЛ» . Биология и терапия рака . 15 (10): 1367–1377. дои : 10.4161/cbt.29841 . ISSN 1555-8576 . ПМК 4130730 . ПМИД 25025901 .
- ^ Шмид А.С., Бирн Р.Д., Вилар Р., Вошольски Р. (май 2004 г.). «Соединения биспероксованадия являются мощными ингибиторами PTEN» . Письма ФЭБС . 566 (1–3): 35–8. дои : 10.1016/j.febslet.2004.03.102 . ПМИД 15147864 .
- ^ Михай С., Бао С., Лай Дж.П., Гадиали С.Н., Ноелл Д.Л. (февраль 2012 г.). «Ингибирование PTEN улучшает заживление ран в эпителии легких за счет изменений в клеточной механике, которые усиливают миграцию» . Американский журнал физиологии. Клеточная и молекулярная физиология легких . 302 (3): Л287-99. дои : 10.1152/ajplung.00037.2011 . ПМК 3289272 . ПМИД 22037358 .
- ^ Лай Дж.П., Далтон Дж.Т., Ноэлл Д.Л. (декабрь 2007 г.). «Гомолог фосфатазы и тензина удален на десятой хромосоме (PTEN) в качестве молекулярной мишени при заживлении эпителиальных ран легких» . Британский журнал фармакологии . 152 (8): 1172–84. дои : 10.1038/sj.bjp.0707501 . ПМК 2189995 . ПМИД 17922022 .
- ^ Уокер К.Л., Уокер М.Дж., Лю Н.К., Рисберг ЕС, Гао X, Чен Дж, Сюй XM (2012). «Системный биспероксованадий активирует Akt/mTOR, уменьшает аутофагию и ускоряет восстановление после травмы шейного отдела спинного мозга» . ПЛОС ОДИН . 7 (1): e30012. Бибкод : 2012PLoSO...730012W . дои : 10.1371/journal.pone.0030012 . ПМЦ 3254642 . ПМИД 22253859 .
- ^ Адамс Х.Х., Хибар Д.П., Чураки В., Стейн Дж.Л., Найквист П.А., Рентерия М.Э. и др. (декабрь 2016 г.). «Новые генетические локусы, лежащие в основе внутричерепного объема человека, выявлены посредством общегеномной ассоциации» . Природная неврология . 19 (12): 1569–1582. дои : 10.1038/nn.4398 . ПМК 5227112 . ПМИД 27694991 .
- ^ Мартин Н.П., Маррон Фернандес де Веласко Э., Мизуно Ф., Скаппини Э.Л., Глосс Б., Эркслебен С. и др. (сентябрь 2014 г.). «Быстрый цитоплазматический механизм регуляции киназы PI3 с помощью ядерного рецептора гормона щитовидной железы, TRβ, и генетические доказательства его роли в созревании синапсов гиппокампа мыши in vivo» . Эндокринология . 155 (9): 3713–24. дои : 10.1210/en.2013-2058 . ПМК 4138568 . ПМИД 24932806 .