Сигнальный путь TGF бета
Сигнальный путь трансформирующего фактора роста бета (TGFB) участвует во многих клеточных процессах как во взрослом организме, так и в развивающемся эмбрионе, включая рост клеток , дифференцировку клеток , миграцию клеток, апоптоз , клеточный гомеостаз и другие клеточные функции. Сигнальные пути TGFB консервативны. [1] Несмотря на широкий спектр клеточных процессов, которые регулирует сигнальный путь TGFβ, этот процесс относительно прост. Лиганды суперсемейства TGFβ связываются с рецептором типа II, который рекрутирует и фосфорилирует рецептор типа I. Рецептор типа I затем фосфорилирует SMAD, регулируемые рецептором ( R-SMAD ), которые теперь могут связывать coSMAD SMAD4 . Комплексы R-SMAD/coSMAD накапливаются в ядре, где они действуют как факторы транскрипции и участвуют в регуляции экспрессии генов-мишеней. [2]
Механизм
[ редактировать ]Связывание лиганда
[ редактировать ]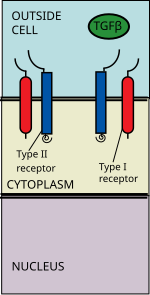
Суперсемейство лигандов TGF-бета включает: костные морфогенетические белки (BMP) , факторы роста и дифференцировки (GDF) , антимюллеров гормон (АМГ) , активин , Nodal и TGFβ . [3] Передача сигнала начинается со связывания лиганда суперсемейства TGF бета с рецептором TGF бета типа II. киназу серин/треонинового рецептора, которая катализирует фосфорилирование Рецептор типа II представляет собой рецептора типа I. Каждый класс лигандов связывается с определенным рецептором типа II. [4] У млекопитающих известно семь рецепторов типа I и пять рецепторов типа II. [5]
Существует три активина: активин А , активин В и активин AB . Активины участвуют в эмбриогенезе и остеогенезе. Они также регулируют многие гормоны, включая гормоны гипофиза , половых желез и гипоталамуса , а также инсулин . Они также являются нервных клеток факторами выживания .
BMP связываются с рецептором костного морфогенетического белка типа 2 (BMPR2). Они участвуют во множестве клеточных функций, включая остеогенез, дифференцировку клеток , спецификацию передней/задней оси, рост и гомеостаз.
Семейство TGFβ включает: TGFβ1 , TGFβ2 , TGFβ3 . Как и BMP, TGFβ участвуют не только в эмбриогенезе и дифференцировке клеток, но также в апоптозе и других функциях. Они связываются с рецептором TGF-бета типа 2 (TGFBR2).
Узловой связывается с рецептором активина А типа IIB ACVR2B . Затем он может образовывать рецепторный комплекс с рецептором активина A типа IB ( ACVR1B ) или с рецептором активина A типа IC ( ACVR1C ). [5]
Когда связывание рецептора с лигандом происходит посредством местного действия, это классифицируется как паракринная передача сигналов .
Рекрутирование рецепторов и фосфорилирование
[ редактировать ]
Бета-лиганд TGF связывается с димером рецептора типа II, который рекрутирует димер рецептора типа I, образуя гетеротетрамерный комплекс с лигандом. [6] Эти рецепторы представляют собой рецепторы серин/треонинкиназы . Они имеют цистеином богатый внеклеточный домен , трансмембранный домен и цитоплазматический домен, богатый серином/треонином. Домен GS рецептора I типа состоит из серии примерно из тридцати серин - глициновых повторов. [7] Связывание лиганда семейства TGFβ вызывает вращение рецепторов так, что их цитоплазматические киназные домены располагаются в каталитически выгодной ориентации. Рецептор типа II фосфорилирует остатки серина рецептора типа I, что активирует белок.
SMAD фосфорилирование
[ редактировать ]
Существует пять SMAD, регулируемых рецепторами: SMAD1 , SMAD2 , SMAD3 , SMAD5 и SMAD9 (иногда называемые SMAD8). По существу существует два внутриклеточных пути, в которых участвуют эти R-SMAD . TGFβ, активины, Nodals и некоторые GDF опосредуются SMAD2 и SMAD3, тогда как BMP, AMH и некоторые GDF опосредуются SMAD1 , SMAD5 и SMAD9 . Связывание R-SMAD с рецептором I типа опосредуется белком, содержащим домен FYVE с двойным цинковым пальцем . Два таких белка, которые опосредуют путь TGFβ, включают SARA ( якорь SMAD для активации рецептора ) и HGS (субстрат тирозинкиназы, регулируемый фактором роста гепатоцитов).
SARA присутствует в ранней эндосоме , которая посредством клатрин-опосредованного эндоцитоза интернализует рецепторный комплекс. [8] САРА нанимает R-SMAD . SARA позволяет связывать R-SMAD с областью L45 рецептора I типа. [9] SARA ориентирует R-SMAD так, что остаток серина на его С-конце обращен к каталитической области рецептора I типа. Рецептор типа I фосфорилирует остаток серина R-SMAD. Фосфорилирование вызывает конформационное изменение домена MH2 R-SMAD и его последующую диссоциацию от рецепторного комплекса и SARA. [10]
Привязка CoSMAD
[ редактировать ]
Теперь фосфорилированный RSMAD имеет высокое сродство к coSMAD (например, SMAD4 ) и образует с ним комплекс. Фосфатная группа не действует как место стыковки для coSMAD, а скорее фосфорилирование открывает участок аминокислоты, обеспечивающий взаимодействие.
Транскрипция
[ редактировать ]
Фосфорилированный комплекс RSMAD/coSMAD попадает в ядро, где связывается с промоторами/кофакторами транскрипции и вызывает транскрипцию ДНК.
Костные морфогенетические белки вызывают транскрипцию мРНК, участвующих в остеогенезе , нейрогенезе и вентральной мезодермы спецификации .
TGFβ вызывают транскрипцию мРНК, участвующих в апоптозе , неогенезе внеклеточного матрикса и иммуносупрессии . Они также участвуют в аресте G1 в клеточном цикле .
Активин вызывает транскрипцию мРНК, участвующих в росте гонад , дифференцировке эмбрионов и формировании плаценты.
Nodal вызывает транскрипцию мРНК, участвующих в спецификации левой и правой оси, мезодермы и энтодермы индукции .
Регулирование пути
[ редактировать ]Сигнальный путь TGF-бета участвует в широком спектре клеточных процессов и впоследствии очень жестко регулируется. Существует множество механизмов, в которых этот путь модулируется либо положительно, либо отрицательно, включая агонисты лигандов и R-SMAD, рецепторы-ловушки и убиквитинирование R -SMAD и рецепторов.
Агонисты/антагонисты лигандов
[ редактировать ]И чордин , и ноггин являются антагонистами BMP. Они связывают BMP, предотвращая связывание лиганда с рецептором. [11] Было продемонстрировано, что Chordin и Noggin дорсализуют мезодерму . Оба они обнаружены в дорсальной губе Xenopus и преобразуют ткань, специфичную для эпидермиса, в нервную ткань (см. нейруляцию ). Ноггин играет ключевую роль в формировании рисунка хрящей и костей. Мыши Noggin-/- имеют избыток хрящей и отсутствие формирования суставов. [11]
Члены семейства белков DAN также противодействуют членам семейства TGF-бета. В их число входят Цербер , ДАН и Гремлин . Эти белки содержат девять консервативных цистеинов , которые могут образовывать дисульфидные мостики. Считается, что ДАН противодействует GDF5 , GDF6 и GDF7 .
Фоллистатин ингибирует активин, который он связывает. Он напрямую влияет на секрецию фолликулостимулирующего гормона (ФСГ). Фоллистатин также участвует в развитии рака простаты, где мутации в его гене могут препятствовать его действию на активин, обладающий антипролиферативными свойствами. [11]
Lefty является регулятором TGFβ и участвует в формировании паттерна оси во время эмбриогенеза. Он также является членом суперсемейства белков TGF. Он асимметрично экспрессируется в левой части мышиных эмбрионов и впоследствии играет роль в спецификации лево-право. Левти действует, предотвращая фосфорилирование R-SMAD. Это происходит через конститутивно активный рецептор TGFβ типа I и через процесс, следующий за его активацией. [12]
Также были идентифицированы антагонисты на основе лекарств, такие как SB431542, [13] который избирательно ингибирует ALK4, ALK5 и ALK7.
Регуляция рецепторов
[ редактировать ]Рецептор трансформирующего фактора роста 3 (TGFBR3) на данный момент является наиболее распространенным из рецепторов TGF-β. [14] у него нет известного сигнального домена. [15] Однако он может способствовать усилению связывания лигандов TGFβ с рецепторами TGFβ типа II путем связывания TGFβ и представления его TGFBR2. Одна из нижестоящих мишеней передачи сигналов TGFβ, GIPC , связывается с его доменом PDZ, что предотвращает его протеосомную деградацию, что впоследствии увеличивает активность TGFβ. Он также может служить корецептором ингибина для ActivinRII . [11]
BMP и мембраносвязанный ингибитор активина (BAMBI) имеют внеклеточный домен, аналогичный рецепторам I типа. У него отсутствует внутриклеточный домен серин/треониновой протеинкиназы, и поэтому он является псевдорецептором. Он связывается с рецептором типа I, предотвращая его активацию. Он служит негативным регулятором передачи сигналов TGFβ и может ограничивать экспрессию TGFβ во время эмбриогенеза. Для его экспрессии требуется передача сигналов BMP.
FKBP12 связывается с областью GS рецептора I типа, предотвращая фосфорилирование рецептора рецепторами типа II. Считается, что FKBP12 и его гомологи помогают предотвратить активацию рецептора I типа в отсутствие лиганда, поскольку связывание лиганда вызывает его диссоциацию.
Регуляция R-SMAD
[ редактировать ]Роль ингибирующих SMAD
[ редактировать ]Есть еще два SMAD, которые дополняют семейство SMAD: ингибирующие SMAD (I-SMADS), SMAD6 и SMAD7 . Они играют ключевую роль в регуляции передачи сигналов TGF-бета и участвуют в отрицательной обратной связи. Как и другие SMAD, они имеют домены MH1 и MH2. SMAD7 конкурирует с другими R-SMAD за рецептор I типа и предотвращает их фосфорилирование. [11] [16] Он находится в ядре и при активации рецептора TGFβ транслоцируется в цитоплазму, где связывается с рецептором I типа. SMAD6 связывает SMAD4, предотвращая связывание других R-SMAD с coSMAD. Уровни I-SMAD увеличиваются при передаче сигналов TGFβ, что позволяет предположить, что они являются нижестоящими мишенями передачи сигналов TGFβ.
Убиквитинирование R-SMAD
[ редактировать ]Убиквитин-протеинлигазы E3 SMURF1 и SMURF2 регулируют уровни SMAD. Они принимают убиквитин от фермента, конъюгирующего E2, где переносят убиквитин на RSMAD, что вызывает их убиквитинирование и последующую протеосомную деградацию. SMURF1 связывается с SMAD1 и SMAD5, тогда как SMURF2 связывается с SMAD1 , SMAD2 , SMAD3 , SMAD6 и SMAD7 . Это [ нужны разъяснения ] усиливает ингибирующее действие SMAD7 при одновременном снижении транскрипционной активности SMAD2.
Сводная таблица
[ редактировать ]Лиганды TGF-β H.sapiens выделены серым цветом, лиганды D.melanogaster - розовым, C.elegans - желтым.
| Лиганд суперсемейства TGF-β | Ингибиторы лигандов | Рецептор типа II | Рецептор I типа | R-SMAD | coSMAD | Я-СМАД |
|---|---|---|---|---|---|---|
| Активин А | Фоллистатин | ACVR2A | ACVR1B (АЛК4) | СМАД2 , СМАД3 | SMAD4 | SMAD7 |
| GDF1 | ACVR2A | ACVR1B (АЛК4) | СМАД2 , СМАД3 | SMAD4 | SMAD7 | |
| GDF11 | ACVR2B | ACVR1B (ALK4), TGFβRI (ALK5) | СМАД2 , СМАД3 | SMAD4 | SMAD7 | |
| БМП2-8 | Ноггин , Чордин , ДЭН | БМПР2 | БМПР1А (АЛК3), БМПР1Б (АЛК6) | СМАД1 СМАД5 , СМАД8 | SMAD4 | СМАД6 , СМАД7 |
| Узловой | Левша | ACVR2B | ACVR1B (ALK4), ACVR1C (ALK7) | СМАД2 , СМАД3 | SMAD4 | SMAD7 |
| TGFβs | LTBP1 , THBS1 , Декорин | TGFβRII | ACVRL1 (ALK1), TGFβRI (ALK5) | СМАД2 , СМАД3 | SMAD4 | SMAD7 |
| ДПП | Пунт | Ткв | Безумный | Медея | ||
| Винт | Пунт | Верно | Безумный | Медея | ||
| миоглианин | Остроумие | Бабуин | dSmad2 | Медея | ||
| дактивин | Белый , Точка | Бабуин | dSmad2 | Медея | ||
| ГБ | Белый , Точка | Ткв , Сакс | Безумный | Медея | ||
| Даф-7 | Даф-4 | Даф-1 | Даф-8 , Даф-14 | Даф-3 | ||
| Двухместный-1 | Даф-4 | Сма-6 | СМА-2 , СМА-3 , СМА-4 | Сма-4 |
Внешние ссылки
[ редактировать ]- Киотская энциклопедия генов и геномов - сигнальных путей бета-TGF карта
- Netpath — тщательно подобранный ресурс о путях передачи сигнала у человека.
Ссылки
[ редактировать ]- ^ Гуминецкий Л., Голдовский Л., Фрейлих С., Мустакас А., Узунис С., Хелдин CH (февраль 2009 г.). «Появление, развитие и диверсификация сигнального пути TGF-бета в животном мире» . Эволюционная биология BMC . 9 (1): 28. дои : 10.1186/1471-2148-9-28 . ПМК 2657120 . ПМИД 19192293 .
- ^ Зи, Жике (12 июля 2019 г.). «Молекулярная инженерия сигнального пути TGF-β» . Журнал молекулярной биологии . 431 (15): 2644–2654. дои : 10.1016/j.jmb.2019.05.022 . hdl : 21.11116/0000-0003-F2A7-F . ISSN 1089-8638 . ПМИД 31121181 . S2CID 163166017 .
- ^ «Документация Prosite PDOC00223» . Архивировано из оригинала 25 мая 2011 г. Проверено 1 июля 2006 г.
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). Молекулярная биология клетки . Нью-Йорк, штат Нью-Йорк: Garland Science. ISBN 978-0-8153-3218-3 .
- ^ Перейти обратно: а б Мунир С, Сюй Г, Ву Ю, Ян Б, Лала ПК, Пэн С (июль 2004 г.). «Nodal и ALK7 ингибируют пролиферацию и индуцируют апоптоз в клетках трофобласта человека» . Журнал биологической химии . 279 (30): 31277–86. дои : 10.1074/jbc.M400641200 . ПМИД 15150278 .
- ^ Врана Дж.Л., Аттисано Л., Каркамо Дж., Зентелла А., Дуди Дж., Лайхо М. и др. (декабрь 1992 г.). «TGF бета передает сигналы через гетеромерный рецепторный комплекс протеинкиназы». Клетка . 71 (6): 1003–14. дои : 10.1016/0092-8674(92)90395-С . ПМИД 1333888 . S2CID 54397586 .
- ^ «Запись Pfam TGF_beta_GS» . Проверено 1 июля 2006 г.
- ^ Рунян CE, Шнапер Х.В., Понселе AC (март 2005 г.). «Роль интернализации в трансформации индуцированной фактором роста бета1 ассоциации Smad2 с якорем Smad для активации рецептора (SARA) и Smad2-зависимой передачей сигналов в мезангиальных клетках человека» . Журнал биологической химии . 280 (9): 8300–8. дои : 10.1074/jbc.M407939200 . ПМИД 15613484 .
- ^ Мустакас А. (сентябрь 2002 г.). «Смадная сеть сигнализации» . Журнал клеточной науки . 115 (Часть 17): 3355–6. дои : 10.1242/jcs.115.17.3355 . ПМИД 12154066 .
- ^ Сушельницкий С, Рённстранд Л, Хелдин Ч., тен Дийке П (2001). «Фосфорилирование сигнальных белков Smad с помощью рецепторных серин/треониновых киназ». Протоколы протеинкиназы . Методы молекулярной биологии. Том. 124. стр. 107–20. дои : 10.1385/1-59259-059-4:107 . ISBN 1-59259-059-4 . ПМИД 11100470 .
- ^ Перейти обратно: а б с д и Массаге Дж., Чен Ю.Г. (март 2000 г.). «Контроль передачи сигналов TGF-бета» . Гены и развитие . 14 (6): 627–44. дои : 10.1101/gad.14.6.627 . ПМИД 10733523 . S2CID 84047115 .
- ^ Уллоа Л., Табибзаде С. (июнь 2001 г.). «Левша ингибирует регулируемое рецептором фосфорилирование Smad, индуцированное активированным рецептором трансформирующего фактора роста-бета» . Журнал биологической химии . 276 (24): 21397–404. дои : 10.1074/jbc.M010783200 . ПМИД 11278746 .
- ^ Лапинг Нью-Джерси, Грыгелько Э., Матур А., Баттер С., Бомбергер Дж., Твид С. и др. (июль 2002 г.). «Ингибирование внеклеточного матрикса, индуцированного трансформирующим фактором роста (TGF)-бета1, с помощью нового ингибитора киназной активности рецептора TGF-бета I типа: SB-431542». Молекулярная фармакология . 62 (1): 58–64. дои : 10.1124/моль.62.1.58 . ПМИД 12065755 . S2CID 792324 .
- ^ Блоб GC, Лю X, Фанг С.Дж., Хау Т., Лодиш Х.Ф. (октябрь 2001 г.). «Новый механизм регуляции передачи сигналов трансформирующего фактора роста бета (TGF-бета). Функциональная модуляция экспрессии рецептора TGF-бета типа III посредством взаимодействия с белком домена PDZ, GIPC» . Журнал биологической химии . 276 (43): 39608–17. дои : 10.1074/jbc.M106831200 . ПМИД 11546783 .
- ^ Интернет-менделевское наследование у человека (OMIM): ТРАНСФОРМИРУЮЩИЙ ФАКТОР РОСТА-БЕТА-РЕЦЕПТОР, ТИП III; ТГФБР3 - 600742
- ^ Ито Ф., Асао Х., Сугамура К., Хелдин Ч., тен Дейке П., Ито С. (август 2001 г.). «Стимулирование передачи сигналов костных морфогенетических белков посредством негативной регуляции ингибирующих Smads» . Журнал ЭМБО . 20 (15): 4132–42. дои : 10.1093/emboj/20.15.4132 . ПМК 149146 . ПМИД 11483516 .