Путь MAPK/ERK

Путь MAPK/ERK (также известный как путь Ras-Raf-MEK-ERK ) представляет собой цепочку белков в клетке , которая передает сигнал от рецептора на поверхности клетки к ДНК в ядре клетки.
Сигнал начинается, когда сигнальная молекула связывается с рецептором на поверхности клетки, и заканчивается, когда ДНК в ядре экспрессирует белок и вызывает некоторые изменения в клетке, например деление клетки . Этот путь включает в себя множество белков, таких как митоген-активируемые протеинкиназы (MAPK), первоначально называемые киназами, регулируемыми внеклеточными сигналами (ERK), которые взаимодействуют путем добавления фосфатных групп к соседнему белку ( фосфорилируя его), тем самым действуя как «включенный» путь. или переключатель «выкл.».
Когда один из белков этого пути мутирует, он может застрять в положении «включено» или «выключено», что является необходимым шагом в развитии многих видов рака. Фактически, компоненты пути MAPK/ERK были впервые обнаружены в раковых клетках, а препараты, которые меняют положение «включения» или «выключения», исследуются в качестве лечения рака. [1]
Фон
[ редактировать ]Сигналом, запускающим путь MAPK/ERK, является связывание внеклеточного митогена с рецептором клеточной поверхности . Это позволяет белку Ras ( малой ГТФазе ) заменять молекулу GDP на молекулу GTP , переключая «включатель/выключатель» этого пути. Белок Ras затем может активировать MAP3K (например, Raf ), который активирует MAP2K , который активирует MAPK . Наконец, MAPK может активировать фактор транскрипции , такой как Myc . Более подробно этот процесс описан ниже.
Активация Раса
[ редактировать ]Связанные с рецептором тирозинкиназы , такие как рецептор эпидермального фактора роста (EGFR), активируются внеклеточными лигандами , такими как эпидермальный фактор роста (EGF). Связывание EGF с EGFR активирует тирозинкиназную активность цитоплазматического домена рецептора. EGFR фосфорилируется по остаткам тирозина. Стыковочные белки, такие как GRB2, содержат домен SH2 , который связывается с остатками фосфотирозина активированного рецептора. [2] GRB2 связывается с фактором обмена гуаниновых нуклеотидов SOS посредством двух доменов SH3 GRB2. Когда комплекс GRB2-SOS стыкуется с фосфорилированным EGFR, SOS активируется. [3] Активированный SOS затем способствует удалению GDP из члена подсемейства Ras (особенно H-Ras или K-Ras ). Затем белок Ras может связываться с GTP и становиться активным.
Помимо EGFR, другие рецепторы клеточной поверхности, которые могут активировать этот путь через GRB2, включают Trk A/B , рецептор фактора роста фибробластов (FGFR) и PDGFR .
Киназный каскад
[ редактировать ]Активированный Ras затем активирует протеинкиназную активность киназы RAF . [4] Киназа RAF фосфорилирует и активирует киназу MAPK/ERK ( MEK1 или MEK2 ). МЕК фосфорилирует и активирует митоген-активируемую протеинкиназу (МАРК).
RAF и MAPK/ERK представляют собой серин/треонин-специфичные протеинкиназы . МЕК представляет собой серин/тирозин/треонин киназу.
В техническом смысле RAF, MEK и MAPK являются митоген -активируемыми киназами, как и MNK (см. ниже). Первоначально МАРК назывались « киназы, регулируемые внеклеточными сигналами » (ERK) и «протеинкиназы, ассоциированные с микротрубочками» (MAPK). Одним из первых белков, фосфорилируемых с помощью ERK, был белок, ассоциированный с микротрубочками (MAP). Как обсуждается ниже, позже было обнаружено множество дополнительных мишеней для фосфорилирования с помощью МАРК, и белок был переименован в «митоген-активируемую протеинкиназу» (МАРК). Ряд киназ от RAF до MEK и MAPK является примером протеинкиназного каскада . Такие серии киназ открывают возможности для регуляции по обратной связи и усиления сигнала.
Регуляция трансляции и транскрипции
[ редактировать ]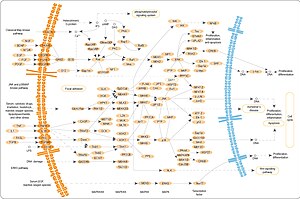
Три из многих белков, фосфорилируемых МАРК, показаны на рисунке справа. является изменение трансляции мРНК Одним из эффектов активации MAPK в белки. МАРК фосфорилирует 40S рибосомальную протеинкиназу S6 (RSK) . Это активирует RSK, который, в свою очередь, фосфорилирует рибосомальный белок S6 . [5] Первыми были выделены митоген-активируемые протеинкиназы, фосфорилирующие рибосомальный белок S6. [4]
МАРК регулирует активность нескольких факторов транскрипции . МАРК может фосфорилировать C-myc . МАРК фосфорилирует и активирует MNK, которая, в свою очередь, фосфорилирует CREB . МАРК также регулирует транскрипцию гена C-Fos . Изменяя уровни и активность факторов транскрипции, МАРК приводит к изменению транскрипции генов, которые важны для клеточного цикла .
Гены 22q11, 1q42 и 19p13, влияя на путь ERK, связаны с шизофренией , шизоаффективным расстройством , биполярным расстройством и мигренью .
Регуляция входа и пролиферации клеточного цикла
[ редактировать ]Роль передачи сигналов митогенов в развитии клеточного цикла
[ редактировать ]Путь ERK играет важную роль в интеграции внешних сигналов от присутствия митогенов, таких как эпидермальный фактор роста (EGF), в сигнальные события, способствующие росту и пролиферации клеток во многих типах клеток млекопитающих. В упрощенной модели присутствие митогенов и факторов роста запускает активацию канонических рецепторных тирозинкиназ, таких как EGFR, что приводит к их димеризации и последующей активации малой ГТФазы Ras. [6] Затем это приводит к серии событий фосфорилирования ниже каскада MAPK (Raf-MEK-ERK), что в конечном итоге приводит к фосфорилированию и активации ERK. Фосфорилирование ERK приводит к активации его киназной активности и фосфорилированию многих последующих мишеней, участвующих в регуляции клеточной пролиферации. В большинстве клеток необходима некоторая форма устойчивой активности ERK, чтобы активировать гены, которые индуцируют вход в клеточный цикл и подавляют негативные регуляторы клеточного цикла. Две такие важные мишени включают комплексы циклина D с Cdk4 и Cdk6 (Cdk4/6), которые оба фосфорилируются ERK. [7] Переход из фазы G1 в фазу S координируется активностью циклина D-Cdk4/6, которая увеличивается в конце фазы G1, когда клетки готовятся войти в S-фазу в ответ на митогены. Активация Cdk4/6 способствует гиперфосфорилированию и последующей дестабилизации белка ретинобластомы (Rb). [7] Гипофосфорилированный Rb обычно связан с транскрипционным фактором E2F в раннем G1 и ингибирует его транскрипционную активность, предотвращая экспрессию генов входа в S-фазу, включая циклин E, циклин A2 и Emi1. [6] Активация ERK1/2 после митоген-индуцированной передачи сигналов Ras необходима и достаточна для устранения этого блока клеточного цикла и обеспечения перехода клеток к S-фазе в большинстве клеток млекопитающих.

Управление обратной связью на выходе и создание бистабильного переключателя G1/S
[ редактировать ]Точка ограничения (R-точка) отмечает критическое событие, когда клетка млекопитающего начинает пролиферацию и становится независимой от стимуляции роста. Он имеет основополагающее значение для нормальной дифференцировки и тканевого гомеостаза и, по-видимому, нарушается практически при всех видах рака. Хотя точка R связана с различными активностями, участвующими в регуляции перехода G1-S клеточного цикла млекопитающих, основной механизм остается неясным. Используя измерения на отдельных клетках, Yao et al. показали, что путь Rb-E2F функционирует как бистабильный переключатель для преобразования ступенчатого поступления сыворотки в ответы E2F «все или ничего». [8]
Сигналы роста и митогенов передаются ниже по пути ERK и включаются в многочисленные петли положительной обратной связи, генерируя бистабильный переключатель на уровне активации E2F. [8] Это происходит из-за трех основных взаимодействий на поздней фазе G1. Первый является результатом стимуляции митогеном через ERK, приводящей к экспрессии транскрипционного фактора Myc, который является прямым активатором E2F. [7] Второй путь является результатом активации ERK, приводящей к накоплению активных комплексов циклина D и Cdk4/6, которые дестабилизируют Rb посредством фосфорилирования и в дальнейшем служат для активации E2F и стимулирования экспрессии его мишеней. Наконец, все эти взаимодействия усиливаются дополнительной петлей положительной обратной связи со стороны E2F на самого себя, поскольку его собственная экспрессия приводит к выработке активного комплекса циклина E и CDK2, который дополнительно служит для фиксации решения клетки войти в S-фазу. В результате, когда концентрация в сыворотке увеличивается постепенно, большинство клеток млекопитающих реагируют переключающимся образом при входе в S-фазу. Этот стимулируемый митогеном бистабильный переключатель E2F демонстрирует гистерезис, поскольку клеткам запрещается возвращаться в G1 даже после отмены митогена после активации E2F. [8]
Динамическая обработка сигналов по пути ERK
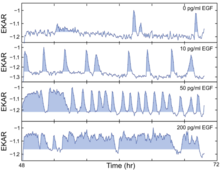
[ редактировать ]Путь EGFR-ERK/MAPK (рецептор эпидермального фактора роста, внеклеточно-регулируемая киназа/митоген-активируемая протеинкиназа), стимулируемый EGF, имеет решающее значение для клеточной пролиферации, но временное разделение между сигналом и реакцией скрывает взаимосвязь сигнал-ответ в предыдущих исследованиях. В 2013 году Альбек и др. [9] предоставили ключевые экспериментальные данные, чтобы заполнить этот пробел в знаниях. Они измерили силу и динамику сигнала при стационарной стимуляции EGF, при которой передачу сигнала и выходной сигнал можно легко связать. Далее они нанесли на карту взаимосвязь сигнал-реакция во всем динамическом диапазоне пути. Используя иммунофлуоресцентное обнаружение высокого содержания (HCIF) фосфорилированной ERK (pERK) и биосенсоры FRET живых клеток, они контролировали последующие выходные сигналы пути ERK как в живых клетках, так и в фиксированных клетках. Чтобы дополнительно связать количественные характеристики передачи сигналов ERK со скоростью пролиферации, они установили серию стационарных условий, используя диапазон концентраций EGF, применяя EGF с различными концентрациями.
Эксперименты по визуализации отдельных клеток показали, что ERK активируется стохастическими всплесками в присутствии EGF. Более того, было показано, что этот путь кодирует силу входных сигналов посредством частотно-модулированных импульсов своей активности. Используя биосенсоры FRET живых клеток, клетки, индуцированные различными концентрациями EGF, вспыхивали незаконную активность с разной частотой, при этом более высокие уровни EGF приводили к более частым всплескам активности ERK. Чтобы выяснить, как на вход в S-фазу могут влиять спорадические импульсы активности ERK при низких концентрациях EGF, они использовали клетки MCF-10A, совместно экспрессирующие EKAR-EV и RFP-геминин, и идентифицировали импульсы активности ERK с помощью подсчета очков, а затем сопоставили их. эта активность ERK профилируется со временем индукции GFP-геминина. Они обнаружили, что более длительные периоды активности ERK стимулируют вход в S-фазу, о чем свидетельствует увеличенная длина импульса. Чтобы понять динамику пути EGFR-ERK, в частности, как модулируется частота и амплитуда, они применили ингибитор EGFR гефитиниб или высокоселективный ингибитор киназы MAPK/ERK (MEK) PD0325901 (PD). Два ингибитора на самом деле дают немного разные результаты: гефитиниб в промежуточной концентрации будет вызывать пульсирующее поведение, а также бимодальный сдвиг, чего не наблюдается при БП. Далее они объединили EGF и PD вместе и пришли к выводу, что частота активности ERK модулируется количественными вариациями, тогда как амплитуда модулируется изменением активности MEK. Наконец, они обратились к Fra-1, одному из нижестоящих эффекторов пути ERK, поскольку напрямую оценить активность ERK технически сложно. Чтобы понять, как выходной сигнал интегрированного пути ERK (который должен быть независим ни от частоты, ни от амплитуды) влияет на скорость пролиферации, они использовали комбинацию широкого диапазона концентраций EGF и PD и обнаружили, что на самом деле существует одиночная криволинейная форма перевернутой буквы «L». взаимосвязь, которая предполагает, что при низких уровнях выходного сигнала пути ERK небольшие изменения интенсивности сигнала соответствуют большим изменениям скорости пролиферации, тогда как большие изменения интенсивности сигнала вблизи верхнего конца динамического диапазона мало влияют на пролиферацию. Колебания передачи сигналов ERK подчеркивают потенциальные проблемы с современными терапевтическими подходами, открывая новую перспективу с точки зрения размышлений о нацеливании лекарств на путь ERK при раке.
Интеграция сигналов митогена и стресса в пролиферацию
[ редактировать ]Недавние эксперименты по визуализации живых клеток в клетках MCF10A и MCF7 показали, что сочетание передачи сигналов митогена через ERK и сигналов стресса посредством активации р53 в материнских клетках способствует вероятности того, что вновь образовавшиеся дочерние клетки немедленно снова войдут в клеточный цикл или вступят в него. состояние покоя (G0), предшествующее митозу. [10] Вместо того, чтобы дочерние клетки начинались без ключевых сигнальных белков после деления, мРНК циклина D1, индуцированная митогеном / ERK, и белок p53, индуцированный повреждением ДНК, которые являются долгоживущими факторами в клетках, могут стабильно унаследоваться от материнских клеток после деления клеток. Уровни этих регуляторов варьируются от клетки к клетке после митоза, и стехиометрия между ними сильно влияет на выполнение клеточного цикла посредством активации Cdk2. Химические возмущения с использованием ингибиторов передачи сигналов ERK или индукторов передачи сигналов p53 в материнских клетках позволяют предположить, что дочерние клетки с высокими уровнями белка p53 и низкими уровнями транскриптов Cyclin D1 в первую очередь проникают в G0, тогда как клетки с высоким уровнем Cyclin D1 и низкими уровнями p53 наиболее вероятны. вновь войти в клеточный цикл. Эти результаты иллюстрируют форму закодированной молекулярной памяти через историю передачи сигналов митогенов через ERK и реакцию на стресс через p53. [11] [12]
Клиническое значение
[ редактировать ]Неконтролируемый рост является необходимым шагом для развития всех видов рака. [13] При многих видах рака (например, меланоме ) дефект пути MAP/ERK приводит к неконтролируемому росту. Многие соединения могут ингибировать этапы пути MAP/ERK и, следовательно, являются потенциальными лекарствами для лечения рака. [14] [15] [16] [17] [18] например, болезнь Ходжкина . [19]
Первым препаратом, имеющим лицензию на действие по этому пути, является сорафениб — ингибитор Raf- киназы. Другие ингибиторы Raf включают SB590885, PLX4720, XL281, RAF265, энкорафениб , дабрафениб и вемурафениб . [18]
Некоторые ингибиторы MEK включают кобиметиниб , CI-1040, PD0325901, биниметиниб (MEK162), селуметиниб , [18] и траметиниб (GSK1120212) [20]
Было обнаружено, что прижигание акупунктурных точек играет роль в облегчении вызванного алкоголем повреждения слизистой оболочки желудка на мышиной модели, что может быть тесно связано с его воздействием на активацию пути передачи сигнала эпидермального фактора роста/ERK. [21]
Путь RAF-ERK также участвует в патофизиологии синдрома Нунан , полимальформативного заболевания.
Анализ белковых микрочипов можно использовать для обнаружения тонких изменений в активности белков в сигнальных путях. [22] Синдромы развития, вызванные мутациями зародышевой линии в генах, которые изменяют компоненты RAS пути передачи сигнала MAP/ERK, называются RASopathies .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Ортон Р.Дж., Штурм О.Е., Вышемирский В., Колдер М., Гилберт Д.Р., Колх В. (декабрь 2005 г.). «Вычислительное моделирование пути МАРК, активируемого рецептором тирозинкиназой» . Биохимический журнал . 392 (Часть 2): 249–61. дои : 10.1042/BJ20050908 . ПМЦ 1316260 . ПМИД 16293107 .
- ^ Шульце WX, Денг Л, Манн М (2005). «Фосфотирозиновый интерактом семейства киназ ErbB-рецептора» . Молекулярная системная биология . 1 (1): 2005.0008. дои : 10.1038/msb4100012 . ПМЦ 1681463 . ПМИД 16729043 .
- ^ Зарич Н., Олива Х.Л., Мартинес Н. и др. (август 2006 г.). «Grb2 является отрицательным модулятором внутренней активности Ras-GEF hSos1» . Молекулярная биология клетки . 17 (8): 3591–7. дои : 10.1091/mbc.E05-12-1104 . ПМЦ 1525251 . ПМИД 16760435 .
- ^ Jump up to: а б Авруч Дж., Хохлачев А., Кириакис Дж.М. и др. (2001). «Ras-активация киназы Raf: рекрутирование тирозинкиназы в каскад киназы MAP» . Последние достижения в исследованиях гормонов . 56 (1): 127–55. дои : 10.1210/rp.56.1.127 . ПМИД 11237210 .
- ^ Pende M, Um SH, Mieulet V, et al. (Apr 2004). "S6K1, (-/-) /S6K2 (-/-) у мышей наблюдается перинатальная летальность и чувствительная к рапамицину 5'-концевая олигопиримидиновая трансляция мРНК, а также выявлен митоген-активируемый протеинкиназно-зависимый путь киназы S6» . Molecular and Cellular Biology . 24 (8): 3112–24. doi : 10.1128/MCB. 24.8.3112-3124.2004 . ПМЦ 381608 .
- ^ Jump up to: а б Мелош и др. «Путь протеинкиназы, активируемой митогеном ERK1/2, как главный регулятор перехода G1-S-фазы». Онкоген, вып. 26, нет. 22, 2007, стр. 3227–3239., дои : 10.1038/sj.onc.1210414 .
- ^ Jump up to: а б с Шамбард, Жан-Клод и др. «Влияние ERK на регуляцию клеточного цикла». Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток, том. 1773, нет. 8, 2007, стр. 1299–1310., дои : 10.1016/j.bbamcr.2006.11.010 .
- ^ Jump up to: а б с 4. Яо, Гуан и др. «Бистабильный переключатель Rb-E2F лежит в основе точки ограничения». Природная клеточная биология, том. 10, нет. 4, 2008, стр. 476–482., два : 10.1038/ncb1711 .
- ^ Альбек, Джон А. Г. и др. «Частотно-модулированные импульсы активности ERK передают количественные сигналы пролиферации». Молекулярная клетка, том. 49, нет. 2, 2013, стр. 249–261., два : 10.1016/j.molcel.2012.11.002 .
- ^ 8. Ян, Хи Вон и др. «Конкурирующие воспоминания о входе в клеточный цикл контроля передачи сигналов митогена и p53». Природа, вып. 549, нет. 7672, июнь 2017 г., стр. 404–408., дои : 10.1038/nature23880 .
- ^ Ян, Хи Вон и др. «Конкурирующие воспоминания о входе в клеточный цикл контроля передачи сигналов митогена и p53». Природа, вып. 549, нет. 7672, июнь 2017 г., стр. 404–408., дои : 10.1038/nature23880 .
- ^ Кедзиора, Катажина М. и Джереми Э. Первис. «Клеточная биология: устойчивость памяти». Nature, vol. 549, нет. 7672, июнь 2017 г., стр. 343–344., дои : 10.1038/nature23549 .
- ^ Вниз Дж (2003). «Нацеливание на сигнальные пути RAS в терапии рака». Обзоры природы Рак . 3 (1): 11–22. дои : 10.1038/nrc969 . ПМИД 12509763 . S2CID 43074411 .
- ^ Хильгер Р.А., Шеулен М.Е., Страмберг Д. (декабрь 2002 г.). «Путь Ras-Raf-MEK-ERK в лечении рака» (PDF) . Онкология . 25 (6): 511–8. дои : 10.1159/000068621 . ПМИД 12566895 . S2CID 26673969 . Архивировано из оригинала 6 октября 2012 г.
- ^ Зебольт-Леопольд Дж.С. (июнь 2008 г.). «Достижения в разработке методов лечения рака, направленных против пути протеинкиназы, активируемой RAS-митогеном» . Клин. Рак Рез . 14 (12): 3651–6. дои : 10.1158/1078-0432.CCR-08-0333 . ПМИД 18559577 . Архивировано из оригинала 6 сентября 2011 г.
- ^ Хосино Р., Чатани Ю., Ямори Т. и др. (январь 1999 г.). «Конститутивная активация сигнального пути митоген-активируемой протеинкиназы 41/43 кДа в опухолях человека» . Онкоген . 18 (3): 813–22. дои : 10.1038/sj.onc.1202367 . ПМИД 9989833 .
- ^ МакКубри Дж.А., Стилман Л.С., Чаппелл В.Х. и др. (август 2007 г.). «Роль пути Raf/MEK/ERK в росте клеток, злокачественной трансформации и устойчивости к лекарствам» . Биохим. Биофиз. Акта . 1773 (8): 1263–84. дои : 10.1016/j.bbamcr.2006.10.001 . ПМК 2696318 . ПМИД 17126425 .
- ^ Jump up to: а б с Квонг-Квок Вонг (2009). «Последние разработки противораковых агентов, действующих на пути Ras/Raf/MEK/ERK» (PDF) . Архивировано из оригинала (PDF) 16 июня 2010 г.
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ Чжэн Б., Фьюмара П., Ли Ю.В. и др. (август 2003 г.). «Путь MEK/ERK аберрантно активен при болезни Ходжкина: сигнальный путь, общий для CD30, CD40 и RANK, который регулирует пролиферацию и выживание клеток» . Кровь . 102 (3): 1019–27. дои : 10.1182/кровь-2002-11-3507 . ПМИД 12689928 .
- ^ «Клиническое исследование рака: исследование по определению эффективности GSK1120212 в BRAF…» . Архивировано из оригинала 8 июля 2012 г. Проверено 26 ноября 2010 г.
- ^ Чжан Х, Го Х, Чжан ЮК, Лю М, Ай К, Су ЮМ, Ли МХ, Ли ТЛ (2014). «[Влияние прижигания на экспрессию рецептора эпидермального фактора роста желудка и экспрессию киназы 1/2, регулируемую внеклеточным сигналом, у крыс с язвой желудка]». Чжэнь Ци Янь Цзю . 39 (5): 351–7. ПМИД 25518106 .
- ^ Калверт В.С., Тан Ю., Бовея В., Вульфкуле Дж., Шутц-Гешвендер А., Оливер Д.М., Лиотта Л.А., Петрикоин Э.Ф. (2004). «Разработка мультиплексного профилирования и обнаружения белков с использованием обнаружения в ближнем инфракрасном диапазоне белковых микроматриц с обращенной фазой». Журнал клинической протеомики . 1 (1): 81–89. дои : 10.1385/CP:1:1:081 .
Внешние ссылки
[ редактировать ]- Ресурс MAP-киназы .
- Киотская энциклопедия генов и геномов — путь MAPK
- MAP+киназа+сигнальная+система в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)