Каркасный белок
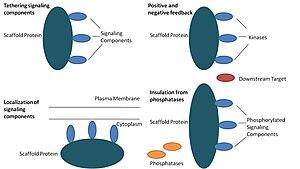
В биологии каркасные белки являются важнейшими регуляторами многих ключевых сигнальных путей . Хотя функции каркасов строго не определены, известно, что они взаимодействуют и/или связываются с несколькими участниками сигнального пути, связывая их в комплексы . В таких путях они регулируют трансдукцию сигнала и помогают локализовать компоненты пути (организованные в комплексы) в определенных областях клетки, таких как плазматическая мембрана , цитоплазма , ядро , аппарат Гольджи , эндосомы и митохондрии .
История
[ редактировать ]Первым обнаруженным сигнальным каркасным белком был белок Ste5 из дрожжей Saccharomyces cerevisiae . Было показано, что три различных домена Ste5 связываются с протеинкиназами Ste11 , Ste7 и Fus3 , образуя мультикиназный комплекс. [2]
Функция
[ редактировать ]Каркасные белки действуют по крайней мере четырьмя способами: связывают сигнальные компоненты, локализуют эти компоненты в определенных областях клетки, регулируют трансдукцию сигнала путем координации сигналов положительной и отрицательной обратной связи и изолируют правильные сигнальные белки от конкурирующих белков. [1]
Привязка сигнальных компонентов
[ редактировать ]Эта конкретная функция считается самой основной функцией строительных лесов. Скаффолды собирают сигнальные компоненты каскада в комплексы. Эта сборка может быть способна повысить специфичность передачи сигналов за счет предотвращения ненужных взаимодействий между сигнальными белками и повысить эффективность передачи сигналов за счет увеличения близости и эффективной концентрации компонентов в каркасном комплексе. Типичным примером того, как каркасы повышают специфичность, является каркас, который связывает протеинкиназу и ее субстрат, тем самым обеспечивая специфическое фосфорилирование киназы. Кроме того, некоторые сигнальные белки требуют множественных взаимодействий для активации, и привязка каркаса может конвертировать эти взаимодействия в одно взаимодействие, которое приводит к множественным модификациям. [3] [4] Каркасы также могут быть каталитическими, поскольку взаимодействие с сигнальными белками может приводить к аллостерическим изменениям этих сигнальных компонентов. [5] Такие изменения могут усиливать или ингибировать активацию этих сигнальных белков. Примером является каркас Ste5 в пути митоген-активируемой протеинкиназы ( MAPK ). Было предложено, чтобы Ste5 направлял передачу сигналов спаривания через Fus3 MAPK путем каталитического разблокирования этой конкретной киназы для активации ее MAPKK Ste7. [6]
Локализация сигнальных компонентов в клетке
[ редактировать ]Каркасы локализуют сигнальную реакцию в определенной области клетки, и этот процесс может быть важен для локальной продукции сигнальных промежуточных продуктов. Конкретным примером этого процесса является каркас, якорные белки А-киназы (AKAP), которые нацеливают циклическую AMP-зависимую протеинкиназу ( PKA ) на различные участки клетки. [7] Эта локализация способна локально регулировать PKA и приводит к локальному фосфорилированию PKA ее субстратов.
Координация положительных и отрицательных отзывов
[ редактировать ]Многие гипотезы о том, как каркасы координируют положительную и отрицательную обратную связь, основаны на инженерных каркасах и математическом моделировании. В трехкиназных сигнальных каскадах каркасы связывают все три киназы, повышая специфичность киназы и ограничивая амплификацию сигнала за счет ограничения фосфорилирования киназы только одной нижестоящей мишенью. [3] [8] [9] Эти способности могут быть связаны со стабильностью взаимодействия каркаса с киназами, базальной активностью фосфатазы в клетке, расположением каркаса и уровнем экспрессии сигнальных компонентов. [3] [8]
Защита правильных сигнальных белков от инактивации
[ редактировать ]Сигнальные пути часто инактивируются ферментами, которые обращают состояние активации и/или вызывают деградацию сигнальных компонентов. Были предложены каркасы для защиты активированных сигнальных молекул от инактивации и/или деградации. Математическое моделирование показало, что киназы в каскаде без каркасов имеют более высокую вероятность дефосфорилирования фосфатазами еще до того, как они смогут фосфорилировать нижестоящие мишени. [8] Кроме того, было показано, что каркасы изолируют киназы от субстрат- и АТФ-конкурентных ингибиторов. [10]
Краткое описание каркасного белка
[ редактировать ]| Каркасные белки | Путь | Потенциальные функции | Описание |
|---|---|---|---|
| КСР | МАПК | Сборка и локализация пути RAS-ERK | Одним из наиболее изученных сигнальных путей в биологии является путь RAS-ERK , в котором G-белок RAS активирует MAPKKK RAF , который активирует MAPKK MEK1 (киназа MAPK/ERK 1), который затем активирует MAPK ERK . Было идентифицировано, что несколько каркасных белков участвуют в этом пути и других подобных путях МАРК. Одним из таких каркасных белков является KSR, который является наиболее вероятным эквивалентом хорошо изученного каркасного белка дрожжей MAPK Ste5. [11] Он является положительным регулятором этого пути и связывает многие белки этого пути, включая все три киназы в каскаде. [6] Было показано, что KSR локализуется на плазматической мембране во время активации клеток, тем самым играя роль в сборке компонентов пути ERK и локализации активированной ERK на плазматической мембране. [12] |
| МЕКК1 | МАПК | Сборка и локализация сигналосомы рецептора смерти | Другие каркасные белки включают B-клеточную лимфому 10 ( BCL-10 ) и киназу MEK 1 ( MEKK1 ), которые играют роль в пути N-концевой киназы JUN ( JNK ). |
| БКЛ-10 | МАПК | Сборка и специфика JNK | |
| КАП | ПКА Пути | Координация фосфорилирования с помощью PKA на нижестоящие мишени | Это семейство белков связано только структурно по своей способности связывать регуляторную субъединицу PKA, но в остальном может связывать очень разнообразный набор ферментов и субстратов. |
| АХНАК-1 | Передача сигналов кальция | Сборка и локализация кальциевых каналов | Передача сигналов кальция необходима для правильного функционирования иммунных клеток. Недавние исследования показали, что каркасный белок AHNAK1 важен для эффективной передачи сигналов кальция и активации NFAT в Т-клетках благодаря его способности правильно локализовать кальциевые каналы на плазматической мембране [14]. Также было показано, что в неиммунных клетках AHNAK1 связывает кальциевые каналы с фосфолипазой Cγ ( PLC-γ ) и PKC . [1] Кальций-связывающие белки часто подавляют большую часть поступающего кальция, поэтому связывание этих эффекторов кальция может быть особенно важным, когда сигналы индуцируются слабым притоком кальция. |
| ГОМЕР | Передача сигналов кальция | Ингибирование активации NFAT | Другим примером каркасного белка, который модулирует передачу сигналов кальция, являются белки семейства HOMER. Было показано, что белки HOMER конкурируют с кальциневрином за связывание с N-концом NFAT в активированных Т-клетках. [13] Благодаря этой конкуренции белки HOMER способны снижать активацию NFAT, что также снижает выработку цитокина IL-2 . [13] Напротив, было показано, что белки HOMER положительно регулируют передачу сигналов кальция в нейронах, связывая рецептор глутамата с рецепторами трифосфата в эндоплазматическом ретикулуме. [14] |
| Пеллино | Врожденная иммунная сигнализация | Сборка сигналосомы TLR | Существуют доказательства того, что белки Pellino функционируют как каркасные белки в важном сигнальном пути врожденного иммунитета, пути Toll-подобного рецептора ( TLR ). Большая часть функций Пеллино — это спекуляции; однако белки Pellino могут связываться с IRAK1, TRAF6 и TAK1 после активации IL-1R, что указывает на то, что они могут собирать и локализовать компоненты пути TLR вблизи его рецептора. [15] [16] |
| НЛРП | Врожденная иммунная сигнализация | Сборка инфламмасомы | Семейство NLR представляет собой высококонсервативное и большое семейство рецепторов, участвующих во врожденном иммунитете. Семейство рецепторов NLRP (семейство NLR, содержащее пириновый домен) действует как каркас, собирая инфламмасому, комплекс, который приводит к секреции провоспалительных цитокинов, таких как IL-18 и IL-1β. [17] |
| ДЛГ1 | рецептора Т-клеток Передача сигналов | Сборка и локализация сигнальных молекул TCR, активация p38 | DLG1 высококонсервативен в иммунных клетках и важен для активации Т-клеток на периферии. Он рекрутируется в иммунологический синапс и связывает ζ-цепь рецептора Т-клеток ( TCR ) с CBL, WASP, p38, LCK, VAV1 и ZAP70. [18] [19] [20] [21] Эти данные позволяют предположить, что DLG1 играет роль в связывании сигнального механизма TCR с регуляторами цитоскелета, а также предполагает роль в альтернативной активации пути p38. Однако неясно, регулирует ли DLG1 активацию Т-клеток положительно или отрицательно. |
| Спинофилин | дендритных клеток Передача сигналов | Сборка белков иммуносинапсов DC | Спинофилин участвует в функции дендритных клеток, в частности в формировании иммунологических синапсов. Спинофилин рекрутируется в синапс после контакта дендритной клетки с Т-клеткой. Это рекрутирование, по-видимому, важно, поскольку без спинофилина дендритные клетки не могут активировать Т-клетки in vitro или in vivo . [22] Каким образом спинофилин облегчает презентацию антигена в этом случае, пока неизвестно, хотя возможно, что спинофилин регулирует продолжительность контакта клеток в синапсе или регулирует рециркуляцию костимулирующих молекул в клетке, таких как молекулы MHC. [1] |
| Регуляторный белок растительного гриппа [23] | Координация отрицательной обратной связи при биосинтезе протохлорофиллида . | Сборка и локализация пути, осуществляющего синтез высокотоксичного протохлорофиллида , предшественника хлорофилла . | Синтез протохлорофиллида необходимо строго регулировать, поскольку его превращение в хлорофилл требует света. Регуляторный белок FLU расположен в мембране тилакоида и содержит лишь несколько сайтов белок-белкового взаимодействия без каталитической активности. Мутанты, лишенные этого белка, в темноте накапливают избыточное количество протохлорофиллида. Партнеры по взаимодействию неизвестны. В ходе эволюции белок претерпел упрощение. |
Белок хантингтин
[ редактировать ]Белок хантингтин локализуется совместно с белком репарации АТМ в местах повреждения ДНК . [24] Хантингтин представляет собой каркасный белок в комплексе ответа на окислительное повреждение ДНК АТМ. [24] Пациенты с болезнью Хантингтона с аберрантным белком хантингтина не способны восстанавливать окислительные повреждения ДНК . болезни Хантингтона Окислительное повреждение ДНК, по-видимому, лежит в основе патогенеза . [25] Болезнь Хантингтона, вероятно, вызвана дисфункцией мутантного каркасного белка хантингтина при репарации ДНК, что приводит к усилению окислительного повреждения ДНК в метаболически активных клетках. [24]
восстановление ДНК
[ редактировать ]SPIDR (каркасный белок, участвующий в репарации ДНК ) регулирует стабильность или сборку RAD51 и DMC1 на одноцепочечной ДНК. [26] RAD51 и DMC1 представляют собой рекомбиназы млекопитающих, , которые действуют во время мейоза опосредуя обмен цепей во время восстановления двухцепочечных разрывов ДНК путем гомологичной рекомбинации . [26]
Другое использование термина «каркасный белок».
[ редактировать ]В некоторых других случаях в биологии (не обязательно в отношении передачи сигналов в клетках) термин «каркасный белок» используется в более широком смысле, когда белок удерживает вместе несколько вещей для каких-либо целей.
- При сворачивании хромосом
- Хромосомный каркас играет важную роль в удержании хроматина в компактной хромосоме . Хромосомный каркас состоит из белков, включая конденсин , топоизомеразу IIα и члена семейства 4 кинезинов (KIF4). [27] Белки, составляющие каркас хромосом, также называются каркасными белками.
- В ферментативной реакции
- Крупные многофункциональные ферменты, выполняющие серию или цепочку реакций по общему пути, иногда называемые каркасными белками. [28] такие как пируватдегидрогеназа .
- В формировании формы молекулы
- Фермент или структурный белок, который удерживает вместе несколько молекул, удерживая их в правильном пространственном расположении, например, каркасные белки кластера железа и серы . [29] [30]
- Структурные леса
- В цитоскелете и внеклеточном матриксе молекулы обеспечивают механический каркас. Например, коллаген 4 типа. [31]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д Шоу, Андрей С.; Филберт, Эрин Л. (январь 2009 г.). «Каркасные белки и передача сигналов иммунных клеток». Обзоры природы Иммунология . 9 (1): 47–56. дои : 10.1038/nri2473 . ПМИД 19104498 . S2CID 13443447 .
- ^ Чой, Кан-Йелл; Саттерберг, Бретт; Лайонс, Дэвид М.; Элион, Элейн А. (август 1994 г.). «Ste5 связывает несколько протеинкиназ в каскаде MAP-киназ, необходимых для спаривания у S. cerevisiae ». Клетка . 78 (3): 499–512. дои : 10.1016/0092-8674(94)90427-8 . ПМИД 8062390 . S2CID 20541545 .
- ^ Jump up to: а б с Левченко, Андре; Брук, Иегошуа; Штернберг, Пол В. (23 мая 2000 г.). «Каркасные белки могут двухфазно влиять на уровни передачи сигналов митоген-активируемой протеинкиназы и снижать ее пороговые свойства» . Труды Национальной академии наук . 97 (11): 5818–23. Бибкод : 2000PNAS...97.5818L . дои : 10.1073/pnas.97.11.5818 . ЧВК 18517 . ПМИД 10823939 .
- ^ Феррелл, Джеймс Э. (3 октября 2000 г.). «Что на самом деле делают каркасные белки?». Научная сигнализация . 2000 (52): пе1. дои : 10.1126/stke.522000pe1 . S2CID 219192522 .
- ^ Бурак, В. Ричард; Шоу, Андрей С. (апрель 2000 г.). «Передача сигнала: висение на помосте». Современное мнение в области клеточной биологии . 12 (2): 211–6. дои : 10.1016/S0955-0674(99)00078-2 . ПМИД 10712921 .
- ^ Jump up to: а б Хорошо, Мэтью; Тан, Грейс; Синглтон, Джули; Ремени, Аттила; Лим, Венделл А. (март 2009 г.). «Скаффолд Ste5 направляет передачу сигналов спаривания путем каталитического разблокирования киназы Fus3 MAP для активации» . Клетка . 136 (6): 1085–97. дои : 10.1016/j.cell.2009.01.049 . ПМЦ 2777755 . ПМИД 19303851 .
- ^ Вонг, Вэй; Скотт, Джон Д. (декабрь 2004 г.). «Комплексы сигнализации АКАП: фокусы в пространстве и времени». Nature Reviews Молекулярно-клеточная биология . 5 (12): 959–970. дои : 10.1038/nrm1527 . ПМИД 15573134 . S2CID 15268680 .
- ^ Jump up to: а б с Локасейл, Джейсон В.; Шоу, Андрей С.; Чакраборти, Аруп К. (14 августа 2007 г.). «Белки каркаса придают протеинкиназным каскадам разнообразные регуляторные свойства» . Труды Национальной академии наук . 104 (33): 13307–12. Бибкод : 2007PNAS..10413307L . дои : 10.1073/pnas.0706311104 . ЧВК 1948937 . ПМИД 17686969 . S2CID 8907943 .
- ^ Улик, Марк Т; Абелл, Эми Н; Куэвас, Брюс Д.; Накамура, Кадзухиро; Джонсон, Гэри Л. (1 декабря 2004 г.). «Схемы подключения регулирования МАПК по МЕКК1, 2 и 3». Биохимия и клеточная биология . 82 (6): 658–663. дои : 10.1139/o04-114 . ПМИД 15674433 .
- ^ Гринвальд, Эрик С.; Редден, Джон М.; Додж-Кафка, Кимберли Л.; Сосерман, Джеффри Дж. (24 января 2014 г.). «Переключение состояний каркаса усиливает, ускоряет и изолирует передачу сигналов протеинкиназы C» . Журнал биологической химии . 289 (4): 2353–60. дои : 10.1074/jbc.M113.497941 . ПМЦ 3900978 . ПМИД 24302730 .
- ^ Клаперон, А.; Терриен, М. (май 2007 г.). «KSR и CNK: два каркаса, регулирующие RAS-опосредованную активацию RAF» . Онкоген . 26 (22): 3143–58. дои : 10.1038/sj.onc.1210408 . ПМИД 17496912 . S2CID 31061333 .
- ^ Мюллер, Юрген; Ори, Стефан; Коупленд, Терри; Пивница-Вормс, Хелен; Моррисон, Дебора К. (ноябрь 2001 г.). «C-TAK1 регулирует передачу сигналов Ras путем фосфорилирования каркаса MAPK, KSR1» . Молекулярная клетка . 8 (5): 983–993. дои : 10.1016/S1097-2765(01)00383-5 . ПМИД 11741534 .
- ^ Jump up to: а б Хуан, Го Н.; Хусо, Дэвид Л.; Буян, Самуэль; Ту, Цзяньчэнь; МакКоркелл, Келли А.; Мэй, Майкл Дж.; Чжу, Ювэнь; Лутц, Майкл; Коллинз, Сэмюэл; Дехофф, Марлин; Канг, Шин; Уортенби, Кэтрин; Пауэлл, Джонатан; Лихи, Дэниел; Уорли, Пол Ф. (25 января 2008 г.). «Связывание NFAT и регуляция активации Т-клеток цитоплазматическими каркасными белками Гомера» . Наука . 319 (5862): 476–481. Бибкод : 2008Sci...319..476H . дои : 10.1126/science.1151227 . ПМК 3602998 . ПМИД 18218901 .
- ^ Сяо, Бо; Ченг Ту, Цзянь; Уорли, Пол Ф. (июнь 2000 г.). «Гомер: связь между нейронной активностью и функцией рецепторов глутамата». Современное мнение в нейробиологии . 10 (3): 370–4. дои : 10.1016/S0959-4388(00)00087-8 . ПМИД 10851183 . S2CID 8699597 .
- ^ Цзян, Чжэнфань; Джонсон, Х. Ян; Не, Хуэйцин; Цинь, Цзиньчжун; Берд, Тимоти А.; Ли, Сяося (28 марта 2003 г.). «Пеллино-1 необходим для передачи сигналов, опосредованной интерлейкином-1 (IL-1), посредством его взаимодействия с комплексом киназы 4, ассоциированной с рецептором IL-1 (IRAK4)-IRAK-фактора 6, связанного с рецептором некроза опухоли (TRAF6)» . Журнал биологической химии . 278 (13): 10952–6. дои : 10.1074/jbc.M212112200 . ПМИД 12496252 . S2CID 10165785 .
- ^ Ю, Кан Ёль; Квон, Хён Джу; Норман, Дэвид AM; Виг, Ева; Гебл, Марк Г.; Харрингтон, Морин А. (15 октября 2002 г.). «Авангард: мышиный пеллино-2 модулирует передачу сигналов IL-1 и липополисахаридов» . Журнал иммунологии . 169 (8): 4075–8. дои : 10.4049/jimmunol.169.8.4075 . ПМИД 12370331 . S2CID 25317655 .
- ^ Петрилли, Вирджиния; Достерт, Кэтрин; Муруве, Дэниел А; Чопп, Юрг (декабрь 2007 г.). «Инфламмасома: комплекс обнаружения опасности, запускающий врожденный иммунитет». Современное мнение в иммунологии . 19 (6): 615–622. дои : 10.1016/j.coi.2007.09.002 . ПМИД 17977705 .
- ^ Ксавье, Рамник; Рабизаде, Шахруз; Исигуро, Казухиро; Андре, Нико; Ортис, Дж. Бернабе; Вахтель, Хизер; Моррис, Дэвид Г.; Лопес-Иласака, Марко; Шоу, Альберт С.; Сват, Войцех; Сид, Брайан (19 июля 2004 г.). «Комплексы больших дисков (Dlg1) при активации лимфоцитов» . Журнал клеточной биологии . 166 (2): 173–8. дои : 10.1083/jcb.200309044 . ПМК 2172307 . ПМИД 15263016 .
- ^ Ханада, Тошихико; Линь, Лунхуэй; Чанди, К. Джордж; О, С. Стивен; Чишти, Атар Х. (24 октября 1997 г.). «Человеческий гомолог большого супрессора опухоли дисков дрозофилы связывается с тирозинкиназой p56 lck и калиевым каналом шейкерного типа Kv1.3 в Т-лимфоцитах» . Журнал биологической химии . 272 (43): 26899–904. дои : 10.1074/jbc.272.43.26899 . ПМИД 9341123 . S2CID 23446334 .
- ^ Раунд, Джун Л.; Хамфрис, Лиза А.; Томасян, Тамар; Миттельштадт, Пол; Чжан, Мин; Мичели, М. Кэрри (февраль 2007 г.). «Каркасный белок Dlgh1 координирует активацию альтернативной киназы p38, направляя сигналы рецептора Т-клеток на NFAT, но не на факторы транскрипции NF-κB». Природная иммунология . 8 (2): 154–161. дои : 10.1038/ni1422 . ПМИД 17187070 . S2CID 11906543 .
- ^ Раунд, Джун Л.; Томасян, Тамар; Чжан, Мин; Патель, Виреш; Шенбергер, Стивен П.; Мичели, М. Кэрри (7 февраля 2005 г.). «Dlgh1 координирует полимеризацию актина, синаптические рецепторы Т-клеток и агрегацию липидных рафтов, а также эффекторную функцию в Т-клетках» . Журнал экспериментальной медицины . 201 (3): 419–430. дои : 10.1084/jem.20041428 . ПМК 2213022 . ПМИД 15699074 .
- ^ Блум, Она; Унтернарер, Джулия Дж.; Цзян, Айминь; Шин, Чон Сук; Деламар, Лелия; Аллен, Патрик; Меллман, Ира (21 апреля 2008 г.). «Спинофилин участвует в передаче информации в иммунологических синапсах» . Журнал клеточной биологии . 181 (2): 203–211. дои : 10.1083/jcb.200711149 . ПМК 2315669 . ПМИД 18411312 . S2CID 1717736 .
- ^ Мешкаускене, Раса; Натер, Мена; Гослингс, Дэвид; Кесслер, Феликс; Лагерь, Роэл оп ден; Апель, Клаус (23 октября 2001 г.). «ГРИПП: негативный регулятор биосинтеза хлорофилла у Arabidopsis thaliana» . Труды Национальной академии наук . 98 (22): 12826–31. Бибкод : 2001PNAS...9812826M . дои : 10.1073/pnas.221252798 . ПМК 60138 . ПМИД 11606728 .
- ^ Jump up to: а б с Маиури, Тамара; Мокль, Эндрю Дж.; Хунг, Клаудия Л.; Ся, Цзяньрун; ван Роон-Мом, Виллеке MC; Труант, Рэй (25 декабря 2016 г.). «Хантингтин является каркасным белком в комплексе ответа на окислительное повреждение ДНК АТМ» . Молекулярная генетика человека . 26 (2): 395–406. дои : 10.1093/hmg/ddw395 . ПМИД 28017939 .
- ^ Аяла-Пенья, Сильветт (сентябрь 2013 г.). «Роль окислительного повреждения ДНК в митохондриальной дисфункции и патогенезе болезни Хантингтона» . Свободнорадикальная биология и медицина . 62 : 102–110. doi : 10.1016/j.freeradbiomed.2013.04.017 . ПМЦ 3722255 . ПМИД 23602907 .
- ^ Jump up to: а б Хуан Т, Ву X, Ван С, Бао Z, Ван Ю, Ван Z, Ли М, Юй X, Lv Y, Лю Z, Чэнь X, Чан WY, Гао F, Лу G, Чен ZJ, Лю Х (май 2023 г.) ). «SPIDR необходим для гомологичной рекомбинации во время мейоза млекопитающих» . Нуклеиновые кислоты Рез . 51 (8): 3855–68. дои : 10.1093/nar/gkad154 . ПМЦ 10164582 . ПМИД 36938872 .
- ^ Пунперм, Равин; Таката, Хидеаки; Хамано, Тору; Мацуда, Ацуши; Утияма, Сусуму; Хираока, Ясуши; Фукуи, Киичи (1 июля 2015 г.). «Хромосомный каркас представляет собой двухцепочечную сборку каркасных белков» . Научные отчеты . 5 (1): 11916. Бибкод : 2015НатСР...511916П . дои : 10.1038/srep11916 . ПМЦ 4487240 . ПМИД 26132639 .
- ^ молекулярно-клеточная биология Лодиша [ нужна полная цитата ]
- ^ Айяла-Кастро, Карла; Шайни, Авнеш; Ауттен, Ф. Уэйн (2008). «Пути сборки кластеров Fe-S в бактериях» . Обзоры микробиологии и молекулярной биологии . 72 (1): 110–125. дои : 10.1128/MMBR.00034-07 . ПМК 2268281 . ПМИД 18322036 .
- ^ Адровер, Микель; Хоуз, Барри Д.; Яннуцци, Клара; Смулевич, Джульетта; Пасторе, Анналиса (1 июня 2015 г.). «Анатомия каркасного белка кластера железа и серы: понимание факторов, определяющих стабильность кластера [2Fe – 2S] на IscU» . Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1853 (6): 1448–56. дои : 10.1016/j.bbamcr.2014.10.023 . hdl : 2158/944532 . ПМИД 25447544 .
- ^ Молекулярно-клеточная биология Лодиша и др. издание 5 [ нужна страница ]