Фосфолипаза С

Фосфолипаза C ( PLC ) представляет собой класс мембраносвязанных ферментов , которые расщепляют фосфолипиды непосредственно перед фосфатной группой (см. рисунок). Чаще всего его считают синонимом человеческих форм этого фермента, которые играют важную роль в эукариотических клеток физиологии , в частности в путях передачи сигнала . Роль фосфолипазы С в передаче сигнала заключается в расщеплении фосфатидилинозитол-4,5-бисфосфата (PIP 2 ) на диацилглицерин (DAG) и инозитол-1,4,5-трифосфат (IP 3 ), которые служат вторичными мессенджерами . Активаторы каждого PLC различаются, но обычно включают гетеротримерные субъединицы G-белка, протеинтирозинкиназы , небольшие G-белки , Ca 2+ и фосфолипиды. [1]
Существует тринадцать видов фосфолипазы C млекопитающих, которые по структуре подразделяются на шесть изотипов (β, γ, δ, ε, ζ, η). Каждый PLC имеет уникальный и перекрывающийся контроль над экспрессией и внутриклеточным распределением. Однако PLC не ограничивается млекопитающими и присутствует также в бактериях и Chromadorea.
| Фосфолипаза С | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 3.1.4.3 | ||
| Номер CAS. | 9001-86-9 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Варианты
[ редактировать ]Варианты млекопитающих
[ редактировать ]Обширное количество функций, выполняемых реакцией PLC, требует, чтобы она строго регулировалась и была способна реагировать на множественные вне- и внутриклеточные входы с соответствующей кинетикой. Эта потребность привела к эволюции шести изотипов PLC у животных, каждый из которых имеет свой собственный способ регуляции. Пре-мРНК PLC также может подвергаться дифференциальному сплайсингу, так что у млекопитающего может быть до 30 ферментов PLC. [2]
- бета: PLCB1 , PLCB2 , PLCB3 , PLCB4
- гамма: PLCG1 , PLCG2
- дельта: PLCD1 , PLCD3 , PLCD4
- эпсилон: PLCE1
- и: PLCH1 , PLCH2
- дзета: PLCZ1
- фосфолипаза C-подобная: PLCL1 , PLCL2
Бактериальные варианты
[ редактировать ]Большинство бактериальных вариантов фосфолипазы С относятся к одной из четырех групп структурно родственных белков. Токсичные фосфолипазы С способны взаимодействовать с мембранами эукариотических клеток и гидролизовать фосфатидилхолин и сфингомиелин, что приводит к лизису клеток. [3]
- Цинк-металлофосфолипазы C: Clostridium perfringens альфа-токсин , Bacillus cereus PLC (BC-PLC)
- Сфингомиелиназы: B. cereus , Staphylococcus aureus.
- Ферменты, гидролизующие фосфатидилинозитол: B. cereus , B. thuringiensis , L. monocytogenes (PLC-A)
- Псевдомонадные фосфолипазы C: Pseudomonas aeruginosa (PLC-H и PLC-N)
Хромадория
[ редактировать ]Класс Chromadorea также использует фермент фосфолипазу C для регулирования высвобождения кальция. Фермент высвобождает инозитол-1,4,5-трифосфат (IP3) , который обозначает сигнальный путь, участвующий в активации овуляции, продвижении ооцита в сперматеку. Этот ген участвует в различных действиях, таких как контроль ГТФазы, расщепление определенных молекул и связывание с небольшой ГТФазой. Он помогает бороться с бактериями и регулировать движение белков в клетках. Он обнаружен в выделительной системе, кишечнике, нервах и репродуктивных органах. Экспрессия фермента в сперматеке контролируется факторами транскрипции FOS-1 и JUN-1. [4]
Структура фермента
[ редактировать ]
У млекопитающих PLC имеют консервативную основную структуру и различаются по другим доменам, специфичным для каждого семейства. Основной фермент включает разделенный ствол триозофосфат-изомеразы (TIM) , домен гомологичности плекстрина (PH) , четыре тандемных домена EF Hand и домен C2 . [1] Ствол ТИМ содержит активный центр, все каталитические остатки и Ca. 2+ сайт связывания. Он имеет автоингибирующую вставку, которая прерывает его активность, называемую линкером XY. Было показано, что XY-линкер перекрывает активный сайт, и при его удалении активируется ПЛК. [5]
Гены, кодирующие альфа-токсин ( Clostridium perfringens ) , Bacillus cereus PLC (BC-PLC) и PLC Clostridium bifermentans и Listeria monocytogenes были выделены и секвенированы нуклеотиды. Последовательности имеют значительную гомологию, примерно 250 остатков, начиная с N-конца. Альфа-токсин имеет еще 120 остатков на С-конце. Сообщалось, что С-конец альфа-токсина является «С2-подобным» доменом, что относится к домену С2, обнаруженному у эукариот, который участвует в передаче сигнала и присутствует в фосфоинозитид-фосфолипазе C млекопитающих . [6]
Ферментативный механизм
[ редактировать ]
Первичная катализируемая реакция PLC происходит на нерастворимом субстрате на границе раздела липид-вода. Остатки в активном центре консервативны во всех изотипах PLC. У животных PLC избирательно катализирует гидролиз фосфолипида фосфатидилинозитол-4,5-бисфосфата (PIP 2 ) на глицериновой стороне фосфодиэфирной связи. Происходит образование слабо связанного с ферментом промежуточного продукта, инозитол-1,2-циклического фосфодиэфира, и высвобождение диацилглицерина (ДАГ) . Промежуточное соединение затем гидролизуют до инозитол-1,4,5-трифосфата (IP 3 ) . [7] Таким образом, двумя конечными продуктами являются DAG и IP 3 . Для кислотно-основного катализа необходимы два консервативных остатка гистидина и Ca 2+ ион необходим для гидролиза PIP 2 . Было замечено, что активный центр Ca 2+ координируется с четырьмя кислотными остатками, и если какой-либо из остатков мутирован, то больший Ca 2+ концентрация необходима для катализа. [8]
Сигнальный путь
[ редактировать ]Фосфоинозитид-специфическая фосфолипаза C (PLC) является ключевым игроком в процессах передачи сигналов в клетках. Когда клетки сталкиваются с сигналами, такими как гормоны или факторы роста, PLC расщепляет молекулу под названием PIP2 для производства новых сигнальных молекул. PIP2 — это тип молекулы, обнаруженной в клеточных мембранах. Когда клетки получают определенные сигналы извне, фермент под названием PLC расщепляет PIP2 на более мелкие молекулы, которые затем отправляют сообщения внутри клетки. Различные типы ПЛК активируются по-разному, способствуя способности клеток реагировать на окружающую среду.
Регулирование
[ редактировать ]Активация
[ редактировать ]Рецепторы, которые активируют этот путь, в основном представляют собой связанные с G-белком, связанные с Gαq рецепторы , субъединицей , в том числе:
- 5-HT2 серотонинергические рецепторы
- α 1 (Альфа-1) адренергические рецепторы [9]
- Рецепторы кальцитонина
- H 1 гистаминовые рецепторы
- Метаботропные глутаматные рецепторы , группа I.
- М 1 , М 3 и М 5 Мускариновые рецепторы
- Рецептор тироид-рилизинг-гормона в передней доле гипофиза
Другими, второстепенными активаторами, кроме G αq, являются:
- МАР-киназа . Активаторы этого пути включают PDGF и FGF . [9]
- βγ-комплекс гетеротримерных G-белков , как второстепенный путь гормона роста высвобождения гормоном, высвобождающим гормон роста . [10]
- Каннабиноидные рецепторы
Торможение
[ редактировать ]- Малая молекула U73122: аминостероид, предполагаемый ингибитор PLC. [11] [12] Однако специфичность U73122 подвергается сомнению. [13] Сообщалось, что U73122 активирует фосфолипазную активность очищенных PLC. [14]
- Эдельфозин : липидоподобное противоопухолевое средство (ET-18-OCH3). [15]
- Аутоингибирование линкера XY в клетках млекопитающих. Предполагается, что линкер XY состоит из длинных участков кислых аминокислот, которые образуют плотные области отрицательного заряда. Эти области могут отталкиваться отрицательно заряженной мембраной при связывании PLC с мембранными липидами. Считается, что сочетание отталкивания и стерических ограничений удаляет линкер XY из зоны активного сайта и ослабляет аутоингибирование. [1]
- Соединения, содержащие каркас морфолинобензойной кислоты, относятся к классу лекарственно-подобных фосфатидилхолин-специфичных ингибиторов PLC. [16] [17] [18]
- о -фенантролин: гетероциклическое органическое соединение, ингибирующее цинк-металлоферменты. [19]
- ЭДТА: молекула, хелатирующая Zn. 2+ ионов и эффективно инактивирует PLC, который, как известно, ингибирует цинк-металлоферменты. [20]
Биологическая функция
[ редактировать ]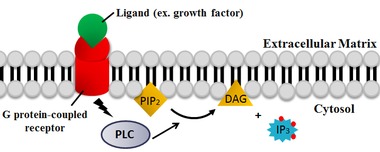
PLC расщепляет фосфолипид фосфатидилинозитол-4,5-бисфосфат (PIP 2 ) на диацилглицерин (DAG) и инозитол-1,4,5-трифосфат (IP 3 ). Таким образом, PLC оказывает глубокое влияние на истощение PIP 2 , который действует как мембранный якорь или аллостерический регулятор и агонист многих липид-управляемых ионных каналов . [21] [22] PIP 2 также действует как субстрат для синтеза более редкого липида фосфатидилинозитол-3,4,5-трифосфата (PIP 3 ) , который отвечает за передачу сигналов во многих реакциях. [23] Следовательно, истощение PIP 2 в результате реакции PLC имеет решающее значение для регуляции локальных концентраций PIP 3 как в плазматической мембране, так и в ядерной мембране.
Два продукта реакции, катализируемой PLC, DAG и IP 3 , являются важными вторичными мессенджерами, которые контролируют различные клеточные процессы и являются субстратами для синтеза других важных сигнальных молекул. Когда PIP 2 расщепляется, DAG остается связанным с мембраной, а IP 3 высвобождается в виде растворимой структуры в цитозоль . IP 3 затем диффундирует через цитозоль и связывается с IP 3 рецепторами , особенно с кальциевыми каналами в гладкой эндоплазматической сети (ER). Это приводит к увеличению цитозольной концентрации кальция, вызывая каскад внутриклеточных изменений и активности. [24] Кроме того, кальций и ДАГ вместе активируют протеинкиназу С , которая затем фосфорилирует другие молекулы, что приводит к изменению клеточной активности. [24] Конечные эффекты включают вкус, стимулирование опухоли, а также экзоцитоз везикул, выработку супероксида из НАДФН-оксидазы и активацию JNK . [24] [25]
И ДАГ, и IP 3 являются субстратами для синтеза регуляторных молекул. ДАГ является субстратом для синтеза фосфатидной кислоты , регуляторной молекулы. IP 3 является субстратом, ограничивающим скорость синтеза инозитол-полифосфатов, которые стимулируют множественные протеинкиназы, транскрипцию и процессинг мРНК. [26] Таким образом, регуляция активности PLC жизненно важна для координации и регуляции других ферментов путей, которые играют центральную роль в контроле клеточной физиологии.
Кроме того, фосфолипаза С играет важную роль в механизме воспаления. Связывание агонистов, таких как тромбин , адреналин или коллаген , с рецепторами на поверхности тромбоцитов может вызвать активацию фосфолипазы С, которая катализирует высвобождение арахидоновой кислоты из двух основных мембранных фосфолипидов, фосфатидилинозитола и фосфатидилхолина . Затем арахидоновая кислота может перейти на циклооксигеназный путь (продуцирование простагландинов (PGE1, PGE2, PGF2), простациклинов (PGI2) или тромбоксанов (TXA2)), а также на липоксигеназный путь (продуцирование лейкотриенов (LTB4, LTC4, LTD4, LTE4)) . [27]
Бактериальный вариант Clostridium perfringens типа А продуцирует альфа-токсин. Токсин обладает активностью фосфолипазы С и вызывает гемолиз , летальность и дермонекроз. В высоких концентрациях альфа-токсин вызывает массивную деградацию фосфатидилхолина и сфингомиелина с образованием диацилглицерина и церамида соответственно. Эти молекулы затем участвуют в путях передачи сигнала. [6] Сообщалось, что токсин активирует каскад арахидоновой кислоты в изолированной аорте крыс. [28] Вызванное токсином сокращение было связано с образованием тромбоксана А 2 из арахидоновой кислоты. Таким образом, вполне вероятно, что бактериальный PLC имитирует действие эндогенного PLC в мембранах эукариотических клеток.
См. также
[ редактировать ]- Гликозилфосфатидилинозитолдиацилглицероллиаза EC 4.6.1.14 Трипаносомный фермент.
- Фосфатидилинозит-диацилглицерин-лиаза EC 4.6.1.13 Другой родственный бактериальный фермент.
- Фосфоинозитидфосфолипаза C EC 3.1.4.11 Основная форма, обнаруженная у эукариот, особенно у млекопитающих.
- Семейство цинк-зависимых бактериальных ферментов фосфолипазы C EC 3.1.4.3 , которое включает альфа-токсины C. perfringens (также известные как лецитиназа ), P. aeruginosa и S. aureus .
Ссылки
[ редактировать ]- ^ Jump up to: а б с Кадамур Г., Росс Э.М. (2013). «Фосфолипаза С млекопитающих». Ежегодный обзор физиологии . 75 : 127–54. doi : 10.1146/annurev-physical-030212-183750 . ПМИД 23140367 .
- ^ Эх, ПГ; Пак, Джи; Манзоли, Л; Кокко, Л; Пик, Джей Си; Катан, М; Фуками, К; Катаока, Т; Юн, С; Рю, С.Х. (2008). «Множественные роли фосфоинозитид-специфичных изоферментов фосфолипазы C» . Отчеты БМБ . 41 (6): 415–34. дои : 10.5483/bmbrep.2008.41.6.415 . hdl : 11585/62661 . ПМИД 18593525 .
- ^ Титболл, RW (1993). «Бактериальные фосфолипазы С». Микробиологические обзоры . 57 (2): 347–66. дои : 10.1128/MMBR.57.2.347-366.1993 . ПМЦ 372913 . ПМИД 8336671 .
- ^ Сингаравелу, Гунасекаран; Сингсон, Эндрю (январь 2013 г.). «Передача сигналов кальция об оплодотворении у нематоды Caenorhabditis elegans» . Клеточный кальций . 53 (1): 2–9. дои : 10.1016/j.ceca.2012.11.009 . ПМЦ 3566351 .
- ^ Хикс С.Н., Ежик М.Р., Гершбург С., Зайферт Дж.П., Харден Т.К., Сондек Дж. (август 2008 г.). «Общее и разностороннее аутоингибирование изоферментов PLC» . Молекулярная клетка . 31 (3): 383–94. doi : 10.1016/j.molcel.2008.06.018 . ПМК 2702322 . ПМИД 18691970 .
- ^ Jump up to: а б Сакурай Дж., Нагахама М., Ода М. (ноябрь 2004 г.). «Альфа-токсин Clostridium perfringens: характеристика и механизм действия». Журнал биохимии . 136 (5): 569–74. дои : 10.1093/jb/mvh161 . ПМИД 15632295 .
- ^ Эссен Л.О., Перишич О., Катан М., Ву Ю., Робертс М.Ф., Уильямс Р.Л. (февраль 1997 г.). «Структурное картирование каталитического механизма фосфоинозитид-специфической фосфолипазы C млекопитающих». Биохимия . 36 (7): 1704–18. дои : 10.1021/bi962512p . ПМИД 9048554 .
- ^ Эллис, М.В.; Джеймс, СР; Перишич, О; Даунс, ПК; Уильямс, РЛ; Катан, М. (1998). «Каталитический домен фосфоинозитид-специфической фосфолипазы C (PLC): анализ мутаций остатков в активном сайте гидрофобного гребня PLCD1» . Журнал биологической химии . 273 (19): 11650–9. дои : 10.1074/jbc.273.19.11650 . ПМИД 9565585 .
- ^ Jump up to: а б Уолтер Ф. Борон (2003). Медицинская физиология: клеточный и молекулярный подход . Эльзевир/Сондерс. п. 1300. ISBN 978-1-4160-2328-9 . Страница 104
- ^ GeneGlobe -> Передача сигналов GHRH [ постоянная мертвая ссылка ] Проверено 31 мая 2009 г.
- ^ Блисдейл Дж. Э., Такур Н. Р., Грембан Р. С., Банди Г. Л., Фитцпатрик Ф. А., Смит Р. Дж., Бантинг С. (ноябрь 1990 г.). «Селективное ингибирование рецептор-связанных фосфолипаз С-зависимых процессов в тромбоцитах и полиморфноядерных нейтрофилах человека». Журнал фармакологии и экспериментальной терапии . 255 (2): 756–68. ПМИД 2147038 .
- ^ Макмиллан Д., Маккаррон Дж.Г. (июль 2010 г.). «Ингибитор фосфолипазы C U-73122 ингибирует высвобождение Ca(2+) из запасов Ca(2+) внутриклеточной саркоплазматической сети путем ингибирования насосов Ca(2+) в гладких мышцах» . Британский журнал фармакологии . 160 (6): 1295–301. дои : 10.1111/j.1476-5381.2010.00771.x . ПМЦ 2938802 . ПМИД 20590621 .
- ^ Хуанг В., Барретт М., Хаджичек Н., Хикс С., Харден Т.К., Сондек Дж., Чжан К. (февраль 2013 г.). «Низкомолекулярные ингибиторы фосфолипазы C из нового высокопроизводительного скрининга» . Журнал биологической химии . 288 (8): 5840–8. дои : 10.1074/jbc.M112.422501 . ПМЦ 3581404 . ПМИД 23297405 .
- ^ Кляйн Р.Р., Бурдон Д.М., Косталес К.Л., Вагнер К.Д., Уайт В.Л., Уильямс Дж.Д., Хикс С.Н., Сондек Дж., Таккер Д.Р. (апрель 2011 г.). «Прямая активация человеческой фосфолипазы С ее хорошо известным ингибитором u73122» . Журнал биологической химии . 286 (14): 12407–16. дои : 10.1074/jbc.M110.191783 . ПМК 3069444 . ПМИД 21266572 .
- ^ Горовиц Л.Ф., Хирдес В., Сух Б.К., Хильгеманн Д.В., Маки К., Хилле Б. (сентябрь 2005 г.). «Фосфолипаза С в живых клетках: активация, ингибирование, потребность в Ca2+ и регуляция тока М» . Журнал общей физиологии . 126 (3): 243–62. дои : 10.1085/jgp.200509309 . ПМК 2266577 . ПМИД 16129772 .
- ^ Рис, Шон В.П.; Люнг, Юфимия; Рейниссон, Йоханнес; Баркер, Дэвид; Пилкингтон, Лиза И. (1 сентября 2021 г.). «Разработка 2-морфолино-N-гидроксибензамидов в качестве антипролиферативных ингибиторов PC-PLC» . Биоорганическая химия . 114 : 105152. doi : 10.1016/j.bioorg.2021.105152 . ISSN 0045-2068 . ПМИД 34328856 .
- ^ Юртивонг, К.; Пилкингтон, Луизиана; ван Ренсбург, М.; Уайт, Р.М.; Каур Брар, Х.; Рис, С.; Полин, ЕК; Сюй, CS; Шарма, Н.; Люнг, IKH; Люнг, Э.; Баркер, Д.; Рейниссон, Дж. (1 февраля 2020 г.). «Открытие новых фосфатидилхолин-специфичных ингибиторов фосфолипазы С, подобных лекарствам, в качестве потенциальных противораковых средств» . Европейский журнал медицинской химии . 187 : 111919. doi : 10.1016/j.ejmech.2019.111919 . ПМИД 31810783 . S2CID 208813280 .
- ^ Пилкингтон, Луизиана; Воробей, К.; Рис, SWP; Полин, ЕК; ван Ренсбург, М.; Сюй, CS; Лэнгли, Р.Дж.; Люнг, IKH; Рейниссон, Дж.; Люнг, Э.; Баркер, Д. (2020). «Разработка, синтез и биологическое исследование нового класса мощных ингибиторов PC-PLC» . Европейский журнал медицинской химии . 191 : 112162. doi : 10.1016/j.ejmech.2020.112162 . ПМИД 32101781 . S2CID 211536972 .
- ^ Little C, Otnåss AB (июнь 1975 г.). «Зависимость фосфолипазы C от ионов металлов Bacillus cereus». Biochimica et Biophysical Acta (BBA) - Энзимология . 391 (2): 326–33. дои : 10.1016/0005-2744(75)90256-9 . ПМИД 807246 .
- ^ «Фосфолипаза C, специфичная для фосфатидилинозитола из Bacillus cereus» (PDF) . Информация о продукте . Сигма Олдрич.
- ^ Хильгеманн Д.В. (октябрь 2007 г.). «Локальные сигналы PIP(2): когда, где и как?». Архив Пфлюгерса . 455 (1): 55–67. дои : 10.1007/s00424-007-0280-9 . ПМИД 17534652 . S2CID 29839094 .
- ^ Хансен (1 мая 2015 г.). «Липидный агонизм: парадигма PIP2 лиганд-управляемых ионных каналов» . Biochimica et Biophysical Acta (BBA) - Молекулярная и клеточная биология липидов . 1851 (5): 620–628. дои : 10.1016/j.bbalip.2015.01.011 . ПМК 4540326 . ПМИД 25633344 .
- ^ Фалькенбургер Б.Х., Дженсен Дж.Б., Диксон Э.Дж., Су Б.К., Хилле Б. (сентябрь 2010 г.). «Фосфоинозитиды: липидные регуляторы мембранных белков» . Журнал физиологии . 588 (Часть 17): 3179–85. дои : 10.1113/jphysicalol.2010.192153 . ПМК 2976013 . ПМИД 20519312 .
- ^ Jump up to: а б с Альбертс Б., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). Молекулярная биология клетки (4-е изд.). Нью-Йорк: Garland Science. ISBN 978-0-8153-3218-3 .
- ^ Ли З, Цзян Х, Се В, Чжан Цз, Смрчка А.В., Ву Д (февраль 2000 г.). «Роль PLC-бета2 и -бета3 и PI3Kgamma в передаче сигнала, опосредованной хемоаттрактантами» . Наука . 287 (5455): 1046–9. Бибкод : 2000Sci...287.1046L . дои : 10.1126/science.287.5455.1046 . ПМИД 10669417 .
- ^ Грессет А., Сондек Дж., Харден Т.К. (2012). «Изозимы фосфолипазы C и их регуляция». Фосфоинозитиды I: ферменты синтеза и деградации . Субклеточная биохимия. Том. 58. стр. 61–94. дои : 10.1007/978-94-007-3012-0_3 . ISBN 978-94-007-3011-3 . ПМЦ 3638883 . ПМИД 22403074 .
- ^ Пиомелли, Даниэле (1 апреля 1993 г.). «Арахидоновая кислота в передаче сигналов в клетках» (PDF) . Современное мнение в области клеточной биологии . 5 (2): 274–280. дои : 10.1016/0955-0674(93)90116-8 . ПМИД 7685181 .
- ^ Фуджи Ю., Сакураи Дж. (май 1989 г.). «Сокращение изолированной аорты крысы, вызванное альфа-токсином Clostridium perfringens (фосфолипазой C): доказательства участия в метаболизме арахидоновой кислоты» . Британский журнал фармакологии . 97 (1): 119–24. дои : 10.1111/j.1476-5381.1989.tb11931.x . ПМЦ 1854495 . ПМИД 2497921 .