Пектинэстераза
| пектинэстераза | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 3.1.1.11 | ||
| Номер CAS. | 9025-98-3 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Пектинэстераза (EC 3.1.1.11; систематическое название пектин-пектилгидролаза , ассоциированный с клеточной стенкой ) представляет собой повсеместно распространенный фермент , который имеет несколько изоформ , которые облегчают модификацию клеточной стенки растений и ее последующее разрушение. Он катализирует следующую реакцию:
- пектин + н H 2 O = н метанол + пектат
Он содержится во всех высших растениях, а также в некоторых бактериях и грибах . Пектинэстераза действует главным образом путем изменения локализованного pH клеточной стенки, что приводит к изменениям целостности клеточной стенки.
Пектинэстераза деэтерификацию пектина метанол в пектат и . катализирует Пектин – один из основных компонентов клеточной стенки растений. У растений пектинэстераза играет важную роль в метаболизме клеточной стенки во время созревания плодов. У бактериальных патогенов растений, таких как Erwinia carotovora , и у грибковых патогенов, таких как Aspergillus niger , пектинэстераза участвует в мацерации и мягком гниении растительной ткани. Растительные пектинэстеразы регулируются ингибиторами пектинэстеразы, которые неэффективны в отношении микробных ферментов. [2]
Функция
[ редактировать ]Недавние исследования [ нужна ссылка ] показали, что манипулирование экспрессией пектинэстеразы может влиять на многочисленные физиологические процессы. У растений пектинэстераза играет роль в модуляции механической стабильности клеточной стенки во время созревания плодов , растяжении клеточной стенки во время прорастания пыльцы и роста пыльцевой трубки , опадения , удлинения стебля, выхода клубней и развития корней. Также было показано, что пектинэстераза играет роль в реакции растений на атаку патогенов . Ассоциированная с клеточной стенкой пектинэстераза Nicotiana tabacum участвует в распознавании рецептором клетки-хозяина белка перемещения вируса табачной мозаики , и было показано, что это взаимодействие необходимо для транслокации вируса от клетки к клетке.
Действие пектинэстеразы на компоненты клеточной стенки растений может привести к двум диаметрально противоположным эффектам. Первый из них способствует укреплению клеточной стенки за счет образования блоков неэстерифицированных карбоксильных групп, которые могут взаимодействовать с ионами кальция, образуя пектатный гель. Во-вторых, высвобождение протонов может стимулировать активность гидролаз клеточной стенки, способствуя ослаблению клеточной стенки.
Этерификация пектина
[ редактировать ]Пектины составляют примерно 35% сухой массы клеточных стенок двудольных растений. Они полимеризуются в цис-цистернах Гольджи , метилэстерифицируются в медиальном отделе Гольджи и замещаются боковыми цепями в транс-цистернах Гольджи. Биохимия пектина может быть довольно сложной, но проще говоря, основная цепь пектина состоит из трех типов полимеров: гомогалактуронан (HGA); рамногалактуронан I (RGI); рамногалактуронан II (RGII).
Гомогалактуронан сильно этерифицирован метилом при экспорте в клеточные стенки и впоследствии деэтерифицируется под действием пектинэстеразы и других пектиновых ферментов. Пектинэстераза катализирует деэтерификацию метилэтерифицированных единиц D-галактозидуроновой кислоты в пектиновых соединениях, образуя субстраты для деполимеризующих ферментов, особенно кислые пектины и метанол .
Большинство очищенных растительных пектинэстераз имеют нейтральные или щелочные изоэлектрические точки и связываются с клеточной стенкой посредством электростатических взаимодействий. Однако пектинестеразы могут иметь кислые изоэлектрические точки, обнаруженные в растворимых фракциях растительных тканей. До недавнего времени считалось, что растительные пектинэстеразы удаляют метиловые эфиры прогрессивным блочным способом, приводя к образованию длинных смежных участков неэтерифицированных остатков GalA в гомогалактуроновых доменах пектина . Альтернативно считалось, что грибковые пектинэстеразы обладают случайной активностью, приводящей к деэтерификации отдельных остатков GalA в результате взаимодействий фермент/субстрат. В настоящее время показано, что некоторые изоформы пектинэстеразы растений могут проявлять оба механизма, и что такие механизмы обусловлены изменениями pH . Оптимальный pH высших растений обычно находится между pH 7 и pH 8, хотя pH пектинэстеразы грибов и бактерий обычно намного ниже этого значения.
Молекулярная биология и биохимия
[ редактировать ]Белки PE синтезируются в виде пребелков из 540–580 аминокислот, обладающих сигнальной последовательностью и большой аминоконцевой длиной около 22 кДа . Это терминальное удлинение в конечном итоге удаляется, образуя зрелый белок массой 34–37 кДа. У большинства PE отсутствуют консенсусные последовательности для N-гликозилирования в зрелом белке, хотя по крайней мере один сайт присутствует в аминоконцевой области расширения.
Пространственная и временная регуляция активности пектинэстеразы в процессе развития растений основана на большом семействе изоформ. Недавно систематическое секвенирование генома Arabidopsis thaliana привело к идентификации 66 открытых рамок считывания , которые аннотированы как пектинэстеразы, большинство из которых кодируются как большие пре-протеины. Пре-область сигнального пептида необходима для нацеливания фермента на эндоплазматический ретикулум и состоит примерно из 25 аминокислотных остатков. Эти N-концевые области содержат несколько сайтов гликозилирования , и считается, что эти сайты также играют роль в нацеливании.
Считается, что пектинэстераза секретируется в апоплазму с высокометилированным пектином, хотя в какой-то момент этого секреторного пути N-концевой пропептид отщепляется. В настоящее время роль прорегиона неизвестна, хотя предполагается, что он может действовать как внутримолекулярный шаперон, обеспечивая правильное сворачивание или дезактивацию активности до тех пор, пока вставка PE в клеточную стенку не завершится.
В последнее время особое внимание было уделено молекулярным исследованиям пектинэстеразы, что позволило охарактеризовать несколько родственных изоформ у различных видов высших растений. Было показано, что некоторые из этих пектинэстераз экспрессируются повсеместно, тогда как другие специфически экспрессируются во время созревания фруктов, прорастания пыльцевого зерна или удлинения стебля. Такие данные позволяют предположить, что пектинэстеразы кодируются семейством генов, которые по-разному регулируются в зависимости от типа клеток в ответ на специфические сигналы развития или окружающей среды.
Изоформы растений
[ редактировать ]несколько изоформ пектинэстеразы, различающихся молекулярной массой , изоэлектрической точкой идентифицировано У двудольных растений и биохимической активностью. Изоформы пектинэстеразы кодируются семейством генов, некоторые из которых конститутивно экспрессируются по всему растению, тогда как другие дифференциально экспрессируются в конкретных тканях и на разных стадиях развития. Изоформы пектинэстеразы различаются по различным биохимическим параметрам, таким как относительная молекулярная масса, изоэлектрическая точка, оптимальный pH, сродство к субстрату, потребность в ионах и местоположение.
Структура
[ редактировать ]| Пектинэстераза, каталитическая | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Пектинэстераза_cat | ||
| Пфам | PF01095 | ||
| ИнтерПро | IPR000070 | ||
| PROSITE | PDOC00413 | ||
| |||
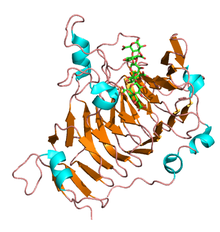
N-концевые пропептиды пектинэстеразы различаются по размеру и последовательности и демонстрируют низкий уровень идентичности аминокислот. Альтернативно, С-концевая каталитическая область высококонсервативна и представляет собой зрелый фермент. Первая трехмерная структура растительной пектинэстеразы была обнаружена для изоформы корня моркови ( Daucus carota ) и состоит из правосторонней параллельной β-спирали, как это наблюдается во всех углеводных эстеразах семейства CE-8, трансмембранного домена и пектиновая щель. [3] Аналогично, несколько структур пектинэстеразы были выявлены у грибов и E.coli и имеют большинство структурных мотивов, наблюдаемых у растений.
Прокариотические и эукариотические пектинэстеразы имеют несколько областей сходства последовательностей. Кристаллическая структура пектинэстеразы Erwinia chrysanthemi имеет структуру бета-спирали, аналогичную структуре пектинолитических ферментов, хотя и отличается от структур большинства эстераз. [4] Предполагаемые каталитические остатки находятся в том же месте, что и активный центр и субстрат-связывающая щель пектатлиазы.
Ссылки
[ редактировать ]- ^ Фрис, М.; Ихриг, Дж.; Броклхерст, К.; Шевчик, В.Е.; Пикерсгилл, RW (2007). «Молекулярные основы активности фитопатогена пектинметилэстеразы» . Журнал ЭМБО . 26 (17): 3879–3887. дои : 10.1038/sj.emboj.7601816 . ПМК 2000356 . ПМИД 17717531 .
- ^ Джоване А, Церноглу Д, Камарделла Л, Ди Маттео А, Райола А, Бонивенто Д, Де Лоренцо Г, Червоне Ф, Беллинкампи Д (2005). «Структурная основа взаимодействия пектинметилэстеразы и специфического белка-ингибитора» . Растительная клетка . 17 (3): 849–858. дои : 10.1105/tpc.104.028886 . ПМЦ 1069703 . ПМИД 15722470 .
- ^ PDB : 1GQ8 ; Йоханссон К., Эль-Ахмад М., Фриман Р., Йорнвалль Х., Маркович О., Эклунд Х. (март 2002 г.). «Кристаллическая структура растительной пектинметилэстеразы» . ФЭБС Летт . 514 (2–3): 243–9. дои : 10.1016/S0014-5793(02)02372-4 . ПМИД 11943159 .
- ^ ВВП : 1QJV ; Пикерсгилл Р.В., Смит Д., Дженкинс Дж., Майанс О., Уорбойс К. (2001). «Трехмерная структура пектинметилэстеразы Erwinia chrysanthemi обнаруживает новый активный центр эстеразы». Дж. Мол. Биол . 305 (4): 951–960. дои : 10.1006/jmbi.2000.4324 . ПМИД 11162105 .
Внешние ссылки
[ редактировать ]- пектинэстераза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)