Трансмембранный белок

Трансмембранный белок — это тип интегрального мембранного белка , который охватывает всю клеточную мембрану . Многие трансмембранные белки функционируют как ворота, обеспечивающие транспорт определенных веществ через мембрану. Они часто претерпевают значительные конформационные изменения для перемещения вещества через мембрану. Они обычно очень гидрофобны , агрегируют и осаждаются в воде. Для экстракции им требуются моющие средства или неполярные растворители, хотя некоторые из них ( бета-бочки ) можно экстрагировать и с помощью денатурирующих агентов .
Пептидная последовательность , которая охватывает мембрану или трансмембранный сегмент , в значительной степени гидрофобна и может быть визуализирована с помощью графика гидропатии . [1] В зависимости от количества трансмембранных сегментов трансмембранные белки можно разделить на однопроходные мембранные белки или многопроходные мембранные белки. [2] Некоторые другие интегральные мембранные белки называются монотопными , что означает, что они также постоянно прикреплены к мембране, но не проходят через нее. [3]
Типы
[ редактировать ]Классификация по структуре
[ редактировать ]Существует два основных типа трансмембранных белков: [4] альфа-спиральные и бета-цилиндры . Альфа-спиральные белки присутствуют во внутренних мембранах бактериальных клеток или плазматической мембране эукариотических клеток, а иногда и во внешней мембране бактерий . [5] Это основная категория трансмембранных белков. По оценкам, у человека 27% всех белков представляют собой альфа-спиральные мембранные белки. [6] Белки бета-бочонка пока обнаруживаются только во внешних мембранах грамотрицательных бактерий , клеточных стенках грамположительных бактерий наружных мембранах митохондрий . и хлоропластов или могут секретироваться в виде порообразующих токсинов , Все трансмембранные белки с бета-цилиндрами имеют простейшую топологию «вверх-вниз», что может отражать их общее эволюционное происхождение и сходный механизм сворачивания. [ нужна ссылка ]
Помимо белковых доменов существуют необычные трансмембранные элементы, образованные пептидами. Типичным примером является грамицидин А , пептид, образующий димерную трансмембранную β-спираль. [7] Этот пептид секретируется грамположительными бактериями как антибиотик . Трансмембранная спираль полипролина-II в природных белках не обнаружена. Тем не менее, эта структура была экспериментально обнаружена в специально созданных искусственных пептидах. [8]
Классификация по топологии
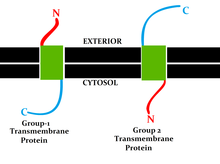
[ редактировать ]Эта классификация относится к положению N- и С-концев белка на разных сторонах липидного бислоя . Типы I, II, III и IV представляют собой однопроходные молекулы . Трансмембранные белки типа I закрепляются на липидной мембране с помощью якорной последовательности стоп-переноса и имеют свои N-концевые домены, направленные на эндоплазматической сети (ЭР) просвет во время синтеза (и внеклеточное пространство, если зрелые формы расположены на клеточных мембранах ). . Типы II и III закреплены с помощью сигнально-якорной последовательности, причем тип II нацелен на просвет ЭР с помощью своего С-концевого домена, тогда как тип III имеет свои N-концевые домены, направленные на просвет ЭР. Тип IV подразделяется на IV-A, N-концевые домены которого направлены на цитозоль, и IV-B, N-концевой домен которого направлен на просвет. [9] Последствия разделения на четыре типа особенно проявляются во время транслокации и трансляции, связанной с ER, когда белок должен пройти через мембрану ER в направлении, зависящем от типа. [ нужна ссылка ]
3D-структура
[ редактировать ]
Структуры мембранных белков можно определить с помощью рентгеновской кристаллографии , электронной микроскопии или ЯМР-спектроскопии . [11] Наиболее распространенными третичными структурами этих белков являются трансмембранный пучок спиралей и бета-цилиндр . Часть мембранных белков, прикрепленная к липидному бислою (см. кольцевая липидная оболочка ), состоит в основном из гидрофобных аминокислот. [12]
Мембранные белки , имеющие гидрофобную поверхность, относительно гибки и экспрессируются на относительно низких уровнях. Это создает трудности с получением достаточного количества белка и последующим выращиванием кристаллов. Следовательно, несмотря на значительную функциональную значимость мембранных белков, определение структур атомного разрешения для этих белков сложнее, чем для глобулярных белков. [13] По состоянию на январь 2013 г. менее 0,1% определенных белковых структур представляли собой мембранные белки, несмотря на то, что они составляли 20–30% от общего протеома. [14] В связи с этой сложностью и важностью этого класса белков были разработаны методы прогнозирования структуры белков на основе графиков гидропатии, правила положительного внутреннего и других методов. [15] [16] [17]
Термодинамическая стабильность и складчатость
[ редактировать ]Стабильность альфа-спиральных трансмембранных белков
[ редактировать ]Трансмембранные альфа-спиральные (α-спиральные) белки необычайно стабильны, судя по исследованиям термической денатурации , поскольку они не разворачиваются полностью внутри мембран (полное разворачивание потребовало бы разрыва слишком большого количества α-спиральных Н-связей в неполярной среде). С другой стороны, эти белки легко неправильно сворачиваются из-за ненативной агрегации в мембранах, перехода в состояние расплавленной глобулы , образования ненативных дисульфидных связей или разворачивания периферических областей и нерегулярных петель, которые локально менее стабильны. [ нужна ссылка ]
Также важно правильно определить развернутое состояние . Развернутое состояние мембранных белков в мицеллах детергентов отличается от такового в экспериментах по термической денатурации . [ нужна ссылка ] Это состояние представляет собой комбинацию свернутых гидрофобных α-спиралей и частично развернутых сегментов, покрытых детергентом . Например, «развернутый» бактериородопсин в мицеллах ДСН имеет четыре сложенные трансмембранные α-спирали, тогда как остальная часть белка расположена на границе раздела мицелла-вода и может принимать различные типы ненативных амфифильных структур. Различия в свободной энергии между такими денатурированными и нативными состояниями детергента аналогичны стабильности водорастворимых белков (<10 ккал/моль). [ нужна ссылка ]
Складывание α-спиральных трансмембранных белков
[ редактировать ]Рефолдинг α-спиральных трансмембранных белков in vitro технически сложен. Примеров успешных экспериментов по рефолдингу, например, бактериородопсина , относительно немного . In vivo все такие белки обычно котрансляционно свернуты внутри большого трансмембранного транслокона . Транслоконный канал обеспечивает высокогетерогенную среду для зарождающихся трансмембранных α-спиралей. Относительно полярная амфифильная α-спираль может принимать трансмембранную ориентацию в транслоконе (хотя она будет находиться на поверхности мембраны или развернута in vitro ), поскольку ее полярные остатки могут быть обращены к центральному заполненному водой каналу транслокона. Такой механизм необходим для включения полярных α-спиралей в структуры трансмембранных белков. Амфифильные спирали остаются прикрепленными к транслокону до тех пор, пока белок не будет полностью синтезирован и свернут. Если белок остается развернутым и прикрепленным к транслокону слишком долго, он разрушается специфическими клеточными системами «контроля качества». [ нужна ссылка ]
Стабильность и фолдинг бета-ствольных трансмембранных белков
[ редактировать ]Стабильность трансмембранных белков бета-барреля (β-бочонка) аналогична стабильности водорастворимых белков, что подтверждается исследованиями химической денатурации. Некоторые из них очень стабильны даже в хаотропных агентах и при высоких температурах. Их сворачиванию in vivo способствуют водорастворимые шапероны , такие как белок Skp. Считается, что мембранные белки β-бочонка произошли от одного предка, даже имея разное количество листов, которые могли добавляться или удваиваться в ходе эволюции. Некоторые исследования показывают огромную консервативность последовательностей у разных организмов, а также консервативные аминокислоты, которые удерживают структуру и помогают сворачивать. [18]
3D-структуры
[ редактировать ]Транспортеры, управляемые поглощением света
[ редактировать ]- Бактериородопсин -подобные белки, включая родопсин (см. также опсин )
- Бактериальные фотосинтетические реакционные центры и фотосистемы I и II.
- Светособирающие бактерий хлоропластов и комплексы
Транспортеры с окислительно-восстановительным приводом
[ редактировать ]- Трансмембранные цитохром b-подобные белки: кофермент Q — цитохром с-редуктаза (цитохром bc1); комплекс цитохрома b6f ; формиатдегидрогеназа, респираторная нитратредуктаза ; сукцинат - коэнзим Q-редуктаза (фумаратредуктаза); и сукцинатдегидрогеназа . См. Цепь переноса электронов .
- Цитохром с бактерий и оксидазы митохондрий
Транспортеры с электрохимическим потенциалом
[ редактировать ]- F-типа и V-типа Протон или натрий, транслоцирующий АТФазы
Транспортеры, управляемые гидролизом PP-связи
[ редактировать ]- P-типа Кальциевая АТФаза (пять различных конформаций)
- Регуляторы кальциевой АТФазы фосфоламбан и сарколипин.
- Транспортеры АВС
- общего секреторного пути (Sec) Транслокон (пребелковая транслоказа SecY)
Портеры (унипортеры, симпортеры, антипортеры)
[ редактировать ]- Митохондриальные белки-переносчики
- Суперсемейство основных посредников (переносчик глицерин-3-фосфата, пермеаза лактозы и переносчик многих лекарств EmrD)
- Деление резистентных узловато-клеточных клеток ( оттока переносчик многих лекарств AcrB, см. множественная лекарственная устойчивость )
- Дикарбоксилат/аминокислота: симпортер катиона (симпортер протона глутамата)
- Моновалентный катион/протонный антипортер (натрий/протонный антипортер 1 NhaA)
- Нейромедиатор симпортер натрия
- Транспортеры аммиака
- Транспортер лекарств/метаболитов (небольшой транспортер EmrE с множественной лекарственной устойчивостью - структуры удалены как ошибочные)
Альфа-спиральные каналы, включая ионные каналы
[ редактировать ]- Потенциал-управляемый ионный канал , включая калиевые каналы KcsA и KvAP, и с внутренним выпрямителем . калиевый ионный канал Кирбак
- Механочувствительный канал большой проводимости, MscL
- Механочувствительный ионный канал малой проводимости (MscS)
- Транспортеры ионов металлов CorA
- Лиганд-зависимый ионный канал рецепторов нейромедиаторов ( рецептор ацетилхолина )
- Аквапорины
- Хлоридные каналы
- Вспомогательные белки внешней мембраны (переносчик полисахаридов) - α-спиральные трансмембранные белки внешней бактериальной мембраны.
Ферменты
[ редактировать ]- Метанмонооксигеназа
- Ромбовидная протеаза
- Белок, образующий дисульфидную связь (комплекс DsbA-DsbB)
Белки с одиночными трансмембранными альфа-спиралями
[ редактировать ]- Субъединицы рецепторного комплекса Т-клеток
- цитохром-с -нитритредуктазы Комплекс
- Димер гликофорина А
- иновируса ( нитчатого фага ) Основной белок оболочки
- батареи
- Легочный сурфактант -ассоциированный белок
- Моноаминоксидазы А и В
- Гидролаза амидов жирных кислот [19]
- Цитохром P450 оксидазы
- Кортикостероидные 11β-дегидрогеназы .
- Сигнальный пептид Пептидаза
Бета-бочки, состоящие из одной полипептидной цепи.
[ редактировать ]- Бета-цилиндры из восьми бета-нитей и с «числом сдвига» десять ( n=8, S=10 ). Они включают в себя:
- OmpA-подобный трансмембранный домен (OmpA)
- Семейство белков внешней мембраны, связанных с вирулентностью (OmpX)
- Семейство белков W наружной мембраны (OmpW)
- Устойчивость к противомикробным пептидам и семейство белков ацилирования липида А (PagP)
- Липид А деацилаза PagL
- Порины семейства непрозрачности (NspA)
- Домен автотранспортера ( n=12,S=14 )
- Семейство транспортных белков внешней мембраны FadL , включая жирных кислот транспортер FadL ( n=14,S=14 )
- Общее семейство бактериальных поринов , известное как тримерные порины ( n=16,S=20 )
- Мальтопорин , или сахарные порины ( n=18,S=22 )
- Нуклеозидспецифический порин ( n=12,S=16 )
- Фосфолипаза A1 внешней мембраны ( n=12,S=16 )
- TonB-зависимые рецепторы и их плагин-домен . Они представляют собой лиганд-управляемые каналы внешней мембраны ( n = 22, S = 24 ), включая транспортер кобаламина BtuB, рецептор Fe (III)-пиохелина FptA, рецептор FepA, рецептор захвата гидроксамата железа FhuA, транспортер FecA и рецептор пиовердина FpvA.
- белков внешней мембраны OpcA Семейство ( n=10,S=12 ), которое включает протеазу внешней мембраны OmpT и белок адгезина/инвазина OpcA.
- белка G внешней мембраны Семейство поринов ( n = 14, S = 16 )
Примечание: n и S — соответственно количество бета-нитей и «число сдвига». [20] из бета-ствола
Бета-бочки, состоящие из нескольких полипептидных цепей.
[ редактировать ]- Тримерный автотранспортер ( n=12,S=12 )
- Белки оттока внешней мембраны , также известные как тримерные факторы внешней мембраны (n = 12, S = 18), включая TolC и белки множественной лекарственной устойчивости.
- Порин MspA (октамер, n=S=16 ) и α-гемолизин (гептамер n=S=14 ). Эти белки секретируются.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Поместье, Джошуа; Фельдблюм, Эстер С.; Аркин, Исайя Т. (2012). «Полярность окружающей среды в белках, неинвазивно картированная с помощью FTIR-спектроскопии» . Журнал физической химии . 3 (7): 939–944. дои : 10.1021/jz300150v . ПМЦ 3341589 . ПМИД 22563521 .
- ^ Альбертс, Брюс; Джонсон, Александр; Льюис, Джулиан; Рафф, Мартин; Робертс, Кейт; Уолтер, Питер (2002). «Мембранные белки» . Молекулярная биология клетки. 4-е издание . Гирляндная наука . Проверено 31 октября 2023 г.
- ^ Стивен Р. Гудман (2008). Медицинская клеточная биология . Академическая пресса. стр. 37–. ISBN 978-0-12-370458-0 . Проверено 24 ноября 2010 г.
- ^ Цзинь Сюн (2006). Основная биоинформатика . Издательство Кембриджского университета. стр. 208–. ISBN 978-0-521-84098-9 . Проверено 13 ноября 2010 г.
- ^ Альфа-спиральные белки наружных мембран включают станнин и некоторые липопротеины и другие.
- ^ Альмен М.С., Нордстрем К.Дж., Фредрикссон Р., Шиот Х.Б. (2009). «Картирование протеома мембраны человека: большинство мембранных белков человека можно классифицировать по функциям и эволюционному происхождению» . БМК Биол . 7:50 . дои : 10.1186/1741-7007-7-50 . ПМК 2739160 . ПМИД 19678920 .
- ^ Николсон, ЛК; Кросс, Т.А. (1989). «Катиновый канал грамицидина: экспериментальное определение направления правой спирали и проверка водородной связи бета-типа». Биохимия . 28 (24): 9379–9385. дои : 10.1021/bi00450a019 . ПМИД 2482072 .
- ^ Кубышкин Владимир; Грейдж, Стефан Л.; Ульрих, Энн С.; Будиса, Недилько (2019). «Толщина бислоя определяет выравнивание модельных полипролиновых спиралей в липидных мембранах» . Физическая химия Химическая физика . 21 (40): 22396–22408. Бибкод : 2019PCCP...2122396K . дои : 10.1039/c9cp02996f . ПМИД 31577299 .
- ^ Харви Лодиш и др.; Молекулярно-клеточная биология , издание шестое, стр.546.
- ^ Годер, Вейт; Шписс, Мартин (31 августа 2001 г.). «Топогенез мембранных белков: детерминанты и динамика». Письма ФЭБС . 504 (3): 87–93. дои : 10.1016/S0014-5793(01)02712-0 . ПМИД 11532438 .
- ^ Кросс, Тимоти А.; Шарма, Мукеш; Йи, Мёнги; Чжоу, Хуан-Сян (2011). «Влияние солюбилизирующей среды на мембранные белковые структуры» . Тенденции биохимических наук . 36 (2): 117–125. дои : 10.1016/j.tibs.2010.07.005 . ПМК 3161620 . ПМИД 20724162 .
- ^ Уайт, Стивен. «Общий принцип сворачивания и стабильности мембранных белков». Домашняя страница лаборатории Стивена Уайта. 10 ноября 2009 г. Интернет. [ нужна проверка ]
- ^ Карпентер, Элизабет П.; Бейс, Константинос; Кэмерон, Александр Д; Ивата, Со (октябрь 2008 г.). «Преодоление проблем мембранной кристаллографии белков» . Современное мнение в области структурной биологии . 18 (5): 581–586. дои : 10.1016/j.sbi.2008.07.001 . ПМК 2580798 . ПМИД 18674618 .
- ^ «Мембранные белки известной трехмерной структуры» . Архивировано из оригинала 25 декабря 2013 г. Проверено 1 мая 2016 г.
- ^ Элофссон, Арне; Хейне, Гуннар фон (7 июня 2007 г.). «Структура мембранного белка: прогноз против реальности». Ежегодный обзор биохимии . 76 (1): 125–140. CiteSeerX 10.1.1.332.4023 . doi : 10.1146/annurev.biochem.76.052705.163539 . ПМИД 17579561 .
- ^ Чен, Чиен Питер; Рост, Буркхард (2002). «Современное состояние прогнозирования мембранных белков». Прикладная биоинформатика . 1 (1): 21–35. CiteSeerX 10.1.1.134.7424 . ПМИД 15130854 .
- ^ Хопф, Томас А.; Колвелл, Люси Дж.; Шеридан, Роберт; Рост, Буркхард; Сандер, Крис; Маркс, Дебора С. (июнь 2012 г.). «Трехмерные структуры мембранных белков по данным геномного секвенирования» . Клетка . 149 (7): 1607–1621. дои : 10.1016/j.cell.2012.04.012 . ПМЦ 3641781 . ПМИД 22579045 .
- ^ Михалик, Марцин; Орвик-Ридмарк, Марселла; Хабек, Майкл; Альва, Викрам; Арнольд, Томас; Линке, Дирк; Пермяков, Евгений А. (3 августа 2017 г.). «Эволюционно консервативный глицин-тирозиновый мотив образует складчатое ядро в белках внешней мембраны» . ПЛОС ОДИН . 12 (8): e0182016. Бибкод : 2017PLoSO..1282016M . дои : 10.1371/journal.pone.0182016 . ПМЦ 5542473 . ПМИД 28771529 .
- ^ Брейси М.Х., Хэнсон М.А., Масуда К.Р., Стивенс Р.К., Краватт Б.Ф. (ноябрь 2002 г.). «Структурные адаптации мембранного фермента, который прекращает передачу сигналов эндоканнабиноидов». Наука . 298 (5599): 1793–6. Бибкод : 2002Sci...298.1793B . дои : 10.1126/science.1076535 . ПМИД 12459591 . S2CID 22656813 .
- ^ Мурзин А.Г., Леск А.М., Чотия С. (март 1994 г.). «Принципы, определяющие структуру стволов бета-листов в белках. I. Теоретический анализ». Дж. Мол. Биол . 236 (5): 1369–81. дои : 10.1016/0022-2836(94)90064-7 . ПМИД 8126726 .